Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.9 no.1 Manizales Jan./June 2010
CITOCROMO P450 2A6 (CYP2A6) HUMANO Y SU RELACIÓN CON EL CONSUMO DE TABACO
VARIABILITY IN LEVELS OF EXPRESSION AND ACTIVITY OF HUMAN CYTOCHROME P450 2A6 (CYP2A6) AND ITS RELATIONSHIP WITH TOBACCO CONSUMPTION
José Henry Osorio1
1 Laboratorio de investigación en Bioquímica Clínica y Patología Molecular, Departamento de Ciencias Básicas de la Salud, Universidad de Caldas. E-mail: jose.osorio_o@ucaldas.edu.co.
Recibido: septiembre 25 del 2009 - Aceptado: enero 19 del 2010
RESUMEN
El desarrollo de la dependencia por la nicotina está determinado no solamente por factores sociales, sino además por factores psicológicos y biológicos individuales. Ha sido demostrado que el citocromo P450 2A6 (CYP2A6) humano, la enzima que cataliza el metabolismo de la nicotina, presenta gran variabilidad interindividual e interétnica en los niveles de expresión y actividad. La variación interindividual en la actividad metabólica puede afectar el metabolismo de los sustratos de CYP2A6 incluyendo la nicotina, cotinina (el mayor metabolito de la nicotina), diferentes procancerígenos tabaco-específicos, cumarina y muchas toxinas. La presente revisión analiza la literatura científica relacionada con las variaciones en CYP2A6 y el consumo de tabaco.
PALABRAS CLAVE: CYP2A6, nicotina, metabolismo, tabaco.
ABSTRACT
The development of nicotine dependence is determined not only by social factors but also by individual psychological and biological factors. Human cytochrome P450 2A6 (CYP2A6), the enzyme that catalyses the metabolism of nicotine, has been shown to have large interindividual and interethnic variability in expression and activity levels. The interindividual variation in metabolic activity may affect the metabolism of CYP2A6 substrates including nicotine, cotinine (the major metabolite of nicotine), several tobaccospecific procarcinogens, coumarin and many toxins. The present review analyses the scientific literature related to variations in CYP2A6 and tobacco consumption.
KEY WORDS: CYP2A6, nicotine, metabolism, tobacco.
INTRODUCCIÓN
La nicotina es un alcaloide volátil e incoloro, que se encuentra en la Nicotiana tabacum y Nicotiana rustica; es el componente principal del tabaco (entre 10 a 25 mg por cigarrillo), siendo la responsable de la adicción al tabaco. Se encuentra comercialmente en cigarrillos, gomas de mascar, parches transdérmicos, aerosol nasal y tabletas sublinguales.
El desarrollo de la dependencia por la nicotina resulta del efecto directo de la misma sobre los receptores nicotinérgicos de acetilcolina y el sistema de transmisión dopaminérgico (1). El núcleo accumbens, una parte importante del sistema dopaminérgico, parece también desempeñar un papel importante en la dependencia por la nicotina (2).
Estudios recientes de genética molecular han demostrado la relación entre la dependencia de la nicotina y factores genéticos (3). Una posible variabilidad genética relevante en el sistema dopaminérgico fue encontrada en el gen del receptor D2 de la dopamina (DRD2) de alcohólicos fumadores (4). Así mismo, estudios en animales han mostrado variaciones en la estructura del receptor nicotinérgico de la acetilcolina, lo que podría interferir con el desarrollo de la dependencia por la nicotina (5).
El citocromo P450 2A6 (CYP2A) humano, la enzima que cataliza el metabolismo de la nicotina presenta gran variabilidad interindividual e interétnica en los niveles de expresión y actividad, esto se debe a polimorfismos genéticos. En años recientes, más de 37 variantes genéticas de CYP2A han sido identificadss, siendo relacionadas con alteraciones en la actividad de la enzima CYP2A6 (6). Por ejemplo, hay alelos que resultan en variantes que son inactivas (debidas a deleciones en el gen), y presentan disminución en la actividad transcripcional o estructura de las enzima alteradas, o actividad enzimática incrementada (duplicaciones del gen) (7).
La variación interindividual en la actividad metabólica puede afectar el metabolismo de los sustratos de CYP2A6 incluyendo la nicotina, cotinina (el mayor metabolito de la nicotina), diferentes procancerígenos tabaco-específicos, cumarina y muchas toxinas.
Las frecuencias de los alelos CYP2A6 varían considerablemente entre diferentes poblaciones étnicas, lo cual podría explicar en parte la variabilidad interétnica encontrada en la actividad metabólica de CYP2A6 (metabolismo de la nicotina), conductas (hábito de fumar) y enfermedad (cáncer de pulmón) (8).
La presente revisión analiza la literatura científica relacionada con las variaciones en CYP2A6 y el consumo de tabaco.
METABOLISMO DE LA NICOTINA
La nicotina es una base débil, y su absorción a través de las membranas depende del pH. El pH de la mayoría de los cigarrillos es acídico (5,5), por eso la nicotina está ionizada y no puede cruzar las membranas celulares. Cuando la nicotina es inhalada de los cigarrillos, alcanza los pulmones, es bufferada a un pH neutro pudiendo entonces cruzar libremente las membranas celulares y es rápidamente absorbida dentro de los alvéolos pulmonares pasando rápidamente a la circulación sanguínea. Por otra parte, los tabacos y la picadura utilizada para fumar utilizando pipa presentan un pH más alcalino (8,5); la nicotina no está ionizada y es fácilmente absorbida por los tejidos de la boca (9). Después de ser absorbida, la nicotina circula rápidamente por todo el organismo.
La nicotina es una amina terciaria compuesta por un anillo de piridina y otro de pirrolidina. La vida media de la nicotina oscila entre 2 y 3 horas; aproximadamente entre el 80 y el 90% de la nicotina ingerida o inhalada, es metabolizada por el hígado, riñones y pulmones (10). La nicotina es degradada a cotinina, ión nicotinaimino, nicotirina, y nornicotina principalmente mediante la enzima codificada por el gen CYP2A6. Este gen genéticamente polimórfico corresponde a la familia P450. La cotinina es el principal metabolito en la mayoría de fumadores (11). La nicotina y la cotinina son excretadas vía renal, un proceso dependiente del pH urinario (12). La vida media de la cotinina (16-18 horas), es mayor que el de la nicotina (2-3 horas). Por lo tanto, la cotinina está presente en la sangre de los fumadores 10 a 15 veces la concentración de la nicotina.
Los niveles de cotinina en plasma de personas que consumen pocos cigarrillos al día oscilan entre 10 y 100 mg/ml, mientras que los que consumen más de 20 cigarrillos al día, presentan concentraciones de más de 300 mg/ml (13). Las concentraciones urinarias de cotinina son aproximadamente 5 a 10 veces más altas que los niveles en plasma (14). Numerosos estudios demuestran que las mayores diferencias en el metabolismo de la nicotina están relacionadas con variaciones en las enzimas polimórficas P450 responsables de su metabolismo, lo que puede explicar los diferentes patrones de adicción y de intensidad en el uso del tabaco entre consumidores (15).
Los efectos de la nicotina dependen de la célula u órgano sobre el que actúe. Entre 10 a 20 segundos después de fumar un cigarrillo, la nicotina es absorbida y se une a la superficie de las células que expresan receptores nicotínicos para acetilcolina (nAChRs). Este receptor es un pentámero compuesto por cinco subunidades de membrana, ubicadas alrededor de un poro central o canal iónico. La nicotina se une a los receptores induciendo la liberación de numerosos neurotransmisores como adrenalina (epinefrina), noradrenalina (norepinefrina), dopamina, acetilcolina, serotonina, glutamato, β-endorfina, y ácido γ-aminobutírico (GABA). Muchos de estos neurotransmisores actúan como estimulantes mediando algunos efectos psico-conductuales de la nicotina. Aunque muchos miembros de la familia de receptores nAChR son expresados dentro del sistema nervioso central y periférico, numerosos tipos de células encontrados en diferentes órganos incluyendo células del sistema inmune, células epiteliales y células endoteliales pueden expresarlos (16).
Se estima que la dosis letal de nicotina en adultos oscila entre 0,5 y 1 mg por kilogramo de peso vivo, siendo menor en niños (17). La intoxicación sistémica aguda por nicotina se caracteriza por efectos sobre el sistema nervioso central (cefalea, mareos, insomnio, tremor, convulsiones, y coma en casos severos), gastrointestinales (boca seca, nausea, vómito, dispepsia, diarrea) y efectos musculoesqueléticos como mialgia. Los efectos adversos por aplicación local incluyen sensación de quemadura en la boca o en la piel, salivación, heridas y úlceras en la boca o en la piel, irritación nasal y ojos llorosos (18). La intoxicación crónica por exposición a la nicotina por largos períodos de tiempo tiene que ver con la activación del sistema nervioso simpático (incremento de la frecuencia cardíaca, la presión sanguínea y la contractilidad cardíaca).
El metabolismo de la nicotina puede dividirse en dos fases. En la primera fase, se presenta c-oxidación y conversión de 50-hidroxinicotina en ácido 3-piridilacético, con formación de nornicotina, demetil cotinina, trans-3-hidroxi-cotinina y ácido d(3-piridil)-g-metilaminobutírico, mediante P450 (CYP). Y en la segunda fase, se desencadena N-y O-glucuronidaión, las cuales involucran enzimas como la UDP-glucuronosiltransferasa (UGT), produciendo compuestos solubles en agua.
Primera fase del metabolismo de la nicotina
En la mayoría de las personas, entre el 70 y el 80% de la nicotina es metabolizada a cotinina mediante C-oxidación, este metabolito ha sido identificado en orina de humanos, ratones y conejos (19). El mecanismo propuesto para la conversión de nicotina en cotinina involucra la hidroxilación de la nicotina mediante enzimas microsomales y su conversión a su aldehído correspondiente con producción de cotinina por una enzima citosólica. (20). El ión imino se forma primero por pérdida de agua de la 50-hidroxinicotina y se convierte en cotinina (21). La (g-(3-piridil)-g-oxo-N-metilbutiramida es el metabolito que se aísla luego de administrar cotinina y ha sido detectado en la orina humana (22).
Luego de administrar (2)-cotinina, se aísla ácido 3-Pyridyl acético (23) y otros metabolitos como el ácido d-(3-piridil)-g-oxobutírico, los que también se convierten en ácido 3-piridil acético (24).
En orina se han aislado, además, demetil cotinina, nornicotina, y 3-hidroxicotinina, luego de la administración de (2)-nicotina y (2)-cotinina a humanos y animales (25), hay formación de 3-hidroxicotinina a partir de 14C-(2)-nicotina (26). También, se ha demostrado que la nicotinametil-14C se convierte en 3-hidroxicotinina, cotinina y d-(3-piridil)-g-oxo-N-metilbutiramida, mientras que la 14-C-cotinina se convierte en 3-hidroxicotinina, demetilcotinina y g-(3-piridil)-g-oxo-N-metilbutiramida (27). La etapa final de la primera fase consiste en N-oxidación y N-metilación (28), la formación de óxido nicotina-N-1 es catalizada por FMO3, una monooxigenasa hepática que contiene flavina, donde la N-oxidación de cotinina también tiene lugar, sin embargo, la enzima responsable de este proceso no ha sido identificada aún.
Estudios cinéticos diastreospecíficos de la oxidación de la nicotina en hígado porcino mostraron estereoselectividad en la formación de NO-oxidos-NO diastoméricos (29). La N-metilación y N-demetilación de la nicotina (30), se da luego de la administración de (2)-nicotina y (2)-cotinina a animales, los iones isometilnicotinio y cotinine metonio se forman como metabolitos urinarios (31).
Se ha demostrado que la N-metilación de la nicotina es una reacción estereoespecífica que involucra únicamente a (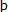 )-nicotina (32). La metilación de los enantiómeros de la nicotina con estereoselectividad por sustrato también ha sido observada en el citosol del hígado humano (33).
)-nicotina (32). La metilación de los enantiómeros de la nicotina con estereoselectividad por sustrato también ha sido observada en el citosol del hígado humano (33).
Segunda fase del metabolismo de la nicotina
Como se mencionó anteriormente, en esta fase se presenta N-y O-glucuronidación, mediante enzimas como la UDP-glucuronosiltransferasa (UGT), las cuales producen compuestos solubles en agua. Los conjugados de nicotina y sus metabolitos, con glucorónico, nicotina y cotinina N-glucurónidos son excretados en la orina (34). Las N-glucuronidaciones de nicotina y cotinina en microsomas hepáticos humanos muestran que la de nicotina es bifásica y la de cotinina es monofásica (35), ambas involucran UGT1A1, UGT1A9 y UGT1A4. Así mismo, otro metabolito CYP de la nicotina, trans-30-hidroxinicotina es conjugado mediante O-glucuronidación (36). La excreción de nicotina se da por orina, heces, bilis, saliva, jugo gástrico, sudor y leche (37, 38, 39).
En trabajos de experimentación con animales, se ha encontrado excreción de nicotina metabolizada en orina en un 55% y sin metabolizar en un 1%; el proceso metabólico puede ser afectado por el ácido ascórbico, el cual incrementa la excreción urinaria de cotinina y nicotina (40). La nicotina y cotinina se encuentran en la orina de los niños alimentados con leche de madres fumadoras, lo cual puede afectar al niño (41). Además, al estudiar la relación entre la tasa de excreción renal de nicotina y el consumo de esta, se ha encontrado que el consumo de nicotina es 18% mayor en personas con una excreción renal mayor, por lo cual se concluye que la tasa de eliminación influye directamente sobre el consumo (42). Pero la tasa de excreción de la nicotina está influenciada por el pH de la orina; cuando el pH es alcalino, la proporción de nicotina sin cargar es alta y por lo tanto, la reabsorción se aumenta, excretando menores cantidades, sucediendo lo contrario con la orina ácida (43).
EXPRESIÓN Y ACTIVIDAD DEL CITOCROMO P450 2A6 (CYP2A6) HUMANO
Las CYPs son enzimas que contienen hemo, las cuales catalizan el metabolismo de una amplia variedad de compuestos endógenos y exógenos, incluyendo polulantes ambientales y químicos de la dieta. Los genes CYP son designados utilizando un número para la familia, una letra para la subfamilia y un asterisco seguido por un número (s) para cada variante alélica (por ejemplo CYP2A6*2). Las CYPs se categorizan en familias y subfamilias dependiendo de las similaridades en su secuencia. Aquellas con secuencias de aminoácidos idénticas en más de un 40% pertenecen a la misma familia, mientras que aquellas que tienen secuencias idénticas en más del 55% pertenecen a la misma subfamilia. En humanos, 18 familias CYP y 43 subfamilias han sido reportadas (44). Las familias CYP1, CYP2 y CYP3 contienen las enzimas principalmente involucradas en el metabolismo de compuestos endógenos como las drogas. A la fecha han sido secuenciados 57 genes y 29 pseudogenes (no producen proteínas funcionales) (44). El gen CYP2A6 fue clonado y secuenciado en 1990 (45, 46) y comprende una región de 6kbp que contiene 9 exones y se ubica en el brazo largo del cromosoma 29 entre 19q12 y 19q13.2 (20, 21).
Existe una gran variabilidad interindividual e interétnica en la actividad y niveles de las enzimas CYP, lo cual puede llevar diferencia en los efectos y toxicidades de muchas drogas, clínicas o recreacionales, y compuestos ambientales (47). Las causas de esta variabilidad incluyen factores genéticos y ambientales. Se estima que entre el 20 al 40% de la variabilidad interindividual en el metabolismo de las drogas y la respuesta a las mismas puede ser atribuida a la existencia de polimorfismos en CYP (47).
La enzima CYP2A6, expresada principalmente en el hígado, fue reconocida por su papel en el metabolismo de la cumarina (48). Esta enzima es selectiva para la 7-hidroxilación de la cumarina, lo que hace a la cumarina un sustrato ideal para medir la actividad in vitro e in vivo de la CPY2A6. Además, CYP2A6 también está involucrada en la activación de muchos medicamentos y compuestos tóxicos y/o procancerígenos (49, 50, 51). Los polimorfismos en el gen CYP2A6 son responsables de la variabilidad en la actividad de la enzima, lo que indica que las variantes de CYP2A6 pueden influir, en la dosis necesaria, la acción y los efectos adversos de varias drogas, así como en los efectos adversos relacionados con la exposición a ciertos compuestos potencialmente tóxicos. Por ejemplo, las personas con alelos defectuosos de CYP2A6 también denominados metabolizadores lentos, pueden estar parcialmente protegidos de la hepatotoxicidad causada por ciertas drogas como el ácido valproico (52) o halotano (53), que son metabólicamente activadas por CYP2A6; por otro lado, las personas con copias extra de CYP2A6, pueden estar en gran riesgo de hepatotoxicidad.
Se sabe que la frecuencia alélica de CYP2A6 varía entre los diferentes grupos étnicos, afectando de manera interétnica la habilidad promedio para metabolizar sustratos de CYP2A (54).
CYP2A6 Y EL HÁBITO DE FUMAR
En años recientes se ha estudiado la relación entre CYP2A6 y el metabolismo de la nicotina, encontrándose que la enzima es responsable en más del 90% del paso que inactiva mediante C-oxidación la nicotina convirtiéndola en cotinina (55). En algunos individuos pequeñas contribuciones de CYP2B6 han sido detectadas (56).
Diversos estudios han demostrado que existen diferencia étnicas en el metabolismo de la nicotina, por ejemplo, los afroamericanos muestran una depuración reducida de la cotinina, así como conversión fraccionada de nicotina a cotinina (57); la relación cotinina a nicotina es elevada en koreanos cuando se compara con los japoneses, y los chinoamericanos metabolizan un 25% más lentamente nicotina al compararlos con los caucásicos y los latinos (58).
Las tasas de metabolismo alteradas pueden afectar la conducta de fumar, el riesgo de cáncer relacionado con el tabaco y el tratamiento de la adicción a la nicotina, así como otros desórdenes relacionados con terapias de reemplazo a base de nicotina. Se ha estimado que aproximadamente un tercio de la población global mayor de 15 años fuma, y que anualmente el número promedio de muertes asociadas al consumo del tabaco es de 3'000.000 en todo el mundo (59).
Se ha demostrado que el hábito de fumar está influenciado por factores genéticos y ambientales (60). Muchos estudios muestran que la genética contribuye con el 50% de la iniciación en el hábito y en más del 70% del mantenimiento del mismo (61). La nicotina es la sustancia responsable de la adicción al tabaco (62). Además los fumadores ajustan la conducta de fumar para mantener constante los niveles de nicotina en sangre y cerebro (63), lo cual es controlado por el consumo de nicotina y su metabolismo (remoción). Las variantes de CYP2A6 pueden alterar la tasa metabólica de la nicotina y por lo tanto, la cantidad de nicotina que circula en la sangre, es decir que los metabolizadotes lentos, tienen problemas menores de dependencia, pero al tener niveles de nicotina prolongados por más tiempo en el organismo, van a estar más expuestos a los efectos adversos de la nicotina (64). Pero, también se ha demostrado que los individuos con alelos inactivos CYP2A compensan su metabolismo disminuido con un menor consumo (65) y las personas con copias extras de CYP2A, de metabolismo rápido, lo compensan fumando más e inhalando el humo con mayor intensidad. Además los individuos con alelos de CYP2A inactivos comienzan a fumar más tarde, en promedio 3 años después, fuman por un período de tiempo menor, aproximadamente 9 años menos y tienen 1,75 veces más probabilidad de dejar de fumar que los fumadores con CYP2A6 normal (66).
Otro aspecto importante a tener en cuenta es que se ha establecido una relación directa entre el consumo de tabaco y el cáncer de pulmón, así como con otras formas de cáncer (67). Está claro que a mayor consumo de cigarrillos por día, mayor riesgo, agravado por el hecho de que los cigarrillos contienen cientos de compuestos, de los cuales los hidrocarbonos aromáticos policíclicos y la nitrosamina específica del tabaco (NNK) se relacionan directamente con el cáncer de pulmón (68). Los estudios de citotoxicidad y mutagenicidad, han revelado que CYP2A6 está presente en hígado y en pequeñas cantidades en pulmón (69), y puede activar eficientemente NNK y otras nitrosaminas presentes en el tabaco, como N-nitrosodietilamina (NNN) a intermediarios carcinogénicos (70), por lo cual los individuos con una actividad disminuida de CYP2A6, pueden estar de alguna manera protegidos contra el cáncer (71).
Es importante también mencionar que si se tiene en cuenta que las variantes inactivas de CYP2A6 pueden influir disminuyendo el hábito de fumar, se puede esperar que al inhibir de alguna manera la CYP2A6, se produzca el mismo efecto, esto con el fin de mejorar los tratamientos instaurados para el manejo de la adicción a la nicotina, por lo cual la dosis de nicotina oral a suministrar puede ser menor, evitando efectos indeseables sobre el sistema digestivo (72). Por eso algunos estudios muestran que algunos inhibidores de la CYP2A6, como el methoxsalen y la tranilcipromina, suministrados en combinación con nicotina oral, incrementan los niveles de nicotina en plasma, y son responsables de reducciones significativas de los niveles de monóxido de carbono en sangre, medidos luego de inhalar humo de cigarrillo, mostrando además una disminución en el número de cigarrillos consumidos por día, cuando se comparan con el suministro de placebos o de nicotina oral (73).
CONCLUSIÓN
Teniendo en cuenta el papel decisivo de la enzima CYP2A6 en el metabolismo de la nicotina, su relación con el hábito de fumar y el cáncer producto del consumo de tabaco, sería valioso estudiar la genética de nuestra región para inferir si existen variantes enzimáticas, que puedan proteger de manera natural a nuestras poblaciones, o si se pueden tomar medidas tendientes a controlar el hábito de fumar en los grupos poblacionales vulnerables, utilizando según sea el caso, inhibidores de CYP2A6. Todavía hace falta mucha experimentación acerca del metabolismo mediado con CYP2A6 y sus efectos benéficos o nocivos relacionados con el consumo del tabaco.
REFERENCIAS
1. Arcury TA, Quandt SA, Preisser JS, Bernert JT, Norton D, Wang J. High levels of transdermal nicotine exposure produce green tobacco sickness in Latino farmworkers. Nicotine Tob Res 2003;5(3):315-321. [ Links ]
2. Mills EJ, Wu P, Spurden D, Ebbert J, Wilson K. Efficacy of pharmacotherapies for short-term smoking abstinence: A systematic review and meta-analysis. Harm Reduct J 2009;6(25): 1-16. [ Links ]
3. Dome P, Lazary J, Kalapos MP, Rihmer Z. Smoking, nicotine and neuropsychiatric disorders. Neurosci Biobehav Rev 2009. 34(3):295-342. [ Links ]
4. Williams JM, Gandhi KK. Use of caffeine and nicotine in people with schizophrenia. Curr Drug Abuse Rev 2008 Jun;1(2):155-161. [ Links ]
5. Thunnissen FB. Acetylcholine receptor pathway and lung cancer. J Thorac Oncol 2009 Aug;4(8):943-946. [ Links ]
6. Zhang W, Kilicarslan T, Tyndale RF, Sellers EM. Evaluation of methoxsalen, tranylcypromine, and tryptamine as specific and selective CYP2A6 inhibitors in vitro. Drug Dispos 2001;29:897-902. [ Links ]
7. Sellers EM, Kaplan HL, Tyndale RF. Inhibition of cytochrome P450 2A6 increases nicotine's oral bioavaiability and decreases smoking. Clin Pharmacol Ther 2000;6835-6843. [ Links ]
8. Kharasch ED, Hankins DC, Taraday JK. Single-dose methoxsalen effects on human cytochrome P-450 2A6 activity. Drug Metab Dispos 2000;28:28-33. [ Links ]
9. Armitage AK, Turner DM. Absorption of nicotine in cigarette and cigar smoke through the oral mucosa. Nature 1970;27:1231-1232. [ Links ]
10. Gupta SK, Benowitz NL, Jacob P 3rd, Rolf CN, Gorsline J. Bioavailability and absorption kinetics of nicotine following application of a transdermal system. Br J Clin Pharmacol 1993;36(3):221-227. [ Links ]
11. Benowitz NL, Jacob P 3rd. Metabolism of nicotine to cotinine studied by a dual stable isotope method. Clin Pharmacol Ther 1994;56(5):483-493. [ Links ]
12. Benowitz NL, Kuyt F, Jacob P 3rd, Jones RT, Osman AL. Cotinine disposition and effects. Clin Pharmacol Ther 1983;34(5):604-611. [ Links ]
13. Hatsukami DK, Grillo M, Pentel PR, Oncken C, Bliss R. Safety of cotinine in humans: physiologic, subjective, and cognitive effects. Pharmacol Biochem Behav 1997;57(4):643-650. [ Links ]
14. Robinson DE, Balter NJ, Schwartz SL. A physiologically based pharmacokinetic model for nicotine and cotinine in man. J Pharmacokinet Biopharm 1992;20(6):591-609. [ Links ]
15. Nakajima M, Kuroiwa Y, Yokoi T. Interindividual differences in nicotine metabolism and genetic polymorphisms of human CYP2A6. Drug Metab Rev 2002;34(4):865-877. [ Links ]
16. Rush R, Kuryatov A, Nelson ME, Lindstrom J. First and second transmembrane segments of alpha3, alpha4, beta2, and beta4 nicotinic acetylcholine receptor subunits influence the efficacy and potency of nicotine. Mol Pharmacol 2002;61(6):1416-1422. [ Links ]
17. Singer J, Janz T. Apnea and seizures caused by nicotine ingestion. Pediatr Emerg Care 1990;6(2):135-137. [ Links ]
18. Arcury TA, Quandt SA, Simmons S. Farmer health beliefs about an occupational illness that affects farmworkers: the case of green tobacco sickness. J Agric Saf Health 2003;9(1):33-45. [ Links ]
19. McKennis JH, Turnbull LB, Bowmann ER. (3-Pyridyl)-methylamino butyric acid as a urinary metabolite of nicotine. J Am Chem Soc 1957;79:6342-6343. [ Links ]
20. Hucker HB, Gilette JR, Brodie BB. Enzymatic pathway for the formation of cotinine, a major metabolite of nicotine in rabbit liver. J Pharmacol Exp Ther 1960;129:94-100. [ Links ]
21. Murphy, PJ. Enzymatic oxidation of nicotine to nicotine iminium ion. J Biol Chem 1973; 248: 2796-2800. [ Links ]
22. McKennis H, Bowman ER, Turnbull LB. The isolation and the structure of a ketoamide arising from the metabolism of nicotine. J Am Chem Soc 1960;82:3974-3976. [ Links ]
23. McKennis H, Bowman, ER, Turnbull LB. Mammalian degredation of nicotine to 3-pyridyl acetic acid and other compounds. Proc Soc Exp Biol Med 1961;107:145-148. [ Links ]
24. McKennis H, Schwartz, SL, Bowman, ER. Alternate routes in the metabolic degredation of the pyyrolidine ring of nicotine. J Biol Chem 1964;239:3990-3996. [ Links ]
25. Bowman ER, McKennis H. Studies on the metabolism of cotinine in the human. J Pharmacol Exp Ther 1962;135: 306-311. [ Links ]
26. Hansson EH, Hoffmann PC, Schmiterlow CG. Metabolism of nicotine in mouse tissue slices. Acta Physiol Scand 1964;61:380-392. [ Links ]
27. Stalhandsko T. The metabolism of nicotine and cotinine by a mouse liver preparation. Acta Physiol Scand 1970;78:236-248. [ Links ]
28. Papdopulos NM. Nicotine-1-oxide. Arch Biochem Biophys 1964;106:182-185. [ Links ]
29. Nakajima M, Iwata K, Yoshida T, Yamamoto T, Kuroiwa Y. Diastereospecific kinetics of nicotine N0-oxidation in rat liver microsomes. Xenobiotica 1998;28(2):127-135. [ Links ]
30. Gorrod JW, Schepers G, Jacob P. Analytical determination of nicotine and related compounds and their metabolites. Elsevier, Amsterdam. p. 45-67. [ Links ]
31. McKennis H, Turnbull LB, Brownmann EB. Nmethylation of nicotine and cotinine in vivo. J Biol Chem 1963;238:719-723. [ Links ]
32. Cundy KC, Godin KS, Crooks PA. Evidence of stereospecifity in the in vivo methylation of nicotine in the guinea pig. Drug Metab Dispos 1984;12:755-759. [ Links ]
33. Crooks PA, Godin CS. N-methylation of nicotine enantiomers by human liver cytosol. J Pharm Pharmacol 1988;40:153-154. [ Links ]
34. Tsai MC, Gorrod JW. Evidence for the biosynthesis of A glucuronide conjugate of (S)-(2)-nicotine, but not (S)-(2)-cotinine or (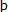 /2)-trans-30-hydroxycotinine by marmoset hepatic microsomes. Drug Metabol Drug Interact 1999;15(4):223-237. [ Links ]
/2)-trans-30-hydroxycotinine by marmoset hepatic microsomes. Drug Metabol Drug Interact 1999;15(4):223-237. [ Links ]
35. Nakajima M, Yamamoto T, Nunoya K, Yokoi T, Nagashima K, Inoue K, Funae Y, Shimada N, Kamataki T, Kuroiwa Y. Role of human cytochrome P4502A6 in C-oxidation of nicotine. Drug Metab Dispos 1996;24(11):1212-1217. [ Links ]
36. Benowitz NL, Jacob P. Effects of cigarette smoking and carbon monoxide on nicotine and cotinine metabolism. Clin Pharmacol Ther 2000;67(6):653-659. [ Links ]
37. Perlman HH, Dannenberg AM, Bokolof N. The excretion of nicotine in breast milk and urine from cigarette smoking its effect on location and the nursling. J Am Med Assoc 1942;120:1003-1009. [ Links ]
38. Turner DM. The metabolism of nicotine in the cat. Biochem J 1969;115:889-896. [ Links ]
39. Seaton MJ, Kyerematen GA, Vesell ES. Rates of excretion of cotinine, nicotine glucuronide, and 3-hydroxycotinine glucuronide in rat bile. Drug Metab Dispos 1993;21(5):927-932. [ Links ]
40. Dawson EB, Evans DR, Harris WA, McGanity WJ. The effect of ascorbic acid supplementation on the nicotine metabolism of smokers. Prev Med 1999;6(Pt 1):451-454. [ Links ]
41. Luck W., Nau H. 1985. Nicotine and cotinine concentrations in serum and urine of infants exposed via passive smoking or milk from smoking mothers. J Pediatr 1999;107(5):816-820. [ Links ]
42. Benowitz NL, Jacob P. Nicotine renal excretion rate influences nicotine intake during cigarette smoking. J Pharmacol Exp Ther 1985;234(1):153-155. [ Links ]
43. Becket AH, Rowland M, Triggs EJ. Significance of smoking in investigation of urinary excretion rates of amines in man. Nature1965;207:200-201. [ Links ]
44. Nelson DR. Cytochrome P450. Homepage; 2002. http://drnelson.utmem.edu/CytochromeP450.html. [ Links ]
45. Yamano S, Tatsuno J, González F. The CYP2A3 gene product catalyses coumarin 7-hydroxylation in human liver microsomes. Biochemistry 1990;29: 1322-1329. [ Links ]
46. Miles J, McLaren A, Forrester M, Glancey M, Lang M, Wolf C. Identification of the human liver cytochrome P-450 responsible for coumarin 7-hydroxylase activity. Biochem J 1990;267:365-371. [ Links ]
47. Ingelman-Sundberg M. Pharmacogenetics: an opportunitybioavailfor a safer and more efficient pharmacotherapy. J Intern Med 2001;250:186-200. [ Links ]
48. Raunio H, Syngelma T, Pasanen M, Juvonen R, Honkakoski P, Kairaluoma MA, Sotaniemi E, Lang MA, Pelkonen O. Immunochemical and catalytical studies on hepatic coumarin 7-hydroxylase in man, rat, and mouse. Biochem Pharmacol 1988;37:3889-3895. [ Links ]
49. Li Y, Li NY, Sellers EM. Comparison of CYP2A6 catalytic activity on coumarin 7-hydroxylation in human and monkey liver microsomes. Eur J Drug Metab Pharmacokinet 1997;22:295-304. [ Links ]
50. Yamano S, Tatsuno J, González F. The CYP2A3 gene product catalyses coumarin 7-hydroxylation in human liver microsomes. Biochemistry 1990;29:1322-1329. [ Links ]
51. Hoffman SM, Fernández P, Salguero FJ, González, HW Mohrenweiser. Organization and evolution of the cyto-chrome P450 CYP2A-2B-2F subfamily gene cluster on human chromosome 19. J Mol Evol 1995;41:894-900. [ Links ]
52. Sadeque AJ, Fisher MB, Korzekwa K, González FJ, Rettie AE. Human CYP2C9 and CYP2A6 mediate formation of the hepatotoxin 4-ene-valproic acid. J Pharmacol Exp Ther 1997;283:698-703. [ Links ]
53. Zaccaro C, De Matteis F, Pahler F, Dekant W. Neoantigen formation and clastogenic action of HCFC-123 and perch-loroethylene in human MCL-5 cells. Toxicol Lett 2001;124:129-138. [ Links ]
54. Benowitz NL, Pérez Stable EJ, Herrera B, Jacob P 3rd. Slower metabolism and reduced intake of nicotine from cigarette smoking in Chinese-Americans. J Natl Cancer Inst 2002;94:108-115. [ Links ]
55. Benowitz NL, Jacob P 3rd. Metabolism of nicotine to cotinine studied by a dual stable isotope method. Clin Pharmacol Ther 1994;56:483-493. [ Links ]
56. Messina ES, Tyndale RF, Sellers EM. A major role for CYP2A6 in nicotine C-oxidation by human liver micro somes. J Pharmacol Exp Ther 1997;282:1608-1614. [ Links ]
57. Benowitz NL, Pérez Stable EJ, Fong I, Modin G. Nicotine and cotinine. J Pharmacol Exp Ther 1999;291:1196-1203. [ Links ]
58. Pérez Stable EJ, Herrera B, Jacob P, Benowitz NL. Nicotine metabolism and intake in black and white smokers. J Am Med Assoc 1998;280:152-156. [ Links ]
59. WHO. Guidelines for Controlling and Monitoring the Tobacco Epidemic. Geneva: WHO; 1998. [ Links ]
60. True WR, Heath AC, Scherrer JF, Waterman B, Goldberg J, Lin N, Eisen SA, Lyons MJ, Tsuang MT. Genetic and environmental contributions to smoking. Addiction 1997;92:1277-1287. [ Links ]
61. Madden PA, Heath AC, Pedersen NL, Kaprio J, Koskenvuo MJ, Martin NG. The genetics of smoking per-sistence in men and women: a multicultural study. Behav Genet 1999;29:423-431. [ Links ]
62. Henningfield JE, Miyasato K, Jasinski DR. Abuse liability and pharmacodynamic characteristics of intravenous and inhaled nicotine. J Pharmacol Exp Ther 1985;234:1-12. [ Links ]
63. McMurrow MJ, Fox RM. Nicotine's role in smoking: an analysis of nicotine regulation. Psychol Bull 1983;93:302-327. [ Links ]
64. Tyndale RF, Sellers EM. Genetic variation in CYP2A6-medicated nicotine metabolism alters smoking behavior. Ther Drug Monit 2002;24:163-171. [ Links ]
65. Rao Y, Hoffmann E, Zia M, Bodin L, Zeman M, Sellers M, Tyndale RF. Duplications and defects in the CYP2A6 gene: identification, genotyping, and in vivo effects on smoking. Mol Pharmacol 2000;58:747-755. [ Links ]
66. Gu DF, Hinks LJ, Morton NE, Day INM. The use of long PCR to confirm three common alleles at the CYP2A6 locus and the relationship between genotype and smoking habit. Ann Hum Genet 2000;64:383-390. [ Links ]
67. Hara H, Nakanishi Y, Izumi M. Epidemiology of lung cancer in Japan. Nippon Rinsho 2000;58:1005-1011. [ Links ]
68. Hecht SS. Tobacco smoke carcinogens and lung cancer. J Natl Cancer Inst 1999;91:1194-1210. [ Links ]
69. Su T, Bao Z, Zhang QY, Smith TJ, Hong JY, Ding X. Human cytochrome P450 CYP2A13: predominant expres-Toxsion in the respiratory tract and its high efficiency metabolic activation of a tobacco-specific carcinogen, 4-(methylnit-rosamino)-1-(3-pyridyl)-1-butanone. Cancer Res 2000;60:5074-5079. [ Links ]
70. Patten CJ, Smith TJ, Tynes R, Friesen M, Lee J, Yang CS, Murphy SE. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine a-hydroxylation in human liver microsomes. Carcinogenesis 1997;18:1623-1628. [ Links ]
71. Hecht SS. Inhibition of carcinogenesis by isothiocyanates. Drug Metab Rev 2000;32:395-411. [ Links ]
72. Giovino GA, Shelton DM, Schooley MW. Trends in cigarette smoking cessation in the United States. Tobacco Control 1993;2(suppl):3-16. [ Links ]
73. Sellers EM, Kaplan HL, Tyndale RF. Inhibition of cytochrome P450 2A6 increases nicotine's oral bioavailability and decreases smoking. Clin Pharmacol Ther 2000;68:35-43. [ Links ]














