Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.9 no.2 Manizales July/Dec. 2010
COMPOSICIÓN QUÍMICA Y ACTIVIDAD ACARICIDA DEL ACEITE ESENCIAL DE CYMBOPONGON CITRATUS STAPF CONTRA EL ACARO INTRADOMICILIARIO DERMATOPHAGOIDES FARINAE (ACARI:PYROGLYPHIDAE)
CHEMICAL COMPOSITION AND ACARICIDAL ACTIVITY OF ESSENTIAL OIL CYMBOPONGON CITRATUS STAPF AGAINST HOUSE DUST MITE DERMATOPHAGOIDES FARINAE (ACARI: PYROGLYPHIDAE)
Dary Luz Mendoza Meza1 y Manuel Taborda2
1 Docente, Grupo de Investigaciones Biomédicas. Facultad de Ciencias de la Salud. Programa de Medicina, Universidad del Magdalena. Carrera 32 No. 22-08 Sector San Pedro Alejandrino, Santa Marta, Colombia. PBS: (57-5) 4301292 Ext. 326- 327. E-mail: dary_mendoza@yahoo.com.
2 Docente, Grupo de Investigaciones Fitoquímicas. Facultad de Ciencias Básicas, Laboratorio de Química, Universidad del Magdalena. Carrera 32 No. 22-08 Sector San Pedro Alejandrino, Santa Marta, Colombia. PBS: (57-5) 4301292 Ext. 160. E-mail: quimicataborda@yahoo.es.
Recibido: febrero 19 de 2010 - Aceptado: agosto 18 de 2010
RESUMEN
Los ácaros del polvo son fuente importante de alérgenos intradomiciliarios, por lo que su control biológico es una prioridad en la prevención y control de la sensibilización alérgica. El propósito de este trabajo fue obtener el aceite esencial de hojas de Cymbopongon citratus Stapf y evaluar su actividad acaricida sobre Dermatophagoides farinae. El aceite esencial se obtuvo por hidrodestilación y extracción con diclorometano. La composición química relativa del aceite fue determinada por CG-EM. Se realizaron bioensayos de concentración- respuesta en papeles filtros tratados con 5; 0,5; 0,05 y 0,005 µL del aceite esencial/cm2 de papel. La ausencia de movimiento del ácaro al contacto con una aguja fina se tomó como indicador de muerte. El rendimiento de extracción del aceite fue 1,22% v/p de hojas frescas. El análisis de CG-EM reveló el citral (41,8% de geranial y 34,9% de neral) como componente mayoritario. El efecto tóxico del aceite esencial del C. citratus Stapf sobre el ácaro D. farinae fue proporcional a la concentración y tiempo de exposición. A una concentración de 0,5 µL/cm2 de aceite esencial, el 46,67% de los ácaros murieron después de 60 minutos de exposición. Estos resultados permitieron comprobar una alta actividad tóxica del aceite esencial de C. citratus Stapf sobre el ácaro D. farinae, este efecto puede estar relacionado con la presencia del geranial y neral, monoterpenos análogos a la octopamina, un neurotransmisor periférico de insectos.
PALABRAS CLAVE: Cymbopogon citratus Stapf, ácaros intradomiciliarios, Dermatophagoides farinae, aceites esenciales, actividad acaricida.
ABSTRACT
Dust mites are an important source of intradomiciliary allergens reason why their the biological control is a priority in the prevention and control of allergic sensitization. The purpose of this work was to obtain the essential oil of leaves of Cymbopongon citratus Stapf and evaluate its acaricidal activity on Dermatophagoides farinae mite. The essential oil was obtained through hydrodistillation and extraction with dichloromethane. The relative chemical composition of the oil was determined by GC-MS. Concentration-response bio essays were carried out in filter paper treated with 5, 0.5, 0.05, and 0.005 µL of essential oil/cm2. The absence of dust mite movement when they touched with a fine needle was considered as an indicator of death. The oil extraction yield was 1.22 % v/w of fresh leaves. The GC-MS analysis revealed citral (41.8% of geranial over 34.9% of neral) as a major component. The toxic effect of the C. citratus Stapf essential oil on dust mites D. farinae was proportional to concentration and time exposure. Using a 0.5 µL/cm2 concentration of essential oil, 46.67% of dust mites died after 60 minutes exposure. These results allowed the verification of a high toxic activity of C. citrates Stapf essential oil on D. farinae mites; this effect may be related to the presence of geranial and neral monoterpenes analogue to octopamine, an peripheral neurotransmitter in insect.
KEY WORDS: Cymbopogon citrates Stapf, domiciliary dust mites, Dermatophagoides farinae, essential oils, acaricidal activity.
INTRODUCCIÓN
Los aceites esenciales son metabólicos secundarios producidos por las plantas, están compuestos por una mezcla compleja de terpenoides, principalmente, monoterpenos (C10), sesquiterpenos (C15), y una variedad de fenoles aromáticos, óxidos, éteres, alcoholes, esteres, aldehidos y cetonas que determinan el aroma y el olor característico de la planta (1, 2). La presencia de monoterpenos volátiles o aceites esenciales en las plantas constituye una importante estrategia de defensa contra animales herbívoros y en particular contra plagas de insectos y hongos patógenos (2). Estos aceites se emplean en las industrias farmacéutica, cosmética y alimentaria; su rendimiento varía desde unas cuantas milésimas por ciento hasta 1-7% del peso fresco de material vegetal (3, 4).
Cymbopogon citratus Stapf es una planta herbácea, pertenece a la familia Poaceae (Graminae), su nombre común es limonaria, se cultiva en Brasil, India, Argentina, Guatemala e Indonesia por su aceite esencial (5), y su constituyente principal es el citral (70 - 80%), el cual es usado como materia prima para la síntesis de compuestos aromáticos y vitamina A, además de emplearse en perfumería (6, 7, 8). En Colombia el C. citratus Stapf está adaptado a los diversos pisos climáticos, es frecuente encontrarlo en avenidas y jardines familiares como planta ornamental y medicinal. El C. citratus Stapf se usa como anticatarral, febrífugo, antitusivo, estomáquico, carminativo, expectorante y ansiolítico, para aliviar el vómito, antiespasmódico, antitusivo, analgésico, antipirético, como depresor del sistema nervioso central y para disminuir el colesterol. Se reporta también como antipalúdico, diaforético y estimulante, diurético y en el control de la presión arterial (9).
Se ha descrito el uso de los aceites esenciales para el control de plagas (10), también se han evaluado sus propiedades acaricidas e insecticidas (11, 12), especialmente en el control de las plagas que afectan los granos, cereales y otros productos agrícolas de almacenamiento (13, 14, 15). Adicionalmente, se ha demostrado que los aceites esenciales y sus componentes pueden utilizarse para eliminar ácaros parásitos y de vida libre (16). En el 2004 Hoiseon L. reportó el efecto acaricida del p-anisaldehído, un componente del aceite de las semillas de la Pimpinella anisum Linnaeus (17). También se ha reportado la actividad acaricida de 14 aceites esenciales y sus constituyentes monoterpénicos principales contra el ácaro del polvo de habitación Dermatophagoides pteronyssinus (18). Adicionalmente, se notificó el efecto acaricida contra dos ácaros de la familia Pyroglyphidae, Dermatophagoides farinae y Dermatophagoides pteronyssinus, por la planta herbal Mentha pulegium Linnaeus. (pennyroyal) (19).
El ácaro intradomiciliario Dermatophagoides farinae es un importante factor desencadenante y sensibilizante de las alergias respiratorias, como asma (20, 21, 22). Esta enfermedad es un problema de salud mundial, con aproximadamente 300 millones de personas afectadas (23). En Colombia la prevalencia de pacientes asmáticos es alta, un estudio epidemiológico realizado en seis ciudades de Colombia reportó prevalencias de: 9,4% en Bogotá; 10,7% en Cali; 11,5% en Bucaramanga; 11,7% en San Andrés; 13% en Medellín y 8,1% en Barranquilla (24). Por otra parte, la evidencia epidemiológica indica que la exposición a los alérgenos ambientales es un factor de riesgo para el asma y que la disminución en la exposición a estos alérgenos reduce a la mitad el riesgo de sufrir hiperreactividad respiratoria (25). Por lo anterior, la búsqueda de estrategias encaminadas a disminuir la población de ácaros del polvo de los ambientes intramuros, es de especial interés para la prevención de la sintomatología clínica de las alergias respiratorias.
Este artículo reporta la composición química del aceite esencial de las hojas de C. citratus Stapf, colectado en la zona urbana del Distrito de Santa Marta, departamento del Magdalena, y la evaluación de su actividad acaricida contra ácaros nativos de la especie D. farinae.
MATERIALES Y MÉTODOS
Material vegetal y método de extracción de los aceites esenciales
Las hojas de C. citratus Stapf fueron colectadas en marzo de 2009, en el barrio Once de Noviembre del Distrito de Santa Marta, ubicado a 45 msnm. Una muestra fue depositada en el Herbario de la Universidad del Magdalena UTM 1200 con el número 6. Las hojas frescas fueron sometidas a hidrodestilación por arrastre de vapor por 6 h. El aceite fue extraído con diclorometano y almacenado en viales a baja temperatura antes del análisis de su composición química. La productividad se calculó a partir de la relación del volumen de aceite volátil obtenido y la masa de material vegetal fresco usado en la extracción.
Cromatografía de Gases acoplada a espectrometría de masas (CG-EM)
El análisis del aceite esencial se llevó a cabo en el Laboratorio de Cromatografía de la Universidad Industrial de Santander, en un cromatógrafo de gases Agilent Technologies 6890 Plus acoplado a un detector selectivo de masas (MSD, Agilent Technologies 5973) operado en el modo de barrido completo de radiofrecuencias (full scan). La columna empleada en el análisis fue DB-5MS [5%-fenil-poli (dimetilsiloxano), 60 m x 0,25 mm x 0,25 µm] (J & W Scientific, Folsom, CA, EE.UU). La inyección se realizó en modo Split (50:1), Viny = 1µL. Los compuestos determinados en la muestra de aceite esencial se identificaron con base en sus índices de retención de Van den Dool y Kratz (26) y por comparación de los espectros de masas obtenidos y los almacenados en la bases de datos del NIST y otros espectros de masa publicados por Wiley y Adams (27).
Bioensayo
- Material biológico. Los ácaros de la especie Dermatophagoides farinae, usados para evaluar la actividad acaricida del aceite esencial de C. citrarus Stapf, fueron obtenidos de un cultivo puro en fase de crecimiento exponencial que se encuentra en el Laboratorio de Bioquímica de la Universidad del Magdalena (Figura 1). Los cultivos fueron establecidos a partir de individuos silvestres aislados de muestras de polvo intradomiciliario colectadas en el Distrito de Santa Marta en noviembre de 2007. Después de haber sido aislados, los ácaros fueron identificados mediante las claves pictóricas de Collof y Spierman (28) y mantenidos en oscuridad bajo condiciones controladas de temperatura y humedad relativa (28 ± 2°C y HR: 60 ± 5%), usando como medio nutritivo harina de pescado y levadura seca en proporción 1:1.
- Ensayo acaricida. El método utilizado para evaluar la susceptibilidad de los ácaros D. farinae a los componentes volátiles del aceite esencial de C. citratus fue adaptado del experimento descrito por Kwon y Ahn (29). Se seleccionaron 150 individuos adultos de ambos sexos, los cuales fueron transferidos a cajas de petri de 5 cm de diámetro x 1,2 cm de alto. Para evaluar la relación concentración-respuesta, se realizaron cinco tratamientos con diferentes concentraciones del aceite esencial. El procedimiento consistió en aplicar el aceite sobre un disco de papel filtro Whatman No.1 de 47 mm de diámetro, el cual fue fijado previamente a la cara superior interna de la caja de petri. Por cada cm2 del filtro se aplicó 5; 0,5; 0,05 y 0,005 µL de aceite esencial diluido en etanol al 70%, también se realizó un ensayo testigo con 1mL de etanol al 70%. Todos los ensayos se realizaron por triplicado. Los ácaros fueron mantenidos bajo las mismas condiciones ambientales en cada tratamiento, temperatura de 28 ± 2°C y HR de 60 ± 5%. La mortalidad de los ácaros fue evaluada a los 60, 120 y 180 minutos de exposición a cada tratamiento. La ausencia de movimiento del ácaro, después de ser tocado con una aguja fina, fue considerada como indicador de muerte.
Los datos obtenidos fueron sometidos a un análisis estadístico univariado utilizando medidas de frecuencia, pruebas de tendencia central y de dispersión. Se realizó un análisis de varianza, para establecer si existían diferencias significativas entre los tratamientos. También se aplicó un análisis de regresión a las curvas concentración-respuesta, las rectas obtenidas se compararon para determinar la homogeneidad de los bioensayos. Todas las pruebas se realizaron con el programa Statgraphics Plus 5-1.
RESULTADOS
Composición química del aceite esencial
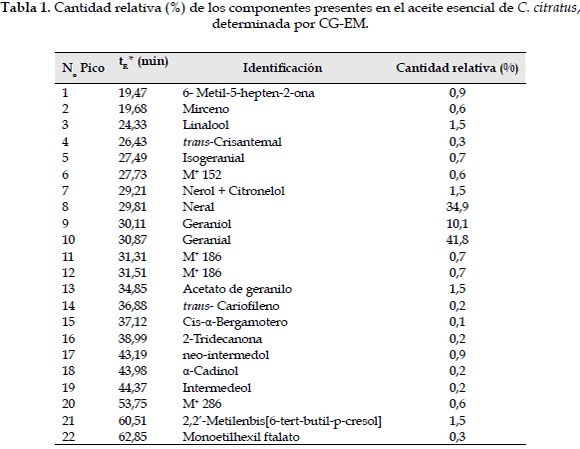
La eficiencia de extracción del aceite esencial de las hojas del C. citratus fue de 1,22% v/p de hojas frescas. El análisis por CG/EM permitió la identificación de 18 compuestos que representan el 97,4% de los constituyentes del aceite esencial. Los componentes mayoritarios identificados fueron los monoterpenos geranial (41,8%) y neral (34,9%), los cuales constituyen una mezcla de esteroisomeros conocida como citral, siendo este el 76,7% del aceite obtenido. Otros componentes minoritarios identificados fueron terpenos, alcoholes, aldehídos, cetonas, esteres y compuestos aromáticos (Tabla 1).
La investigación química del aceite esencial de hojas de C. citratus, colectado en el Distrito de Santa Marta revela una alta concentración de monoterpenos (94,3%), estos datos son consistentes con los reportados en la literatura científica (5, 9, 30, 31, 32, 33).
Actividad acaricida del aceite esencial (Mortalidad)
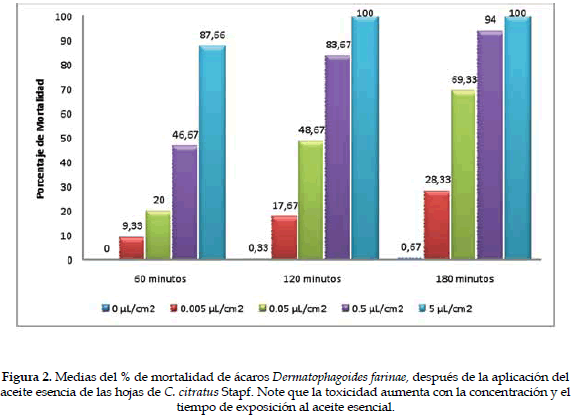
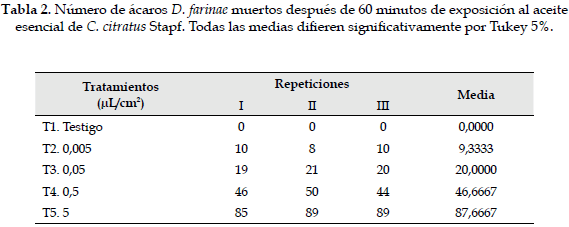
El bioensayo de actividad acaricida permitió demostrar que los compuestos presentes en la fase de vapor del aceite esencial de las hojas de C. citratus Stapf son tóxicos para el ácaro D. farinae. La toxicidad fue proporcional a la concentración del aceite; sin embargo, no hubo diferencia significativa entre el tiempo de exposición de 120 y 180 minutos para los diferentes tratamientos (Figura 2). La Tabla 2 muestra el número de ácaros muertos después de 60 minutos de realizada la aplicación del aceite, y se observa un 46,67% de individuos muertos a una concentración de 0,5 µL/cm2.
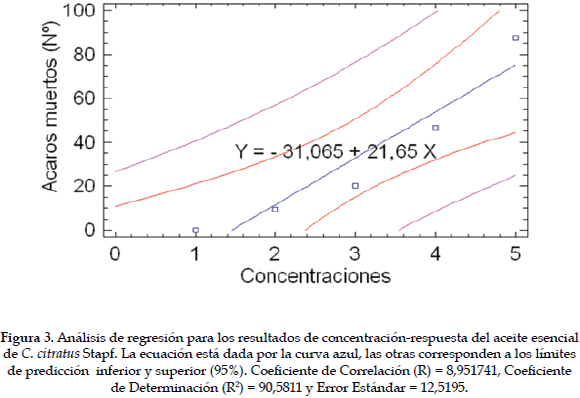
El análisis de varianza mostró diferencias significativas entre tratamientos (Gl = 4), (F =1101.39), (p = 0,0). Tukey 5% señala que cada uno de los tratamientos fue significativamente diferente del otro. Cualquier concentración de aceite esencial de C. citratus Stapf usada mata a los ácaros, pero la concentración de 5 µL/cm2 es la más efectiva porque mata el mayor porcentaje de ácaros (87,6%) a los 60 minutos de exposición (Tabla 2). El análisis de regresión concentración-respuesta muestra que la mortalidad de los ácaros depende de la concentración del aceite esencial utilizada (Figura 3). Debido a que el efecto tóxico del aceite sobre los ácaros es rápido, se deben hacer observaciones a intervalos de tiempo más corto para el cálculo del TL50 y la CL50.
DISCUSION
Los aceites esenciales de las plantas se consideran actualmente como una fuente alternativa de principios bioactivos con uso potencial en el control de los ácaros de almacenamiento. La actividad acaricida de muchos aceites esenciales se ha relacionado positivamente con su composición en monoterpenos, y en el caso particular del Dermatophagoides sp, se ha reportado actividad acaricida de los monoterpenos cinamaldehido, clorotimol y citronelol (11). En el presente estudio se observó que el aceite esencial de las hojas de C. citratus Stapf posee una fuerte actividad acaricida contra individuos adultos de la especie D. farinae, lo que puede estar relacionado con su alto contenido en monoterpenos. Estudios anteriores han reportado el efecto insecticida del aceite esencial de C. citratus contra garrapatas y piojos (34, 35), larvas de Aedes aegypti Linnaeus (36) y la mosca doméstica (37); otros han notificado que el citral, componente mayoritario del C. citratus, puede interrumpir el ciclo de vida del vector de la enfermedad de Chagas, Rhodnius prolixus Stal; causar la muerte de Culex pipiens Linnaeus, vector de la encefalitis equina; así como de ácaros de la familia Tarsonemidae, parásitos de las abejas (38, 39, 40).
El efecto tóxico de los aceites esenciales sobre los artrópodos y otros insectos parece estar relacionado directamente con la volatilidad alta e hidrofobicidad de sus componentes, propiedades que facilitan su penetración en el cuerpo del insecto. Experimentos con la cucaracha Periplaneta americana Linnaeus sugieren que el efecto de los aceites esenciales y algunos de sus monoterpenos mayoritarios es neurotóxico, como lo evidencia la hiperactividad, seguida de hiperextensión de las patas y abdomen, inmovilización y muerte del insecto, después de la exposición al aceite (41). Se ha observado que en invertebrados, la octopamina (p-hidroxietanolamina), una amina biogénica que actúa como neurohormona, neuromodulador y neurotransmisor en invertebrados, provoca la hiperextensión de patas y abdomen por incremento de la frecuencia excitatoria del potencial post-sináptico recibido por las neuronas motoras abdominales (42, 43).
Algunos autores consideran los receptores de la octopamina como el sitio de la activad insecticida de los aceites esenciales, de esta forma los terpenos con estructura química análoga a la octopamina podrían unirse a los receptores octopaminérgicos del insecto causando su sobre-estimulación y, en consecuencia, el efecto tóxico (44, 45). Lo anterior se ha investigado con el eugenol sobre varias especies de insectos (46). El geranial y el neral, componentes mayoritarios del aceite esencial de C. citratus, tienen una alta homología estructural con la octopamina, lo que sugiere un efecto neurotóxico de este aceite sobre el ácaro D. farinae; además, estudios realizados con cuatro ácaros de vida libre, incluido D. farinae, demostró que el citral es una feromona de alarma en estos ácaros, lo que apoya la hipótesis de un efecto neurotóxico para el aceite esencial de C. citratus (47, 48). Debido a que no se ha reportado la estructura de los receptores octapaminergicos en el D. farinae, se hace necesario realizar más estudios para demostrar esta hipótesis.
En conclusión, el uso del aceite esencial de C. citratus Stapf se constituye en una buena opción para el control ambiental de ácaros intradomiciliarios desencadenantes de alergias respiratorias; sin embargo, se hace necesario realizar otros estudios para establecer la relación costo-beneficio de su uso. Estos resultados representan el primer reporte de la actividad tóxica de una planta nativa de la flora Colombia contra una de las especies de ácaros prevalentes en el ambiente intradomiciliario.
BIBLIOGRAFÍA
1. Betts TJ. Chemical characterization of the different types of volatile oil constituents by various solute retention ratios with the use of conventional and novel commercial gas chromatographic stationary phases. J. Chromatogr 2001;936:33-46. [ Links ]
2. Bakkali F, Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils - A review. Food Chem Toxicol 2008;46(2):446-75. [ Links ]
3. Dewick P. Medicinal Natural Products. 2nd Edition. England: John Wiley and Sons Ltd; 2002:179-85. [ Links ]
4. Tzortzakis Nikos G, Economakis Costas D. Antifungal activity of lemongrass (Cymbopogon citratus L) essential oil against key postharvest pathogens. Inn Food Sci Emerg Technol 2007;8:253-8. [ Links ]
5. Quintero A, González N, Vera A. Obtención y análisis cromatográfico del aceite esencial de Cymbopogon citratus (Limonaria). Mem Inst Biol Exper 1999;1(2):211-4. [ Links ]
6. Figueirinha A, Paranhos A, Pérez C, Buelga A, Batista S. Cymbopogon citratus leaves: Characterization of flavonoids by HPLC-PDA-ESI/MS/MS and an approach to their potential as a source of bioactive polyphenols. Food Chem 2008;110(3):718-28. [ Links ]
7. Rao BL, Sunita L. New aroma chemicals in Cymbopogon for future. Indian Perfumer 1992;36(4):241-5. [ Links ]
8. Puatanachokchai R. Kishida H. Denda A. Murata N, Konishi Y, initketkumnuen U, Nakae D. Inhibitory effects of lemon grass (Cymbopogon citratus, Stapf) extract on the early phase of hepato-carcinogenesis after initiation with diethylnitrosamine in male Fischer 344 rats. Cancer Lett 2002;183:9-15. [ Links ]
9. Negrelle RRB, Gomes EC. Cymbopogon citratus (D.C.) Stapf: chemical composition and biological activities. Rev Bras Pl Med 2007;9: 80-92. [ Links ]
10. Aslan I, Ozbek H, Çalmasur O, SahIn F. Toxicity of essential oil vapours to two greenhouse pests, Tetranychus urtiae Koch and Bemisia tabaci Genn. Ind Crop Prod 2004;19:167-73. [ Links ]
11. El-Zemity SR, Rezk HA, Zaitoon AA. Acaricidal activity of some essential Oils and Their Monoterpenoidal Constituents Againts the parasitic Bee Mites, varroa destructor (Acari: varroidae). Journal of Applied sciences Research 2006;2(11):1032-6. [ Links ]
12. Damiani N, Gende LB, Bailac P, Marcangeli JA, Eguaras MJ. Acaricidal and insecticidal activity of essential oils on Varroa destructor (Acari: Varroidae) and Apis mellifera (Hymenoptera: Apidae). Parasitol Res 2009:145-52. [ Links ]
13. Kim E, Kim H, Cho D, Ahn Y. Acaricidal activity of clove bud oil compounds against Tyrophagus putrescentiae (Acari: Acaridae). Appl Entomol Zool 2003;38(2):261-6. [ Links ]
14. Rajendran S, Sriranjini V. Plant products as fumigants for stored-product insect control. J Stored Prod Res 2008;44:126-35. [ Links ]
15. Nerio L, Olivero-Verbel J, Stashenko E. Repellent activity of essential oils from seven aromatic plants grown in Colombia against Sitophilus zeamais Motschulsky (Coleoptera). J Stored Prod Res 2009:1-3. [ Links ]
16. Kim S, Yi J, Tak J, Ahn Y. Acaricidal activity of plant essential oils against Dermanyssus gallinae (Acari: Dermanyssidae). Vet. Parasitol 2004;120:297-304. [ Links ]
17. Hoiseon L. p-Anisaldehyde: acaricidal component of pimpinella anisum seed oil against the house dust mites Dermatophagoides farinae and Dermatophagoides pteronyssinus. Planta Med 2004; 70(3):279-81. [ Links ]
18. Saad E, Hussien R, Saher F, Ahmed Z. Acaricidal activities of some essential oils and their monoterpenoidal constituents against house dust mite, Dermatophagoides pteronyssinus (Acari: Pyroglyphidae). J Zhejiang Univ Sci B 2006;7(12):957-62. [ Links ]
19. Rim IS, Jee CH. Acaricidal effects of herb essential oils Against Dermatophagoides farinae and D. pteronyssinus (Acari: Pyroglyphidae) and qualitative analysis of a herb Mentha pulegium (pennyroyal). Korean J Parasitol 2006;44(2):133-8. [ Links ]
20. Fernández-Caldas E, Puerta L, Mercado D, Jockey RF, Caraballo L. Mite fauna Der p1, Der f1 and Blomia tropicalis allergens levels in a tropical enviroment. Clin Exp Allergy 1993;23:292-7. [ Links ]
21. Puerta L, Fernández-Caldas E, Lockey R, Caraballo L. Mite allergy in the tropics: sensitization to six domestic mites species in Cartagena, Colombia. J Invest Allergol Clin Immunol 1993;3:198-204. [ Links ]
22. Meza J, Mendoza D, Mercado D. Identificación de ácaros del polvo casero en colchones y almohadas de niños alérgicos de Santa Marta, Colombia. Duazary 2008;1:24-31. [ Links ]
23. GINA Report, Global Strategy for Asthma Management and Prevention, 2009. Disponible on line en www.ginasthma.gov. [ Links ]
24. Dennis R, Caraballo L, García E, Caballero A, Aristizábal G, Córdoba H, et al. Asthma and other allergic conditions in Colombia: a study in 6 cities. Ann Allergy Asthma Immunol 2004;93:568-74. [ Links ]
25. Arlian LG, Bernstein D, Bernstein IL, Friedman S, Grant A, Lieberman P, et al. Prevalence of dust mites in the homes of people with asthma living in eight different geographic areas of the United States. J Allergy Clin Immunol 1992;90(3 Pt 1):292-300. [ Links ]
26. Van den Dool H, Kratz PH. A generalization of the retention index system including linear temperature programmed gas liquid partition chromatography. J Chromatogr 1963;11: 463-71. [ Links ]
27. Adams RP. Identification of essential oil components by Gas Chromatography/Mass Spectroscopy. US (United States): Allured Publ Corp Carol Stream IL1995:468. [ Links ]
28. Collof M., Spierman F. Pictorial Keys for the identification of domestic mites Clin Exp Allergy 1992;22:823-30. [ Links ]
29. Kwon JH, Ahn YJ. Acaricidal activity of butylidenephthalide identified in Cnidium officinale rhizome against Dermatophagoides farinae and Dermatophagoides pteronyssinus (Acari: Pyroglyphidae). J Agric Food Chem 2002;50:4479-83. [ Links ]
30. Linares S, González N, Gómez E, Usubillaga A, Darghan E. Efecto de la fertilización, densidad de siembra y tiempo de corte sobre el rendimiento y calidad del aceite esencial extraído de Cymbopogon citratus Stapf. Rev Fac. Agron (LUZ) 2005;22:250-63. [ Links ]
31. Mattos M, Florisvaldo D, Das Graças M, Cardoso E, Hilsdorf Piccoli R. Disinfectant action of Cymbopogon sp. essential oils in different phases of biofilm formation by Listeria monocytogenes on stainless steel surface Food Control. 2010;21(4):549-53. [ Links ]
32. Cristiane da S, Raubera S, Guterresa ES, Schapovala. LC determination of citral in Cymbopogon citratus volatile oil. J Pharm Biomed Anal 2005;37(3):597-601. [ Links ]
33. Saleem M, Afza N, Anwar MA, Hai SM, Ali MS. A Comparative Study of Essential Oils of Cymbopogon citratus and Some Members of the Genus Citrus. Nat Prod Res 2003;17(5):369-73. [ Links ]
34. Chungsamarnyart N, Jiwajinda S. Acaricidal activity of volatile oil from lemmon and citronella grasses on tropical cattle ticks. Nat Sci Suppl 1992;26:45-51. [ Links ]
35. Yan Y, Lee H, Clark JM, Ahn Y. Insecticidal activity of plant essential oil againts Pediculus humanus capitis (Anoplura:pediculidae). J Med Entomol 2004;41(4):699-704. [ Links ]
36. Barreira Cavalcanti ES, Maia de Morais S, Lima MA, Pinho Santana EW. Larvicidal activity of essential oils from Brazilian plants against Aedes aegypti L. Mem Inst Oswaldo Cruz, Rio de Janeiro 2004;99(5):541-44. [ Links ]
37. Samarasekera, Radhika, Kalhari, Kosmulalage S, Weerasinghe, Indira S. Insecticidal Activity of Essential Oils of Ceylon cinnamomum and Cymbopogon species against Musca domestica. J. Essent Oil Res 2006;18(3):352-54. [ Links ]
38. Abramson CI, Aldana E, Sulbaran E. Exposure to Citral, Cinnamon and Ruda Disrupts the Life Cycle of a Vector of Chagas Disease. Am J Environ Sci 2007;3(1):7-8. [ Links ]
39. Yang P, Ma Y, Zheng S. Adulticida activity for five essential oil against Culex pupens quinquefasciatus. Pesticide Sci Soc Japan 2005;30(2):84-9. [ Links ]
40. Ellis M, Baxendale FP. Toxicity of Seven Monoterpenoids to Tracheal Mites (Acari: Tarsonemidae) and Their Honey Bee (Hymenoptera: Apidae) Hosts When Applied as Fumigants. J. Econ. Entomol 1997;90(5):1087-91. [ Links ]
41. Price DN, Berry MS. Comparison of effects of octopamine and insecticidal essential oils on activity in the nerve cord, foregut, and dorsal unpaired median neurons of cockroaches. J Insect Physiol 2006;52:309-19. [ Links ]
42. Farooqui T. Octopamine Mediated Neuromodulation of Insect Senses. Neurochem Res 2007;32:1511-29. [ Links ]
43. Roeder T. Octopamine in invertebrates. Progress Neurobiol 1999;59: 533-61. [ Links ]
44. Enan E. Insecticidal activity of essential oils: octopaminergic sites of action. Comp Biochem Physiol 2001;130:325-37. [ Links ]
45. Kostyukovsky M, Rafaeli A, Gileadi C, Demchenko N, Shaaya E. Activation of octopaminergic receptors by essential oil constituents isolated from aromatic plants: possible mode of action against insect pests. Pest Management Science 2002;58:1101-6. [ Links ]
46. Ngoh SP, Choo LEW, Pang FY, Huang Y, Kini MR, Ho SH. Insecticidal and repellent properties of nine volatile constituents of essential oils against the American cockroach, Periplaneta americana. Pest Management Science 1998;54:261-8. [ Links ]
47. Kuwahara Y, Fukami S, Ishii S, Matsumoto K, Wada Y. Pheromone study on acarid mites. II. Citral: isolation and identification from four species of acarid mites, and its possible role. Jap. J. Sanit. Zool 1980;31:49-52. [ Links ]
48. Kuwahara Y, Matsumoto K, Wada Y. Pheromone study on acarid mites. IV. Citral: composition and function as an alarm pheromone and its secretory gland in four species in acarid mites. Jap. J. Sanit. Zool 1980;31:73-80. [ Links ]