Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biosalud
versión impresa ISSN 1657-9550
Biosalud v.9 n.2 Manizales jul./dic. 2010
¿CÓMO AFECTA EL ESTRÉS CALÓRICO LA REPRODUCCIÓN?
HOW DOES CALORIC STRESS AFFECT REPRODUCTION?
Miryam Vélez Marín1 y Luis Fernando Uribe Velásquez2
1 Estudiante de Maestría en Ciencias Veterinarias, Universidad de Caldas, Facultad de Ciencias Agropecuarias, Programa de Maestría en Ciencias Veterinarias. Manizales, Colombia. E-mail: miryam.velez@ucaldas.edu.co.
2 PhD. Universidad de Caldas, Facultad de Ciencias Agropecuarias, Departamento de Salud Animal. Manizales, Colombia.
Recibido: septiembre 01 de 2010 - Aceptado: noviembre 08 de 2010
RESUMEN
La presente revisión analiza algunos de los efectos del estrés calórico sobre la reproducción. El estrés se manifiesta por la incapacidad de un animal para hacer frente a su entorno, un fenómeno que a menudo se refleja en la pérdida del potencial genético. El estrés calórico puede tener efectos en la función reproductiva en mamíferos. La regulación neuroendocrina del desarrollo folicular y de la ovulación requiere de una compleja y delicada interacción entre las gonadotropinas hipofisarias y la retroalimentación del principal esteroide folicular, el estradiol. Debido a esta compleja interacción, la regulación de la fase folicular del ciclo estral y la ovulación es especialmente vulnerable a los efectos del estrés. El estrés impacta el eje reproductivo del hipotálamo (al afectar la secreción de GnRH) y la glándula pituitaria (al afectar la secreción de gonadotropinas), con efectos directos sobre las gónadas, siendo éstos de menor relevancia. La importancia de la secreción de cortisol inducida por el estrés varía según la especie. En algunos casos, es poco el impacto que tienen los aumentos a corto plazo de las concentraciones de cortisol y el aumento prolongado en la concentración plasmática puede ser requerido antes de cualquier efecto nocivo evidente sobre la reproducción. Algunos cambios en el medio ambiente, así como la fisiología de los animales, crean condiciones de estrés. El estrés puede ser considerado como un agente externo que aplicado a un animal genera un efecto sobre su actividad fisiológica. De cualquier modo, es necesario identificar los mecanismos por los cuales el estrés altera la reproducción.
PALABRAS CLAVE: cortisol, ciclo estral, estradiol, estrés calórico, progesterona.
ABSTRACT
The present review analyses some of the effects of caloric stress on reproduction. Stress is revealed by the inability of an animal to cope with its environment, a phenomenon that is often reflected in a loss of genetic potential. Caloric stress can have big effects on most aspects of reproductive function in mammals. The neuroendocrine regulation of follicular development and ovulation require a complex and delicate interaction between the pituitary gonadotropins and the feedback of estradiol, the major follicular steroid. Because of this complex interaction, the regulation of the follicular stage of the estrous cycle and ovulation is especially vulnerable to the effects of stress. Stress impacts the reproductive axis at the hypothalamus (because affect the GnRH secretion) and the pituitary gland (because affect the gonadotrophin secretion), with direct effects on the gonads being these of a lesser relevance. The significance of stress-induced secretion of cortisol varies depending on the species. In some instances, the impact of short-term increases in cortisol concentrations is little and extended increase in plasma concentration may be required before any evident noxious effect on reproduction be apparent. Some environmental changes, as well as the animals physiology Here are certain changes in environment as well as animal physiology create stressful conditions. Stress may be considered as an external agent that, applied to an animal generates an effect on its physiological activity. Anyway, it is necessary to identify the mechanisms by which stress to alter reproduction.
KEY WORDS: cortisol, estrous cycle, estradiol, caloric stress, progesterone.
INTRODUCCIÓN
Modificaciones del fotoperiodo, temperatura, lluvias y disponibilidad de alimento son factores ambientales que afectan diferentes momentos del desarrollo biológico de un individuo. Estos eventos parecen sincronizar aspectos fisiológicos tales como la reproducción, el crecimiento de tejidos y el metabolismo, de acuerdo a las condiciones en que se encuentren los animales (1). La regulación del ciclo estral se desarrolla en el organismo por el sistema hipotálamo- hipófisis-gonadal. La interrelación entre estos componentes se realiza a través de la vía neurohormonal. Dicho sistema desencadena estímulos que favorecen el ciclo estral, como la secreción de hormona luteinizante (LH), estradiol (E2), progesterona (P4), prostaglandina (PG), entre otras, las cuales a su vez pueden ser reguladas por agentes causantes de estrés, como el incremento de la temperatura ambiental, promoviendo el estrés calórico (2).
La activación del eje hipotálamo-hipófisis- adrenal frente a situaciones estresantes desencadena cambios conductuales y fisiológicos que mejoran la adaptabilidad del organismo e incrementan sus oportunidades de supervivencia. Sin embargo, dicha activación y sus hormonas en lo individual afectan el funcionamiento reproductivo de varias especies animales en diversos niveles: secreción de GnRH hipotalámica, secreción de gonadotropinas desde la hipófisis, funcionamiento gonadal y falla en la expresión conductual del estro (3). El cortisol, producido por la corteza adrenal a partir del colesterol, participa en la regulación de todos los aspectos del metabolismo, directamente o por interacción con otras hormonas, al activar la gluconeogénesis, síntesis de proteínas y lipólisis, además de estar involucrado en los procesos de estrés (4). También se ha reportado que el cortisol es el principal glucocorticoesteroide secretado como respuesta del animal a condiciones de estrés, la cual es más rápida comparada con las hormonas secretadas por la glándula tiroides (5).
El aumento de la infertilidad en vacas lecheras durante las últimas décadas y los efectos negativos que el estrés calórico tiene sobre la fertilidad han sido ampliamente descritos en el mundo (6, 7, 8). La baja fecundidad en vacas durante el verano se asocia principalmente con los meses cálidos del año, de junio a septiembre en el hemisferio norte, y a su vez, repercuten en la fertilidad en los meses de octubre y noviembre, correspondientes a otoño (9).
La disminución en las tasas de concepción puede ser debida, entre otros factores, al efecto nocivo que el estrés calórico tiene sobre la dinámica folicular (10), el desarrollo del subsiguiente cuerpo lúteo (11), la producción insuficiente de progesterona lútea (12) o en el desarrollo embrionario deficiente (13). Las concentraciones circulantes de P4 en momentos específicos favorecen el mantenimiento de la preñez; de la misma manera, niveles de P4 menores a 1 ng/mL contribuyen con la baja fertilidad (14).
El objetivo de esta revisión es identificar las consecuencias del estrés calórico en animales, especialmente en bovinos, dado que este estrés altera los mecanismos de termorregulación del individuo y, a su vez, genera cambios hormonales y metabólicos que se reflejan sobre la reproducción.
¿QUÉ ES EL ESTRÉS?
El término "estrés" fue acuñado por Hans Selye, quien descubrió los estímulos que podían provocar esta condición. Este autor definió el estrés como "la acción de estímulos nerviosos y emocionales provocados por el ambiente sobre los sistemas nervioso, endocrino, circulatorio y digestivo de un animal, produciendo cambios medibles en los niveles funcionales de estos sistemas" (15). Además, señaló que el estrés presenta una relación positiva entre la agresividad del medio externo y la magnitud de la respuesta orgánica del individuo, siendo una reacción de defensa ante los agentes inductores de estrés, los cuales desencadenan respuestas orgánicas capaces de alterar los mecanismos reguladores de la homeostasis.
Se ha discutido la existencia de una respuesta específica frente al estrés, y se ha sugerido que tanto las respuestas conductuales como fisiológicas muestran un alto grado de especificidad según el factor estresante. La respuesta al estrés propuesto por Herskin y Munksgaar (16) describe que el mecanismo está basado principalmente en dos conceptos básicos: el Síndrome de Emergencia y el Síndrome General de Adaptación (17). El primero involucra el Sistema Simpático-Adrenal, en el cual el organismo se prepara para hacer frente a peligros súbitos generando la respuesta de "lucha y huida", llamada actualmente respuesta simpática-suprarrenal. Ésta posibilita a un organismo reaccionar inmediatamente frente a un agente estresor, lo que provoca una activación neuronal en el hipotálamo, causa la liberación de adrenalina desde la médula suprarrenal, aumenta el ritmo cardiaco, la disponibilidad de glucosa, e incrementa la presión y el volumen sanguíneo, el cual es reencausado fuera de los órganos no esenciales hacia el corazón y los músculos estriados, a fin de que el animal pueda responder luchando o escapando de la amenaza (18). El segundo concepto es el Síndrome General de Adaptación de Selye (15), que corresponde a una teoría de adaptación a un estrés biológico y consta de tres estadios: en primer lugar, respuesta inmediata, mediada por el sistema simpático; de carácter automática, defensiva y antiinflamatoria, produce un aumento de la frecuencia cardiaca, contracción esplénica con liberación de glóbulos rojos, aumento de la capacidad respiratoria y aumento de la coagulación sanguínea. Es una respuesta de duración limitada caracterizada por una gran liberación de glucocorticoides al torrente sanguíneo. En segundo lugar, resistencia, en esta etapa el organismo intenta superarse, adaptarse o afrontar la presencia de los factores que percibe como una amenaza o agente nocivo. En esta etapa hay una participación del eje hipotálamo-hipófisis y corteza adrenal, ocurre una normalización de los niveles de corticoesteroides y tiene lugar la desaparición de la sintomatología. Finalmente, reacción de agotamiento, que ocurre cuando el estímulo crónico se repite con frecuencia o es de larga duración sobrepasando los niveles de resistencia, el cual aumenta la actividad endocrina, ocasionando efectos dañinos sobre los sistemas y aparatos, y esto podría terminar con la muerte del individuo (19). Sin embargo, Bohus et al. (20) indican que las tres fases que presenta el síndrome general de adaptación de Selye (15), no representan fielmente la realidad animal, ya que los animales presentan reacciones diferentes a los humanos en cuanto a la percepción del ambiente, estrés y adaptación.
ESTRÉS CALÓRICO
Existen rangos de tolerancia frente a la temperatura ambiental, denominados bienestar térmico para los animales. Las mejores condiciones de temperatura y humedad relativa para criar animales, en general, están alrededor de los 13 a 18°C y 60 a 70%, respectivamente (21). Los rangos de temperatura ambiental reportados como de confort para animales de tipo Bos taurus van de 0 a 20°C y para Bos índicus de 10 a 27°C, con 70% de humedad ambiental en ambos casos, aunque se reportan diferencias entre razas, edad, estado fisiológico, sexo y variaciones individuales de los animales (22). Éstos, al verse sometidos a temperaturas por encima de dicho rango, responden mediante mecanismos compensadores como la evaporización respiratoria y cutánea, los cuales tienen un alto gasto energético. Cuando dichos mecanismos son insuficientes, la temperatura corporal aumenta produciendo hipertermia o estrés térmico (23).
Los efectos del estrés calórico sobre el animal pueden ser de dos tipos:
- Directos: son las alteraciones del metabolismo para acomodarse al incremento de calor, con repercusión hormonal, las cuales afectan directamente el inicio de la actividad ovárica (24).
- Indirectos: cuando ocurre alteración de la calidad y cantidad del alimento. Entre los factores que influencian el grado de afección por estrés calórico se pueden mencionar: raza, estado fisiológico, nivel de producción láctea, edad, color de la piel, exposición al ambiente y variación propia de los animales.
Es ampliamente conocido que los animales Bos indicus son más resistentes que los Bos taurus al estrés calórico, no sólo por las características de adaptación frente al clima y la escasez de alimento, sino también por las ventajas de la termorregulación para ambas situaciones; sin embargo, se han sacrificado las características productivas y reproductivas (24).
Collier et al. (25) han descrito que la temperatura y la humedad de aire elevadas mayores a 18 °C y 70%, respectivamente, son elementos meteorológicos estresantes, generalmente asociados al bajo desempeño de rebaños bovinos criados en las regiones tropicales. Así mismo, se espera que tengan mejor productividad aquellos animales mejor adaptados a las condiciones inherentes al clima tropical, por poseer características fisiológicas, morfológicas y comportamentales más adecuadas a este tipo de ambientes (26).
La intensidad de los efectos negativos de las temperaturas ambientales elevadas depende de la eficiencia de los mecanismos termorreguladores (27). Las glándulas tiroides y adrenales desempeñan papeles importantes en los mecanismos de adaptación (28); de la misma manera, animales bien adaptados responden rápidamente a cambios ambientales, proporcionando los ajustes fisiológicos necesarios (29). Algunos autores demostraron que, en virtud de las altas temperaturas (temperatura media del aire 29, 5°C, humedad relativa del 90, 6%), en el estrés por calor se agudizan altas concentraciones sanguíneas de cortisol en novillas Holstein (30) (Tabla 1) y bajas concentraciones de las hormonas tiroideas, para disminuir la velocidad de producción de calor metabólico (31). Las concentraciones séricas de las hormonas tiroxina (T4), triyodotironina (T3) y el cortisol se ven afectadas por la temperatura y la humedad, de modo que durante el estrés térmico hay una respuesta más rápida del cortisol y aumento del período de latencia en la respuesta de las hormonas tiroideas, en ovinos de raza Corriedale (32).
Se ha propuesto que los glucocorticoides incrementan la fuerza de la retroalimentación negativa de los esteroides gonadales, lo cual modifica la función ovárica (33). A su vez, Domingues y col. (34) encontraron que el cortisol sanguíneo también se incrementa en vacas con mastitis, pero hay una tendencia del E2 plasmático a disminuir en vacas con mastitis subclínica.
Desde el punto de vista bioclimático, las repuestas de los animales al medio ambiente cálido son relacionadas de varias formas, y evidentemente involucran los efectos directos de la temperatura, alterando la regulación del sistema nervioso, el balance hídrico, el nivel hormonal, el balance nutricional y el equilibrio bioquímico (35).
¿COMO AFECTA EL ESTRES CALÓRICO ALGUNOS ESTADIOS DE LA REPRODUCCIÓN?
En condiciones de estrés metabólico asociado a factores ambientales y de comportamiento, el eje hipotálamo-hipófisis-adrenocortical (HPA) estimula a la hipófisis para secretar más hormona adrenocorticotrópica (ACTH), en comparación con las condiciones normales (36). En vacas ovariectomizadas, después de la estimulación del eje HHA por un estrés agudo, aumenta la concentración de progesterona en plasma, originada a partir de la corteza adrenal (37).
El estrés calórico retrasa el desarrollo folicular y la ovulación, lo cual puede estar relacionado con el efecto inhibidor directo de los glucocorticoides sobre la secreción de esteroides gonadales y la sensibilidad del tejido diana a estos esteroides sexuales (39). El estrés estimula el eje HHA, que a su vez modula el eje hipotálamo-hipófisis-gonadal (HHG) y modifica la secreción de gonadotrofinas. Esto significa que la activación del eje HHA durante estrés calórico acarrea un antagonismo entre las hormonas de los dos ejes. El pico preovulatorio de LH es especialmente sensible al efecto inhibitorio de la ACTH y a los glucocorticoides exógenos. La acción fisiológica de los glucocorticoides, que inhiben la secreción por la hipófisis de LH, podría ser efectuada por la modificación del feed-back de los esteroides gonadales, dado que los corticoides reducen el efecto estimulatorio de estradiol sobre la secreción de LH (39). Además, se ha demostrado que los glucocorticoides pueden reducir la inflamación a través de la inhibición de la fosfolipasa A2 y la ciclooxigenasa-2 (COX- 2), mecanismos moleculares implicados en la regulación de la biosíntesis de prostaglandinas (40). En el tejido endometrial, la COX-2, también conocida como prostaglandina G/H sintasa-2 (PGHS-2), es un tipo de enzima que cataliza la producción de prostaglandinas, entre ellas la prostaglandina F2a, principal reguladora de luteólisis (41).
La cadena de procesos que conducen a la luteólisis inicia a partir de la unión del estradiol con su receptor en el endometrio. Entre las principales acciones del estradiol están la regulación de los receptores uterinos de oxitocina y su liberación del cuerpo lúteo. La oxitocina, a su vez, estimula la liberación de una pequeña cantidad de PGF2a uterina, que inicia un circuito de retroalimentación positiva (42). El retraso en la regresión lútea en respuesta a un exceso de estimulación adrenal, puede retardar el desarrollo del folículo dominante, y en consecuencia, disminuir la secreción de estradiol, que no podrá poner en marcha el mecanismo luteolítico (2, 42).
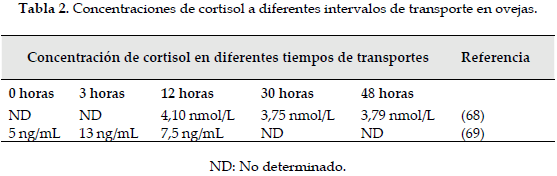
La cascada hormonal desencadenada durante el estrés es capaz de bloquear la actividad del estradiol e inhibir la presentación de la conducta sexual. Estudios han mostrado que el estrés por transporte produce un incremento en la presentación de ovulaciones silenciosas en ovejas, prolongando el ciclo estral y provocando alteraciones ováricas (43), de la misma manera que las concentraciones de cortisol (Tabla 2). A su vez, el estrés por altas temperaturas en vacas (44) y ovejas (45), y por transporte en ovejas (46), causa las mismas alteraciones en la conducta estral, las cuales reducen la duración del estro.
El estrés calórico afecta la reproducción cuando ocurre días antes, durante y después de la ovulación (47, 48). De igual forma, se ha observado un efecto negativo del estrés calórico sobre la viabilidad embrionaria en los primeros días de su desarrollo (49, 50).
Uribe-Velásquez et al. (27, 35) han reportado en rebaños que las elevadas temperaturas, la humedad relativa del aire y la radiación solar son los principales elementos climáticos estresantes que causan disminución en la tasa de crecimiento, producción de leche y fallas en la reproducción, incluyendo estros cortos, ciclos estrales anormales y aumento en la mortalidad embrionaria y fetal temprana, con disminución de la fertilidad.
La baja fertilidad de las vacas lecheras durante el otoño quizá se deba a los consiguientes efectos del estrés por el calor del verano. Las vacas expuestas a estrés térmico alteran su dinámica y dominio folicular en el subsecuente ciclo (51). Estos cambios se asocian a alteraciones en las concentraciones plasmáticas de inhibina y FSH. El estrés agudo por calor reduce la producción de esteroides y el tamaño de los folículos preovulatorios, semanas después del estrés térmico (52). La competencia de ovocitos bovinos tiende a ser baja al comienzo del otoño, y mejora lentamente al final del otoño e inicio del invierno (53).
EL EFECTO DEL ESTRÉS CALÓRICO SOBRE EL EJE HIPOTÁLAMO-HIPOFISARIO- GONADAL
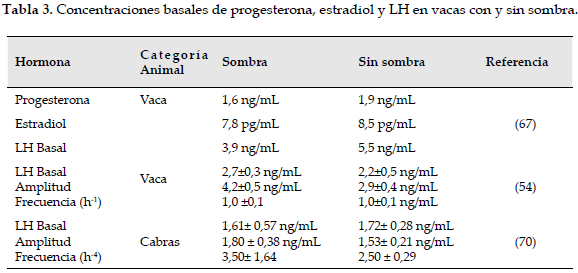
Con relación al patrón de secreción de LH en vacas bajo estrés por calor, se han reportado disminuciones en su amplitud (54), frecuencia de los pulsos (55) y cambios basales (Tabla 3). La disminución de los niveles de LH durante el pico preovulatorio ha sido controversial y se ha relacionado con los niveles preovulatorios de estradiol. La escasa información reportada acerca del efecto del estrés calórico sobre las concentraciones sanguíneas de FSH e inhibina sugiere que la FSH se incrementa y que esto, quizá, se deba a la disminución en la producción de inhibina (8, 56). Se encontró, además, que el estrés calórico no presentó efectos sobre la producción de progesterona, pero sí retrasó la luteólisis. Otros estudios han sido contradictorios (56), pues se ha encontrado que las concentraciones de P4 se incrementan en condiciones de estrés calórico (57) y otros señalan que disminuyen (58). Uribe-Velásquez et al. (35) reportaron que cabras Pardo Alpinas lecheras mantienen las concentraciones de P, cuando son expuestas a estrés repetido e intermitente bajo cámara bioclimática (temperatura 33,84±0, 33°C y humedad relativa 66,05±0, 73%) a pesar de la hipertermia que se produce durante el estrés térmico; esto es similar a lo reportado en ovejas de la raza Pelibuey y Suffolk, pues se halló que la alta temperatura ambiental no evidenció efectos sobre los niveles séricos de progesterona (59). Estas diferencias probablemente se deban a otros factores no controlados como el grado de estrés calórico (agudo o crónico) y las diferencias en el consumo de materia seca (8).
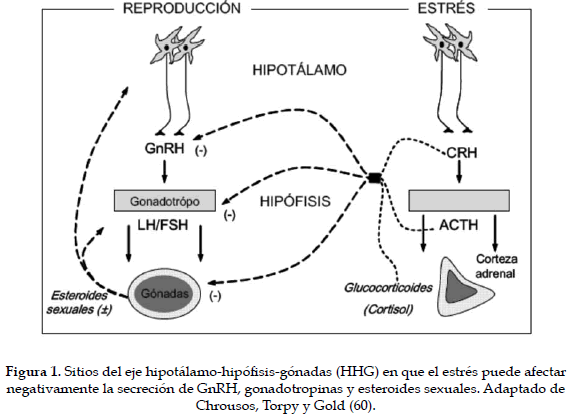
Los mecanismos mediante los cuales el estrés calórico afecta las concentraciones de las hormonas reproductivas son desconocidos. Se ha sugerido como causa, el incremento en la secreción de corticosteroides, porque éstos pueden inhibir la secreción de GnRH, y por lo tanto, de la LH. La secreción de gonadotropinas es inhibida en mayor grado en vacas con bajas concentraciones plasmáticas de estradiol, lo cual sugiere que las altas concentraciones de estradiol pueden neutralizar el efecto del estrés calórico (54). En la Figura 1 se presentan los sitios del eje hipotálamo-hipófisis-gónadas (HHG) en donde el estrés puede afectar negativamente la secreción de GnRH, gonadotropinas y esteroides sexuales. La activación del eje HHA influye en la actividad de neuronas GnRH hipotalámicas, además de alterar la respuesta de los gonadotropos (hipófisis) a la acción de la GnRH. Y el estrés puede afectar la retroalimentación de los esteroides sexuales en el hipotálamo e hipófisis (60).
EL EFECTO DEL ESTRÉS CALÓRICO SOBRE LOS GAMETOS Y EMBRIONES
Temperaturas extremas afectan la supervivencia del ovocito y del espermatozoide, así como el desarrollo embrionario en el aparato reproductor de la hembra. Esto ocasiona que al aumentar la temperatura corporal de las hembras, el embrión pueda perder su viabilidad y reabsorberse. Por esta razón, las tasas de concepción caen en los meses de verano hasta en un 20% (61). El ganado con predominancia fenotípica B. indicus presenta mejores tasas de maduración y fecundación in vitro que el ganado predominantemente B. taurus, debido a que sus ovocitos son más competentes con genes termotolerantes, capaces de resistir las condiciones ambientales del trópico (62).
Varios estudios han demostrado que, cuando las condiciones de confort de los animales no se cumplen y se exponen a temperatura y humedad ambiental elevadas dos días antes del servicio (63), la tasa de fertilización y el desarrollo embrionario se afectan. Al respecto, se ha descrito que el estrés calórico afecta el desarrollo final del folículo ovulatorio y la maduración y competencia del ovocito, lo que repercute negativamente en la tasa de fertilización y en la sobrevivencia embrionaria temprana y tardía (64).
No se sabe el mecanismo exacto por el cual el estrés calórico puede afectar los folículos y los ovocitos, pero se ha descrito que se produce un daño en la comunicación entre las células de la granulosa, del cúmulo y del ovocito (51, 65), lo cual afecta la competencia del ovocito para ser fertilizado (64, 65) y altera el contenido proteínico (6) y la viabilidad de las células de la granulosa y de la teca interna, produciendo cambios en la esteroidogénesis (51).
CONCLUSIÓN
El estrés térmico desencadena alteraciones agudas y crónicas en concentraciones plasmáticas de cortisol y hormonas tiroideas; además, puede acarrear alteraciones en las reacciones fisiológicas y en el comportamiento de los animales. Factores como el clima, el medio ambiente cambiante, el ruido y la alta densidad animal son causantes de estrés, y desencadenan serios problemas reproductivos que influyen en la disminución de fertilidad, en la alteración del desarrollo folicular y en los ovocitos, lo cual afecta el potencial para desarrollar un embrión viable.
BIBLIOGRAFÍA
1. Souza MIL, Uribe-Velásquez LF, Ramos AA, Oba E. Níveis plasmáticos de colesterol total, lipoproteínas de alta densidad (HDL) e cortisol, e sua biorritmicidade, em carneiros Ideal-Polwarth. Cien Anim Bras 2006;7(4):433-8. [ Links ]
2. Dobson H, Smith RF. What is stress, and how does it affect reproduction? Anim Reprod Sci 2000;60-61:743-52. [ Links ]
3. Álvarez L. Efectos negativos del estrés sobre la reproducción en animales domésticos. Arch Zootec 2008;57 (R):39-59. [ Links ]
4. Souza MIL, Rubert MA, Monteiro VJO, Tasca CT, Uribe-Velásquez LF. Concentrações plasmáticas médias de triiodotironina, tiroxina e cortisol em vacas de corte de cascavel-pr-Brasil. En: VI Jornada de Medicina Veterinária Da UNIPAR, Arq. Ciên. Zool. UNIPAR, Umuarama, 2001;4(2):247-51. (Abstract). [ Links ]
5. Arias RA, Mader TL, Escobar PC. Factores climáticos que afectan el desempeño productivo del ganado bovino de carne y leche. Arch Med Vet 2008;40:7-22. [ Links ]
6. Jordan ER. Effects of heat stress on reproduction. J Dairy Sci 2003;86:104-14. [ Links ]
7. Lopez-Gatius F. Is fertility declining in dairy cattle? A retrospective study in northeastern Spain. Theriog 2003;60:89-99. [ Links ]
8. Rensis FD, Scaramuzzi RJ. Heat stress and seasonal effects on reproduction in the dairy cow-a review. Theriog 2003;60:1139-51. [ Links ]
9. Wolfenson D, Roth Z, Meidan R. Impaired reproduction in heat-stressed cattle:basic and applied aspects. J Anim Sci 2000;60-61:535-47. [ Links ]
10. Wolfenson D, Thatcher WW, Badinga L, Savio JD, Meidan R, Lew BJ, et al. Effect of heat stress on follicular development during the estrous cycle in lactating dairy cattle. Biol Reprod 1995;52:1106-13. [ Links ]
11. Ullah G, Fuquay JW, Keawkhong T, Clark BL, Pogue DE, Murphey EJ. Effect of gonadotropin-releasing hormone at estrus on subsequent luteal function and fertility in lactating Holsteins during heat stress. J Dairy Sci 1996;79:1950-3. [ Links ]
12. Almier M, De Rosa G, Grasso F, Napolitano F, Bordi A. Effect of climate on the response of three oestrus synchronisation techniques in lactating dairy cows. Anim Rep Sci 2002;71:157-68. [ Links ]
13. Hansen PJ, Arechiga CF. Strategies for managing reproduction in the heat-stressed dairy cow. J Anim Sci 1999;77(Suppl 2):36-50. [ Links ]
14. Inskeep EK. Preovulatory, postovulatory, and postmaternal recognition effects of concentrations of progesterone on embryonic survival in the cow. J Anim Sci 2004;82:24-39. [ Links ]
15. Selye H. The evolution of the stress concept. Am Sci 1973;6(61):692-8. [ Links ]
16. Herskin MS, Munksgaard L. Relations between adrenocortical and nociceptive responses toward acute stress in individual dairy cows. J Anim Feed Sci 2004;1(Suppl 13):635-8. [ Links ]
17. Cannon WB. Stresses and strains of homeostasis. Am J Med Sci 1935;189:1-14. [ Links ]
18. Lay D, Wilson M. Physiological indicators of stress in domestic livestock. Symposium on Concentrated Animal Feeding Operations Regarding Animal Behavior, Care, and Well-Being, Indiana. 2001; 1-25. [ Links ]
19. Caballero SC, Sumano HS. Caracterización del estrés en bovinos. Arch Med Vet 1993;25:15-30. [ Links ]
20. Bohus B, Koolhass JM, Nyakas C, Steffens AB, Fokkema DS, Scheurink AJW. Physiology of stress: a behavioral view. In: P.R. Wiepkema and P.W.M. Van Adrichem, Editors, Biology of Stress in Farm Animals: An Integrative Approach, Martinus Nijhoff Publishers, Dordrecht 1987. p. 57-70. [ Links ]
21. Pires MFA, Campos AT. Relação dos dados climáticos com o desempenho animal. In: Resende H, Campos AT, Pires MF. (Orgs). Dados climáticos e sua utilização na atividade leiteira, 1 ed, Juiz de Fora: EMBRAPA Gado de Leite. 2003;(1):250. [ Links ]
22. Johnson HD. Bioclimate effects on growth, reproduction and milk production of livestock. En Johnson HD editor. Bioclimatology and Adaptation of Livestock. World Animal Science B - 5. Amsterdam: Elsevier Scientific Publication; 1987. p. 2-26. [ Links ]
23. Chemineau P. Medio ambiente y reproducción animal. Rev Mund Zoot 1993;77:(4):2-14. [ Links ]
24. González F. Curso II de Medicina Veterinaria. Guatemala, s.e.; 2003. 11p. [ Links ]
25. Collier RJ, Beede DK, Thatcher WW. Influence of environment and its modification on dairy animal health and production. J Dairy Sci 1982;65:2213-27. [ Links ]
26. Roman-Ponce HH, Thatcher WW, Wilcox CJ. Hormonal interrelationships and physiologivcal response of lactation dairy cows to a shade management system in a subtropical environment. Theriog 1981;6:139-54. [ Links ]
27. Uribe-Velásquez LF, Oba E, Brasil LHA, Wechsler FS, Stachissini AVM. Concentrações plasmáticas de cortisol, hormônios tireoideanos, metabólitos lipidicos e temperatura corporal de cabras alpinas submetidas ao estresse térmico. Rev Bras Zoot 1998;6:1123-30. [ Links ]
28. Webster MD. Behavioral and physiological adaptations of birds to hot desert climates, In: Proceedings of the 20th International Ornithological Congress: Christchurch, New Zealand; 1991. p. 1765-76. [ Links ]
29. McDonald LE. Veterinary endocrinology and reproduction. 3rd Edition. Philadelphia: Lea and Febiger; 1980. p.173-174. [ Links ]
30. Faure R, Fernández-Limia O, Morales-Denis C. Concentraciones de Cortisol sérico en novillas Holstein durante las dos épocas del año en Cuba. REDVET 2004; 12:12. [ Links ]
31. McNabb AFM. Thyroid hormones, their activation, degradation and effects on metabolism. J Nut 1995;125:1773-76. [ Links ]
32. Cardoso JM, Gomes R, Negrão JÁ, Campos A, Bueno AR. Variação Estacional dos Hormônios Tireoideanos e do Cortisol em Ovinos em Ambiente Tropical. R Bras Zootec 2005;34(6):2064-73. [ Links ]
33. Daley CA, Sakurai H, Adams BM, Adams TE. Effect of stress-like concentrations of cortisol on the feedback potency of oestradiol in orchidectomized sheep. Anim Reprod Sci 2000;59:167-78. [ Links ]
34. Domingues PF, Oba E, Uribe-Velásquez LF, Souza MIL, Ramos AA, Langoni H. Concentração plasmática de estradiol, prolactina e cortisol em vacas com mastite subclínica. A Hora Veterinaria 1999;18(107):9-11. [ Links ]
35. Uribe-Velásquez LF, Oba E, Brasil LHA, Souza FN, Wechsler FS. Efeitos do estresse termico nas concentracoes plasmaticas de progesterona (P4) e estradiol 17-b (E2) e temperatura retal em cabras da raça Pardo Alpina. Rev Bras Zoot 2001;30(2):388-93. [ Links ]
36. Matteri RL, Carroll JA, Dyer CJ. Neuroendocrine response to stress. In: Moberg GP, Mench JA, editors. The biology of animal stress. Basic principles and implications for animal welfare. New York: CABI Publishing; 2001. p. 43-76. [ Links ]
37. Yoshida C, Nakao T. Response of plasma cortisol and progesterone after ACTH challenge in ovariectomized lactating dairy cows. J Reprod Dev 2005;51:99-107. [ Links ]
38. Magiakou MA, Mastorakos G, Webster E, Chrousos GP. The hypothalamic-pituitary-adrenal axis and the female reproductive system. Ann NY Acad Sci 1997;816:42-56. [ Links ]
39. Lucy MC. Mechanisms linking nutrition and reproduction in postpartum cows. Reproduction 2003; (Suppl 61):415-27. [ Links ]
40. Goppelt-Struebe M. Molecular mechanisms involved in the regulation of prostaglandin biosynthesis by glucocorticoids. Biochem Pharmacol 1997;53(10):1389-95. [ Links ]
41. Colitti M, Sgorlon S, Stradaioli G, Farinacci M, Gabai G, Stefanon B. Grape polyphenols affect mRNA expression of PGHS-2, TIS11b and FOXO3 in endometrium of heifers under ACTH-induced stress. Theriog 2007;68:1022-30. [ Links ]
42. Niswender GD, Juengel JL, Silva PJ, Rollyson MK, Mcintush EW. Mechanisms controlling the function and life span of the corpus luteum. Physiol Rev 2000;80:1-29. [ Links ]
43. Braden A, Moule G. Effects of stress on ovarian morphology and oestrus cycles in ewes. Aust J Agr Res 1964;15:937-49. [ Links ]
44. Bond J, McDowell R. Reproductive performance and physiological responses of beef females as affected by a prolonged high environmental temperature. J Anim Sci 1972;4: 320-9. [ Links ]
45. Doney JM, Gunn RG, Griffiths JG. The effect of premating stress on the onset of oestrus and on ovulation rate in Scottish Blackface ewes. J Reprod Fertil 1973;35:381-4. [ Links ]
46. Ehnert K, Moberg GP. Disruption of estrous behavior in ewes by dexamethasone or managementrelated stress. J Anim Sci 1991;69:2988-94. [ Links ]
47. Cartmill JA, El-Zarkouny SZ, Hensley BA, Rozell TG, Smith JF, Stevenson JS. An alternative al breeding protocol for dairy cows exposed to elevated ambient temperatures before or after calving or both. J Dairy Sci 2001;84:799-806. [ Links ]
48. Ravagnolo O, Misztal I. Effect of heat stress on nonreturn rate in Holsteins: fixed-model analysis. J Dairy Sci 2002;85:3101-6. [ Links ]
49. Ealy AD, Drost M, Hansen PJ. Developmental changes in embryonic resistance to adverse effects of maternal heat stress in cows. J Dairy Sci 1993;76:2899-907. [ Links ]
50. Ryan DP, Prichard JF, Kopel E, Godke RA. Comparing early embryo mortality in dairy cows during hot and cool seasons of the year. Theriog 1993;39:719-37. [ Links ]
51. Roth Z, Meidan R, Braw-Tal R, Wolfenson D. Immediate and delayed effects of heat stress on folicular development and its association with plasma FSH and inhibin concentration in cows. J Reprod Fertil 2000;120:83-90. [ Links ]
52. Roth Z, Arav A, Bor A, Zeron Y, Braw-Tal R, Wolfenson D. Improvement of quality of oocytes Ecollected in the autumn by enhanced removal of impaired follicles from previously heat-stressed cows. Reproduction 2001;122:737-44. [ Links ]
53. Roth Z, Meidan R, Shaham-Albalancy A, Braw-Tal R, Wolfenson D. Delayed effect of heat stress on steroid production in medium sized and preovulatory bovine follicles. Reproduction 2001;121:745-51. [ Links ]
54. Gilad E, Meidan R, Berman A, Graber, Wolfenson D. Effect of heat stress on tonic and GnRH-induced gonadotrophin secretion in relation to concentration of oestradiol in plasma of cyclic cows. J Reprod Fertil 1993;99:315-21. [ Links ]
55. Wise ME, Armstrong DV, Huber JT, Hunter R, Wiersma F. Hormonal alterations in the lactating dairy cow in response to thermal stress. J Dairy Sci 1988;71:2480-5. [ Links ]
56. Wilson SJ, Marion RS, Spain JN, Spiers DE, Keisler DH, Lucy MC. Effect of controlled heat stress on ovarian function in dairy cattle: Lactating cows. J Dairy Sci 1998;1:2124-31. [ Links ]
57. Kawate N, Inaba T, Mori J. Effect of cortisol on the amounts of estradiol-17 b and progesterone secreted and the number of luteinizing hormone receptors in cultured bovine granulosa cells. Anim Reprod Sci 1993;32:15-25. [ Links ]
58. Jennifer P, McDowell LR, Hansen PJ. Characteristics of the estrous cycle and antioxidant status of lactating Holstein cows exposed to heat stress. J Dairy Sci 1998;81:1244-50. [ Links ]
59. Rodríguez M, Montaldo HH, Balcázar JA, Hernández J. Niveles de progesterona sérica en ovejas Pelibuey y Suffolk sometidas a estrés térmico. Veterinaria México (en línea) 2009, vol. 40 (citado 2010-10-24). Disponible en URL: http://redalyc.uaemex.mx/src/inicio. [ Links ]
60. Chrousos GP, Torpy DJ, Gold PW. Interactions between the Hypothalamic-Pituitary-Adrenal Axis and the Female Reproductive System: Clinical Implications. Ann Intern Med 1998;129:229-40. [ Links ]
61. Córdova IA, López HR, Saltijeral OJ, Muñoz MR, Córdova JM, Córdova JC, et al. El Bienestar Animal en la Reproducción Animal. Av Tecnol Porc 2005;2(1)1:4-20. [ Links ]
62. Báez FJ, Chávez AC, Hernández HJ, Villamediana PC. Evaluación de la capacidad de desarrollo in vitro de ovocitos bovinos provenientes de vacas con predominancia fenotípica Bos taurus y Bos indicus. Rev Cient 2010;20(3):259-67. [ Links ]
63. Ingraham RH, Stanley RW, Wagner WC. Relationship of temperature and humidity to pregnancy rate of Holstein cows in Hawaii. J Dairy Sci 1976;59:2086-90. [ Links ]
64. Sartori S, Sartor-Bergfelt R, Mertens SA, Guenther JN, Parrish JJ, Wiltbank MC. Fertilization and early embryonic development in heifers and lactating cows in summer and lactating and dry cows in winter. J Dairy Sci 2002;85:2803-12. [ Links ]
65. Al-Katanani YM, Paula-Lopes FF, Hansen PJ. Effect of season and exposure to heat stress on oocyte competence in Holstein cows. J Dairy Sci 2002;85:390-6. [ Links ]
66. Ambrose JD, Guseloglu A, Thatcher MJ, Kassa T, Diaz T, Thatcher WW. Long-term follicular dynamics and biochemical characteristics of dominant follicles in dairy cows subjected to heat-stress. J Reprod Fertil 1999; 54(Suppl):503-4. [ Links ]
67. Roman-Ponce H, Thatcher WW, Canton D, Barron DH, Wilcox CJ. Thermal stress effects on uterine blood flow in dairy cows. J Anim Sci 1978;46:175-80. [ Links ]
68. Fisher AD, Niemeyer JM, Lea C, Lee DR, Paull MT, Ferguson DM. The effects of 12, 30, or 48 hours of road transport on the physiological and behavioral responses of sheep. J Anim Sci 2010;88:2144-52. [ Links ]
69. Smith R, Dobson H. Hormonal interactions within the hypothalamus and pituitary with respect to stress and reproduction in sheep. Domes Anim Endo 2002;23:75-85. [ Links ]
70. Ozawa M, Tabayashi D, Latief TA, Shimizu T, Oshima I, Kanai Y. Alterations in follicular dynamics and steroidogenic abilities induced by heat stress during follicular recruitment in goats. Reproduction 2005;129:621-30. [ Links ]