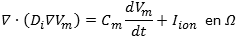Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biosalud
versión impresa ISSN 1657-9550
Biosalud v.10 n.2 Manizales jul./dic. 2011
REMODELADO ESTRUCTURAL Y DE GAP JUNCTIONS EN UN MODELO 3D DE AURÍCULA HUMANA
STRUCTURAL REMODELING AND OF GAP JUNCTIONS IN A 3D MODEL OF HUMAN ATRIAL
Carlos A. Ruiz-Villa1
Andrés P. Castaño Vélez2
Elvio A. Heidenreich3
1 Investigador del área de Bioingeniería y Bioinformática, Facultad de Ingeniería, Universidad de Caldas. Departamento de Informática, Universidad Nacional sede Manizales. Email: carv@ucaldas.edu.co.
2 Investigador del área de Bioingeniería y Bioinformática, Facultad de Ingeniería, Universidad de Caldas. Email: andres.castano@ucaldas.edu.co.
3 Investigador, Universidad Nacional de Lomas de Zamora, Buenos Aires Argentina. Email: elvioh@gmail.com.
Recibido: noviembre 11 de 2011 - Aceptado: diciembre 8 de 2011
RESUMEN
Introducción: la fibrilación auricular (AF), es la más común de la arritmia cardiaca sostenida y un factor de riesgo para el accidente cerebro vascular y otras morbilidades, si no es tratada. Estudios epidemiológicos muestran que la AF tiende a perpetuarse con el tiempo, generando cambios electrofisiológicos y anatómicos denominados: remodelados auriculares. Se ha demostrado que estos cambios provocan variaciones de la velocidad de conducción (CV), en el tejido auricular.
Objetivo: estudiar el efecto del remodelado de gap junctions en la propagación del potencial de acción, implementando un modelo 3D de aurícula humana altamente realista.
Materiales y Métodos: se incorporaron los cambios generados por el remodelado eléctrico a un modelo de potencial de acción (AP) de miocito auricular, acoplado con un modelo tridimensional anatómicamente realista de aurícula humana dilatada. Mediante simulaciones de la propagación del AP en condiciones de remodelado eléctrico y anatómico, y de remodelado de gap junctions, se midieron las ventanas vulnerables de generación de reentradas en la base de las venas pulmonares izquierdas de la aurícula.
Resultados: los resultados obtenidos indican que la ventana vulnerable en el remodelado de gap junctions, se desplazó 38 ms con relación al modelo dilatado, lo que nos muestra el impacto de la dilatación con remodelado de gap junction.
Conclusiones: el remodelado eléctrico generó una disminución del 70 % en la duración del potencial de acción y una disminución de las velocidades de conducción entre un 14.6 y un 26 %, que fueron medidas en diferentes regiones de la aurícula dilatada. El foco disparado en la base de las venas pulmonares izquierdas, generó un frente de onda que mantiene una actividad reentrante debido a la anatomía subyacente de las venas pulmonares.
PALABRAS CLAVE: fibrilación auricular, gap junctions, modelo 3D, potencial de acción, reentrada, remodelado eléctrico.
ABSTRACT
Introduction: Atrial fibrillation (AF) is the most common sustained cardiac arrhythmia and a significant risk factor for cerebrovascular accident and other morbidities if left untreated. Epidemiological studies show that AF tends to persist over time, creating electrophysiological and anatomical changes called atrial remodeling. It has been shown that these changes result in variations in conduction velocity (CV) in the atrial tissue.
Objective: to study the effect of remodeling of gap junctions in the propagation of the action potential by implementing a highly realistic 3D human atrial model.
Materials and methods: the changes caused by electrical remodeling were incorporated in an atrial myocyte action potential (AP) model coupled with an anatomically realistic three-dimensional model of dilated human atria. Through simulations of the AP spread in variations of anatomical and electrical remodeling and of gap junctions remodeling, vulnerable windows of reentry generation were measured at the base of the atrium left pulmonary veins.
Results: the results obtained indicate that vulnerable window in the gap junctions remodeling moved 38 ms in relation with the expanded model which shows the impact of the dilatation gap junction remodeling.
Conclusions: the electrical remodeling produced 70% decrease in action potential duration and decreased conduction velocities between 14.6 and 26 %, which were measured in different regions of the dilated atrium. The focus shot at the base of the left pulmonary veins created a wave which maintains a reentering activity due to the underlying anatomy of the pulmonary veins.
KEY WORDS: Atrial fibrillation, gap junctions, 3D model, action potential, reentry, electrical remodeling.
INTRODUCCIÓN
La fibrilación auricular (AF) es la más común de las arritmias cardíacas sostenidas y contribuye en gran medida a la morbilidad y la mortalidad cardiovascular. El tratamiento de la AF representa un costo para la salud importante. El costo estimado del tratamiento de la AF tan solo en los Estados Unidos en el año 2005 fue de $6.65 billones por año, que incluyen el costo por hospitalización, médico, atención ambulatoria y medicamentos (1). Se calcula que 2.66 millones de personas fueron diagnosticadas con AF en el 2010. Se espera que para el 2050, 12 millones de personas tengan esta condición (2). Aunque los datos respecto de la prevalencia de la AF en Latinoamérica son escasos, se cree que una gran cantidad de pacientes en la región vive con esta afección. En Brasil, se ha estimado que existen alrededor de 1,5 millones de pacientes con AF (3). En Venezuela se cree que hay 230.000 individuos con AF y se prevé que esta cifra aumente a 1 millón para el año 2050 (4). Aunque el inicio de la AF ha sido intensamente investigado (5-7), las teorías que tratan de determinar el principio de la AF, no explican la tendencia persistente de esta arritmia. Desde este punto de vista, la investigación actual, se ha centrado en la remodelación electrofisiológica de la AF crónica. La AF produce un acortamiento del período refractario debido a las reducciones específicas en las densidades de corriente (8, 9), a la disfunción del nódulo sinusal y la reducción de la velocidad de conducción intra-auricular (8). Este último hallazgo muestra una reducción en el acoplamiento intercelular a través de los canales que expresan la proteína connexin 43, que conforman el poro de los gap junctions. La geometría, anisotropía y orientación de las fibras del tejido auricular juegan un papel importante durante la propagación del AP, por tanto, implementar modelos anatómicamente realistas, permite reproducir con mayor precisión el comportamiento eléctrico del tejido, tanto en condición fisiológica normal, como de remodelado, permitiendo así, un mejor análisis para la comprensión de las patologías cardiacas. Sin embargo, la compleja anatomía auricular y los altos costes computacionales, han hecho que la mayoría de los estudios sobre la propagación del AP en modelos de aurícula humana hayan implementado una geometría simplificada (10, 11). Nuestro grupo ha venido desarrollando modelos 3D mejorados (12), que tienen en cuenta estructuras anatómicas como los grandes haces y el remodelado estructural.
El objetivo del presente trabajo es estudiar el efecto de remodelado del gap junctions en la propagación del potencial de acción, implementando un modelo 3D de aurícula humana altamente realista. Entregando una descripción del modelado y simulación electrofisiológica de la aurícula humana. El diseño del modelo geométrico realista, se ha orientado de manera que tenga la capacidad para reproducir clínicamente las arritmias: el modelo es capaz de sostener propagación arrítmica durante varios segundos y permitir intervenciones terapéuticas que puedan ser evaluadas.
MÉTODOS
Modelo 3D de aurícula humana
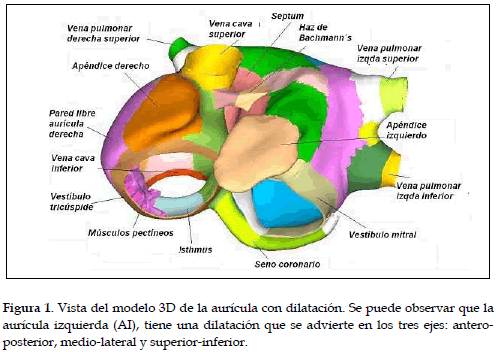
En la figura 1, se detallan las diferentes regiones anatómicas del modelo 3D de aurícula humana implementado. La anatomía global fue desarrollada en estudios previos (13). El modelo fue ajustado a las especificaciones geométricas establecidas (14-15), de esta manera incluye ambas aurículas en las cuales se destaca: el nodo sinoauricular (SAN), la cresta terminalis (CT), el haz intercaval, los músculos pectíneos, destacando: el septum spurium, la fosa oval y su anillo, el septum interauricular, el haz de Bachmann, las aurículas izquierda y derecha, la orejuela derecha e izquierda, dos venas pulmonares derechas y dos venas pulmonares izquierdas, el isthmus, las venas cavas superior e inferior, vestíbulo de la válvula tricúspide, vestíbulo de la válvula mitral, la unión interauricular del seno coronario y el seno coronario.
El modelo consta de 52906 elementos hexaédricos y 100554 nodos. Se identificaron las zonas de alta (cresta terminal, has de Bachmann y anillo de la fosa oval), baja (istmo de la aurícula derecha y fosa oval) y media conductividad (el resto del tejido auricular). Las conductividades fueron ajustadas para obtener velocidades de conducción acordes a datos experimentales (16, 17).
Los valores asignados a las conductividades fueron de 0.25, 0.40 y 0.10 S/cm para las zonas de conductividad media, alta y baja respectivamente.
El modelo se dividió en 42 zonas, con el fin de asignar una dirección de fibra realista con base a datos obtenidos de estudios histológicos de aurícula humana (18). La dirección en sentido longitudinal de la fibra es considerada paralela a la dirección de los grandes haces.
Remodelado eléctrico auricular
El remodelado eléctrico de la aurícula fue demostrado y definido por (19) y consiste en que, el periodo refractario efectivo de la aurícula se acorta progresivamente al aparecer la fibrilación. Además, se pierde la adaptación fisiológica existente entre la duración del periodo refractario efectivo y la frecuencia cardiaca.
Para lograr estas características, se efectuaron cambios en algunos parámetros del modelo de AP de célula de aurícula humana desarrollado por Nygren (20) de acuerdo con resultados experimentales (21, 22), se ha demostrado que episodios de AF inducen cambios en la conductancia y cinética de algunos canales iónicos de miocitos auriculares.
Los parámetros que se ajustaron en el modelo fueron los siguientes: la conductancia del canal Ik1 se incrementó en un 250 %, la de ICal se disminuyó en un 74 %, la de Ito se disminuyó en un 85 %, la cinética de inactivación rápida de ICaL se disminuyó en un 62 %, la curva de activación de Ito fue desplazada +16mV y la curva de inactivación de INa fue desplazada +1.6 mV en la dirección de despolarización.
MÉTODO SIMPLIFICADO DE REMODELADO DE GAP JUNCTIONS
Algunos estudios demuestran que la dilatación produce un remodelado en los gap junctions (23) y que estos producen una reducción de la conductividad en un 40 % en sentido longitudinal y de un 22 % en sentido transversal de manera homogénea (24). Por otra parte el remodelado de gap junctions es asociado también a la dilatación auricular (25).
Otros estudios muestran la importancia de la dilatación en la determinación de propiedades de la propagación transversal, como los cambios en los gap junctions (26). Los resultados sugieren que en un sustrato patológico arritmogénico, el tamaño de la célula durante el remodelado de gap junctions, es importante en el mantenimiento de una tasa máxima de despolarización. Con lo cual, resulta razonable modelar el efecto del remodelado de los gap junctions, teniendo en cuenta la dilatación auricular, el remodelado auricular, la conductividad del tejido y la anisotropía. En este trabajo se asumió un remodelado simplificado de gap junction considerando: situaciones de AF, por remodelado eléctrico y estructurado (dilatación), una reducción de la conductividad del tejido en un 40 % (24), una relación anisotrópica de 10:1 en la cresta terminalis (17) y una reducción de conductividad en el SAN (27, 28).
Propagación del potencial de acción
El modelo monodominio que representa la propagación del AP extendido a un tejido tridimensional reconstruido, se describe:
donde Vm representa el potencial en el espacio intracelular, Di es el tensor de conductividad anisotrópico Cm la capacitancia del medio e Iion, corresponde al conjunto de corrientes que describen el estado iónico de las células en el tejido, como una función del tiempo y de las concentraciones iónicas. Se asume un espacio extracelular con resistencia infinita, con las siguientes condiciones de frontera:
donde n es el vector normal a la superficie.
Para resolver la ecuación (1) de reacción difusión se implementó un código en paralelo usando el método de los elementos fi nitos (FEM).
De dicha discretización, se desprende un sistema de ecuaciones lineales con un término reactivo no lineal representado por el Iion. El término reactivo se resuelve explícitamente mientras que la ecuación temporal se resuelve en forma implícita. El sistema que ha de resolverse en cada paso de tiempo tiene como número de incógnitas el número de nodos (100554).
Protocolo de estimulación
Se aplicó un tren de 10 impulsos en la región del nodo sinoauricular, con el fin de simular el ritmo sinusal del corazón. La longitud del ciclo base (BCL) fue de 300 ms. Un foco ectópico fue modelado por un impulso supraumbral aplicado en un pequeño grupo de células en la pared posterior de la AI, cerca a las VP izquierdas. La actividad focal se aplicó durante la fase de repolarización del décimo ritmo sinusal.
Ventanas vulnerables a reentradas
La ventana vulnerable a reentradas corresponde a la franja de tiempo durante la cual es posible encontrar al menos una reentrada y se mide en ms. El tiempo inicial de la ventana se obtiene aplicando estímulos siguiendo el protocolo de estimulación en la base de las venas pulmonares izquierdas hasta encontrar la generación de la primera reentrada. El proceso se sigue por observación, hasta que no se generen mas reentradas, tiempo que defi ne el límite superior de la ventana.
RESULTADOS Y DISCUSIÓN
Abordamos el estudio de las reentradas anatómicas inducidas al aplicar un foco ectópico en cercanías de la base de las venas pulmonares izquierdas, siguiendo el protocolo establecido. Como se indica en la figura 2, encontramos que la vulnerabilidad a reentradas en la aurícula dilatada con remodelado de gap junctions, aumentó su ventana vulnerable de 18 ms a 31 ms con relación a la observada en la aurícula con dilatación y remodelado eléctrico. La ventana vulnerable se desplazó 38 ms con relación al modelo dilatado y 60 ms en relación a la aurícula con solo remodelado eléctrico, lo que nos muestra el impacto de la dilatación con remodelado de gap junctions. Existen trabajos similares en los que el remodelado eléctrico incluye cambios en ICal, Ito, Ik1 e IKach y el remodelado de gap junctions fue considerado, modificando la conductividad para la ecuación monodominio (29). Además, el estudio computacional que presenta resultados similares al anterior, a pesar que incluye diferentes datos de medición de remodelado, no incluye el remodelado de gap junctions (30).
El frente de activación mantiene un patrón de propagación similar en cada uno de los focos aplicados en la base de las venas pulmonares izquierdas. El frente propaga, rodeando la base de las venas pulmonares izquierdas. El extremo de la propagación en cercanías de la base de la vena pulmonar izquierda inferior, forma un rotor que genera una reentrada funcional que se repite indefinidamente.
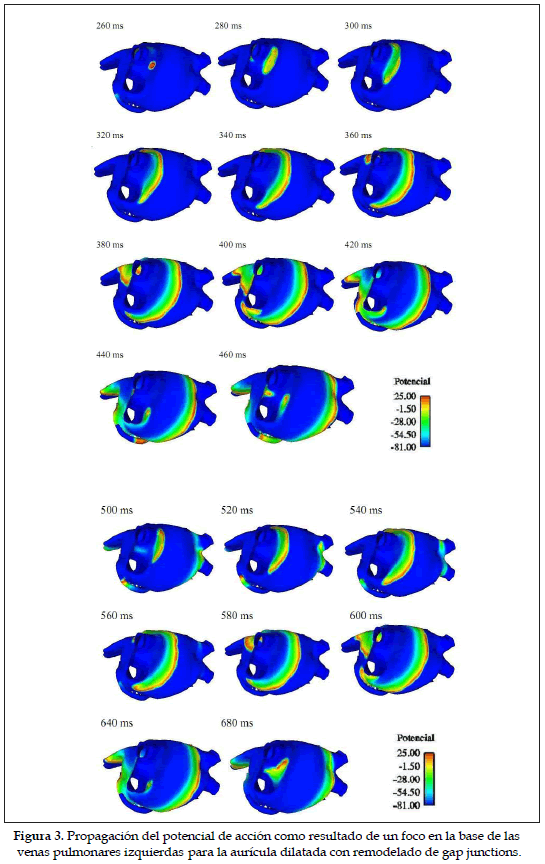
En la figura 3, se muestra la secuencia de propagación del potencial de acción, generado a partir de un estímulo focal disparado en la base de las venas pulmonares izquierdas a los 260 ms del tiempo de intervalo de acoplamiento, siguiendo el protocolo establecido y descrito anteriormente para el modelo de aurícula dilatada. El frente recién formado avanza en dirección transversal a las fibras del tejido y en dirección longitudinal en los extremos uno hacia la parte superior y otro a la parte inferior como puede observarse a los 300 ms.
El extremo superior del frente se dirige hacia las uniones interauriculares y hacia el apéndice, mientras que el frente del extremo inferior rodea la base de las venas pulmonares girando sobre sí mismo. En la base de la vena pulmonar izquierda inferior se genera un nuevo frente a los 440 ms que se convierte en reentrada en forma de rotor.
Esta reentrada genera un frente que nuevamente se extiende por sus extremos. Las ramas de los extremos se encuentran en la pared anterior de la aurícula izquierda y generan una nueva reentrada. El proceso se repite indefinidamente.
CONCLUSIONES
Implementando el modelo 3D de aurícula humana altamente realista, se reprodujo la condición de remodelado eléctrico auricular causado por episodios de AF crónica. El remodelado eléctrico generó una disminución del 70 % en la duración del potencial de acción y una disminución de las velocidades de conducción entre un 14.6 y un 26 %, medidas en diferentes regiones de la aurícula dilatada.
El foco disparado en la base de las venas pulmonares izquierdas, generó un frente de onda que mantiene una actividad reentrante, debido a la anatomía subyacente de las venas pulmonares.
Los valores obtenidos son cuantitativamente similares a los obtenidos en otros estudios experimentales y de simulación.
AGRADECIMIENTOS
Agradecimientos al apoyo prestado por el Instituto de Investigación e Innovación en Bioingeniería de la Universidad Politécnica de Valencia y al Grupo de estructuras y modelado de materiales, Universidad de Zaragoza.
BIBLIOGRAFÍA
1. Coyne KS, Paramore C, Grandy S, Mercader M, Reynolds M, Zimetbaum P. Assessing the direct costs of treating nonvalvular atrial fibrillation in the United States. Value Health 2006; 9(5):348-56. [ Links ]
2. Lloyd-Jones D, Adams RJ, Brown TM, Carnethon M, Dai S, De Simone G, et al. Heart disease and stroke statistics--2010 update: a report from the American Heart Association. Circulation 2010; 121(7):e46-e215. [ Links ]
3. Zimerman L, Fenelon G, Martinelli Filho M, Grupi C, Atié J, Lorga Filho A. Diretrizes brasileiras de fibrilação atrial. Arq Bras Cardiol 2009; 92(6 Suppl. 1):1-39. [ Links ]
4. Fuenmayor A, Fuenmayor A. Tratamiento no farmacológico de la fibrilación auricular. Avances Cardiológicos 2009;29:286-95. [ Links ]
5. Cox JL, Canavan TE, Schuessler RB, Cain ME, Lindsay BD, Stone C, et al. The surgical treatment of atrial fibrillation. II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991; 101(3):406-26. [ Links ]
6. Kirchhof C, Chorro F, Scheffer GJ, Brugada J, Konings K, Zetelaki Z, et al. Regional entrainment of atrial fibrillation studied by high-resolution mapping in open-chest dogs. Circulation 1993; 88(2):736-49. [ Links ]
7. Konings KT, Kirchhof CJ, Smeets JR, Wellens HJ, Penn OC, Allessie MA. High-density mapping of electrically induced atrial fibrillation in humans. Circulation 1994; 89(4):1665-80. [ Links ]
8. Elvan A, Wylie K, Zipes DP. Pacing-induced chronic atrial fibrillation impairs sinus node function in dogs. Electrophysiological remodeling. Circulation 1996; 94(11):2953-60. [ Links ]
9. Tieleman RG, De Langen C, Van Gelder IC, de Kam PJ, Grandjean J, Bel KJ, et al. Verapamil reduces tachycardia-induced electrical remodeling of the atria. Circulation 1997; 95(7):1945-53. [ Links ]
10. Virag N, Jacquemet V, Henriquez CS, Zozor S, Blanc O, Vesin JM, et al. Study of atrial arrhythmias in a computer model based on magnetic resonance images of human atria. Chaos 2002; 12(3):754-763. [ Links ]
11. Jacquemet V, Virag N, Ihara Z, Dang L, Blanc O, Zozor S, et al. Study of unipolar electrogram morphology in a computer model of atrial fibrillation. J Cardiovasc Electrophysiol 2003; 14(Suppl. 10):S172-9. [ Links ]
12. Ruiz-Villa C, Tobón C, Heidenreich E, Hornero F. Propagación de potencial de acción en un modelo 3D realista de Aurícula Humana. In: Congreso Anual de la Sociedad Española de Ingeniería Biomédica; 2006. Pamplona. [ Links ]
13. Ruiz-Villa C, Tobón C, Rodriguez FJ, Heidenreich E. Efecto de la dilatación auricular sobre la vulnerabilidad a reentradas. In: Congreso Anual de la Sociedad española de Ingeniería Biomédica; 2008. Valladolid. [ Links ]
14. Wang K, Ho SY, Gibson DG, Anderson RH. Architecture of atrial musculature in humans. Br Heart J 1995; 73(6):559-65. [ Links ]
15. Cohen GI, White M, Sochowski RA, Klein AL, Bridge PD, Stewart WJ, et al. Reference values for normal adult transesophageal echocardiographic measurements. J Am Soc Echocardiogr 1995; 8(3):221-30. [ Links ]
16. Feld GK, Mollerus M, Birgersdotter-Green U, Fujimura O, Bahnson TD, Boyce K, et al. Conduction velocity in the tricuspid valve-inferior vena cava isthmus is slower in patients with type I atrial flutter compared to those without a history of atrial flutter. J Cardiovasc Electrophysiol 1997; 8(12):1338-48. [ Links ]
17. Hansson A, Holm M, Blomstrom P, Johansson R, Luhrs C, Brandt J, et al. Right atrial free wall conduction velocity and degree of anisotropy in patients with stable sinus rhythm studied during open heart surgery. Eur Heart J 1998; 19(2):293-300. [ Links ]
18. Ho SY, Sanchez-Quintana D, Anderson RH. Can anatomy define electric pathways? In: International Workshop on Computer Simulation and Experimental Assessment of Electrical Cardiac Function; 1998. Lausanne, Switzerland. [ Links ]
19. Allessie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002; 54(2):230-46. [ Links ]
20. Nygren A, Fiset C, Firek L, Clark JW, Lindblad DS, Clark RB, et al. Mathematical model of an adult human atrial cell: the role of K+ currents in repolarization. Circ Res 1998; 82(1):63-81. [ Links ]
21. Bosch RF, Zeng X, Grammer JB, Popovic K, Mewis C, Kuhlkamp V. Ionic mechanisms of electrical remodeling in human atrial fibrillation. Cardiovasc Res 1999; 44(1):121-31. [ Links ]
22. Workman AJ, Kane KA, Rankin AC. The contribution of ionic currents to changes in refractoriness of human atrial myocytes associated with chronic atrial fibrillation. Cardiovasc Res 2001; 52(2):226-35. [ Links ]
23. Takeuchi S, Akita T, Takagishi Y, Watanabe E, Sasano C, Honjo H, et al. Disorganization of gap junction distribution in dilated atria of patients with chronic atrial fibrillation. Circ J 2006; 70(5):575-82. [ Links ]
24. Jongsma HJ, Wilders R. Gap junctions in cardiovascular disease. Circ Res 2000; 86(12):1193-7. [ Links ]
25. Kostin S, Rieger M, Dammer S, Hein S, Richter M, Klovekorn WP, et al. Gap junction remodeling and altered connexin 43 expression in the failing human heart. Mol Cell Biochem 2003; 242(1-2):135-44. [ Links ]
26. Spach MS, Heidlage JF, Dolber PC, Barr RC. Electrophysiological effects of remodeling cardiac gap junctions and cell size: experimental and model studies of normal cardiac growth. Circ Res 2000; 86(3):302-11. [ Links ]
27. Boyett MR, Honjo H, Kodama I. The sinoatrial node, a heterogeneous pacemaker structure. Cardiovasc Res 2000; 47(4):658-87. [ Links ]
28. Wilders R. Computer modelling of the sinoatrial node. Med Biol Eng Comput 2007; 45(2):189-207. [ Links ]
29. Seemann G, Bustamante PC, Ponto S, Wilhelms M, Scholz EP, Do, et al. Atrial fibrillation-based electrical remodeling in a computer model of the human atrium. In: Computing in Cardiology, 2010; 2010 26-29 Sept. 2010; 2010. p. 417-420. [ Links ]
30. Kharche S, Zhang H. Simulating the effects of atrial fibrillation induced electrical remodeling: A comprehensive simulation study. In: Engineering in Medicine and Biology Society, 2008. EMBS 2008. 30th Annual International Conference of the IEEE; 2008. p. 593-5. [ Links ]