Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.10 no.2 Manizales July/Dec. 2011
EL CUERPO LÚTEO: UNA VISIÓN INMUNOLÓGICA
CORPUS LUTEUM: AN INMUNOLOGICAL VIEW
Luis Fernando Uribe-Velásquez1
José Henry Osorio2
Adriana Correa-Orozco3
1 Ph.D., Profesor Asociado, Departamento de Salud Animal, Facultad de Ciencias Agropecuarias, Universidad de Caldas. E-mail: lfuribe@ucaldas.edu.co.
2 Ph.D., Profesor Titular, Departamento de Ciencias Básicas, Facultad de Ciencias para la Salud, Universidad de Caldas.
3 MVZ, M.Sc., Joven Investigador COLCIENCIAS, Grupo de Investigación en Ciencias Veterinarias: CIENVET, Universidad de Caldas.
Recibido: septiembre 22 de 2011 - Aceptado: octubre 7 de 2011
RESUMEN
El objetivo de la presenta revisión es describir los conceptos actuales sobre el mecanismo local de la cascada de desarrollo y regresión del cuerpo lúteo (CL) regulado por macrófagos, células inmunológicas y citoquinas. El CL de la vaca es un órgano dinámico, el cual tiene una vida media de aproximadamente 17 a 18 días. La principal función del CL es secretar grandes cantidades de progesterona (P4). Cuando el CL madura, las células esteroidogénicas establecen contacto con muchos capilares. Además, el CL maduro está compuesto de muchas células endoteliales vasculares, las cuales pueden alcanzar hasta el 50 % de todas las células del CL. En el ganado bovino y otras especies, el CL juega un papel central en la regulación de la ciclicidad y en el mantenimiento de la preñez. En muchas especies, la regresión luteal es iniciada por la liberación uterina de prostaglandina F2α (PGF2α), la cual inhibe la esteroidogénesis, desencadenando una cascada de eventos que llevan a la desaparición final del tejido. Las células inmunes, principalmente los macrófagos y los linfocitos T, son importantes para la ingestión de los restos celulares que resultan de la muerte de las células luteales. Los macrófagos son células multifuncionales que juegan un papel clave en la respuesta inmune y son abundantes en todo el tejido reproductivo de la hembra. Su localización específica y las variaciones de la distribución en el ovario durante los diferentes estados del ciclo, sugieren que los macrófagos juegan diversas funciones en los eventos intraováricos, lo que incluye: la foliculogénesis, la reestructuración del tejido en la ovulación y la formación y regresión del CL.
PALABRAS CLAVE: ciclo estral, endotelinas, factor de necrosis tumoral-α, macrófagos, ovario, progesterona.
ABSTRACT
The aim of the present review is to describe the current concepts of the local mechanism for the cascade of development and regression of the corpus luteum (CL) as regulated by macrophages, immunological cells and cytokines. The cow CL is a dynamic organ which has a life time of approximately 17-18 days. The main function of the CL is to secrete a large amount of progesterone (P4). As the CL matures, the steroidogenic cells establish contact with many capillaries and the matured CL is composed of many vascular endothelial cells that account for up to 50 % of all CL cells. In cattle and other species, the CL plays a central role in the regulation of cyclicity and maintenance of pregnancy. In many species, luteal regression is initiated by uterine release of PGF2α, which inhibits steroidogenesis and may launch a cascade of events leading to the tissue final disappearance. Immune cells, primarily macrophages and T lymphocites are important for ingestion of cellular remnants that result from the death of luteal cells. Macrophages are multifunctional cells that play key roles in the immune response and are abundant throughout female reproductive tissues. Their specific localization and variations in distribution in the ovary during different stages of the cycle, suggest that macrophages play diverse roles in intra-ovarian events including folliculogenese, tissue restructuring at ovulation and CL formation and regression.
KEY WORDS: estrous cycle, endothelin, tumor necrosis factor-α, macrophages, ovary, progesterone.
INTRODUCCIÓN
Los nuevos avances relacionados con la comprensión de la inmunología de la reproducción animal extienden las fronteras de la Medicina Veterinaria y abren las puertas hacia nuevas estrategias terapéuticas, de diagnóstico y de monitoreo de los problemas reproductivos de origen inmunológico en los animales domésticos. El sistema inmune tiene un importante papel en la regulación de los ejes endocrinos, participando activamente en diferentes niveles y localmente en el ovario.
El ciclo ovárico está caracterizado por patrones repetidos de proliferación celular, diferenciación y transformación que acompañan el desarrollo folicular, la formación y regresión del cuerpo lúteo (CL). El CL es una glándula endocrina transitoria, secretora de progesterona (P4), la cual juega un papel importante en el mantenimiento de la preñez en los mamíferos domésticos (1). Además, el CL también secreta en cantidades menores: estrógenos, relaxina, oxitocina, neurofisina I, inhibina y vasopresina. Las gonadotrofinas derivadas de la hipófisis y la hormona del crecimiento (GH), son las principales reguladoras de la maduración folicular final y de la función del CL. Existen también, otros factores de origen extra e intraováricos que modulan la respuesta local de estas hormonas o poseen funciones directas específicas. La formación del CL, es iniciada por una serie de cambios morfológicos y bioquímicos en las células de la teca interna y de la granulosa del folículo preovulatorio. Durante el desarrollo inicial hasta la mitad de la fase luteal, la oxitocina, las prostaglandinas y la P4 estimulan la proliferación de las células luteales, cuya función es soportada por la acción luteotrófica de un gran número de factores de crecimiento. La expresión de RNAm, la concentración de proteínas y los diferentes factores de crecimiento, de los cuales se puede citar el factor de crecimiento endotelial vascular (VEGF); los factores de crecimiento de fibroblastos 1 y 2 (FGF-1 y el FGF-2) y los factores de crecimiento tipo insulina (IGFs) presentes en el citoplasma de las células luteales, sugieren un papel importante en el control luteal. Además de ello, los IGFs están involucrados en la foliculogénesis, la esteroidogénesis ovárica y en la función luteal (2). En la ausencia de preñez, se presenta la luteólisis del CL. En bovinos y otros animales domésticos, la vida media del CL es controlada principalmente por las hormonas luteolíticas uterinas, como: la prostaglandina F2α (PGF2α), la oxitocina y la GH (Hormona del crecimiento), afectando la duración del ciclo estral (3). La misma P4 regula el intervalo interovulatorio, por su influencia al momento de la señalización luteolítica de la PGF2α desde el endometrio (1). La presente revisión pretende explorar, a través de los diferentes trabajos experimentales, los avances más relevantes relacionados con las células inmunológicas involucradas en el proceso de formación, regulación y mantenimiento del CL.
FORMACION DEL CUERPO LUTEO
La ecografía transrectal permite la observación y la evaluación del CL ovino y bovino durante el ciclo estral. Las imágenes ecográficas y el tamaño del CL varían desde la ovulación hasta la luteólisis, siendo el tamaño correlacionado con el día del ciclo estral y los niveles plasmáticos de P4. La presencia de una cavidad central dentro del CL no muestra efectos sobre la duración del ciclo estral o en las concentraciones plasmáticas de P4 (4). A través de la técnica ecográfica, ha sido observado por lo menos un CL en la mitad de la fase luteal en ovejas. El CL, ha sido observado desde el tercer día después de la ovulación en hembras ovinas (5) y también durante todo el ciclo estral en ovejas sincronizadas con prostaglandinas (6). Se ha evidenciado en bovinos (7) que CL cavitarios (son los que presentan una cavidad central llena de liquido), están acompañados de mayores folículos preovulatorios, sin afectar la fertilidad (8), los cuales tienen una importante participación en la secreción de P4.
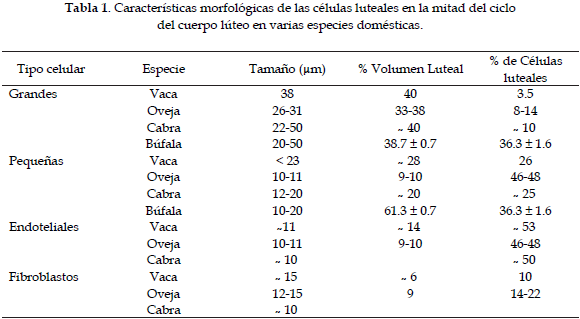
El CL es un tejido heterogéneo, conformado por células endoteliales, miocitos (musculatura lisa), por células inmunes, por fibroblastos y por células luteales grandes, que ocupan el 40.2 ± 7 % del tejido luteal y por las células luteales pequeñas esteroidogénicas, en un porcentaje del 27.7 ± 6.3 % (9). Las características morfológicas de las células luteales en la mitad del ciclo del CL en varias especies domésticas, son mostradas en la tabla 1 (10, 11).
Las células luteales son derivadas de las células de la teca y de la granulosa del folículo ovárico, las cuales se diferencian en células luteales pequeñas y grandes, respectivamente. Las células luteales pequeñas, son estructuralmente más condicionadas para las funciones esteroidogénicas, mientras que las células luteales grandes secretan además de esteroides, péptidos reguladores (11).
El CL en los animales domésticos es un órgano dinámico que depende del crecimiento cíclico y de la regresión. Con la maduración del CL, la angiogénesis, o sea la formación de nuevos vasos sanguíneos, es intensa e indispensable para el rápido crecimiento luteal (12). En la mitad de la fase luteal, la mayoría de las células esteroidogénicas están adyacentes a uno o más capilares, permitiendo el aumento del flujo sanguíneo (13). Aunque las principales hormonas luteotrópicas y luteolíticas en hembras bovinas, son la hormona luteinizante (LH) (14) y la PGF2α (15); respectivamente, algunos péptidos ováricos también son importantes reguladores paracrinos del desarrollo y regresión del CL. Por ejemplo, con respecto a la regulación de la perfusión luteal y secreción de P4, los factores angiogénicos y vasoactivos juegan un papel importante (12). Los principales factores de crecimiento angiogénicos a ser considerados son el VEGF y el FGF2 (factor de crecimiento de fibroblastos), los cuales son potentes estimulantes de la proliferación de las células endoteliales y de la migración (16, 17). Sus actividades biológicas están mediadas por los receptores del factor de crecimiento endotelial vascular (VEGFR) y por los receptores del FGFR, respectivamente (18). Una sustancia vasoactiva ejemplar con gran relevancia para la angiogénesis luteal es el factor vasodilatador óxido nítrico (NO), el cual es liberado desde el lugar de la inflamación aguda (19, 20). Cabe anotar que, las concentraciones en el fluido folicular del NO, varían también de acuerdo al tamaño folicular, estado funcional y fase del ciclo estral, sugiriendo su importancia fisiológica durante el ciclo estral en rumiantes (21).
REGULACIÓN DE LA FUNCIÓN DEL CUERPO LÚTEO
La función luteal intrínseca es controlada por la interacción de varios factores luteotróficos que incluyen gonadotropinas (LH y la gonadotropina coriónica equina -eCG-), prolactina, PGF2α y estrógeno. La hormona luteotrópica primaria en la mayoría de las especies es la LH. Dicha gonadotropina, es esencial para la inducción de la ovulación y el inicio del proceso de luteinización. En los rumiantes domésticos, las principales hormonas luteotróficas que soportan el desarrollo y función del CL son la LH y la GH (Hormona del crecimiento) (1). La síntesis de P4, está dada por las hormonas luteotróficas, principalmente, la LH, además de la hormona folículo estimulante (FSH) y el estradiol, aunque en algunas especies como los roedores, la prolactina ha desempeñado este papel.
El CL bovino se desarrolla rápidamente dos ó tres días después de la ovulación, fenómeno que es acompañado por la angiogénesis y la vascularización desde el folículo preovulatorio (18). Además, el CL bovino posee un gran potencial para producir un número importante de factores angiogénicos. El VEGF, el principal factor regulador de la angiogénesis, es un potente mitógeno para las células endoteliales (22) y un estimulante de la permeabilidad capilar (23).
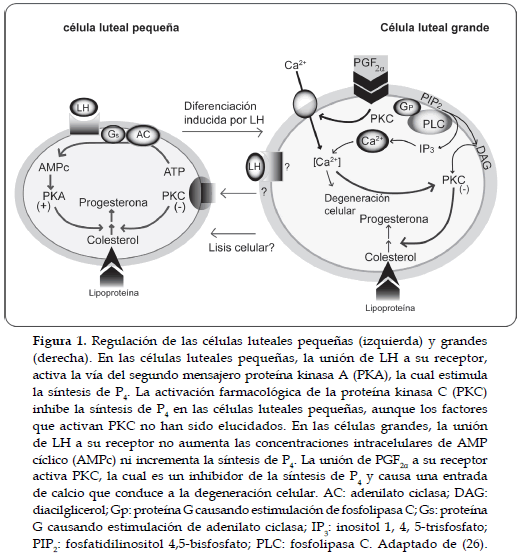
La producción de P4 por el CL bovino, es regulada por la actividad de diferentes enzimas esteroidogénicas, incluyendo la citocromo P450 que rompe la cadena lateral del colesterol (P450scc) (24). Para el control de la síntesis de P4 en el CL, existen, por lo menos, dos tipos de células esteroidogénicas, las cuales son diferentes morfológica y bioquímicamente en el CL de hembras bovinas y ovejas, y en la mayoría de las especies mamíferas (25). En ovejas, las células luteales pequeñas poseen 12-20 µm de diámetro, originarias de las células de la teca folicular con receptores para la LH, responden a LH o al AMP cíclico (AMPc) incrementando la producción de P4. Las células luteales grandes (> 20 µm), son originadas de las células de la granulosa, las cuales secretan altas concentraciones basales de P4 y aunque tienen receptores para LH, dichas células no responden a LH o al AMPc para aumentar las concentraciones de P4, dependiendo entonces de una gran cantidad de receptores para GH, los cuales son responsables por el 80 % de la producción total de P4 (1). En la figura 1, se puede observar el modelo de regulación de las células luteales grandes y pequeñas (26).
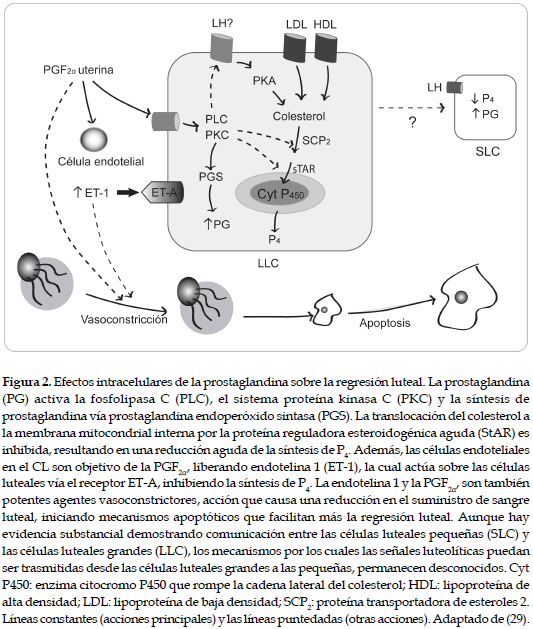
El CL es una glándula transitoria que, en ausencia de apropiadas señales embrionarias, sufre luteólisis. En la mayoría de las especies, la regresión luteal es iniciada por la liberación de la PGF2α desde el útero, lo que provoca una cascada de eventos dentro del CL (figura 2). La luteólisis en mamíferos se compone de una fase de regresión funcional y otra estructural. Así, una disminución en la secreción de P4 se presenta antes de las señales bioquímicas de la luteólisis estructural, provocando una disminución en la morfología del CL (27). Los cambios funcionales y estructurales observados durante la luteólisis inducida por la PGF2α dependen de los factores paracrinos y endocrinos producidos por el CL (28).
CÉLULAS INMUNES DEL CUERPO LÚTEO
En ausencia de preñez, las células inmunes han sido implicadas en el proceso de la regresión luteal. Los neutrófilos, macrófagos y linfocitos T, predominan en el CL alrededor del momento de la luteólisis y están directamente involucrados en la destrucción de las células luteales, con la subsecuente disminución en la secreción de P4 (29, 30). Después de la inflamación, los mecanismos antiinflamatorios interactúan con los procesos inflamatorios propios de la ovulación. Este proceso es mediado en parte por los glucocorticoides originados desde la adrenal, actuando a través del receptor NR3C1 (Receptor nuclear subfamilia 3, grupo C, miembro 1), expresado en las células epiteliales de la superficie ovárica. Las citoquinas proinflamatorias, como la interleuquina-1 (IL-1), pueden producir durante la ovulación incrementos de la expresión de la enzima hidroxiesteroide deshidrogenasa (11-P) en el epitelio ovárico, la cual convierte la cortisona a cortisol antiinflamatorio (31, 32). Consecuentemente, el cortisol se une al NR3C1 e inactiva la señal antiinflamatoria (33). Los niveles circulantes de cortisol son relativamente constantes durante el ciclo estral bovino, hormona que es sintetizada desde la glándula adrenal. Estudios han reportado que el cortisol inhibe la apoptosis inducida por TNF-IFNG (Factor de necrosis tumoral-Interferón gama) in vitro, reduciendo las señales de apoptosis vía CASP8 (Caspasa 8) y CASP3 (Caspasa 3) en el CL bovino. De modo que, el incremento en la secreción del cortisol es resultante del aumento de la HSD11B1 (11beta-hidroxiesteroide deshidrogenasa tipo 1) en las fases iniciales y media del CL, facilitando la función luteal y suprimiendo la apoptosis de las células luteales (34).
En un gran número de especies, la población de las células inmunes dentro del CL fluctúa a través del ciclo estral o menstrual, siendo involucradas en el mantenimiento y la regresión del CL (35). La quimioquina MCP-1 (proteína quimioatrayente de monocitos), es una de las moléculas más potentes que provoca reclutamiento de monocitos y macrófagos. La síntesis y secreción de la MCP-1 en el CL puede ser estimulada por la administración exógena de hormonas luteolíticas (36, 37), como la PGF2α. El reclutamiento de macrófagos hacia el CL de ratas, conejos y hembras bovinas es regulado probablemente, por la expresión de la MCP-1 (38). La expresión de esta proteína y la relativa distribución de las células inmunes en el CL bovino, han sido estudiados durante el ciclo estral. La expresión MCP-1 fue evidente en los días 6, 12 y 18 después de la ovulación durante el ciclo estral bovino (día cero = ovulación). El incremento en la expresión de la MCP-1 fue acompañada por el acúmulo de células inmunes en el CL bovino, resultados que soportan la hipótesis que, la MCP-1 promueve el reclutamiento de las células inmunes hacia el CL facilitando la regresión (35).
Las primeras descripciones de la presencia de las células blancas en el CL bovino fueron en 1968 (39). Estos autores observaron que los linfocitos están presentes en el tejido conectivo rodeando el área vascular luteal en el día 14 del ciclo estral. Durante los días 15 a 17, los linfocitos están infiltrados entre las células luteales grandes y pequeñas, pudiéndose visualizar los macrófagos en el día 19. Las células inmunes más abundantes en el CL bovino, son la línea monocito/macrófago, seguidos por los linfocitos T CD8+ y CD4+. Éstos últimos han sido detectados en el CL en todas las fases del ciclo estral (35). Se ha observado un incremento en la cantidad de linfocitos y macrófagos en el CL al momento de la luteólisis. La mayoría de los linfocitos T en el CL migran hacia el tejido, pero en algunos casos la proliferación de los linfocitos se presenta dentro del tejido. La presencia e incremento de los linfocitos al momento de la luteólisis implica que estas células pueden estar involucradas en el proceso que facilita la regresión (40). Parte de la adquisición de la capacidad luteolítica, se debe al incremento en la MCP-1, incluyendo además, el marcado acumulo de células inmunes en el CL en este periodo. Este concepto se extiende también al periodo de reconocimiento materno de la preñez. La preñez suprime los mecanismos de la respuesta inmune, evitando la regresión del CL (35). Otros autores (41) sugieren que, las células inmunes dentro del CL, contribuyen con alguna toxicidad provocando pérdida embrionaria temprana en bovinos. Las citoquinas, las PGF2α y otros productos originados desde las células inmunes podrían ser responsables de tales efectos tóxicos.
Los macrófagos son importantes para la ingestión de residuos celulares resultantes de la muerte de células luteales. Las células inmunes están involucradas directamente en la destrucción de las células luteales, además de la pérdida de la esteroidogénesis (29).
CARACTERÍSTICAS GENERALES Y FUNCIONES DE LOS MACRÓFAGOS EN EL TEJIDO OVÁRICO
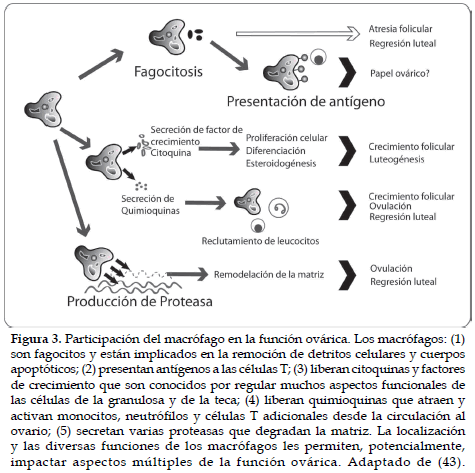
Los macrófagos son células multifuncionales que juegan un rol importante en la respuesta inmune, siendo muy abundantes en el tejido reproductivo de la hembra. Los macrófagos se identifican en los tejidos ejecutando diversas funciones, incluyendo fagocitosis y degradación de antígenos extraños; disolución y remodelación de la matriz; y producción y secreción de citoquinas, quimoquinas y factores de crecimiento. La presencia de los macrófagos en el ovario, ha sido establecida hace varios años. Su identificación fue el resultado de estudios realizados en 1964, examinando la distribución de los macrófagos en el ovario de la rata (42). Su localización específica y distribución en el ovario durante las fases del ciclo estral, sugieren que los macrófagos juegan diversos papeles en los eventos intraováricos, incluyendo la foliculogénesis y la reestructuración de los tejidos, así como en la formación y regresión del CL. De la misma forma, los macrófagos participan en la regulación del eje hipófisis-gónadas encontrándose en diversos órganos como son: el ovario, útero y glándula mamaria. Cada una de las principales funciones de los macrófagos en las diferentes fases del ciclo ovárico y su impacto son mostradas en la figura 3 (43).
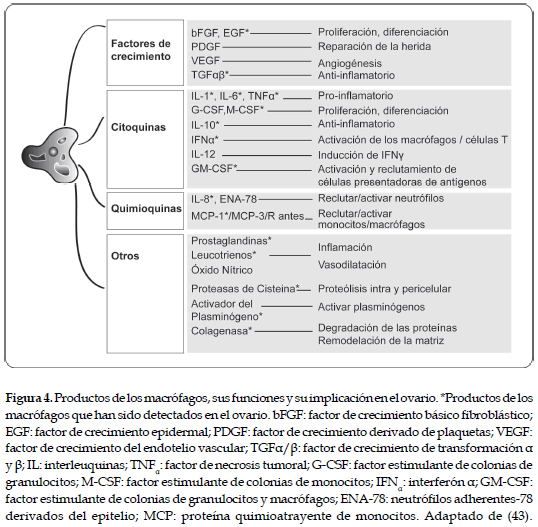
Una selección de los productos de los macrófagos y sus funciones se ilustran en la figura 4. En general, la producción y liberación de estas proteínas secretoras, está regulada temporalmente y de una manera tejido-específica, por mecanismos paracrinos y autocrinos.
Los macrófagos secretan una gran cantidad de citoquinas que incluyen: interleuquinas (IL)-1-6-10 y 12 e interferón α (IFNα), además de una variedad de factores de crecimiento, que contienen el factor de crecimiento epidermal (EGF); el IGF; el VEGF; el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF); y el factor de crecimiento de transformación (TGF) α y β; también el factor de necrosis tumoral (TNFα), cada uno de ellos con un papel importante dentro de la función ovárica (44). El TNFα se origina desde las células endoteliales, el oocito, la teca y la granulosa de los folículos preovulatorios, con un papel relevante en el desarrollo y diferenciación celular, así como en los mecanismos de debilidad y ruptura ovárica. De igual forma, es una citoquina implicada en la regulación reproductiva, mediada por sus efectos sobre las células esteroidogénicas (45). El TNFα es un importante factor local en la atresia o en el proceso inflamatorio que resulta de la ovulación. En la fase luteal, reduce la secreción de estradiol. No obstante, es de fundamental importancia en la luteogénesis y en la luteólisis, debido al control sobre la secreción de las prostaglandinas E y F y, consecuentemente, interviniendo en los niveles de la P4. Las diferencias en las respuestas celulares pueden depender de las interrelaciones entre los mecanismos de la cascada, que pueden coexistir dentro de un tipo particular de células (46). Recientemente (47), se ha encontrado que el TNFα está presente, tanto en las células luteales grandes, como en las pequeñas y en las células inmunes en el CL bovino, a lo largo del ciclo estral y que su concentración es mayor en el estado de regresión luteal (19 a 21 días después de la ovulación) que en los estados inicial (2 a 4 días), medio (8 a 11 días) y final (14 a 16 días).
El TNFα es liberado localmente en el CL durante la luteólisis inducida por prostaglandinas F2α o de forma espontánea y su fisiología depende de la interacción con los diferentes tipos celulares dentro del CL (48, 49). Se ha sugerido que el TNFα secretado por las células luteales e inmunes, juegan un papel autocrino o paracrino en la regulación de la función luteal a lo largo del ciclo estral en el ganado bovino, vía sus receptores específicos tipo I (TNF-RI) y tipo II (TNFRII) (47). La mayoría de los estudios in vitro, han indicado que el TNFα induce la luteólisis solamente en combinación con el interferón o con otros factores intraluteales como el NO (50). Las acciones de la dosis luteolítica del TNFα en la vida media del CL bovino, son completamente bloqueadas por la administración del N (G)-nitro-L-arginina metil éster (un inhibidor no selectivo en la actividad de la síntesis del NO) en la aorta abdominal. Lo que indica que el NO puede jugar un importante rol como mediador de la acción del TNFα, a través de la fase luteal del ciclo estral (51).
Los macrófagos también tienen la capacidad de producir y liberar significativamente un número elevado de enzimas proteolíticas (52), las cuales son capaces de degradar la matriz extracelular, además de activar o inhibir cascadas de proteasas, alterando proteínas bioactivas, como las moléculas adherentes de leucocitos (53).
REGULACION DE LA FORMACION Y REGRESIÓN DEL CUERPO LÚTEO POR LOS MACRÓFAGOS
El ovario está compuesto por folículos atrésicos y en crecimiento, por el CL en desarrollo y en regresión, además de tejido intersticial y estroma. Todos los componentes están presentes en el ovario adulto, lo cual puede variar en sus proporciones dependiendo de la fase del ciclo estral (43).
La habilidad de los macrófagos para regular la proliferación celular ovárica, inflamación y esteroidogénesis, implica que estas células son importantes reguladores de la función ovárica. Después de la ovulación, es requerida una completa reorganización de la ruptura del folículo para la formación del CL. Este proceso es caracterizado por la diferenciación terminal (luteinización) de las células de la granulosa, migración de leucocitos incluyendo macrófagos hacia el folículo luteinizado y la nueva vascularización del CL en desarrollo. La activación de los macrófagos parece ser importante para ejercer sus funciones efectoras dentro del CL. Así, los macrófagos podrían facilitar el establecimiento vascular del CL vía secreción de VEGF, EGF y del factor de crecimiento fibroblástico básico (bFGF), estando implicados en la angiogénesis (44).
De la misma forma, la activación de los macrófagos por las células T puede ser un evento adicional, un mediador indirecto involucrado en la regresión luteal, fenómeno que merece ser estudiado en trabajos posteriores. Los procesos de luteólisis y de regresión son conocidos; involucrando éstos el aumento en la síntesis de la PGF2α, disminuyendo la producción de la P4, produciendo la apoptosis de las células luteales, eventos donde los macrófagos pueden estar interviniendo.
Se ha encontrado también, que los macrófagos incrementan la producción de P4 por parte del CL formado. Contradictoriamente, hay reportes que muestran que, la secreción de P4 es inhibida marcadamente en co-cultivos de células de la granulosa con macrófagos peritoneales (43).
Los diferentes estudios experimentales demuestran como los macrófagos, citoquinas y factores de crecimiento son importantes en la formación, regulación y mantenimiento del CL. Por tanto, el sistema inmune tiene un rol autocrino, paracrino y endocrino en la regulación de la reproducción animal en los diferentes eventos relacionados con la actividad luteal.
CONCLUSIÓN
La presente revisión refleja la importante intervención de una gran cantidad de elementos en la fisiología inmune del CL, lo cual requiere de la cooperación de muchos factores y sistemas regulatorios. Un incremento en la expresión de la MCP-1 se observa en el CL bovino en los últimos días de la fase luteal (días 12-18 posovulación), proceso que está asociado con el acúmulo de monocitos luteales, macrófagos y linfocitos T. Los macrófagos ovarianos, son importantes reguladores de la compleja comunicación entre el sistema inmune y el sistema reproductivo. Estas células presentan cambios en su cantidad y morfología dependiendo de la fase del ciclo estral, además de secretar una gran cantidad de moléculas bioactivas que impactan la reproducción. Los macrófagos son capaces de regular la proliferación, la diferenciación y la apoptosis, participando activamente en la producción esteroidal, vascularización y remodelación del tejido durante el crecimiento folicular, ovulación y luteinización.
BIBLIOGRAFÍA
1. Schams D, Berisha, B. Regulation of corpus luteum function in cattle - an overview. Reprod Dom Anim 2004; 39:241-251. [ Links ]
2. Souza MIL, Ramírez GFB, Uribe-Velásquez LF. Papel del factor de crecimiento semejante a insulina-1 (IGF-1) en la regulación de la función ovárica. Biosalud 2007; 6:149-59. [ Links ]
3. Milvae RA. Inter-relationships between endothelin and prostaglandin F2a in corpus luteum function. Rev Reprod 2000; 5:1-5. [ Links ]
4. Gonzalez de Bulnes A, Moreno JS, Gomez A, Lopez Sebastian A. Relationship between ultrasonographic assesment of the corpus luteum and plasma progesterone concentration during the oestrous cycle in monovular ewes. Reprod Dom Anim 2000; 35:65-68. [ Links ]
5. Uribe-Velásquez LF, Oba E, Souza MIL. Población folicular y concentraciones plasmáticas de progesterona (P4) en ovejas sometidas a diferentes protocolos de sincronización. Arch Med Vet 2008; 40:83-88. [ Links ]
6. Fierro S, Olivera-Muzante J, Gil J, Viñoles C. Effects of prostaglandin administration on ovarian follicular dynamics, conception, prolificacy, and fecundity in sheep. Theriogenology 2011; 76:630-639. [ Links ]
7. Peter AT, Levine H, Drost M, Bergfelt DR. Compilation of classical and contemporary terminology used to describe morphological aspects of ovarian dynamics in cattle. Theriogenology 2009; 71:1343-1357. [ Links ]
8. Perez-Marín C. Formation of corpora lutea and central luteal cavities and their relationship with plasma progesterone levels and other metabolic parameters in dairy cattle. Reprod Dom Anim 2009; 44:384-389. [ Links ]
9. O'Shea JD, Rodgers RJ, D'Occhio MJ. Celular composition of the cyclic corpus luteum of the cow. J Reprod Fert 1989; 85:483-487. [ Links ]
10. Selvaraju S, Raghavendra BS, Siva Subramani T, Priyadharsini R, Reddy IJ, Ravindra JP. Changes in luteal cells distribution, apoptotic rate, lipid peroxidation levels and antioxidant enzyme activities in buffalo (Bubalus bubalis) corpus luteum. Anim Reprod Sci 2010; 120:39-46. [ Links ]
11. Sangha GK, Sharma RK, Guraya SS. Biology of corpus luteum in small ruminants. Small Rumin Res 2002; 43:53-64. [ Links ]
12. Lüttgenau J, Ulbrich SE, Beindorff N, Honnens A, Herzog K, Bollwein H. Plasma progesterone concentrations in the mid-luteal phase are dependen on luteal size, but independent of luteal blood flow and gene expression in lactating dairy cows. Anim Reprod Sci 2011; 125:20-29. [ Links ]
13. Reynolds LP, Grazul-Bilska AT, Redmer DA. Angiogenesis in the corpus luteum. Endocrine 2000; 12:1-9. [ Links ]
14. Rekawiecki R, Kowalik MK, Slonina D, Kotwica J. Regulation of progesterone synthesis and action in bovine corpus luteum. J Physiol Pharmacol Suppl 2008; 59:75-89. [ Links ]
15. Ginther OJ, Araujo RR, Palhao MO, Rodrigues BL, Beg MA. Necessity of sequencial pulses of prostaglandin F2-alpha for complete physiologic luteolysis in cattle. Biol Reprod 2009; 80:641-648. [ Links ]
16. Ferrara N, Gerber HP, LeCouter J. The biology of VEFG and its receptors. Nat Med 2003; 9:669-676. [ Links ]
17. Wiedlocha A, Sorensen V. Signaling, internalization and intracellular activity of fibroblast growth factor. Curr Top Microbiol Immunol 2004; 286:45-79. [ Links ]
18. Miyamoto A, Shirasuna K, Sasahara K. Local regulation of corpus luteum development and regression in the cow: impact of angiogenic and vasoactive factors. Domest Anim Endocrinol 2009; 37:159-169. [ Links ]
19. Rosiansky-Sultan M, Klipper E, Spanel-Borowski K, Meidan R. Inverse relationship between nitric oxide synthases and endothelin-1 synthesis in bovine corpus luteum: interactions at the level of luteal endothelial cell. Endocrinology 2006; 147:5228-5235. [ Links ]
20. Ialenti A, Ianaro A, Moncada S, Di Rosa M. Modulation of acute inflammation by endogenous nitric oxide. Eur J Pharmacol 1992; 211:177-182. [ Links ]
21. Khan FA and Dan GK. Follicular fluid nitric oxide and ascorbic acid concentrations in relation to follicle size, functional status and stage of estrous cycle in buffalo. Anim Reprod Sci 2011; 125:62-68. [ Links ]
22. Ferrara N, Davis-Smyth T. The biology of vascular endothelial growth factor. Endocr Rev 1997; 18:4-25. [ Links ]
23. Connolly DT. Vascular permeability factor: a unique regulator of blood vessel function. J Cell Biochem 1991; 47:219-223. [ Links ]
24. Neuvians TP, Schams D, Berisha B, Pfaffl MW. Involvement of pro-inflammatory cytokines, mediators of inflammation, and basic fibroblast growth factor in prostaglandin F2a - Induced luteolysis in bovine corpus luteum. Biol Reprod 2004; 70:473-480. [ Links ]
25. Niswender GD and Nett TM. Corpus luteum and its control in infraprimate species. In: The Physiology of Reproduction. Vol. 1. New York: E Knobil and JD Neill Raven Press Eds.; 1994. p. 781-816. [ Links ]
26. Niswender GD. Molecular control of luteal secretion of progesterone. Reproduction 2002; 123:333-339. [ Links ]
27. McCracken JA, Custer EE, Lamsa JC. Luteolysis: a neuroendocrine-mediated event. Physiol Rev 1999; 79:263-323. [ Links ]
28. Jaroszewski JJ, Hansel W. Intraluteal administration of a nitric oxid synthase blocker stimulates progesterone and oxytocin secretion and prolongs the lifespan in the bovine corpus luteum. Proc Soc Exp Biol Med 2000; 224:50-55. [ Links ]
29. Pate JL, Keyes PL. Immune cells in the corpus luteum: friends or foes? Reproduction 2001; 122:665-676. [ Links ]
30. Lea RG, Sandra O. Immunoendocrine aspects of endometrial function and implantation. Reproduction 2007; 134:389-404. [ Links ]
31. Rae MT, Niven D, Critchley HO, Harlow CR, Hillier SG. Antiinflamatory steroid action in human ovarian surface epithelial cells. J Clin Endocrinol Metab 2004; 89:389-404. [ Links ]
32. Wang M. The role of glucocorticoid action in the pathophysiology of the metabolic syndrome. Nutr Metab 2005; 2:3. [ Links ]
33. Rae MT, Hillier SG. Steroid signaling in the ovarian surface epithelium. Trends Endocrinol Metab 2005; 16:327-333. [ Links ]
34. Komiyama J, Nishimura R, Lee HY, Sakumoto R, Tetsuka M, Acosta TJ, Skarzynski DJ, Okuda K. Cortisol is a suppressor of apoptosis in bovine corpus luteum? Biol Reprod 2008; 78: 888-95. [ Links ]
35. Townson DH, O'Connor CL, Pru JK. Expression of monocyte chemoattractant protein-1 and distribution of immune cell population in the bovine corpus luteum throughout the estrous cycle. Biol Reprod 2002; 66:361-366. [ Links ]
36. Penny LA, Armstrong DG, Baxter G, Hogg C, Kindahl H. Expression of monocyte chemoattractant protein-1 in the bovine corpus luteum around the time of natural luteolysis. Biol Reprod 1998; 59:1464-1469. [ Links ]
37. Bowen JM, Towns R, Warren JS, Keyes PL. Luteal regression in the normally cycling rat: apoptosis, monocyte chemoattractant protein-1 and inflammatory cell involvement. Biol Reprod 1999; 60:740-746. [ Links ]
38. Penny LA. Monocyte chemoattractant protein-1 in luteolysis. Rev Reprod 2000; 5:63-66. [ Links ]
39. Lobel BL, Levy E. Enzymatic correlates of development, secretory function and regression of follicles and corpora lutea in the bovine ovary. II Formation, development and involution of corpora lutea. Acta Endoc 1968; 132:35-63. [ Links ]
40. Bauer M, Reibiger I, Spanel-Borowski K. Leukocyte proliferation in the bovine corpus luteum. Reproduction 2001; 121:297-305. [ Links ]
41. Buford WI, Ahmad N, Schrick FN, Butcher RL, Lewis PE. Embryotoxiciy of a regressing corpus luteum in beef cows supplemented with progestogen. Biol Reprod 1996; 54:531-537. [ Links ]
42. Bulmer D. The histochemystry of ovarian macrophages in the rat. J Anat 1964; 98:313-319. [ Links ]
43. Wu R, Van der Hoek KH, Ryan NK, Norman RJ, Robker RL. Macrophage contributions to ovarian function. Hum Reprod Update 2004; 2:119-133. [ Links ]
44. Katabuchi H, Fukumatsu Y, Araki M, Suenaga, Y, Ohtake H, Okamura H. Role of macrophages in ovarian follicular development. Horm Res 1996; 46:45-51. [ Links ]
45. Szostek AZ, Lukasik K, Majewska M, Bah MM, Znaniecki R, Okuda K, Skarzynski DJ. Tumor necrosis factor-a inhibits the stimulatory effect of luteinizing hormone and prostaglandin E2 on progesterone secretion by the bovine corpus luteum. Dom Anim Endoc 2011; 40:183-191. [ Links ]
46. Souza MIL, Uribe-Velasquez LF. O fator de necrose tumoral-A (TNF-A) na reprodução de fêmeas - Revisão de literatura. Arq Cien Vet Zool Unipar 2008; 1:47-53. [ Links ]
47. Sakumoto R, Vermehren M, Kenngott RA, Okuda K, Sinowatz F. Localization of gene and protein expressions of tumor necrosis factor-a and tumor necrosis factor receptor types I and II in the bovine corpus luteum during the estrous cycle. J Anim Sci 2011; 89:3040-3047. [ Links ]
48. Benyo DF, Pate JL. Tumor necrosis factor-a alters bovine luteal cell synthetic capacity and viability. Endocrinology 1992; 130:751-756. [ Links ]
49. Petroff MG, Petroff BK, Pate JL. Mechanism of cytokine-induced death of cultured bovine luteal cells. Reproduction 2001; 121:753-760. [ Links ]
50. Meidan R, Milvae RA, Weiss S, Levy S, Friedman A. Intraovarian regulation of luteolysis. J Reprod Fert Suppl 1999; 54:217-228. [ Links ]
51. Skarzynski DJ, Woclawek-Potocka I, Korzekwa AJ. Infusion of exogenous tumor necrosis factor-a dose dependently alters the length of the luteal phase in cattle: differential responses to treatment with indomethacin and L-NAME, a nitric oxide synthase inhibitor. Biol Reprod 2007; 76:619-627. [ Links ]
52. Owen CA, Campbell EJ. The cell biology of leukocyte-mediated proteolysis. J Leukoc Biol 1999; 65:137-150. [ Links ]
53. Bauvois B. Transmembrane proteases in focus: diversity and redundancy? J Leukoc Biol 2001; 70:11-17. [ Links ]