Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.10 no.2 Manizales July/Dec. 2011
FORMAS ALTERNAS DE TRANSMISIÓN DE TOXOPLASMA GONDII
ALTERNATIVE WAYS OF TOXOPLASMA GONDII TRANSMISSION
Jorge Enrique Pérez1
Johan Sebastián Villada Gómez2, Oscar David Naranjo Pérez2
Sandra Viviana Castaño2
1 Docente del Departamento de Ciencias Básicas de la Salud, Facultad de Ciencias para la Salud, Universidad de Caldas. Email: labmicro@ucaldas.edu.co.
2 Estudiantes de Medicina, Facultad de Ciencias para la Salud, Universidad de Caldas.
Recibido: septiembre 13 de 2011 - Aceptado: octubre 13 de 2011
RESUMEN
El Toxoplasma gondii, es un protozoario descubierto hace poco más de un siglo, es un parásito de gran importancia epidemiológica, que puede ocasionar en mujeres embarazadas desde complicaciones neurológicas en el producto, hasta muerte fetal, incluso abortos y encefalitis en pacientes con SIDA, convirtiéndose en Colombia en un grave problema de salud pública. En la revisión de la evidencia disponible, se ha llegado a concluir que las formas en que el parásito llega a infectar al ser humano son muy variadas, incluyendo las formas conocidas desde tiempo atrás como: alimentos contaminados, contacto con heces felinas; además de otras formas no tan conocidas como son: la vía transfusional, por trasplantes de órganos, la vía acuática, la mecánica, la inhalación de ooquistes y la vía sexual; involucrando en el ciclo de vida del parásito, a especies animales diferentes a los felinos, tales como perros e insectos. Así mismo, se resalta la importancia de factores antrópicos y medio ambientales, como moduladores de las dinámicas de transmisión y del ciclo de vida del parasito. Esta revisión, proporciona bases sólidas para alertar al sistema de salud pública colombiano, acerca de la necesidad de adoptar medidas higiénicas y sanitarias para evitar la difusión de esta patología entre poblaciones de alto riesgo.
PALABRAS CLAVE: alimentos, prevención, transmisión, transmisión acuática, transfusión, toxoplasmosis congénita, T. gondii.
ABSTRACT
Toxoplasma gondii is a protozoan discovered more than a century ago. It is a parasite of great epidemiologic importance which can cause from neurologic complications in the product to fetal death in pregnant women, abortion and encephalitis in patients with AIDS, thus becoming a public health problem in Colombia. In this review of the available evidence, it was concluded that the forms in which the parasite infects human beings are very varied, including the forms known long time ago such as contaminated food, contact with feline feces, as well as other not so well known ways like transfusions, organ transplants, waterborne, and mechanic way, ooquist inhalation and sexual transmission, involving animal species different from felines in the parasite lifecycle, such as dogs and insects. Likewise, the importance of anthropic and environmental factors such as modulators of the transmission dynamics and lifecycle of the parasite are highlighted. This review, provides solid bases for alerting the public health systems about the need to adopt hygienic and sanitary measures to avoid the diffusion of this pathology among high risk populations.
KEY WORDS: food, prevention, transmission, waterborne, transfusions, congenital toxoplasmosis, T. gondii.
INTRODUCCIÓN
Toxoplasma gondii (del griego "toxon", que significa "arco"), es un protozoario intracelular obligado, descrito por primera vez y casi simultáneamente en Brasil por Splendore y en África por Nicolle y Manceaux en 1908, estos últimos fueron quienes establecieron su género un año después (1-3). Taxonómicamente, T. gondii, pertenece al supergrupo Chromalveolata, primer rango Alveolata y en el segundo rango Apicomplexa.
T. gondii tiene una distribución cosmopolita (1, 2) y su seroprevalencia varía en función de la edad y la zona geográfica (4-7); como lo señala (8), en Colombia la tasa de prevalencia de acuerdo con el estudio nacional de salud de 1980 fue de 47 %, asociada a un aumento progresivo con la edad; las tasas más elevadas se encuentran en la Región Atlántica (63 %), en contraste con la zona centro (36 %), siendo además, la toxoplasmosis congénita un problema de salud pública en el país (9).
La toxoplasmosis en los seres humanos sanos es generalmente asintomática y tan solo una minoría de las infecciones en el adulto, puede manifestarse en un cuadro febril agudo con erupción maculopapular o como una toxoplasmosis ganglionar u ocular, además en mujeres embarazadas primo-infectadas, existe el riesgo de la toxoplasmosis congénita, que resulta de la transmisión transplacentaria de T. gondii, siendo generalmente, la infección asintomática en la madre (9), pero en el feto, se expresa como una enfermedad con diversos grados de severidad dependiendo del momento de la infección, que va desde abortos, hasta manifestaciones sistémicas, como prematurez con cuadro séptico y elevada mortalidad; el niño infectado también puede tener microcefalia, hidrocefalia y calcificaciones cerebrales (6, 9, 10). En pacientes inmunocomprometidos, como es el caso de los pacientes con VIH+, la forma más común de presentación es la encefalitis, aunque estas manifestaciones también pueden presentarse en pacientes con terapia inmunosupresora y con neoplasias malignas (6, 11). Así mismo, se debe tener en cuenta, que se han reportado casos de toxoplasmosis congénita en niños hijos de madres VIH+ infectadas crónicamente con T. gondii (12), constituyéndose, en un potencial problema de salud pública, si se tiene en cuenta el aumento de la prevalencia de pacientes en edad fértil infectados por VIH.
Actualmente, los estudios diagnósticos para toxoplasma son PCR (reacción en cadena de la polimerasa), la prueba de Sabin y Feldman, inmunofluorescencia indirecta, hemaglutinación indirecta, fijación de complemento, inmunoensayo enzimático y la detección de antígenos de toxoplasma (1).
El presente documento pretende dar una visión amplia acerca de los diferentes condicionantes de la transmisión de T. gondii, así como de las diferentes fuentes y modos de transmisión que han sido reportados y las formas como la infección puede ser prevenida especialmente en grupos de riesgo.
CICLO DE VIDA
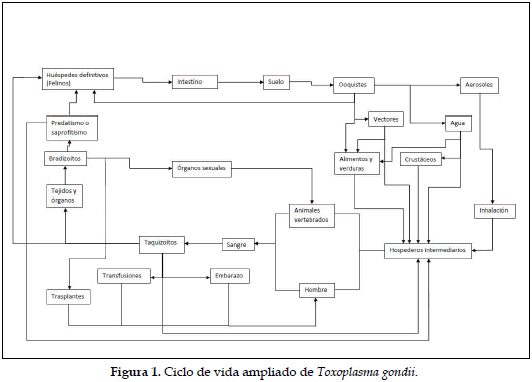
T. gondii se encuentra en la naturaleza (figura 1) en tres formas infecciosas: los taquizoitos presentes en la forma aguda de la enfermedad a nivel sanguíneo generalmente; los bradizoitos contenidos en los quistes tisulares y los esporozoitos que se encuentran en los ooquistes.
El taquizoito ingresa de manera activa al interior de varias células del huésped, que en el ser humano puede ser cualquier célula nucleada (4), entre las que se encuentran: leucocitos mononucleares, células endoteliales (2), células intersticiales, fibras musculares, neuronas, células pulmonares y hepáticas (10); por medio de una vacuola parasitófora que le confiere protección contra la respuesta inmune del huésped, en el interior de dichas células, se multiplican por endodiogenia (asexualmente) (1, 13) hasta romper la membrana celular de la célula continente.
Luego de dividirse, los taquizoitos darán origen a los quistes tisulares intracelulares que se localizan en múltiples tejidos, pero más comúnmente en tejido nervioso y muscular (14); estudios en gatos muestran que la lengua es un órgano altamente parasitado incluso en mayor medida que el cerebro (15), aunque también se han encontrado en ganglios linfáticos y otras visceras (10, 13) conteniendo a cientos de bradizoítos, que pueden persistir en estos tejidos por largo tiempo (13, 16), siendo esto de gran importancia en la transmisión, tanto para huéspedes definitivos, como intermediarios, debido a que cada uno de los estadios puede ser infectante, pero muestran ciertas diferencias en cuanto a la eficiencia con que infectan a los huéspedes definitivos o intermediarios y en la severidad de las manifestaciones clínicas en ambos (13, 17). Cuando los quistes tisulares son ingeridos por los gatos, la pared de éstos sufre proteólisis y los bradizoítos se liberan en el estómago e intestino delgado, algunos penetran la lámina propia y vuelven a su estado de taquizoito para multiplicarse y luego diseminarse; otros penetran la célula epitelial y se transforman en esquizontes (asexuales), que liberarán merozoitos, que posteriormente darán lugar a gametos femeninos y masculinos, estos últimos penetran en el gameto femenino y lo fertilizan iniciando así la reproducción sexual con la formación de la pared del ooquiste alrededor del gameto fertilizado; al madurar el ooquiste irá a la luz intestinal, rompiendo la membrana celular del enterocito (13). La fase sexual del ciclo solo se lleva a cabo en los huéspedes definitivos y, por ello, los ooquistes sólo se forman en los felinos (1), constituyendo una fuente de infección para otros huéspedes, tanto definitivos, como intermediarios (13, 18). Los ooquistes que expulsa el gato no son esporulados, es decir, no infectantes y para que esporulen y se tornen infectantes, deben pasar por fuera del gato entre 1 a 7 días según las condiciones ambientales. Cada ooquiste esporulado contiene 2 esporoquistes con 4 esporozoítos cada uno, es decir, 8 esporozoítos por ooquiste esporulado. Los huéspedes se infectan por consumir tejidos animales infectados con quistes tisulares, alimentos o agua con ooquistes esporulados; tras la ingestión, los bradizoitos o esporozoitos liberados de quistes tisulares u ooquistes, penetran el tejido intestinal, se transforman en taquizoitos y se diseminan por vía sanguínea y linfática; luego de nuevo, dan origen a bradizoítos localizándose en diferentes tejidos (13, 19), aunque la conversión a bradizoitos depende de la respuesta inmunológica del huésped; cuando hay estados de inmunocompromiso, el taquizoito persiste y no dará origen a los bradizoitos (quistes tisulares).
Los taquizoitos, importantes en la transmisión vertical, también pueden trasmitirse por vía oral y aunque tienen una menor resistencia al ácido gástrico, pueden sobrevivir por algún tiempo en soluciones acidas de pepsina (20); esta vía de transmisión se puede producir en situaciones especiales, como en los niños pequeños, donde las enzimas proteolíticas no se han desarrollado bien o en personas adultas, cuando estas consumen alimentos sólidos que pueden elevar considerablemente el pH gástrico (21).
MECANISMOS DE TRANSMISION ALTERNOS DE TOXOPLASMA GONDII
Como puede inferirse del ciclo de vida del parásito, existen dos métodos de transmisión clásicos del mismo: el consumo de ooquistes que provienen de las heces del gato y que contaminan alimentos, y el consumo de carnes crudas o mal cocidas que contienen bradizoitos, no obstante, la revisión de la literatura existente, ha demostrado otras fuentes y formas alternativas de transmisión.
Transmisión acuática de los ooquistes
La transmisión acuática de los ooquistes era considerada poco frecuente, hasta que varios autores demostraron que esta vía podría ser responsable de muchos casos de toxoplasmosis (13, 22-25). La importancia del agua como posible fuente de infección para animales y humanos, empieza a ser tenida en cuenta cuando en la Columbia Británica, Canadá entre finales de 1994 e inicios de 1995, se genera un incremento súbito en el diagnóstico serológico de toxoplasmosis aguda (24), 100 individuos resultaron infectados y se propuso como foco de infección un reservorio de agua que suplía la zona donde se concentró el brote; al reservorio tenían acceso los felinos, careciendo de un sistema de filtración y desinfección del agua. Un estudio llevado a cabo en la zona, demostró la existencia de un ciclo endémico de T. gondii entre los animales ribereños y la excreción de ooquistes por los felinos que frecuentaban el área, convirtiéndose éstos en fuente de infección para el agua (23). En un estudio llevado a cabo en Polonia (25), se concluyó que en ambientes rurales el agua puede ser un medio de transmisión de Toxoplasma gondii y se encontró al protozoario más frecuentemente en granjas con pobres condiciones de higiene, en el agua de pozos superficiales y que no contaban con cubierta, así mismo, se observó que la seroprevalencia era mucho más alta entre quienes consumían agua de los pozos sin hervir, que en quienes la consumían de sistemas de agua, esto último concuerda con lo hallado en un estudio llevado a cabo en Armenia, Colombia, donde consumir agua sin hervir era un factor de riesgo para la infección en mujeres embarazadas (9). Así mismo, a finales del año 2001 e inicios del 2002, en Brasil se reporta un aumento de casos de toxoplasmosis, debido al consumo de agua de un reservorio contaminado y se logró demostrar la presencia del parásito en el agua proveniente de dicho reservorio (22). Se ha evidenciado que el Toxoplasma permanece viable en el agua luego del tratamiento con diversos medios físicos y químicos, entre ellos: el hipoclorito de sodio y el ozono (26-28), dejando abierta la posibilidad que, el agua de las ciudades sea un medio eficaz para la transmisión de la enfermedad. Sólo la radiación UV podría ser un método eficaz para la desinfección del agua (29); sin embargo, los mecanismos de implementación en plantas de tratamiento no se han establecido aún, debido a que, para que dicho método de eliminación de los ooquistes sea efectivo, se requiere de un tiempo de exposición necesario que variaría en función del flujo de agua, de la turbidez y del volumen de la misma.
Respecto al agua en botella (7), se encontraron prevalencias más bajas de T. gondii en usuarios de agua en botella respecto a quienes la bebían de otras fuentes y (9) propuso el consumo de agua en bolsa o botella como factor protector de la infección para mujeres embarazadas, basados en los resultados de su estudio en Colombia.
Otro argumento a favor del agua como medio de transmisión, son los reportes de animales marinos infectados por consumir agua de mar que contiene ooquistes provenientes de ambientes costeros contaminados por gatos (11, 13, 30); por tanto, el agua puede ser un medio eficaz para transportar al parásito e infectar a diferentes especies.
Transmisión vía transfusional y por trasplantes
La toxoplasmosis en pacientes inmunosuprimidos, como son los trasplantados, puede llevar a formas graves y fatales de la enfermedad (31-32). La sangre y los órganos donados como fuentes de T. gondii se han propuesto desde 1965 (33) y han venido cobrando importancia en los últimos años (31), quizá en parte, por los métodos de detección más eficaces y por el aumento en el uso de estas alternativas terapéuticas en diversas patologías. Se acepta que la toxoplasmosis en quienes reciben trasplantes de órganos sólidos es más probable que se deba a la reactivación de bradizoitos presentes en el órgano donado si el receptor no ha tenido contacto previo con el parásito (34). En un estudio llevado a cabo en Cambridge, con receptores de órganos sólidos, se demostró como la infección es más probable en receptores seronegativos que no reciben profilaxis y cuyos donantes son seropositivos para el parásito, mientras que en receptores seropositivos antes del trasplante, la reactivación de la toxoplasmosis se relaciona con las dosis de inmunosupresores recibidas luego del mismo (32). En receptores de células madres hematopoyéticas la reactivación de una infección latente previa al trasplante, aunque rara, se asocia a mal pronóstico, razón por la cual, en estos pacientes la profilaxis con medicamentos contra Toxoplasma debe ser obligatoria (34).
En India T. gondii es el segundo parásito más importante transmitido por transfusiones (4), en un estudio llevado a cabo allí, se estableció que la prevalencia de titulaciones de anticuerpos tipo IgM anti-Toxoplasma era muy alta entre los donantes de un centro de dicho país (31), corroborando los hallazgos de (4), que encontraron una alta prevalencia de anticuerpos en donantes sanos en Karnataka, aunque la mayoría de los anticuerpos eran tipo IgG y solo 3.6 % era IgM, lo cual no necesariamente indica que quienes tengan anticuerpos sean infectantes, pero teniendo en cuenta que el parasito puede sobrevivir en las condiciones en que se almacena la sangre (4), los donantes infectados se convierten en fuentes potenciales de Toxoplasma. En otro reporte se dieron a conocer los casos de varios pacientes que desarrollaron formas fulminantes de toxoplasmosis sistémica al recibir leucocitos para el tratamiento de leucemias agudas, provenientes de donantes con gran sospecha serológica de haber desarrollado toxoplasmosis y, por tanto, involucrándolos como posibles fuentes de infección en los receptores inmunocomprometidos (33). En Colombia no se han hecho estudios que evidencien la frecuencia de Toxoplasma en la sangre obtenida en bancos de sangre; la futura realización de este estudio ayudaría a cuantificar el riesgo de transmisión por esta vía.
Transmisión por inhalación de ooquistes
En 1977, un brote de toxoplasmosis aguda en un establo en Georgia, Atlanta, fue reportado por Teutsch, parece ser el primer caso de toxoplasmosis vinculado a la inhalación de ooquistes aerosolizados durante una cabalgata; aunque los intentos por aislar los ooquistes del suelo fueron infructuosos, si se logró aislar el parásito de tejidos de animales atrapados en el establo; a pesar de este hallazgo, no se encontraron niveles de anticuerpos anti Toxoplasma (11), sin embargo, quedan algunas dudas sobre esta alternativa de transmisión, ya que las formas infectantes deberían ser los ooquistes, los cuales pudieron haber sido aerosolizados y posteriormente, ingeridos para la generación de la enfermedad; no obstante, para que este proceso ocurra, es necesario que haya desecación que permita la aerosolización, asociada a la exposición a la luz solar, dos factores que pueden ser deletéreos para la viabilidad de los ooquistes; es necesario, por tanto, hacer estudios que demuestren la viabilidad de ellos en estas condiciones medioambientales extremas.
La toxoplasmosis congénita
El primer reporte de toxoplasmosis congénita humana (35), se realizó décadas antes de que en 1970 se describiera el ciclo de vida del parásito (1). La toxoplasmosis congénita ocurre cuando los taquizoitos atraviesan la barrera placentaria tras una parasitemia en la madre que sufre una primoinfección (10); la inmunidad materna desarrollada cuando hay contacto con el parásito previo al embarazo, protege al feto de la infección, razón por la cual, las pacientes con IgG que contraen Toxoplasma antes del embarazo, no son un riesgo para el feto, excepto en ciertos estados especiales (12). En ratones la infección congénita es efectiva y se puede transmitir la patología verticalmente hasta por diez generaciones (1). En el ser humano, la incidencia de primoinfección en el embarazo fluctúa entre 1 por cada 310 a 10000 embarazos (7) y en Colombia, la toxoplasmosis congénita tiene una frecuencia de 2 casos por 1000 nacidos vivos (36). Es llamativo en Colombia que la seroprevalencia de T. gondii sea mayor en embarazadas que en la población general (36); en Francia, se encontró que la prevalencia de toxoplasmosis congénita es mayor en productos de mujeres jóvenes, los autores la asociaron con la menor frecuencia de los mecanismos de prevención de la enfermedad en este grupo de edad (37), pero también, podría estar asociada con la baja frecuencia de primoinfección en jóvenes y, por tanto, con baja frecuencia de mujeres jóvenes con niveles protectores de anticuerpos contra Toxoplasma; estudios de simulación matemática han demostrado un alto riesgo de adquisición de la enfermedad en mujeres jóvenes. La probabilidad de infección transplacentaria al igual que las manifestaciones clínicas dependerán del momento del embarazo en que la madre se infecte (11), debido a que la severidad de la enfermedad fetal, es inversa a la edad gestacional (7) por lo que en gestaciones más tempranas hay menor inmunidad a nivel uterino y el parásito logra multiplicarse rápidamente y ocasionar la muerte del producto (14); la infección es más probable en el tercer trimestre, lo que lleva a plantear tal como lo hicieron (38), que la edad gestacional en la que se encuentre la madre es fundamental para que se logre infectar al feto; se ha demostrado que en el tercer trimestre del embarazo hay alta concentración de linfocitos T ayudadores 2 que, como bien se sabe, contribuyen a la disminución de los T ayudadores 1 y a inhibir las respuestas asociadas con los linfocitos T citotóxicos y células NK que son muy importantes en la eliminación de Toxoplasma (39). Las manifestaciones fetales son variadas y van desde aborto y muerte fetal hasta problemas neurológicos y oculares y el pronóstico dependerá además de la cepa de T. gondii (37).
Transmisión sexual
La transmisión por vía sexual del parásito se ha documentado en varias publicaciones desde hace medio siglo en diversos tipos de mamíferos, pero las pruebas que ésta forma de transmisión sea efectiva no son concluyentes. Uno de los animales más estudiados, ha sido las ovejas, con resultados sobresalientes como su alta tasa de abortos asociado a T. gondii posiblemente, adquirido por vía sexual; se demostró experimentalmente que en ovejas seronegativas inseminadas con semen que contenía 4 x 107 taquizoitos, se produjo seroconversión de todos los animales y por PCR se identificó el parásito en la mayoría de los animales inoculados (40), lo que lleva a proponer que con una dosis infectante adecuada, se podría transmitir la toxoplasmosis por el semen. En perros a quienes se les ha inoculado diferentes dosis de ooquistes, se ha logrado encontrar al parásito en testículos, epidídimo y en muestras seminales; al inseminar artificialmente hembras seronegativas con este semen, se produjo conversión serológica (41); la inseminación con estas muestras contaminadas generó toxoplasmosis congénita en los productos de estos animales (40-41). Se puede afirmar que, la transmisión por la vía sexual en los animales sujetos de experimentación es muy probable, pero ¿qué tan probable es en el hombre?, en la literatura actual no se ha documentado este parásito en muestras seminales humanas, sin embargo, se ha relacionado a T. gondii con infertilidad por medio de la producción de anticuerpos antiesperma o como sugieren diversos estudios, en ratones, al producir hipogonadismo hipogonadotrópico (42) y alteraciones en la morfología de los espermatozoides (43). En humanos, tan solo se han hecho estudios post mortem, donde por histopatología se ha encontrado el parásito en testículos, túbulos seminíferos, células de Sertoli y macrófagos testiculares, sin embargo, se debe tener en cuenta que estos sólo fueron encontrados en personas con SIDA (44) y, por ende, es raro que en sujetos adultos sin compromiso del sistema inmune se pueda generar una orquitis por Toxoplasma.
Transmisión mecánica
Varios autores han planteado la posibilidad que en el ciclo de vida del Toxoplasma gondii, animales aparte de los felinos participen en la transmisión del mismo como transportadores mecánicos (13, 45-48). Una de las hipótesis planteadas, involucra a las perros en la transmisión mecánica de Toxoplasma gondii, la cual está sustentada por un experimento en el cual se demostró, como los ooquistes esporulados de T. gondii pueden atravesar el tracto digestivo y ser excretados en heces caninas en formas infectantes sin necesidad que el perro desarrolle la toxoplasmosis clínica (47), claro está que, habría que analizar con más detalle que concentración de ooquistes se necesita para generar una infección efectiva. Los moluscos marinos pueden actuar como vectores mecánicos, al filtrar agua contaminada pudiendo concentrar los ooquistes (15, 30) y así, infectar a quien los consume, tal como lo mostró (30), quienes consideran que consumir ostras puede ser un factor de riesgo para mujeres embarazadas en Estados Unidos. Es de anotar que los moluscos marinos no son huéspedes apropiados para el protozoario.
En base a estudios epidemiológicos y otros estudios teóricos se había propuesto la posibilidad de artrópodos como vectores mecánicos del parásito (46), hay evidencia de transmisión mecánica por cucarachas como Periplaneta americana la cual, transporta los ooquistes infectantes durante 10 días y se ha demostrado que hay transmisión a través de las heces de las misma, al ingerir heces de gatos infectados y posteriormente, tener contacto con alimentos (49). Las moscas sinantrópicas, debido a sus características biológicas son excelentes vectores mecánicos de microorganismos diversos entre ellos T. gondii (45) y se ha demostrado la transmisión por Musca domestica y Chrysomya megacephala, las cuales liberan ooquistes viables por horas e incluso días, luego del contacto con la materia fecal infectada (46, 48). También, se ha descrito en la superficie del cuerpo de escarabajos de estiércol la presencia de ooquistes que pueden permanecer infectantes por meses (48), por lo que podría convertirse en otro vector mecánico del parásito.
Transmisión por alimentos
Se ha considerado que esta es la principal forma en la cual los seres humanos adquieren la infección por Toxoplasma gondii, ya sea por el consumo de quistes tisulares en los tejidos de los animales para consumo humano o por la presencia de ooquistes en frutas y verduras (11, 13), produciendo junto a Salmonella y Listeria más de 1500 muertes al año en Estados Unidos (50). La hipótesis de que la carne poco cocida transmite a Toxoplasma se demostró en un experimento, en el cual Desmonts, observó como aumentaban los anticuerpos contra T. gondii al consumir carne mal cocida, en especial de cordero (1). El consumo de carne cruda o mal cocida ha sido un importante factor de riesgo, tal como se ha demostrado en varios estudios (9); algunas cepas del parásito puede permanecer viables incluso en carne congelada (30); sin embargo, queda la duda de si congelar la carne sea una buena medida para prevenir esta parasitosis. Virtualmente todos los animales de sangre caliente, mamíferos y aves, pueden servir como huéspedes intermediarios de T. gondii y, por tanto, ser fuentes potenciales de infección para los humanos (6, 14, 21). Siempre se debe tener en cuenta que el mayor riesgo epidemiológico está en los animales de consumo tradicional, aunque para fines de salud pública es importante recalcar que por el organotrofismo de T. gondii, el número de quistes en un determinado órgano varían según el huésped intermediario, debido a que hay una mayor cantidad de quistes tisulares en diversos tejidos de cerdos infectados, ovejas y cabras, menos en conejos, perros y caballos y rara vez se encuentra en ganado vacuno o búfalos (21) y, por ende, aunque estos últimos tengan altas tasas de seroprevalencia, es muy raro que transmitan la infección a sus consumidores; algunos estudios en contraste a lo dicho anteriormente, muestran como el consumo de carne mal cocida, en especial de cordero y bovina, son el principal factor de riesgo para adquirir toxoplasmosis en mujeres embarazadas (5); un estudio realizado en la región del eje cafetero colombiano, demostró por medio de reacción en cadena de la polimerasa la frecuencia de Toxoplasma en carnes de cerdo, aves y bovinos, encontrándose que el 53 % de las muestras obtenidas fueron positivas para Toxoplasma, con predominio de la carne de cerdo en Manizales (70 %), de la carne de bovinos (80 %) en Armenia y de la carne de pollo (80 %) en Pereira (51).
Se debe tener en cuenta que a pesar que el cerdo se considera una fuente importante de infección humana, el riesgo está asociado con la forma en que se críen y el contacto que se tenga con gatos, considerándose que estos son factores de riesgo de infección para los cerdos (52); los animales que se mantienen en granjas con buenas condiciones higiénicas y encerrados, tienen menor probabilidad de contacto con roedores y gatos y, por tanto, menor riesgo de infectarse y de infectar a sus posibles consumidores; en nuestra región cafetera, a pesar de la tecnificación existente en la crianza de cerdos y pollos, por los resultados antes mencionados, se concluye que siguen prevaleciendo los factores de riesgo. En España, se evidenció una disminución de la seroprevalencia en cerdos estabulados al vacunar contra T. gondii a los gatos cercanos (53). Las medidas de control de infección de cerdos para consumo humano, deben también encaminarse a prevenir y controlar la contaminación del agua que consumen dichos animales (53).
El consumo de carne de animales silvestres ha sido también motivo de interés de los investigadores, algunos reportes mencionan la importancia del consumo de carne de jabalí mal cocida, como fuente de toxoplasmosis en humanos (54-55). Existe la posibilidad de presencia de quistes tisulares en muchos animales de caza. Hay reportes que han puesto de manifiesto la posibilidad de transmisión del parásito a través del consumo de carne de venado mal cocido, especialmente, en cazadores (56, 57). Los armadillos de vida libre, han sido estudiados para la presencia de Toxoplasma en Brasil y se demostró que, en zonas rurales donde se acostumbraba a consumir su carne, este animal podía ser una fuente importante de infección para humanos (58), lo cual muestra que no solo los animales de frecuente consumo humano pueden ser fuente del parásito.
Los pollos, patos y gallinas, adquieren los ooquistes del suelo, convirtiéndose en hospederos intermediarios potencialmente infectantes para los consumidores de su carne (59-60), en nuestro país pueden ser una fuente importante de infección, debido al alto consumo de esta carne, el riesgo no sólo está asociado con aquellos animales criados de manera tecnificada, sino también, con aquellos animales no tecnificados que son comercializados de manera no formal. A pesar de considerarse que los pollos no tienen gran cantidad de quistes tisulares, las condiciones de higiene en que se críen y el tejido consumido van a modular el riesgo de ser infectantes (5). Aves más pequeñas, como la golondrina urbana, las palomas y los gorriones pueden ser huéspedes de T. gondii (61-62), al ser fuente de alimento de gatos y otros felinos contribuyen a perpetuar el ciclo de infección y transmisión del parasito, además en el caso de las golondrinas, al ser animales de caza, pueden contagiar al ser humano directamente al consumir su carne (62).
La carne también puede infectar a las personas no sólo por su consumo, sino por su manipulación (5) o al producir una contaminación cruzada por medio de los utensilios usados para preparar los alimentos (21) y, por tal razón, se aconseja el lavado de este instrumental en agua caliente y detergente luego de su uso para disminuir la transmisión a carnes no infectadas o a otros alimentos que no se cocinan, como es el caso de algunas verduras.
Por lo anteriormente expuesto, se pensaría que las personas vegetarianas tendrían una menor probabilidad de infectarse con Toxoplasma, sin embargo, esto no es así, lo cual muestra la importancia de la presencia de ooquistes en el agua (61) y especialmente, la contaminación de alimentos, como verduras (5-6, 38); se ha demostrado que el consumir verduras crudas, fue un factor de riesgo en Francia (6); en Estados Unidos T. gondii es considerado como uno de los patógenos que más muertes causa por su transmisión alimentaria (50). Otros alimentos como la leche, pueden llegar a ser una posible fuente de trasmisión al humano, debido a que se han vinculado brotes de toxoplasmosis al consumo de leche cruda de cabra (63-64).
FACTORES AMBIENTALES Y SOCIO-CULTURALES
Se debe tener en cuenta al abordar las dinámicas de transmisión de cualquier microorganismo, las intrincadas relaciones que éstos tienen con el ambiente y el ecosistema al cual pertenecen. T. gondii puede infectar a través de dos maneras; una compleja, que requiere de huéspedes intermediarios para afectar nuevos huéspedes definitivos y que a su vez estará subordinado a la tasa de depredación y tamaño de la población felina (18), así como la disponibilidad de presas infectadas, constituyéndose, en la forma más efectiva de transmisión (18); y la forma simple, donde la adquisición del parásito depende única y exclusivamente, de la densidad poblacional de huéspedes definitivos (18); la manera como las personas se infectan va a depender de diferentes factores en los que intervienen el tipo de ambiente (rural o urbano) y factores antropológicos, como la cultura y las costumbres alimenticias (6, 23, 65); el grado de urbanización afecta la prevalencia del parásito y el mecanismo más probable de transmisión; en el ambiente rural predominará la infección por consumo de carne infectada y en el urbano por ooquistes ambientales (18).
Se sabe que algunos factores ambientales y atmosféricos, afectan de modo importante los ciclos de vida de diversos microorganismos, ya sea interviniendo en la disponibilidad y actividad de los huéspedes o al cambiar condiciones ambientales que afectan sus ciclos reproductivos (65). Los periodos de lluvia aumentan las tasas de infección por T. gondii (22, 24, 66) y en consecuencia, su prevalencia en felinos; haciendo más probable la diseminación de los ooquistes por el suelo, al ser arrastrados por las corrientes de agua lluvia, asociado además, al cambio en las dinámicas poblacionales de las presas potenciales (66); se considera que esta es una de las razones por las cuales la prevalencia en países tropicales es más alta; así mismo, se ha planteado que, como consecuencia del cambio climático global, en ciertas regiones de Europa, se incrementará la incidencia de toxoplasmosis en humanos, debido a que al aumentar las precipitaciones en invierno y al hacer las temperaturas más extremas, se afecta la supervivencia del parásito al encontrarse en un ambiente más húmedo; habrá mayor dispersión de los ooquistes y aumentará la cantidad de vectores invertebrados del parásito (65).
Es claro que los gatos son claves en la contaminación directa del ambiente con ooquistes (15); se sabe que la seroprevalencia en los mismos aumenta con la edad (11, 23, 30, 66), así que, los gatos jóvenes son de mayor riesgo en la transmisión del parasito, por no tener anticuerpos al infectarse y desarrollar los estados sexuales en el intestino que liberan ooquistes al ambiente (9); se ha demostrado que hay un riesgo de seroconversión elevado en los gatos, cuando hay un predominio de gatos jóvenes (66); además, son más altas las tasas de seroconversión en los gatos salvajes y en aquellos que vagan libremente. Otros factores que se han postulado como factores de riesgo de infección, el bajo nivel socioeconómico, las malas condiciones sanitarias (4, 31), ocupaciones como: la jardinería y otras en las que se esté en contacto con suelos (5, 67), haya contacto con carne cruda (5) o se evisceren animales (21). En cuanto al riesgo atribuible por género, los resultados son contradictorios, se ha postulado que las mujeres tienen un mayor riesgo debido al tipo de labores que realizan (31), aunque otros autores plantean como factor de riesgo al hombre, por tener mayor contacto con suelo y mala higiene (4, 6, 30) al igual que realizar viajes fuera de Europa o de otros países industrializados, como lo demuestra un estudio multicéntrico realizado en mujeres embarazadas en Europa (5). Otro estudio postuló, como un factor de riesgo para toxoplasmosis tener más de tres gatos jóvenes (30), pero llama la atención, que este hallazgo se limite a un número especifico de mascotas.
CONCLUSIONES Y PERSPECTIVAS EN SALUD PÚBLICA
Como se ha descrito anteriormente, la transmisión de la toxoplasmosis se caracteriza por tener una amplia variedad de mecanismos que pueden hacer que su control sea poco eficiente o complicado; es necesario dilucidar aún más, los métodos alternos de transmisión, para establecer de esta manera la verdadera importancia de estos mecanismos en la transmisión de la enfermedad.
La toxoplasmosis es una enfermedad que está totalmente olvidada por los entes asociados con salud pública, quizás por su bajo impacto en la población en general y además, porque no se sabe exactamente su verdadera importancia en la generación de bebés con malformaciones genéticas o simplemente con retardos en su desarrollo y aprendizaje.
Se ha visto que las formas en que T. gondii puede llegar a infectar a los seres humanos son diversas y que, en pacientes embarazadas o inmunocomprometidos, la infección tiene consecuencias desastrosas. Sin tener en cuenta, aquellos casos en que la fuente y ruta de transmisión no son identificadas, la mayoría de las fuentes descritas pueden ser evitadas, previniendo así la infección. Entre las medidas que pueden tener un efecto positivo en el control de la toxoplasmosis, está la relacionada con la vigilancia y optimización en la crianza de los animales de granja; así como las buenas prácticas de manipulación y expendio de los alimentos en general.
Algunas prácticas de conservación de carnes, como el salamiento de las mismas, se sabe que no son tan efectivas, si se tiene en cuenta que se ha demostrado que los quistes tisulares requieren una concentración de sal al 6 % para que se eliminen, así en concentraciones menores, la capacidad de eliminar los mismos varía con la temperatura (68); también, deben implementarse medidas adicionales para evitar la dispersión de los ooquistes por medio del agua, así como la inclusión de sistemas de monitoreo, que permitan establecer el grado de contaminación del agua, incluso en aquellas aguas tratadas con sistemas de filtración.
La transmisión de la toxoplasmosis va más allá del hecho de estar en contacto con gatos e incluso, varios autores en sus estudios, han mostrado que el contacto con felinos no siempre está presente como factor de riesgo para la enfermedad (5, 6); sin embargo, en nuestro medio, deben implementarse medidas de control con respecto a los gatos, tales como: controlar la población de gatos silvestres, realizar campañas para promover el confinamiento de los gatos y de esta manera evitar su infección al evitar la caza de los hospederos intermediarios; se hace necesario obtener una vacuna que pueda ser aplicada en gatos y de esa manera contribuir a la disminución de la carga de ooquistes presentes en el ambiente en los depósitos de heces felinas.
Con respecto a los grupos de riesgo que pueden presentar la toxoplasmosis en sus formas más graves, como en pacientes inmunosuprimidos y especialmente en embarazadas y en mujeres en edad reproductiva, se deberían tener las siguientes medidas de control y prevención: detección de niveles de IgG contra Toxoplasma, que permita determinar el estatus inmunológico frente al parásito; en caso que haya mujeres embarazadas y estén seronegativas, es necesario recalcar medidas de prevención para evitar la primoinfección, como son: evitar la manipulación de heces de gato, cocinar bien cualquier tipo de carne, no consumir agua sin hervir y en lo posible que, el agua que tomen sea de botella o bolsa, lavar muy bien las frutas y verduras, y en cada control prenatal monitorear los niveles de IgM frente a Toxoplasm. En pacientes VIH+ con infección crónica por T. gondii, hacer un minucioso seguimiento de los niveles de anticuerpos. Por otro lado, en pacientes receptores de trasplantes que tienen un alto riesgo de desarrollar formas fulminantes de la enfermedad, se debe propender por realizar la determinación de anticuerpos contra Toxoplasma, tanto a donantes, como a receptores, para evaluar el estado de inmunidad contra el parásito y así, el riesgo de infección, llevando a cabo la profilaxis adecuada que, como se ha demostrado, ayuda a prevenir la infección en huéspedes susceptibles (32); se requiere en Colombia estudios que muestren la seroprevalencia del parásito en donantes de sangre, tal como lo han hecho otros países (4, 31, 69-60), para poder discernir el riesgo de adquirir la infección por esta vía y de esta manera implementar dentro de las pruebas de aseguramiento de la calidad de la sangre, métodos que permitan detectar el parásito.
En resumen, a pesar que el T. gondii es un parásito de alta prevalencia mundial, en Colombia la toxoplasmosis congénita es un problema de salud pública y, por ello, los esfuerzos deben estar orientados a evitar la infección en grupos de riesgo, previniendo así, los efectos deletéreos de la misma.
BIBLIOGRAFÍA
1. Dubey JP. The history of Toxoplasma gondii - the first 100 years. J Eukaryot Microbiol 2008; 55:467-475. [ Links ]
2. Faust EC, Russell PF, Jung RC. Otros sporozoa: toxoplasma, sarcocystis, pneumocystis. En: Faust EC, Russell PF, Jung RC. Parasitología clínica de Craig y Faust. 1 ed. México: Salvat Editores; 1979. p. 229-235. [ Links ]
3. Gómez-Marin, JE. Protozoología médica: protozoos parásitos en el contexto latinoamericano. 1 ed. Bogotá: Editorial Manual Moderno; 2010. p. 65-87. [ Links ]
4. Sundar P, Mahadevan A, Jayshree RS, Subbakrishna DK, Shankar SK. Toxoplasma seroprevalence in healthy voluntary blood donors from urban Karnataka. Indian J Med Res 2007; 126:50-55. [ Links ]
5. Cook AJ, Gilbert RE, Buffolano W, Zufferey J, Petersen E, Jenum PA, et al. Sources of Toxoplasma infection in pregnant women: European multicentre case-control study. BMJ 2000; 321:142-147. [ Links ]
6. Gilot-Fromont E, Riche B, Rabilloud M. Toxoplasma seroprevalence in a rural population in France: detection of a household effect. BMC Infect Dis 2009; 9:76. [ Links ]
7. Ertug S, Okyay P, Turkmen M, Yuksel H. Seroprevalence and risk factors for toxoplasma infection among pregnant women in Aydin province, Turkey. BMC Public Health 2005; 5:66. [ Links ]
8. Gómez JE. Toxoplasmosis: un problema de Salud Pública en Colombia. Rev. Salud pública 2002; 4:7-10. [ Links ]
9. López CA, Díaz J, Gómez JE. Factores de riesgo en mujeres embarazadas, infectadas por Toxoplasma gondii en Armenia Colombia. Rev. Salud pública 2005; 7(2):180-190. [ Links ]
10. Gómez-Marín JE. Toxoplasma. En: Díaz FJ, Estrada S, Franco L, Jaramillo JM, Maestre A, Ospina S et al. Microbiología de las infecciones humanas. Medellín: Corporación para Investigaciones Biológicas; 2007. p. 384-399. [ Links ]
11. Dubey JP, Jones JL. Toxoplasma gondii infection in humans and animals in the United States. Int J Parasitol 2008; 38:1257-1278. [ Links ]
12. Azevedo KM, Setúbal S, Lopes VG, Bastos LA, De Oliveira SA. Congenital toxoplasmosis transmitted by human immunodeficiency-virus infected women. Braz J Infect Dis 2010; 14(2):186-189. [ Links ]
13. Dubey JP. Toxoplasmosis - a waterborne zoonosis. Vet Parasitol 2004; 126:57-72. [ Links ]
14. Buxton D. Ovine toxoplasmosis: a review. J R Soc Med 1990; 83:509-511. [ Links ]
15. Dubey JP, Su C, Cortés JA, Sundar N, Gomez JE, Polo LJ et al. Prevalence of Toxoplasma gondii in cats from Colombia, South America and genetic characterization of T. gondii isolates. Vet Parasitol 2006; 141:42-47. [ Links ]
16. Dubey JP, Lindsay DS, Speer CA. Structures of Toxoplasma gondii tachyzoites, bradyzoites and sporozoites and biology and development of tissue cysts. Clin Microbiol Rev 1998; 11:267-299. [ Links ]
17. Dubey JP. Comparative infectivity of oocysts and bradyzoites of Toxoplasma gondii for intermediate (mice) and definitive (cats) hosts. Vet Parasitol 2006; 140:69-75. [ Links ]
18. Lélu M, Langlais M, Poulle M-L, Gilot-Fromont E. Transmission dynamics of Toxoplasma gondii along an urban-rural gradient. Theor Popul Biol 2010; 78:139-147. [ Links ]
19. Dubey JP. Unexpected oocyst shedding by cats fed Toxoplasma gondii tachyzoites: in vivo stage conversion and strain variation. Vet Parasitol 2005; 133:289-298. [ Links ]
20. Dubey JP. Re-examination of resistance of Toxoplasma gondii tachyzoites and bradyzoites to pepsin and trypsin digestion. Parasitology 1998; 116:43-50. [ Links ]
21. Tenter A M. Toxoplasma gondii in animals used for human consumption. Mem Inst Oswaldo Cruz 2009; 104:364-369. [ Links ]
22. De Moura L, Bahía-Oliveira LM, Wada MY, Jones JL, Tuboi SH, Carmo EH, et al. Waterborne Toxoplasmosis, Brazil, from Field to Gene. Emerg Infect Dis 2006; 12(2):326-329. [ Links ]
23. Aramini JJ, Stephen C, Dubey JP, Engelstoft C, Schwantje H, Ribble CS. Potential contamination of drinking water with Toxoplasma gondii oocysts. Epidemiol Infec 1999; 122:305-315. [ Links ]
24. Bowie WR, King AS, Werker DH, Isaac-Renton JL, Bell A, Eng SB, et al. Outbreak of toxoplasmosis associated with municipal drinking water. The Lancet 1997; 350:173-177. [ Links ]
25. Sroka J, Wójcik-Fatla A, Dutkiewicz J. Ocurrence of Toxoplasma gondii in water from wells located on farms. Ann Agric Environ Med 2006; 13:169-175. [ Links ]
26. Kuticic V, Wikerhauser T. Studies of the effect of various treatments on the viability of Toxoplasma gondii tissue cysts and oocysts. Curr Top Microbiol Inmunol 1996; 219:261-265. [ Links ]
27. Shapiro K, Mazet J, Schriewer A, Wuertz S, Fritz H, Miller WA, et al. Detection of Toxoplasma gondii oocysts and surrogate microspheres in water using ultrafiltration and capsule filtration. Water Res 2010; 44:893-903. [ Links ]
28. Wainwright KE, Miller MA, Barr BC, Gardner IA, Melli AC, Essert T, et al. Chemical inactivation of Toxoplasma gondii in water. J. Parasitol 2007; 93(4):925-931. [ Links ]
29. Dumétre A, Le Bras C, Baffet M, Meneceur P, Dubey JP, Derouin F, et al. Effects of ozone and ultraviolet radiation treatments on the infectivity of Toxoplasma gondii oocysts. Vet Parasitol 2008; 153:209-213. [ Links ]
30. Jones JL, Dargelas V, Roberts J, Press C, Remington JS, Montoya JG. Risk factors for Toxoplasma gondii infection in the United States. Clin Infect Dis 2009; 49:878-884. [ Links ]
31. Elhence P, Agarwal P, Prasad KN, Chaudhary RK. Seroprevalence of Toxoplasma gondii antibodies in North Indian blood donors: implications for transfusion transmissible toxoplasmosis. Transfus Apher Sci 2010; 43:37-40. [ Links ]
32. Wreghitt TG, Hakim M, Gray JJ, Balfour AH, Stovin PGI, Stewart S, et al. Toxoplasmosis in heart and heart and lung transplant recipients. J Clin Pathol 1989; 42:194-199. [ Links ]
33. Siegel SE, Lunde MN, Gelderman AH, Halterman RH, Brown JA, Levine AS, et al. Transmission of toxoplasmosis by leukocyte transfusion. Blood 1971; 37:388-394. [ Links ]
34. Garcia de la Fuente I, Ansari M, Rougemont AL, Passweg JR, Gumy-Pause F, Ozsahin H, et al. Acute disseminated fatal toxoplasmosis after haploidentical stem cell transplantation despite atovaquone prophylaxis in a young man. Pediatr Infect Dis J 2010; 29:1059-1060. [ Links ]
35. Wolf A, Cowen D, Paige B. Human toxoplasmosis: ocurrence in infants as an encephalomyelitis verification by transmission to animals. Science 1939; 89:226-227. [ Links ]
36. Gómez JE, Ruíz B, Silva P, Beltrán S, Cortés J, Montoya J, et al. Guía de práctica clínica para toxoplasmosis durante el embarazo y toxoplasmosis congénita en Colombia. Infectio 2007; 11(3): 129-141. [ Links ]
37. Villena I, Ancelle T, Delmas C, García P, Brézin AP, Thulliez P, et al. Congenital toxoplasmosis in France in 2007: first results from a national surveillance system. Euro Surveill 2010; 15(25): 1-6. [ Links ]
38. Ocampo LM, Duarte I. Modelo para la dinámica de transmisión de la toxoplasmosis congénita. Rev. Salud pública 2010; 12(2):317-326. [ Links ]
39. Roberts CW, Walker W, Alexander J. Sex-Associated Hormones and Inmunity to Protozoan Parasites. Clin Microbiol Rev 2001; 14:476-488. [ Links ]
40. De Moraes EP, Batista AM, Faria EB, Freire BL, Freitas AC, Ramos MA, et al. Experimental infection by Toxoplasma gondii using contaminated semen containing different doses of tachyzoites in sheep. Vet Parasitol 2010; 170:318-322. [ Links ]
41. Arantes TP, Zanetti WD, Machado R, Pinto JS, Pinto VMR, Sakamoto CA, et al. Toxoplasma gondii: Evidence for the transmission by semen in dogs. Exp Parasitol 2009; 123:190-194. [ Links ]
42. Pellati D, Mylonakis I, Bertoloni G, Fiore C, Andrisani A, Ambrosini G, et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol 2008; 140: 3-11. [ Links ]
43. Terpsidis KI, Papazahariadou MG, Taitzoglou IA, Papaioannou NG, Georgiadis MP, Theodoridis IT. Toxoplasma gondii: Reproductive parameters in experimentally infected male rats. Exp Parasitol 2009; 121:238-241. [ Links ]
44. Martinez F, Regadera J, Mayer R, Sanchez S, Nistal M. Protozoan infections in the male genital tract. J Urol 1996; 156:340-349. [ Links ]
45. Graczyk TK, Knight R, Gilman RH, Cranfield MR. The role of non-biting flies in the epidemiology of human infectious diseases. Microbes infect 2001; 3:231-235. [ Links ]
46. Wallace GD. Experimental transmission of Toxoplasma gondii by filth-flies. Am J Trop Med Hyg 1971; 20:411-413. [ Links ]
47. Lindsay DS, Dubey JP, Butler JM, Blagburn BL. Mechanical transmission of Toxoplasma gondii oocysts by dogs. Vet Parasitol 1997; 73:27-33. [ Links ]
48. Graczyk TK, Knight R, Tamang L. Mechanical Transmission of Human Protozoan Parasites by Insects. Clin Microbiol Rev 2005; 18:128-132. [ Links ]
49. Wallace GD. Experimental Transmission of Toxoplasma gondii by Cockroaches. J Infect Dis 1972; 126:545-547. [ Links ]
50. Mead PS, Slutsker L, Dietz V, McCaig LF, Bresee JS, Shapiro C, et al. Food-Related Illness and Death in the United States. Emerg Infect Dis 1999; 5(5):607-625. [ Links ]
51. Lora F, Aricapa HJ, Pérez JE, Arias LE, Idárraga SE, Mier D et al. Detección de Toxoplasma gondii en carnes de consumo humano por la técnica de reacción en cadena de la polimerasa en tres ciudades del eje cafetero. Infectio 2007; 11:117-123. [ Links ]
52. Ortega A, Acosta KY, Guzmán E, Uitzil B, Rodríguez JC, Jimenez M. Infection dynamic of Toxoplasma gondii in Two fattening pig farms exposed to high and low cat density in an endemic región. Vet Parasitol 2011; 175:367-371. [ Links ]
53. Mateus NE, Hannon B, Weigel RM. A computer simulation of the prevention of the transmission of Toxoplasma gondii on swine farms using a feline T. gondii vaccine. Prev Vet Med 2002; 55:17-36. [ Links ]
54. Gauss CBL, Dubey JP, Vidal D, Ruiz F, Vicente J, Marco I, et al. Seroprevalence of Toxoplasma gondii in wild pigs (Sus scrofa) from Spain. Vet Parasitol 2005; 131:151-156. [ Links ]
55. Fornazari F, Langoni H, Da Silva RC, Guazzelli A, Garcia M, Chiacchio SB. Toxoplasma gondii infection in wild boars (Sus scrofa) bred in Brazil. Vet Parasitol 2009; 164:333-334. [ Links ]
56. Ross RD, Stec LA, Werner JC, Blumenkranz MS, Glazer L, Williams GA. Presumed acquired ocular toxoplasmosis in deer hunters. Retina 2001; 21:226-229. [ Links ]
57. Sacks JJ, Delgado DG, Lobel HO, Parker RL. Toxoplasmosis infection associated with eating undercooked venison. Am J Epidemiol 1983; 118(6):832-838. [ Links ]
58. Da Silva RC, Zetun CB, Gimenes S de M, Bagagli E, Rosa PS, Langoni H. Toxoplasma gondii and Leptospira spp. Infection in free-ranging armadillos. Vet Parasitol 2008; 157:291-293. [ Links ]
59. Yan C, Yue CL, Yuan ZG, He Y, Yin CC, Lin RQ, et al. Toxoplasma gondii infection in domestic ducks, free-range and caged chickens in southern China. Vet Parasitol 2009; 165:337-340. [ Links ]
60. Dubey JP, Patitucci AN, Su C, Sundar N, Kwok OC, Shen SK. Characterization of Toxoplasma gondii isolates in free-range chickens from Chile, South America. Vet Parasitol 2006; 140:76-82. [ Links ]
61. Waap H, Vilares A, Rebelo E, Gomes S, Ángelo H. Epidemiological and genetic characterization of Toxoplasma gondii in urban pigeons from the area of Lisbon (Portugal). Vet Parasitol 2008; 157:306-309. [ Links ]
62. Martínez C, Bernabé A, Ortiz JM, Alonso FD. Experimental toxoplasmosis in red-legged partridges (Alectoris rufa) fed Toxoplasma gondii oocysts. Vet Parasitol 2005; 130:55-60. [ Links ]
63. Skinner LJ, Timperley AC, Wightman D, Chatterton JM, Ho-Yen DO. Simultaneous Diagnosis of Toxoplasmosis in Goats and Goatowner's Family. Scand J Infect Dis 1990; 22:359-361. [ Links ]
64. Sacks JJ, Roberto RR, Brooks NF. Toxoplasmosis infection associated with Raw Goat's Milk. JAMA 1982; 248:1728-1732. [ Links ]
65. Meerburg BG, Kijlstra A. Changing climate-changing pathogens: Toxoplasma gondii in North Western Europe. Parasitol Res 2009; 105:17-24. [ Links ]
66. Afonso E, Thulliez P, Gilot-Fromont E. Local meteorological conditions, dynamics of seroconversión to Toxoplasma gondii in cats (Felis catus) and oocyst burden in a rural environment. Epidemiol Infect 2010; 138:1105-1113. [ Links ]
67. Dos Santos TR, Nunes CM, Luvizotto MC, De Moura AB, Lopes WD, Da Costa AJ, et al. Detection of Toxoplasma gondii oocysts in environmental samples from public schools. Vet Parasitol 2010; 171:53-57. [ Links ]
68. Dubey JP. Survival of Toxoplasma gondii tissue cysts in 0.85-6 % NaCl solutions at 4-20ºC. J Parasitol 1997; 83:946-949. [ Links ]
69. Studenicovà C, Bencaiovà G, Holková R. Seroprevalence of Toxoplasma gondii antibodies in a healthy population from Slovakia. Eur J Intern Med 2006; 17(7):470-473. [ Links ]
70. Martín I, García SM. Prevalencia de anticuerpos IgG contra Toxoplasma gondii en donantes de sangre cubanos. Rev Biomed 2003; 14:247-251. [ Links ]