Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.11 no.1 Manizales Jan./June 2012
RESVERASOR EFFECT ON REPRODUCTIVE PARAMETERS IN RATS TREATED WITH ACTH EXOGENOUS
Miryam Vélez Marín1
Luis Fernando Uribe Velásquez2
Henry Mesa3
1 MSc. Profesora Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales, Universidad de Caldas, Manizales. Correo electrónico: miryam.velez@ucaldas.edu.co
2 Ph.D. Profesor Asociado Departamento de Salud Animal, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales. Correo electrónico: lfuribe@ucaldas.edu.co
3 Ph.D.. Profesor Departamento Producción Agropecuaria, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Manizales. Correo electrónico: henry.mesa@ucaldas.edu.co
RESUMEN
El estrés es definido como "la acción de estímulos nerviosos y emocionales provocados por el ambiente sobre los sistemas nervioso, endocrino, circulatorio y digestivo de un animal, produciendo cambios medibles en los niveles funcionales de estos sistemas" (1). El objetivo del presente trabajo fue determinar el efecto antioxidante del resverasor, a través de la actividad enzimática de la superóxido dismutasa (SOD) en los eritrocitos de rata, y relacionarlo con los parámetros reproductivos, número de cuerpos lúteos (CL) y supervivencia posimplante (SP). Se utilizaron 48 ratas hembras y 16 machos de la cepa Wistar de tres meses de edad, que permanecieron bajo condiciones ambientales controladas, temperatura 20±2°C, ciclos de luz-oscuridad de 14 y 10 horas, respectivamente. A los animales se les proporcionó alimento balanceado con libre acceso al agua. Las ratas fueron divididas en cuatro grupos al azar: el grupo 1 fue tratado con 5 ug/kg de ACTH i.p. cada 12 horas; un segundo grupo recibió el mismo tratamiento con ACTH, además de una suplementación oral de 40 mg/kg de extracto de uva; un tercer grupo solo recibió extracto de uva, y el último grupo sirvió como control, el cual recibió solución salina i.p. y oral. El diseño experimental fue un factorial 2×2, con dos niveles de ACTH y dos niveles de extracto de uva. Al final del experimento se sacrificaron las ratas hembras y se les extrajo el tracto reproductivo para determinar el número de CL y de fetos. Se observó que la dosis utilizada del resverasor no afectó la actividad SOD eritrocitaria y el desempeño reproductivo, medido en función de número de CL y supervivencia posimplante en ratas tratadas con ACTH y uva. Esto indica que, posiblemente, las ratas se adaptaron al estrés crónico y, en consecuencia, al estrés oxidativo.
Palabras clave: CL, estrés, rata, reproducción, resverasor, SOD.
ABSTRACT
Stress is defined as "the action of nervous and emotional stimuli provoked by the environment on the nervous, endocrine, circulatory and digestive systems of an animal, producing measurable changes on the functional levels of these systems" (1). The goal of this work was to determine the resverasor antioxidant effect through the superoxide dismutase (SOD) enzymatic activity in the rats erythrocyte, and to correlate it with the reproductive parameters, number of corpora lutea (CL). and postimplantation survival (PS). Forty-eight female and 16 male three months old rats of the Wistar strain, were used, kept in a controlled environment, 20±2°C temperature and light-dark cycles of 14 and 10 h, respectively. The animals were fed a balanced diet and they had free access to water. Rats were divided in four groups at random: group 1 was treated with 5 ACTH i.p. ug/kg every 12 h; group 2 received the same ACTH treatment plus a 40 mg/kg oral grape extract supplement; group 3 received only the grape extract, and the last group served as control group and received oral i.p saline solution . The experimental design was 2×2 factorial, with two ACTH levels and two grape extract levels. At the end of the experiment female rats were sacrificed to extract the reproductive tract and determine the number of CL and fetuses. It was observed that the resverasor dose used did not affect erythrocyte SOD activity or reproductive performance measured in terms of CL and PS in rats treated with ACTH and grapes. This indicates that, possibly, rats adapted to chronic stress, and in consequence, to oxidative stress.
Key words: corpus luteum, rat, reproduction, resverasor, SOD, stress.
En los últimos años se ha expresado cada vez más una preocupación mundial frente al bienestar de los animales domésticos, debido a la aplicación de tecnologías productivas, que se pueden convertir en factores que producen estrés y provocar un detrimento de la calidad de vida y productividad de los mismos. Factores tales como el clima, el medio ambiente cambiante, el ruido, la alta densidad animal, entre otros, son causantes de estrés y ocasionan problemas en la reproducción (2).
El término estrés fue acuñado por Hans Selye (1), quien descubrió los estímulos que podían provocar esta condición. Este autor definió el estrés como "la acción de estímulos nerviosos y emocionales provocados por el ambiente sobre los sistemas nervioso, endocrino, circulatorio y digestivo de un animal, produciendo cambios medibles en los niveles funcionales de estos sistemas". El estrés inducido retrasa el desarrollo folicular y la ovulación, lo cual puede estar relacionado con el efecto inhibidor directo de los glucocorticoides sobre la secreción de esteroides gonadales y la sensibilidad del tejido diana a los esteroides sexuales (3). El estrés desencadena alteraciones agudas y crónicas en las concentraciones plasmáticas de cortisol y hormonas tiroideas; además, puede acarrear alteraciones en las reacciones fisiológicas y en el comportamiento de los animales (4).
Se ha demostrado también que los glucocorticoides pueden reducir la inflamación a través de la inhibición de la fosfolipasa A2 y la ciclooxigenasa-2 (COX-2), mecanismos moleculares implicados en la regulación de la biosíntesis de prostaglandinas (5). En el tejido endometrial la COX-2, también conocida como prostaglandina G/H sintasa-2 (PGHS-2), es un tipo de enzima que cataliza la producción de prostaglandinas, entre ellas la prostaglandina F2a, principal reguladora de luteólisis (6).
La cadena de procesos que conduce a la luteólisis inicia a partir de la unión del estradiol con su receptor en el endometrio. Entre las principales acciones del estradiol, se encuentran la regulación de los receptores uterinos de oxitocina y su posterior liberación desde el cuerpo lúteo. La oxitocina, a su vez, estimula la liberación de una pequeña cantidad de PGF2a uterina, que inicia un circuito de retroalimentación positiva (7). El retraso en la regresión lútea en respuesta a un exceso de estimulación adrenal puede retardar el desarrollo del folículo dominante y, en consecuencia, disminuir la secreción de estradiol, que no podrá poner en marcha el mecanismo luteolítico (7,8,9).
Para una reproducción eficiente, los folículos deben crecer a un ritmo adecuado en los ovarios, para que ocurra una ovulación y secreciones hormonales adecuadas, no solo para preparar el útero y recibir el concepto, sino también para controlar la liberación de feromonas. Todos estos eventos son coordinados por las interacciones endocrinas que se interrumpen en situaciones de estrés (10). Sin embargo, no es claro el mecanismo por el cual el estrés influye en la reproducción, pero puede involucrar los sistemas endocrino, paracrino y neural. El estrés impacta el eje reproductivo en el hipotálamo (afectando la secreción de GnRH) y la glándula pituitaria (afectando la secreción de gonadotropinas) con efectos directos sobre las gónadas. Cada factor estresante tiene efectos diferentes, y se presentan diferencias en la respuesta al estrés a corto y largo plazo (11).
Los polifenoles (PFs) son un grupo heterogéneo de sustancias químicas encontradas en plantas, caracterizadas por la presencia de más de un grupo fenol por molécula. Estas sustancias son originadas del metabolismo de las plantas, principalmente a partir de dos vías: la ruta del ácido shikímico y del ácido acético (12).
Los compuestos polifenólicos de la uva se encuentran en la piel, especialmente en las células epidérmicas y en las semillas, siendo su concentración baja en la pulpa. La cantidad y calidad de polifenoles en la uva depende principalmente de la variedad de la vid, del clima, del terreno y de las prácticas de cultivo (13). Los principales constituyentes fenólicos del vino con capacidad antioxidante son: derivados de ácidos fenólicos, ácidos cinámicos y tirosina, estilbenos, flavonoides y proantocianidinas.
El objetivo del presente trabajo fue determinar el efecto antioxidante del resverasor mediante la actividad enzimática de la superóxido dismutasa (SOD) en los eritrocitos de rata sobre el sistema reproductor de la rata por medio de parámetros reproductivos, número de cuerpos lúteos (CL) y supervivencia posimplante (SP).
Se utilizaron 48 ratas hembras adultas y 16 machos de la cepa Wistar (Rattus norvegicus) de tres meses de edad y con un peso corporal de 200-250 g y 300-350 g para hembras y machos, respectivamente, que permanecieron bajo condiciones ambientales controladas, temperatura 20±2°C, ciclos de luz-oscuridad de 14 y 10 horas, respectivamente. La salud de los animales fue evaluada por examen clínico antes y durante todo el período experimental. Los animales fueron distribuidos en cuatro grupos experimentales al azar de 12 hembras y cuatro machos cada uno, los cuales fueron ubicados en cuatro jaulas compuestas cada una por tres hembras y un macho. Cada jaula se tomó como una unidad experimental. Todos los procedimientos se llevaron a cabo en relación con la Legislación colombiana sobre el cuidado de los animales (14) y aprobado por el Comité de Ética de la Universidad de Caldas, Manizales, Colombia (15). Los biomodelos fueron procedentes del Bioterio de la Universidad del Valle, Cali, Colombia.
Periodo de adaptación
Los animales tuvieron un periodo de adaptación de diez días, momento en el cual fueron distribuidos en cuatro grupos al azar de 16 ratas (12 hembras y cuatro machos) por tratamiento, donde se les proporcionó alimento balanceado para ratas (proteína mínima 23,5%; grasa mínima 6,5%; fibra máxima 5% y cenizas máxima 8%), con libre acceso al agua. Cada unidad experimental se conformó de cuatro hembras y un macho.
Tratamientos
Grupo 1: fue tratado con 5 ug/kg de ACTH intraperitoneal (i.p.) (Tetracosactrin acetato; Synacthen, Novartis®, Barcelona, España) cada 12 horas durante 30-33 días. Grupo 2: recibió el mismo tratamiento con ACTH, además de una suplementación oral con el uso de una sonda intragástrica, de 40 mg/kg de extracto de uva (Resverasor®, Soria Natural S.A. Garray Soria, España). Grupo 3: solo recibió extracto de uva 40 mg/kg. Grupo 4: sirvió como control en donde los animales recibieron solución salina (0,9%) i.p. y oral. Las hembras estuvieron separadas del macho por un vidrio, el cual fue retirado 10 días post-adaptación, momento en el cual se observó en las hembras la presencia de tapón vaginal cada 12 horas para determinar cópula, que fue tomado como día 0 (cero) de gestación.
Medición de la enzima SOD
Para la determinación de SOD se utilizó el kit comercial de Ransod SD125 (Randox Laboratorios Ltda, U.K.), el cual emplea xantina y xantina oxidasa para formar radicales superóxido, con formación de color. Para ello se tomaron 0,5 mL de sangre con anticoagulante (EDTA) y se centrifugó 10 min a 865 × g. El plasma se decantó y los eritrocitos se lavaron cuatro veces con 3 mL de solución de NaCl (0,9%), siendo centrifugado después de cada lavado. La lisis de los eritrocitos se produjo mediante la adición de 2 mL de agua destilada fría, colocándose durante 15 min a 4°C. Seguidamente, esta preparación de eritrocitos lisados se diluyó 50 veces con 0,01 mol/L de solución amortiguadora fosfato (pH= 7) para alcanzar porcentajes de inhibición entre 30 y 60%. El factor de dilución final fue de 200. La actividad de la enzima se medió por el grado de inhibición en la formación del colorante en la reacción. Una unidad de SOD será definida como la cantidad de enzima necesaria que puede causar el 50% de inhibición del colorante a temperatura ambiente. La actividad enzimática se calculó usando un estándar comercial y los resultados se expresaron en U/mg de proteína.
Índices reproductivos
Las hembras fueron sacrificadas en el día 17 de gestación, momento en el cual se les extrajo el tracto reproductivo (útero y ovarios) para observar a través de un estereoscopio el número de CL y de fetos. En los machos, se calculó el índice reproductivo (I) en función de las hembras con el número de ovulaciones (NO), supervivencia posimplante (SP) y número de hembras preñadas (HP), utilizando la fórmula I=NO*SP*HP, planteada por Cammack et al (16).
Diseño experimental y análisis estadístico
El diseño realizado fue un factorial 2×2, con dos niveles de ACTH (ausencia y presencia) y dos niveles de polifenol (ausencia y presencia), balanceado y completo, con cuatro réplicas. La unidad experimental estaba conformada por una jaula con tres hembras y un macho. Mediante análisis de varianza se evaluó el efecto de estrés inducido, polifenol y su interacción lineal sobre: CL totales y supervivencia posimplante.
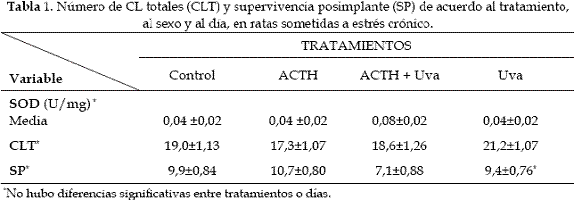
Cuando se analizó la variable SOD frente a los tratamientos e interacciones (ACTH + Uva) no se encontró efecto (p>0,05) de ninguno de ellos, al igual que no hubo diferencias entre machos y hembras (Tabla 1). Contrario a esto, Kairisalo et al. (17) demostraron que el resverasor reduce el estrés oxidativo y aumenta la supervivencia celular, dependiendo de la concentración usada (50 a 75 uM). En las células, se ha identificado que el resverasor aumenta los niveles de antioxidantes de la SOD. Sin embargo, se desconoce el mecanismo por el cual el resverasor actúa como antioxidante, no entendiéndose completamente sus propiedades, pero se ha reportado que afecta la activación de ciertos genes y proteínas (18).
Pasko et al. (19) reportaron que ratas tratadas con semillas de amaranto, un cereal antioxidante, presentaron disminución de malonaldehído en plasma y disminución de la actividad enzimática antioxidante de la SOD eritrocitaria, demostrando que las semillas de amaranto pueden actuar como un agente protector moderado frente a los cambios inducidos por la fructosa, lo que sugiere que el sistema antioxidante del plasma, el corazón y los pulmones son más eficaces cuando hay consumo de semillas de amaranto. Tal vez la disminución de la actividad de la SOD podría estar asociada con un alto contenido de metionina en las semillas de amaranto en comparación con una dieta normal. Esto se puede deducir de otros estudios (20), debido a que cuando se administra metionina se reduce la concentración de Cu y Zn en el corazón.
Posiblemente, los mismos cambios se pueden dar en las células eritrocitarias, en donde la mayoría de la SOD eritrocitaria son dependientes de Cu y Zn. A su vez, el Cu puede actuar indirectamente como antioxidante, ya que inhibe la acción de los metales como catalizadores en la formación de radicales libres (21), disminuyendo así el estrés oxidativo, sin afectarse la actividad de la SOD.
Otros autores (22,23) mostraron que los antioxidantes exógenos pueden restablecer el balance entre las moléculas oxidantes y antioxidantes en el organismo, manteniendo así la integridad de las membranas celulares y previniendo el daño oxidativo. El estrés promueve primero una disminución de la absorción y movilización de las moléculas que constituyen los agentes antioxidantes (24).
La dualidad de la respuesta de la SOD puede estar asociada a que el estrés oxidativo induce la producción de enzimas, como mecanismo compensatorio, incrementando su actividad con el fin de mantener la homeostasis. De la misma manera, muchas de estas enzimas se inducen en respuesta al estrés, de manera que un mayor nivel podría indicar mejor protección o, alternativamente, una mayor necesidad de defensas antioxidantes por causa de un aumento en la generación de oxidantes (25). La reducción de la actividad de SOD observada en algunos experimentos puede asociarse, en parte, a una inactivación de la enzima debido a elevadas concentraciones de EROs (26).
La falta de variación en la concentración de SOD eritrocitaria en la presente investigación puede estar relacionada con el hecho de que la SOD tiene su mayor actividad entre los tres y seis meses de edad, disminuyendo entre los seis y 12 meses de edad (27). Las ratas del presente estudio tenían tres meses de edad, período en el cual se encontraba la SOD en su mayor actividad, razón por la cual probablemente no se identificó ningún efecto de los tratamientos.
Los resultados no mostraron diferencia en las variables número de CL y supervivencia posimplante, entre los tratamientos y entre hembras y machos (en función de las hembras, Tabla 1). Contrariamente, se ha reportado que las hembras son más susceptibles al estrés dependiente del eje HPA, de acuerdo con los niveles esteroidales en el ovario, y que éste afecta su ciclicidad (28).
Otras investigaciones sobre la actividad reproductiva y el estrés oxidativo en los vertebrados se centró en la concentración de la SOD en los músculos pectorales de los machos y de las hembras del pájaro Taenopygia guttata y su correlación con el tamaño de la nidada (29). Los autores encontraron que la actividad de SOD disminuyó, cuando aumentó el tamaño de la nidada; esto, probablemente, se deba al aumento del daño oxidativo, dado el desequilibrio del esfuerzo reproductivo y la protección antioxidante (29). Los resultados presentados por Gil et al. (27) constituyen el primer trabajo que ha analizado el estrés oxidativo en mamíferos machos y la relación con la reproducción y el envejecimiento. El estudio muestra que la actividad reproductora en ratas macho altera todos los parámetros oxidativos en el cerebro, lo que indica un aumento significativo en los niveles de daño oxidativo y en las defensas enzimáticas antioxidantes, en algunos grupos de edad, indicando que las alteraciones presentadas conducen a cambios en la calidad de vida de los animales.
Mourlon et al. (28) demostraron que el estrés modifica el patrón del estro, así como el proestro en ratas hembras. En cambio, no encontraron alteraciones importantes en ratas macho, ni en la respuesta de glucocorticoides inducida por el estrés, ni en la sensibilidad de retroalimentación del eje HPA, lo que indicó que las hembras son más vulnerables a un desequilibrio del eje HPA después de la exposición al estrés. Este dimorfismo sexual probablemente indica una adaptación hormonal a la exposición a estrés crónico; desconociéndose el mecanismo de interacción entre los ejes HPA y el hipotálamo hipófisis gonadal por la vía neuro-hormonal (30). La complejidad de la biología del estrés requiere de estudios más profundos, que incluyan una muestra importante de animales, con el fin de identificar los efectos del estrés agudo, crónico y oxidativo que puedan ser útiles y fáciles de medir en condiciones de campo (31).
Al igual que las especies reactivas de oxígeno, no actúan de forma general sobre todas las biomoléculas, ni tampoco todas ellas son igualmente susceptibles de daño oxidativo. Los antioxidantes probablemente pueden actuar protegiendo determinadas vías y sistemas orgánicos.
En los resultados de la presente investigación se observó que la dosis utilizada del resverasor (40 mg/kg) no afectó la actividad SOD eritrocitaria y el desempeño reproductivo, medido en función de número de CL y supervivencia posimplante, en ratas tratadas con ACTH y uva. Esto indica que, posiblemente, las ratas se adaptaron al estrés crónico y, en consecuencia, al estrés oxidativo.
1. Selye H. The evolution of the stress concept. Am Sci 1973; 6:692-8. [ Links ]
2. Almier M, De Rosa G, Grasso F, Napolitano F, Bordi A. Effect of climate on the response of three oestrus synchronization techniques in lactating dairy cows Anim Rep Sci 2002; 71:157-68. [ Links ]
3. Magiakou MA, Mastorako G, Webster E, Chrousos GP. The hypothalamic-pituitary-adrenal axis and the female reproductive system. Ann NY Acad Sci 1997; 816:42-56. [ Links ]
4. Vélez-Marín M, Uribe-Velasquez LF. ¿Cómo afecta el estrés calórico la reproducción? Biosalud 2011; 9:83-95. [ Links ]
5. Goppelt Struebe M. Molecular mechanisms involved in the regulation of prostaglandin biosynthesis by glucocorticoids. Biochem Pharmacol 1997; 53:1389-95. [ Links ]
6. Colitti M, Sgorlon S, Stradaioli G, Farinacci M, Gabai G., Stefanon B. Grape polyphenols affect mRNA expression of PGHS-2, TIS11b and FOXO3 in endometrium of heifers under ACTH-induced stress. Theriog 2007; 68:1022-30. [ Links ]
7. Niswender GD, Juengel JL, Silva PJ, Rollyson MK, Mcintush EW. Mechanisms controlling the function and life span of the corpus luteum. Physiol Rev 2000; 80:1-29. [ Links ]
8. Kawate N, Inaba T, Mori J. Changes in plasma concentrations of gonadotropins and steroid hormones during the formation of bovine follicular cysts induced by the administration of ACTH. J Vet Med Sci 1996; 58:141-4. [ Links ]
9. Dobson H, Ribadu AY, Noble KM, Tebble JE, Ward WR. Ultrasonography and hormone profiles of adrenocorticotrophic hormone (ACTH)-induced persistent ovarian follicles (cysts) in cattle. J Reprod Fertil 2000; 120:405-10. [ Links ]
10. Dobson H, Fergani C, Routly JE, Smith RF. Effects of stress on reproduction in ewes, Anim Rep Sci 2012. [In press] [ Links ].
11. Tilbrook AJ, Turner AI, Clark IJ. Effects of stress on reproduction in non-rodent mammals: the role of glucocorticoids and sex differences Rev Reprod 2000; 5:105-13. [ Links ]
12. Harborne JB. Methods in Plant Biochemistry, In: plant phenolics. London: Academic Press; 1989. [ Links ]
13. Infante R. Polifenoles del vino y oxidabilidad de las lipoproteínas. ¿Blanco o tinto? Clin Invest Arterioscl 1997; 91:9-22. [ Links ]
14. Ministerio De Protección Social. Resolución 8430 Por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Colombia; 1993. [ Links ]
15. Universidad de Caldas. Resolución Rectoral N° 000259. Por la cual se crea el comité de ética para la experimentación con animales; 2008, Mar 31. [ Links ]
16. Cammack KM, Mesa H, Lamberson WR. Genetic variation in fertility of heat-stressed male mice. Theriog; 2006; 66:2195-201. [ Links ]
17. Kairisalo M, Bonomoa A, Hyrskyluotoa A, Mudòb G, Belluardob N, Korhonena L, et al. Resverasor reduces oxidative stress and cell death and increases mitochondrial antioxidants and XIAP in PC6.3-cells. Neurosci Lett 2011; 488:263-6. [ Links ]
18. St-Pierre J, Drori S, Uldry M, Silvaggi JM, Rhee J, Jager S, et al. Suppression of reactive oxygen species and neurodegeneration by the PGC-1 transcriptional coactivators. Cell 2006, 127:397-408. [ Links ]
19. Pasko P, Barton H, Zagrodzki P, Chlopicka J, Izewska A, Gawlik M, et al. Effect of amaranth seeds in diet on oxidative status in plasma and selected tissues of high fructose-fed rats. Food Chem 2011; 126:85-90. [ Links ]
20. Patra RC, Swarup D. Effect of antioxidant ascorbic acid, l-methionine or a tocopherol alone or along with chelator on cardiac tissue of lead-treated rats. Veterinarski Arhiv 2004; 74:235-44. [ Links ]
21. Conner EM. Grisham M.B. Inflammation, Free Radicals, and Antioxidants. Nutrition 1996; 12: 274-7. [ Links ]
22. Woung WY, Thomas MGL, Merkus MWM, Zielhueis GA. Steegers-Theunissen RPM. Male factor subfertility: possible causes and the impact of nutritional factors. Fertil Steril 2000; 73: 435-42. [ Links ]
23. Saleh RA, Agarwal A. Oxidative stress and male infertility: from research bench to clinical practice. J Androl 2002; 23:737-52. [ Links ]
24. Holland MK, Storey BT. Oxygen metabolism of mammalian spermatozoa. Generation of hydrogen peroxide by rabbit epididimal spermatozoa. Biochem J 1981; 198:273-80. [ Links ]
25. Céspedes EM, Reyes A. Marcadores de estrés oxidativo en ratas senescentes. Rev Cubana Invest Bioméd 2007; 26(2). [ Links ]
26. Mora H, Ángela C, Aragón Diana M, Ospina G. Luis F. Caracterización del estrés oxidativo en ratas wistar diabéticas por estreptozotocina. Vitae 2009; 16:311-9. [ Links ]
27. Gil PV, Schäfer F, Machado T, Almeida MF, Ramos P, Krumberg A, et al. Oxidative stress in the brain of reproductive male rats during aging. Exp Gerontol 2011; 46:241-8. [ Links ]
28. Mourlon V, Naudon L, Giros B, Crumeyrolle Arias M, Daugé V. Early stress leads to effects on estrous cycle and differential responses to stress. Physiol Behav 2011; 102:304-10. [ Links ]
29. Wiersma P, Selman C, Speakman J, Verhulst S. Bird sacrifice oxidative protection for reproduction. Proc R Soc 2004; 271:360-3. [ Links ]
30. Dalla C, Antoniou K, Drossopoulou G, Xagoraris M, Kokras N, Sfikakis A, Daifoti Z. Chronic mild stress impact: Are females more vulnerable? Neuroscience 2005; 135:703-71. [ Links ]
31. Romero MH, Uribe-Velásquez LF, Sánchez JA. Biomarcadores de estrés como indicadores de bienestar animal en ganado de carne. Biosalud 2011; 10:71-87. [ Links ]














