Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biosalud
versión impresa ISSN 1657-9550
Biosalud vol.11 no.2 Manizales jul./dic. 2012
ANTIMYCOTIC SENSITIVITY OF DIFFERENT ISOLATED FUNGI SPECIES IN PATIENTS WITH THE ONYCHOMYCOSIS IN MANIZALES-CALDAS-COLOMBIA
Jorge Enrique Pérez-Cárdenas1
Ana María Hoyos Zuluaga2
Carolina Cárdenas Henao3
1 Profesor, Facultad de Ciencias para la Salud, Universidad de Caldas. Correo electrónico: labmicro@ucaldas.edu.co Correspondencia: Jorge Enrique Pérez Cárdenas, Profesor Titular Universidad de Caldas. Laboratorio Biosalud, oficina C103, Universidad de Caldas. Calle 65 No. 26-10, Manizales (Caldas, Colombia). Teléfono (576)8781500 ext. 12223.
2 Profesora, Facultad de Ciencias para la Salud, Universidad de Caldas. Correo electrónico: amhoyos64@hotmail.com
3 Dermatóloga, EPS Salud Total. Correo electrónico: carocarh@gmail.com
La micosis ungueal es la principal causa de lesión ungueal y afecta entre el 2,5 y el14% de la población; la elección del tratamiento se basa principalmente en la identificación del agente causal por cultivo; la enfermedad tiene una alta tasa de resistencia y recurrencia terapéutica definidas como falta de aclaramiento de al menos el 25% de la uña o al aislamiento del hongo, determinable solo hasta el final del tratamiento o meses después. La prueba de sensibilidad antifúngica no se ha establecido como un método rutinario de laboratorio, su implementación podría reducir los riesgos de toxicidad por medicamentos innecesariamente instaurados, elevar la tasa de respuesta al tratamiento, medir la tasa de resistencia de los hongos a los antifúngicos disponibles, utilizar antimicóticos frente a los cuales sí haya sensibilidad por parte del agente micótico y reducir costos de terapia. Objetivo: Determinar la sensibilidad in vitro de tres fármacos antifúngicos en los agentes etiológicos aislados de lesiones micóticas ungueales. Tipo de estudio: Descriptivo. Población de referencia: Adultos con diagnóstico clínico de micosis ungueal de la ciudad de Manizales (Caldas, Colombia) de quienes se aislaron diferentes especies de agentes micóticos. Materiales y Métodos: Para la realización de los ensayos con los antifúngicos se emplearon los métodos propuestos por el CLSI en los protocolos M27-A2 y M27-S3 para levaduras y el M38-A2 para hongos miceliales. Se hizo análisis estadístico mediante el programa SPSS, aplicando el test de Student para el análisis de frecuencias y pruebas no paramétricas para el análisis de los resultados obtenidos con los antifúngicos. Resultados obtenidos: Los dermatofitos (T. rubrum, T. mentagrophytes y T. tonsurans) mostraron mayor sensibilidad a terbinafina e itraconazol con MIC50 de 0,0156 ug/ml y 0,0625 ug/ml, respectivamente. Las levaduras y hongos miceliales no dermatofitos tuvieron elevadas concentraciones inhibitorias mínimas para los tres fármacos. La mayor tasa de resistencia in vitro (fluconazol 100%, terbinafina 25%, itraconazol 67%) se observó en el grupo de los hongos miceliales no dermatofitos (Fusarium spp., Penicillium spp., Helmintosporium spp., Aspergillus spp., Acremonium spp. y Scopulariopsis spp.). Conclusiones: Aunque no existen hasta la fecha puntos de corte aplicables a la práctica clínica, ni es clara la correlación de los resultados con el desenlace clínico, la estandarización del test de sensibilidad antifúngica in vitro abre la posibilidad de hacer comparaciones con otros estudios y vigilancia de resistencias emergentes.
Palabras clave: Dermatofitos, levaduras, Hongos no dermatofitos, Fluconazol, Itraconazol, Terbinafina, onicomicosis.
The onychomycosis is the main cause of nail injury and affects between 2.5 and 14% of the population; the election of treatment is based primarily on the identification of the causative agent by culture. The disease has a high rate of recurrence and therapeutic resistance defined by lack of clearance of at least 25% of the nail or the isolation of fungus, determinable only until the end of treatment or months later. Antifungal susceptibility testing has not been established as a routine laboratory method; its implementation could reduce the risk of drug toxicity by unnecessary administration, raise the rate of response to treatment, measure the rate of resistance of fungi to antifungal agents available, use of antifungal against which there is sensitivity by the mycotic agent and reduce costs. Objective: To determine the in vitro susceptibility of three antifungal drugs in etiologic agents isolated from fungal nail lesions. Study type: Descriptive. Reference population: Adults with a clinical diagnosis of nail mycosis in the city of Manizales, Caldas, Colombia from whom different species of mycotic agents were isolated. Materials and Methods: To perform tests with antifungal agents, the methods proposed by the CLSI in the M27-A2 and M27-S3 protocols for yeasts and M38-A2 for mycelial fungi were used. The statistical analysis was done using the SPSS program, applying Student's test for frequency analysis and non-parametric tests for the results obtained with antifungals. Results: The dermatophytes (T. rubrum, T. mentagrophytes and T. tonsurans) showed increased sensitivity to terbinafine and itraconazole with MIC50 of 0.0156 mg/ml and 0.0625 mg/ml respectively. Yeasts and no dermatophytes mycelial fungi had elevated MICs for all three drugs. The highest rate of resistance in vitro (fluconazole 100%, terbinafine 25%, itraconazole 67%) was observed in the group of non-dermatophyte filamentous fungi (Fusarium spp., Penicillium spp., Helminthosporium spp., Aspergillus spp., Scopulariopsis spp. and Acremonium spp.). Conclusions: Although to date breakpoints applicable to clinical practice do not exist and clear correlation of the results with the clinical outcome is not clear either, the standardization of the antifungal susceptibility test in vitro opens the possibility to make comparisons with other studies and surveillance of emerging resistance.
Key words: Dermatophytes, yeast, nodermatophytes molds, onychomycosis, itraconazole, terbinafine, fluconazole
La micosis ungueal constituye la principal causa de afección del aparato ungueal, es una infección causada con mayor frecuencia por hongos dermatofitos aunque también puede ser causada por levaduras y mohos (1, 2). Clínicamente se reconoce por la presencia de hiperqueratosis, detritos subungueales, engrosamiento y cambios de coloración de la placa, que progresa hasta la distrofia total de la uña en los casos más avanzados.
En general los antimicóticos sistémicos de uso más frecuente para la micosis ungueal son el fluconazol, la terbinafina y el itraconazol, con esquemas prolongados, riesgo de interacciones medicamentosas y elevados costos asociados, que dificultan la adherencia al tratamiento; en la mayoría de los casos el éxito obtenido con el tratamiento utilizado es bajo y esto puede deberse a múltiples factores dentro de los cuales se cuenta la resistencia de los hongos aislados a los medicamentos utilizados (3).
La efectividad de los antimicóticos se mide de acuerdo a los criterios para determinar si hay una cura clínica y/o una cura micológica; determinar la cura clínica es difícil ya que se basa en varios parámetros de evaluación asociados con anomalías clínicas en las uñas (4); hay una curación clínica cuando el 100% de las uñas afectadas se observan normales; se considera que hay una curación micológica cuando hay ausencia de estructuras micóticas a nivel microscópico y no desarrollo de crecimiento micótico en cultivo al cabo de un mes de incubación; este hallazgo se considera como el más importante ya que es difícil establecer cuándo se produce la cura clínica ya que muchas veces no se observan cambios importantes a nivel de las uñas luego del tratamiento (5, 6). El fluconazol, tiene como principal ventaja la dosificación semanal con regímenes entre 150 mg a 450 mg por semana durante 12 a 24 semanas. Pero aún con dosis altas, la tasa de curación en dermatofitos, no supera el 50% comparado con la terbinafina (p<0,0001) (7).
El itraconazol, es altamente lipofílico, penetra rápida y duraderamente la placa ungueal (se detecta en la parte distal de la uña a los 7 días de iniciado el tratamiento), es altamente activo contra dermatofitos, mohos y levaduras. A pesar de tener una tasa de cura micológica inferior a la terbinafina en dermatofitos, tiene un espectro más amplio que cubre incluso las levaduras, donde alcanza tasas del 92% (versus el 40% con terbinafina) (5, 8).
La terbinafina, es fungicida por bloqueo irreversible de la enzima escualeno epoxidasa de la membrana fúngica, tiene las más altas tasas de cura micológica en infecciones por dermatofitos (5, 8).
Las recurrencias no son raras, con predominio de la micosis ungueal de los pies en sujetos con persistencia de los factores de riesgo. La micosis ungueal de las manos puede responder mejor al tratamiento probablemente debido a la mayor tasa de crecimiento de la placa y mejor perfusión de las extremidades superiores. Existen datos emergentes que sugieren pobre respuesta e incluso cepas con resistencia a los agentes antifúngicos como aislamientos de T. rubrum resistentes a la terbinafina; los parámetros de éxito terapéutico varían según los autores, algunos lo han definido como el aclaramiento o mejoría del 90 al 100% de la uña, otros como la mejoría suficiente para reducir el área afectada a menos del 25% al final de la terapia, y otros lo definen como la cura micológica demostrada por laboratorio y al menos 5 mm de uña nueva y sin lesión clínica evidente (9).
En la predicción de la respuesta clínica no solo se debe tener en cuenta la concentración inhibitoria mínima, sino también la farmacocinética del medicamento el cual para el caso de la micosis ungueal puede estar en mayor o menor concentración que la encontrada a niveles plasmáticos; por ejemplo, los niveles de terbinafina, itraconazol y fluconazol en las uñas de las manos son menores que los encontrados en las uñas de los pies; estas diferencias están asociadas con la velocidad de crecimiento de la uña, con su grosor y con la composición de la misma; así mismo, se ha observado cómo los niveles de itraconazol y terbinafina son menores a los encontrados en plasma, mientras que los niveles de fluconazol son mayores; también, la permanencia de niveles altos del antimicótico luego de finalizado el tratamiento es otro factor importante que puede estar relacionado con la frecuencia de recaídas; de los tres antimicóticos se ha encontrado que el fluconazol puede permanecer por periodos más largos de tiempo y a concentraciones elevadas en la placa ungueal (10).
En Manizales esta afección es relativamente frecuente; estudios anteriores han mostrado una frecuencia del 19,7% con un predominio de los hongos dermatofitos (11); sin embargo, estudios posteriores han evidenciado disminución de los hongos dermatofitos con elevación de la frecuencia de hongos no dermatofitos y de diferentes especies de Candida (12); por otro lado, la experiencia clínica también ha demostrado que la tasa de remisión frente a los medicamentos suministrados es baja; por estas razones, se hace necesario determinar la frecuencia de la sensibilidad frente al itraconazol, fluconazol y terbinafina de los hongos dermatofitos, no dermatofitos y Candida aislados de una muestra de pacientes con enfermedad micótica ungueal.
Se realizó la prueba de sensibilidad antifúngica a 55 dermatofitos, 43 levaduras y 23 hongos miceliales no dermatofitos aislados de pacientes con enfermedad micótica ungueal, para fluconazol, terbinafina, e itraconazol; para ello, se diseñó un protocolo utilizando los métodos de referencia para la determinación de la sensibilidad a antimicóticos para levaduras y hongos miceliales propuesto por The Clinical and Laboratory Standards Institute (CLSI, por sus siglas en Inglés), métodos de referencia M27-A3 (13) y M27-S3 (14) y M38-A2 (15).
Las levaduras obtenidas se cultivaron en agar papa dextrosa (PDA) por 24 horas a 35ºC. El contenido de 5 colonias se colectó en solución salina estéril y se leyó la absorbancia a 530 nm ajustándola a la obtenida en el tubo 0,5 de McFarland, posteriormente se realizó una dilución 1:50 en RPMI 1640 (SIGMA®) y luego una dilución 1:20 en el mismo medio, para obtener una concentración final de 2,5x103 a 5x103 levaduras/ml.
Los hongos miceliales no dermatofitos se cultivaron en PDA por 48 horas a 35ºC; en caso de que el hongo aislado fuera Fusarium y no generara conidias se prolongó su incubación entre 20 a 25ºC por siete días; luego de obtener colonias con abundante esporulación, se agregó al cultivo 1 ml de solución salina estéril y se realizó frotis de la colonias con un aplicador de algodón; el material se recolectó en un tubo estéril y se dejó reposar por 3 a 5 minutos; el sobrenadante se transfirió a tubo estéril y se mezcló en vortex por 15 segundos, posteriormente se leyó la absorbancia a 530 nm ajustándola a valores que oscilaron entre 0,09 y 0,250, según el agente etiológico; luego de ajustada la absorbancia, se hizo una dilución 1:50 en RPMI 1640 (Sigma®), para obtener la concentración de las conidias en un rango entre 0,5x104 a 5x104 esporas x ml.
Para hongos dermatofitos se hizo cultivo en PDA a 30ºC por 4 a 5 días; en caso de no generarse esporulación se utilizó agar avena. Se agregaron 2 ml de solución salina estéril y se realizó frotamiento de las colonias con un aplicador de algodón. Las conidias desprendidas, se recolectaron en tubo estéril que se dejó reposar durante 10 minutos; el sobrenadante se transfirió a otro tubo estéril a partir del cual se hizo recuento de colonias en un hematocitómetro, ajustando la concentración de las mismas a un valor final de 1x103 a 3x103 células/ml.
Los antimicóticos utilizados: fluconazol (Sigma®), clorhidrato de terbinafina (Sigma®) e itraconazol (Sigma®) se diluyeron en dimetil sulfóxido o agua destilada estéril dependiendo de su solubilidad, preparando una solución madre de 1280 ug/ml; solución que sirvió para obtener las concentraciones finales desde los 64 ug/ml hasta los 0,0095 ug/ml. Dichas diluciones se hicieron en placas de 96 pozos estériles utilizando como diluyente y medio de cultivo el RPMI 1640 (SIGMA®) con L-glutamina, glucosa al 2%, y sin bicarbonato de sodio (Sigma ®), tamponado con ácido morfolinpropansulfónico (sigma ®) a una concentración de 0,165 M; 100 uL de cada dilución del antimicótico, se colocaron en contacto con 100 uL de la solución de conidias o blastoconidias. El periodo de incubación a 35ºC para levaduras fue de 24 a 48 horas; para hongos dermatofitos por 4 días y para hongos miceliales no dermatofitos el periodo de incubación varió entre 46 a 50 horas dependiendo de la velocidad de crecimiento de dicho hongo.
En cada ensayo se utilizó como control de crecimiento, el medio de cultivo con la respectiva suspensión de esporas; como control de esterilidad del medio se utilizó un pozo al cual se le agregó únicamente el medio de cultivo; como control de calidad se empleo Trichophyton rubrum cepa ATCC® MYA-4438 y Candida parasilopsis ATCC® 22019. Luego del tiempo de incubación se hizo la lectura comparando cada pozo con el control de crecimiento, considerando la concentración inhibitoria mínima cuando se observó mínimo un 80% de inhibición del crecimiento micótico en todos los casos. Se calculó la concentración inhibitoria mínima en la cual se obtuvo inhibición del 50% de los aislamientos y 90% de los aislamientos para determinar los MIC50 y MIC90, respectivamente.
Para la interpretación de los resultados no se han establecido a la fecha puntos de corte de sensibilidad y resistencia para las lesiones micóticas ungueales, así como no se ha determinado correlación entre la sensibilidad in vitro y el desenlace clínico. Para este estudio y con finalidades estadísticas, se tuvieron en cuenta las concentraciones de cada medicamento en la placa ungueal descritas previamente por Ghannoum et al. (7) así: fluconazol: 11,7 ug/ml, itraconazol: 0,93 ug/ml y terbinafina: 0,39 ug/ml, considerándose estas concentraciones como punto de corte para establecer la sensibilidad de los aislamientos.
Para la recolección de la información se elaboró una base de datos en Microsoft Excel para Windows versión 7. El análisis de los mismos se realizó en el programa SPSS (PAWS Statistics) 18 IBM inc. Chicago Il en español; para el análisis de los resultados obtenidos en las pruebas de sensibilidad antimicótica, se aplicó inicialmente una prueba de ANOVA a los resultados obtenidos, en el caso de que presentaran diferencias significativas, se aplicó la prueba de Kruskall-Wallis para confirmar diferencias entre las varianzas; en el caso de que estas presentaran significancia se realizó una prueba no paramétrica como la prueba de Tukey para determinar cuáles tratamientos presentaron estas diferencias.
Los dermatofitos evaluados mostraron menor sensibilidad al fluconazol y mayor sensibilidad al itraconazol, con MIC90 de 1 ug/ml. Trichophyton spp. presentó la MIC más alta para el fluconazol, mientras que Trichophyton tonsurans mostró la media geométrica más elevada con terbinafina e itraconazol; al hacer el análisis de ANOVA a este grupo con respecto a los antimicóticos, no se encontraron diferencias estadísticas significativas. Todos los resultados se resumen en la Tabla 1.
En el grupo de las levaduras, se observó menor sensibilidad en general a los tres medicamentos. Comparativamente C. albicans tuvo la menor sensibilidad al fluconazol y al itraconazol. Candida krusei tuvo la menor sensibilidad a la terbinafina; la menor concentración inhibitoria mínima para todas las levaduras se observó con itraconazol. Al aplicarse el análisis de ANOVA, se encontró significancia estadística entre las medias de las diferentes especies de levaduras analizadas frente a los tres medicamentos, sin embargo, al aplicárseles pruebas no paramétricas como Kruskall-Wallis y la prueba de Tukey solamente se encontró diferencias en el itraconazol entre C. krusei, G. candidum, C. tropicalis y C. albicans, demostrando la menor sensibilidad de C. albicans a este antimicótico con respecto a las otras especies analizadas.
En el grupo de los hongos miceliales no dermatofitos la menor sensibilidad se encontró con el fluconazol, solamente Scopulariopsis spp. presentó una sensibilidad mayor a los demás; Helmintosporium presentó menor sensibilidad a la terbinafina, mientras que Acremonium presentó la menor sensibilidad al itraconazol; en general, este grupo de hongos presentó mayor sensibilidad a la terbinafina. Para el análisis de varianza de este grupo debido al bajo número de especies diferentes a Fusarium, se formaron dos grupos en los que se comparó a Fusarium con el resto de los hongos miceliales no dermatofitos aislados; 13 de los 14 aislamientos obtenidos de Fusarium presentaron resistencia a los tres antimicóticos, mientras que 3 de 9 los aislamientos de hongos diferentes a Fusarium (Aspergillus spp., Penicillium spp. y Scopulariopsis spp.) presentaron este tipo de multirresistencia. Al aplicársele el test de ANOVA a los resultados obtenidos, se encontraron diferencias estadísticas solamente frente al itraconazol, resultados que se confirmaron con la prueba de Kruskall-Wallis y la prueba de Tukey, confirmándose de esta manera la menor sensibilidad de Fusarium frente al itraconazol con respecto al grupo de los otros hongos no dermatofitos (Tabla 1).
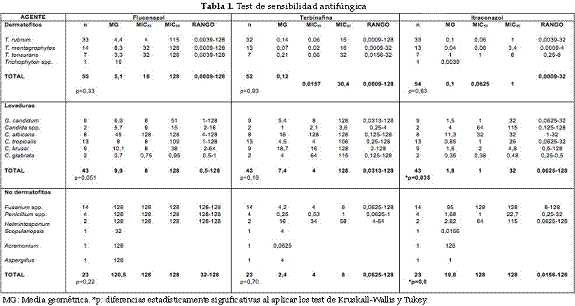
Debido a que no se han establecido puntos de corte de sensibilidad y resistencia de los hongos dermatofitos, hongos miceliales no dermatofitos y levaduras en las uñas, se clasificaron los hongos a los que se les realizó las pruebas de sensibilidad como sensibles o resistentes de acuerdo a la concentración de los diferentes antimicóticos en la placa ungueal descritos en Materiales y Métodos (Tabla 2).
De acuerdo a la clasificación antes realizada, al hacer el análisis estadístico se encontraron diferencias estadísticamente significativas para todos los antimicóticos (valores de p=0,000). Para el fluconazol, los dermatofitos mostraron sensibilidad en el 47% de los aislamientos; el mayor porcentaje de resistencia ocurrió con Trichophyton mentagrophytes (58% de los aislamientos probados); las levaduras presentaron un porcentaje de aislamientos sensibles mayor que el de los dermatofitos aun cuando C. albicans solo presentó MICs por debajo de los límites de sensibilidad en dos de sus aislamientos; con respecto a los no dermatofitos se observan valores muy altos de la MIC para este antimicótico (Tabla 2).
Para la terbinafina hubo sensibilidad en el 63% de los dermatofitos; el mayor porcentaje de resistencia ocurrió con Trichophyton rubrum (49%); las levaduras presentaron un porcentaje de aislamientos resistentes muy alto encontrándose a C. albicans, C. tropicalis y C. krusei con el mayor número de cepas resistentes (6 de 8 aislamientos de C. albicans, 10 de los 13 aislamientos de C. tropicalis y todos los de C. krusei); con respecto al comportamiento de los no dermatofitos, se observó también una alta frecuencia de cepas con valores altos de la MIC, siendo Fusarium el que presentó el mayor número de aislamientos resistentes (13 de 14) (Tabla 2).
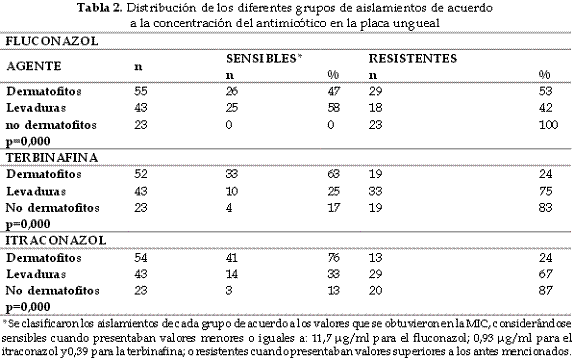
Con el itraconazol se observó sensibilidad en el 76% de los aislamientos de los dermatofitos, T. tonsurans fue el que presentó un mayor porcentaje de resistencia (57%); en cuanto a las levaduras se presentó también una resistencia alta pero menor a la observada con la terbinafina, las especies que presentaron mayor resistencia fueron C. albicans (todos los aislamientos), C. krusei (7 de 9 aislamientos) y C. tropicalis (7 de 13 aislamientos); para el caso de los hongos miceliales no dermatofitos también se encontraron altos niveles de resistencia, nuevamente Fusarium presentó todos los aislamientos con resistencia a este antimicótico.
De los 122 aislamientos a los que se les realizó las pruebas de sensibilidad, se encontraron 19 (15,7%) con sensibilidad a los tres antimicóticos, 36 (29,5%) a dos antimicóticos, 31 (25,4%) a un antimicótico; el grupo de los dermatofitos fue el que presentó el mayor número de cepas con sensibilidad a cada uno de los antimicóticos, presentando significancia estadística para la sensibilidad a los tres y a dos antimicóticos (p=0,04 y p<0,01) respectivamente; 36 cepas (29,5%) fueron resistentes a los tres antimicóticos, el grupo de las levaduras fue el que presentó un mayor número de aislamientos (p=0,04) seguido de los hongos miceliales no dermatofitos (p<0,01); la distribución por especies se observa en la Tabla 3.

Un número importante de pacientes que presentan micosis ungueal al ser tratados con itraconazol, fluconazol o terbinafina presentan una pobre o nula respuesta al tratamiento; evidencia de ello es el tiempo que las personas involucradas tienen con la enfermedad que puede estar asociada no solo con la poca preocupación que dichas lesiones les causan, sino también con el uso de diferentes esquemas de tratamiento poco efectivos.
La guía para la realización del test de sensibilidad antifúngica para hongos miceliales, publicada por CLSI en 2008 propone un método estándar para la evaluación de la sensibilidad in vitro de los hongos miceliales no dermatofitos y dermatofitos (15). Para establecer la reproducibilidad se realizaron estudios en los que se comparó la sensibilidad de dermatofitos de referencia a diferentes medicamentos antifúngicos, estudiada por seis laboratorios independientes; como resultado de estos estudios se obtuvieron los rangos de sensibilidad aceptables para el control de calidad del test (16, 17). No se ha establecido correlación entre la sensibilidad in vitro y la respuesta clínica, así como no se han publicado puntos de corte interpretativos que puedan orientar al clínico sobre la resistencia o sensibilidad de un hongo a determinado medicamento; aun cuando los MICs no predicen la respuesta clínica, la presencia de microorganismos resistentes puede ser un factor indicador de falla en el tratamiento instaurado (18).
Es claro que en la respuesta clínica al tratamiento interactúan diferentes factores, no solo relacionados con la sensibilidad del agente infeccioso al medicamento, como la farmacodinamia del mismo, las características de inmunidad del huésped, entre otros (19). Ghannoum et al. en el año 2000 describen en relación con la sensibilidad conjunta de los dermatofitos al fluconazol un rango de MIC entre 0,125-32 (media de 2,77 ug/ml y MIC50 de 1 ug/ml, MIC90 de 4 ug/ml). Si bien mencionan que T. mentagrophytes tuvo MICs elevados, consideran adecuados los rangos de sensibilidad de los dermatofitos al fluconazol (7). Por otro lado Karaca y Koç en 2004, describen un rango de sensibilidad de 50 cepas de T. rubrum entre <0,06->32 ug/ml (MIC50: 4 ug/ml, MIC90: 32 ug/ml) y un rango en T. mentagrophytes de 16-32 ug/ml (MIC50: 32 ug/ml), identificando MICs más elevadas y aparente menor sensibilidad de los dermatofitos al fluconazol (20). Estos hallazgos son concordantes con los identificados en este estudio. En el estudio de Silva Barros y Soares Hamdan en 2005, se evalúa solo a T. mentagrophytes y se encuentra un rango alto de 4-64 ug/ml, con MICs en más del 80% de los casos entre 32 y 64 ug/ml para fluconazol (21). En general, se observa una marcada tendencia a encontrar una sensibilidad a concentraciones altas del fluconazol en los dermatofitos de este estudio.
La terbinafina es un medicamento considerado como una excelente herramienta contra los dermatofitos tanto por su sensibilidad in vitro como por la respuesta clínica demostrada. El estudio de Ghannoum et al. reportó un rango <0,001-0,004 ug/ml (media de 0,012 y MIC90: 0,002 ug/ml) (7), concentraciones coherentes con las identificadas en los estudios publicados por Karaca y Koç (20) y Silva Barros y Soares Hamdan (21). El estudio publicado por Carrillo et al. en 2008, realizado específicamente con terbinafina, muestra rangos de sensibilidad in vitro con MIC50 de 0,01ug/ml y MIC90 de 0,06 ug/ml (22). Contrasta con estos resultados la identificación en este estudio de medias geométricas en todos los dermatofitos por encima de 0,07 ug/ml, con MIC50 de 0,0156 y MIC90 de 30,4 ug/ml, mostrando una tendencia de este grupo de hongos a tener una menor sensibilidad in vitro a este medicamento. Estudios relacionados con la farmacodinamia de la terbinafina han demostrado que con una dosis de 250 mg/día, se alcanzan niveles ungueales de 0,5 a 1,5 ug/g (23, 24); según el dato anterior, es de esperarse que la probabilidad de éxito clínico con este antimicótico en Manizales sea de al menos el 50% de acuerdo a los resultados obtenidos en el MIC50; sin embargo, al determinar el porcentaje de dermatofitos que presentaron concentraciones inhibitorias mínimas menores o iguales a la concentración ungueal del antimicótico, se observa que este rango de valores se encuentra en el 63% de las muestras.
La sensibilidad in vitro de los dermatofitos al itraconazol en el estudio de Ghannoum et al., reporta un rango de MIC entre <0,06-1 ug/ml, media de 0,104 ug/ml y donde el 90% de los aislamientos respondieron a dosis menores o iguales a 0,125 ug/ml (MIC90) (7). Más recientemente Bueno et al. publican un estudio realizado en Colombia describiendo un rango de 0,006-1 ug/ml para T. rubrum, MIC50 de 0,25 y MIC90 de 0,5 ug/ml con este medicamento (25); encontrándose valores elevados del MIC90 con relación al primero. Este estudio muestra cómo el 76% de los aislamientos fueron sensibles al itraconazol; sin embargo, se encontraron valores del MIC de hasta 32 ug/ml, asociados con T. rubrum; estos resultados indican que a pesar de que se presenta resistencia a este micótico en esta región, puede seguir siendo una muy buena alternativa para el tratamiento de la micosis ungueal relacionada con los dermatofitos.
Un sesgo probable para el hallazgo de sensibilidades a los antimicóticos probados a concentraciones más elevadas en el estudio, puede ser causado por la inclusión de casos expuestos al fluconazol con anterioridad y una posible selección de casos con resistencia establecida.
El menor porcentaje de cepas de dermatofitos sensibles al fluconazol comparado con el itraconazol y la terbinafina, corroboran lo encontrado en otros estudios que han mostrado la poca efectividad de este medicamento en el tratamiento de la micosis ungueal; lo cual además está directamente asociado con los niveles de fluconazol encontrados en las uñas luego de 7 días que son de 7,1 ug/ml, cuando se administra una dosis de 150 mg/día (26); valores que para este estudio están muy por debajo del promedio de la concentración inhibitoria mínima para este antimicótico (36,6 ug/ml).
La infección por Candida del aparato ungueal tiene un amplio espectro de manifestaciones clínicas como paroniquia, onicolisis, granuloma candidiásico o distrofia total (27); la frecuencia de las infecciones por levaduras en la micosis ungueal se ha elevado y se ha observado emergencia de Candida no-albicans dentro de los agentes causales. El origen de esta tendencia se ha explicado por factores como el aumento de trastornos relacionados con inmunosupresión o por el uso indiscriminado del fluconazol, que selecciona especies como C. glabrata y C. krusei con resistencia conocida. La infección ungueal por Cándida puede funcionar como reservorio o foco de diseminación (28).
Los estudios de sensibilidad in vitro de levaduras, derivan muy frecuentemente de cepas aisladas de pacientes con infecciones sistémicas o de mucosa oral, existen escasos reportes asociados con micosis ungueal. En el estudio de Bueno et al. en 2009 realizado en micosis ungueal, las levaduras más frecuentemente aisladas fueron C. parapsilosis, C. albicans y C. guillermondi, seguidas en menor número por C. tropicalis, C. famata, C. lusitanie y C. rugosa; para C. albicans describen un rango de sensibilidad al fluconazol entre 0,125 y 4 ug/ml; con itraconazol de 0,031 a 0,5 ug/ml y con terbinafina el rango es de 0,016-4 ug/ml (25); mostrando un perfil de sensibilidad in vitro adecuado de esta especie a los tres medicamentos y muy superior al identificado en este estudio, en el que se encuentra que las ocho cepas de Candida albicans tuvieron un rango de sensibilidad al fluconazol entre 4 y 64 ug/ml, MIC50 y MIC90 de 64 ug/ml y con una media geométrica de 45 ug/ml. En cuanto a la sensibilidad in vitro de las levaduras con la terbinafina, Gupta, Ryder y Summerbell en el año 2003 publican un estudio de sensibilidad in vitro de dermatofitos y no dermatofitos a ketoconazol, ciclopirox, terbinafina e itraconazol; los rangos de MIC para terbinafina de C. albicans, C. glabrata, C. tropicalis y C. krusei fueron hasta de 2 ug/ml; en general reportan una MIC50 de 0,18 ug/ml para itraconazol y de 1,77 ug/ml para la terbinafina (29), mostrando en cualquier caso, menores MICs y mejores niveles de actividad de los antimicóticos que los identificados en este estudio. Garg et al. de 25 aislamientos obtenidos de orina, sangre y otras secreciones, comparan la respuesta a la terbinafina por el método de sensibilidad antifúngica de macrodilución y describen para C. tropicalis MICs entre 1-2 ug/ml, para C. krusei de 1-4 ug/ml, para C. albicans 2-4 ug/ml y para C. glabrata 0,031-4 ug/ml (30). Todos los rangos, muestran más sensibilidad que los registrados en este estudio, pero las características disimiles del método y el número de aislamientos, no permiten establecer comparaciones.
Recientemente un estudio publicado por Kiraz et al. sobre 50 cepas de C. glabrata, obtenidas de distintas secreciones y utilizando el mismo método de sensibilidad antifúngica in vitro, identificaron resistencia al fluconazol con MICs ≥64 ug/ml en un 22% de los casos y al itraconazol con MIC ≥1 ug/ml en un 36% (31); aunque el número de cepas de C. glabrata en el presente estudio fue baja, el grado de sensibilidad al fluconazol e itraconazol de dichas cepas fue alto, contrario a lo que otros autores han descrito con respecto a esta especie (32, 33).
El porcentaje de resistencia de las levaduras en este estudio fue de 42% al fluconazol, de 75% a la terbinafina y de 67% al itraconazol, asociados con el alto número de aislamientos de C. albicans, C. tropicalis y C. krusei que mostraron MICs por encima del rango de sensibilidad; es sabido que C. krusei puede presentar resistencia primaria a los triazoles, mientras que en C. tropicalis usualmente se genera una resistencia adquirida (32); la inclusión de pacientes con tratamientos previos de la micosis ungueal podría explicar el alto porcentaje de cepas de Candida resistentes a la terbinafina y al itraconazol, así como también la alta resistencia que C. albicans, C. tropicalis y C. krusei presentan a los tres antimicóticos ensayados.
Algunos autores han descrito que la resistencia de las levaduras al fluconazol debe traer como consecuencia la resistencia al itraconazol (33); en el presente estudio esta afirmación se confirma al encontrar MICs90 de 64 ug/ml para el fluconazol y MICs90 mayores de 1 ug/ml para el itraconazol en los aislamientos de C. albicans, mientras que en los aislamientos de C. tropicalis y C. krusei, se observan MICs entre 38 y 57 ug/ml para el fluconazol frente a MICs90 mayores de 1 ug/ml para el itraconazol.
La emergencia de infecciones por hongos no dermatofitos en la micosis ungueal se ha asociado principalmente a Neoscitalydium, Scopulariopsis, Aspergillus, Fusarium y Acremonium. Aunque estas infecciones se han asociado en principio a pacientes con importante inmunosupresión, principalmente por VIH, con porcentajes tan altos como del 31,6%, tal relación no ha sido aparente en todos los estudios de micosis ungueal por hongos miceliales no dermatofitos (34).
En este estudio predominó el aislamiento de Fusarium spp., lo cual representa un desafío en la práctica clínica, pues es conocida su resistencia a la mayoría de los agentes antifúngicos (35). En el estudio colombiano de Castro et al. en 2008, se identificaron 128 especies de Fusarium (F. solani, F. oxysporum y F. verticilloides) en pacientes con micosis ungueal, en su mayoría tratados con fluconazol, ketoconazol, terbinafina e itraconazol. En dicho estudio se encontró un porcentaje de resistencia de 29,8%; tales resultados son alentadores frente a otros reportes con el mismo medicamento que han identificado resistencia in vitro de hasta el 50% (36). En el estudio de Bueno et al., reportan rangos de MIC entre 4-64 ug/ml para fluconazol en F. dimidiatum y de 64 ug/ml para F. oxysporum y F. solani; con itraconazol los rangos para estas dos últimas especies fueron de 0,03-16 y de 16 ug/ml, respectivamente. De manera llamativa los rangos fueron inferiores con terbinafina para F. dimidiatum 0,03-0,5 ug/ml y F. oxysporum 0,25-16 ug/ml (25); de forma similar a lo identificado en este estudio, lo que sugiere la posibilidad de emplear este medicamento en el tratamiento de este tipo de hongos en Manizales.
La baja sensibilidad de las levaduras y de los hongos miceliales no dermatofitos en especial al fluconazol y al itraconazol, puede estar influenciando de manera importante el cambio del perfil microbiológico de las infecciones micóticas en las uñas; es posible que en la mayoría de los casos las lesiones inicialmente sean generadas por un dermatofito que produce cambios en la placa ungueal, que posteriormente pueden ser aprovechados por hongos con bajo potencial de invasión, generando más cambios degenerativos asociados con el proceso inflamatorio mantenido por los productos de los hongos o por sus procesos invasivos; Evans propone que esto puede ser posible al encontrar coexistencia de Scopulariopsis con dermatofitos y observar que esta coinfección puede retardar la efectividad del antimicótico suministrado (37).
Llama la atención la alta tasa de resistencia al itraconazol en las levaduras, ya que es de esperarse mayor tasa de resistencia al fluconazol por el uso indiscriminado de este medicamento en el tratamiento de diferentes tipos de candidiasis; además, algunos estudios han afirmado que cuando hay resistencia a cualquiera de los triazoles, esta resistencia se presenta en todas las moléculas asociadas con estas características químicas; en este estudio se observa que aunque hay una resistencia alta al fluconazol (23,9%) algunas de las levaduras aisladas a pesar de ser resistentes al itraconazol son sensibles al fluconazol; este hallazgo puede estar indicando además, diferencias en los mecanismos de resistencia de las levaduras a ambos medicamentos.
La implementación de estudios de sensibilidad in vitro de forma estandarizada no solo ofrece al clínico la oportunidad de conocer el perfil de sensibilidad de determinado hongo a los medicamentos disponibles, sino que también permite estudios de identificación de especies resistentes a medicamentos específicos así como la emergencia de nuevas resistencias. Es pertinente entonces, realizar estudios a largo plazo no solo en condiciones clínicas de urgencia, sino también en condiciones crónicas como la micosis ungueal.
1. Schlefman B. Onychomycosis: A compendium of facts and a clinical experience. The Journal of Foot & Ankle Surgery 1999; 38:290-302. [ Links ]
2. Nunley KS, Cornelius L. Current management of onychomycosis. Journal of Hand Surg 2008; 33A:1211-1214. [ Links ]
3. Gupta AK, Albreski D. The use of the new oral antifungal agents, Itraconazole, Terbinafine, and Fluconazole, to treat onychomycosis and other dermatomycoses. Current Problems in Dermatology 2001; 13:213-48. [ Links ]
4. Cordeiro RA, Brilhante RS, Rocha MF, Rabenhorsch SH, Moreira JL, Grangeiro TB, Sidrim JJ. Antifungal susceptibility and genetic similarity of sequential isolates of Trichophyton rubrum from an immunocompetent patient with chronic dermatophytosis. Clinical Experimental Dermatology 2006; 31:122-24. [ Links ]
5. Roberts DT, Taylor WS, Boyle J. Guidelines for treatment of onychomycosis. British Journal of Dermatology 2003; 148:402-410. [ Links ]
6. Darkes MJM, Scott LJ, Goa KI. Terbinafine. A review of its use in onychomycosis in adults. American Journal of Dermatology 2003; 4:39-65. [ Links ]
7. Ghannoum MA, Hajjeh RA, Scher R, Konnikov N, Gupta AK, Summerbell R, et al. A large-scale North American study of fungal isolates from nails: The frequency of onychomycosis, fungal distribution, and antifungal susceptibility patterns. Journal of American Academy of Dermatology 2000; 43: 641-8. [ Links ]
8. Isaza C, Isaza G, Fuentes J, Marulanda T. Antimicóticos. En: Isaza C, Isaza G, Fuentes J, Marulanda T, editores. Fundamentos de farmacología en terapeútica. Pereira, Colombia: Postergraph; 2002. p. 459-466. [ Links ]
9. Masis CM, Gutiérrez RF. Antifungal drug resistance to azoles and polyenes. Lancet infections diseases, 2002; 2:550-63. [ Links ]
10. Debruyne D, Coquerel A. Pharmacokinetics of antifungal agents in onychomycoses. Clinical Pharmacokinetics 2001; 40:441-472. [ Links ]
11. Buitrago GE. Dermatomicosis en población de Manizales. Biomédica 1994; 14:77-84. [ Links ]
12. Pérez JE, Cárdenas C, Hoyos AM. Características clínicas, epidemiológicas y microbiológicas de la onicomicosis en un laboratorio de referencia, Manizales (Caldas), 2009. Infectio 2011; 15:168-176. [ Links ]
13. Clinical and Laboratory Standards Institute. Reference Method for broth dilution antifungal susceptibility testing of yeast; approved Standard-third edition, 2008a. M27-A3. Vol. 28, No. 14. [ Links ]
14. Clinical and laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeast; Third informational Supplement, 2008b. M27-S3. Vol. 28, No. 15. [ Links ]
15. Clinical and laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi; Approved Standard-Second edition, 2008c. M38-A2. Vol. 28, No. 16. [ Links ]
16. Ghannoum MA, Chaturvedi V, Espinel-Ingroff A, Pfaller MA, Rinaldi MG, Lee-Yang W, et al. Intra- and Interlaboratory Study of a Method for Testing the Antifungal Susceptibilities of Dermatophytes. Journal of Clinical Microbiology 2004; 42:2977-2979. [ Links ]
17. Ghannoum MA, Arthington-Skaggs B, Chaturvedi V, Espinel-Ingroff A, Pfaller MA, Rennie R, et al. Interlaboratory Study of Quality Control Isolates for a Broth Microdilution Method (Modified CLSI M38-A) for Testing Susceptibilities of Dermatophytes to Antifungals. Journal of Clinical Microbiology 2006; 44:4353-4356. [ Links ]
18. Rodríguez-Tudela JL, Alcázar-Fouli L, Cuesta I, Alastruey-Izquierdo A, Monzón A, Mellado E, et al. Clinical relevance of resistance of antifungals. International Journal of Antimicrobial Agents 2008; 32:S111-S113. [ Links ]
19. Liao R, Dunne WM. Current concepts in antifungal susceptibility testing. Part I. Clinical Microbiology Newsletter 2003; 25:177-181. [ Links ]
20. Karaca N, Koç N. In vitro susceptibility testing of dermatophytes: comparison of disk diffusion and reference broth dilution methods. Diagnostic Microbiology and Infectious Disease 2004; 48:259-264. [ Links ]
21. Silva Barros ME, Soares Hamdan J. Determination of susceptibility-resistance to antifungal drugs of Trichophyton mentagrophytes isolates by a macrodilution method. Canadian Journal of Microbiology 2005; 51:983-987. [ Links ]
22. Carrillo AJ, Guisiano G, Cárdenes D, Hernández JM, Eraso E, Quindós G, et al. Terbinafine susceptibility patterns for onychomycosis-causative dermatophytes and Scopulariopsis brevicaulis. International Journal of Antimicrobial Agents 2008; 31:540-543. [ Links ]
23. Faergemann J, Zehender H, Denouel J, Millerioux L. Levels of terbinafine in plasma, stratum corneum, dermis-epidermis (without stratum corneum), sebum, hair and nails during and after 250 mg terbinafine orally once per day for four weeks. Acta Dermato-Venereologica 1993; 73:205-209. [ Links ]
24. Schatz FF, Bräutigam MM, Dobrowolski EE, Effendy II, Haberl HH, Mensing HH, et al. Nail incorporation kinetics of terbinafine in onychomycosis patients. Clinical and Experimental Dermatology 1995; 20:377-383. [ Links ]
25. Bueno JG, Martínez C, Zapata B, Sanclemente G, Gallego M, Mesa C. In vitro activity of fluconazole, itraconazole, voriconazole and terbinafine against fungi causing onychomycosis. Clinical and Experimental Dermatology 2009; 35:658-663. [ Links ]
26. Carrillo-Muñoz AJ, Giusiano G, Guarro J, Quindós G, Guardia C, del Valle O, et al. In vitro activity of voriconazole against dermatophytes, Scopulariopsis brevicaulis and other opportunistic fungi as agents of onychomycosis. International Journal of Antimicrobial Agents 2007; 30:157-161. [ Links ]
27. Elewski BE. Onychomycosis: pathogenesis, diagnosis and management. Clinical Microbiology Reviews 1998; 11:415-429. [ Links ]
28. Bassetti M, Righi E, Costa A, Fasce R, Molinari MP, Rosso R, et al. Epidemiological trends in nosocomial candidemia in intensive care. BMC Infect Diseases 2006; 6:21. [ Links ]
29. Gupta AK, Ryder JE, Summerbell RC. The diagnosis of nondermatophyte mold onychomycosis. International Journal of Dermatology 2003; 42:272-273. [ Links ]
30. Garg S, Naidu J, Singh SM, Nawange SR, Jharia N, Saxena M. In vitro activity of terbinafine against Indian clinical isolates of Candida albicans and non-albicans using a macrodilution method. Journal de Mycologie Médicale 2006; 16:119-125. [ Links ]
31. Kiraz N, Dag I, Oz Y, Yamac M, Kiremitci A, Kasifoglu, N. Correlation between broth microdilution and disk diffusion methods for antifungal susceptibility testing of caspofungin, voriconazole, amphotericin B, itraconazole and fluconazole against Candida glabrata. Journal of Microbiological Methods 2010; 82:136-140. [ Links ]
32. Krcmery V, Barnes AJ. Non-albicans Candida spp. Causing fungaemia: pathogenicity and antifungal resistance. Journal of Hospital Infection 2002; 50:243-260. [ Links ]
33. Rogers TR. Antifungal drug resistance: limited data, dramatic impact? International Journal of Antimicrobial Agents 2006; 27S:S7-S11. [ Links ]
34. Moreno G, Arenas R. Other fungi causing Onychomycosis. Clinics in Dermatology 2010; 28:160-163. [ Links ]
35. Malani AN, Kauffman CA. Changing epidemiology of Rare mould infections. Implications for Therapy. Drugs 2007; 67:1803-1812. [ Links ]
36. Castro N, Casas C, Sopo L, Del Portillo P, Cepero MC, Restrepo S. Fusarium species detected in onychomycosis in Colombia. Mycoses 2008; 12:350-356. [ Links ]
37. Evans EGV. Causative pathogens in onychomycosis and the possibility of treatment resistance: A review. J Am Acad Dermatol 1998; 38:S32-6. [ Links ]













