Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biosalud
versión impresa ISSN 1657-9550
Biosalud vol.13 no.1 Manizales ene./jun. 2014
ANALYSIS OF THE CANINE ABCB1-1▲ MUTATION AND ITS THERAPEUTIC AND TOXICOLOGICAL IMPLICATIONS
Ricardo Andrés Correa-Salgado1
Eduardo Castaño2
1 M.V.Z, MSc (c), Departamento de Salud Animal, Farmacología y Toxicología Veterinaria, Facultad de Ciencias Agropecuarias, Universidad de Caldas, Calle 65 # 26-10, Manizales, Colombia, correo electrónico: ricardo.correa@ucaldas.edu.co.
2 Ph.D, Departamento de Ciencias Básicas para la Salud, Laboratorio de Biología Molecular y Genética. Universidad de Caldas.
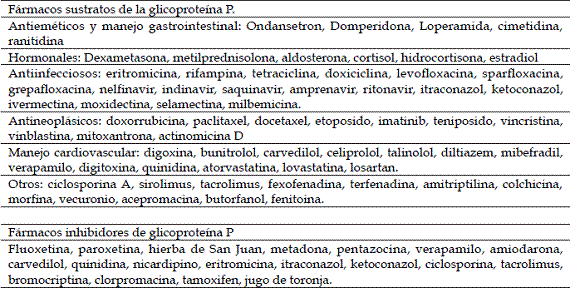
Se analizó la literatura científica de los últimos 10 años en las bases de datos BBCS-LILACS, Fuente Académica, IB-PsycINFO, IB-SSCI, IB-SciELO, SCOPUS y SCIRUS, estudiando las implicaciones terapéuticas de la mutación del gen ABCB1 en perros; esta mutación que consiste en la deleción de 4 pares de bases que provocan un codón de terminación prematuro, es la responsable de la ausencia de la glicoproteína P en la barrera hematoencefálica, la carencia de esta glicoproteína priva al cerebro de la protección de una bomba de eflujo frente a múltiples xenobióticos. Además, se describen los cambios farmacocinéticos y las intoxicaciones medicamentosas resultantes de esta mutación y se presenta una lista, extraída de los distintos estudios, donde se copilan algunos fármacos sustratos para la glicoproteína P y los medicamentos que pueden inhibir dicha glicoproteína, todos ellos capaces de inducir severos efectos adversos en los perros con dicha mutación.
Palabras clave: farmacogenética, gen ABCB1, ivermectina, mutación, perros.
ABSTRACTWe conducted a review of the results of the studies of the last ten years from the data bases BBCS-LILACS, IB- PsycINFO, IB-SSCI, IB.SciELO, SCOPUS and SCIRUS, about the therapeutic implications of the gene mutation ABCB1 in dogs. This mutation is responsible for the absence of the glycoprotein P in the blood-brain barrier, depriving the brain of an efflux pump to protect against various xenobiotics. Furthermore, we described the pharmacokinetic changes and drug poisoning resulting from this mutation. We also present a list of drug substrates for the glycoprotein P and the medications that can inhibit said glycoprotein, all of them capable of inducing severe side effects in dogs with the mutation.
Key words: pharmacogenetics, gene ABCB1, ivermectin, mutation, dogs.
En el año de 1976, Juliano y Ling demostraron que las células de ovario de hámster chino (células CHO) eran resistentes a los efectos de la Colchicina, ya que dichas células expresan una proteína de 170-kDa que funciona como una bomba de eflujo que expulsa el medicamento desde la membrana plasmática. A esta proteína que altera la Permeabilidad la denominaron Glicoproteína P (GpP) (1). Está es una proteína de 1280 aminoácidos con seis dominios transmembrana y con dos sitios de unión a ATP que le dan energía para exportar sustancias (2). La GpP transporta una variedad de sustratos, la mayoría de ellos de más de 400-Da, básicos y con anillos aromáticos, aunque estas no son características obligadas. Sin embargo, todas son sustancias hidrofóbicas y anfipáticas (2, 3).
En 1987, Ueda et al. descubrió que las células cancerosas que se volvían resistentes a los efectos de los medicamentos quimioterapéuticos, tenían un incremento en la expresión de la GpP y que este fenómeno se daba por el aumento de la transcripción de un gen al que denomino Gen de resistencia a múltiples fármacos (MDR1, de las siglas en inglés de multidrug resistance) (4). Este descubrimiento desencadenó una gran cantidad de investigaciones que demostraron que las cantidades de GpP se incrementaban tras la exposición a variados medicamentos, pero que en condiciones fisiológicas era normal hallarla en altas concentraciones en varios tejidos y órganos.
La GpP se encuentra en la membrana apical de los enterocítos (2), donde actúa conjuntamente con un grupo enzimático de los citocromos, el CYP3A4, previniendo la entrada de xenobióticos desde la luz intestinal hacia el torrente circulatorio y además extraen sustancias desde la sangre y las envían a la luz del tracto digestivo (5). Adicionalmente, tenemos GpP en la membrana de las células canaliculares biliares y en las células epiteliales tubulares proximales del riñón, donde se encarga de la excreción de xenobióticos y metabolítos hacia la bilis o la orina respectivamente (2, 6); otros sitios donde está presente la GpP son las adrenales, los ductos pancreáticos (6), en linfocitos (5), en la barrera hematotesticular (3) y en gran cantidad en la barrera hematoencefálica, a nivel de las células de los capilares cerebrales, evitando allí el ingreso de sustancias potencialmente dañinas para el tejido nervioso (2, 7, 8). Se expresa también en la placenta, impidiendo el ingreso de xenobióticos al feto; sin embargo, en esta ubicación, la cantidad de GpP depende básicamente de la expresión genética del feto y no de la madre (9).
Como parte de las investigaciones sobre la GpP, se modificaron ratones a los que se les anulaba el gen MDR1 y, por ende, no producían GpP (ratones Knockout MDR1 -/-), estos ratones no presentaban alteraciones fisiológicas ni reproductivas (2), sin embargo, la modificación genética los hacía más sensibles a ciertos fármacos, descubrimiento hecho por casualidad, al tratar una infestación por piojos con ivermectina y provocando la muerte de todos los ratones MDR1 -/- tratados, a pesar de usar las dosis recomendadas para dicha especie. Por otro lado, también se descubrió que era la GpP la responsable de evitar el ingreso de antirretrovirales al encéfalo, el testículo y los linfocitos, considerados estos como santuarios para la sobrevivencia del VIH (3). Posteriormente, la investigación sobre GpP entro en receso al descubrir que no solo la GpP, sino que muchos otros transportadores de membrana de la familia ABC estaban involucrados en la resistencia a fármacos (5).
Los transportadores ABC (ATP binding cassette) comprenden una superfamilia de transportadores dependientes de ATP que integran la membrana celular; se encuentran en múltiples tejidos e incluso en bacterias y hongos, cumpliendo importantes funciones de transporte de productos metabólicos, lípidos y esteroles a través de la membrana.
Se conocen 49 transportadores en humanos, divididos en 7 subfamilias (ABCA hasta ABCG) y una variedad de patologías asociadas a su mal funcionamiento (10), como predisposición a tumores renales, enfermedad de Parkinson, cáncer mamario, enfermedad inflamatoria intestinal y colitis ulcerativa (3, 11). Muchos de estos transportadores son sustrato selectivos y otros son menos específicos, principalmente los que responden a xenobióticos (ABCB1, C1, C2, C4 y G2) (10).
En 2005 Dean recomendó sustituir el nombre MDR1 e incluirlo en la nomenclatura de los transportadores ABC, refiriéndose a este como ABCB1 (12, 13). El gen ABCB1 codifica la GpP y junto con ABCC1 y ABCG2 son los responsables del desarrollo de resistencia a los fármacos contra el cáncer (10). En ratones, son dos los genes responsables de la producción de GpP, el MDR1 y el MDR2, así como aún no se conoce el homólogo exacto en el humano nos seguiremos refiriendo con estas siglas cuando se trate del gen en el ratón.
El gen ABCB1 se encuentra en el cromosoma 14 en perros y en el cromosoma 7 en humanos (3) y se compone de 28 exones en ambas especies (14).
Las investigaciones con fármacos en los ratones MDR1 -/- mostraron que después de la administración de ivermectina, los niveles de esta en el cerebro eran 100 veces superiores a las de ratones con gen MDR1 normal; mientras los niveles plasmáticos eran 3 veces más altos. Otros fármacos como vinblastina, ciclosporina A y digoxina mostraban niveles 20 veces más altos en el cerebro y dos veces en plasma; sin embargo, la administración crónica de digoxina, alcanzaba niveles en cerebro 200 veces más altas que en ratones MDR1 (+/+). También se incrementaban los niveles, aunque en valores no tan altos, de morfina y dexametasona (2). Igualmente, se descubrió que se podía inhibir el funcionamiento de la GpP y provocar que un ratón MDR1 (+/+) se comportara como un ratón MDR1 (-/-) con medicamentos como la quinidina, el verapamilo y el ketoconazol. Muchos de estos fármacos sustratos o inhibidores de GpP son de uso rutinario en la terapéutica veterinaria (15).
La ivermectina es usada de manera rutinaria en medicina veterinaria, a pesar de que muchos parásitos se están volviendo resistentes (16) tal como ocurre en el parásito gastrointestinal de las ovejas Haemonchus, en el que se ha asociado una resistencia a la ivermectina con un incremento en la expresión de la GpP (17, 18).
La primera intoxicación con ivermectina en perros de raza Collie fue descrita por Preston en 1983, luego Tranquilli en 1987 demostró que no todos los Collie, sino que solo algunos de ellos, se intoxicaban y que con una mínima fracción de la dosis era suficiente para encontrar efectos adversos, comparados con perros de otras razas (19). A pesar de múltiples investigaciones, no se pudo encontrar la razón de esta sensibilidad racial, sin embargo, los signos previos a la muerte de los ratones MDR1 -/- expuestos a la ivermectina, recordaban la sintomatología que exhibían los Collie intoxicados con la misma, por lo que basado en estos hallazgos Mealey en 2001 descubrió que la sensibilidad de estos perros pastores se debía a una mutación en el gen ABCB1 (20).
La ivermectina es un agonista de los receptores glutamato dependientes de canales de cloro, específico de las neuronas de los invertebrados, pero que está filogenéticamente relacionado con el receptor GABA dependiente de canales de cloro de los vertebrados (11). En invertebrados como nematodos y artrópodos, estas neuronas están distribuidas por todo el cuerpo y la exposición a la ivermectina provoca una parálisis tónica y la muerte. En mamíferos, las neuronas GABA se encuentran restringidas al SNC y están protegidas de la ivermectina por la GpP de la barrera hematoencefalica, que evita el ingreso del medicamento al cerebro y hace que este fármaco sea muy seguro para usar en mamíferos (21).
A veces el gen ABCB1 que codifica para la GpP puede estar mutado y en estos casos la mutación se ha denominado de diferentes maneras, como mdr1-1?, ABCB1-1? o mdr1 nt230 (del4) (22). La secuencia del gen normal y la del gen mutado es 99,9 % idéntica (21), pero en el gen mutado existe una deleción de 4 pares de bases (23), donde se pierde una secuencia GATA en el exón 4, que origina un codón de terminación prematuro; finalmente, este gen mutado produce una proteína de 91 aminoácidos, que difiere totalmente de los 1281 aminoácidos que tiene la GpP, siendo el producto del gen mutado totalmente afuncional (13, 21).
En los perros con la mutación, donde la GpP no es funcional, se incrementa enormemente la absorción, disminuye la excreción y se tiene un fácil acceso al cerebro de los fármacos que son sustrato de la GpP y, por ende, una alta susceptibilidad a la intoxicación por los mismos (1, 24). Es así como el fenómeno de absorción de medicamentos no depende solo de variables fisicoquímicas (pKa, peso molecular, lipofilicidad) o biológicas (tiempo de tránsito, pH, flujo sanguíneo), sino que también depende de la expresión en los enterocitos de la GpP y CYP3A4 (3).
La mutación ABCB1-1? se ha reportado en 12 razas de perros y ocasionalmente en perros mestizos. La mayoría son perros pastores, como el pastor Collie, Shetland sheepdog, Old english sheepdog, Australian shepherd, Border collie, pastor alemán, English shepherd, White swiss shepherd, McNab, Waller y en dos razas de perros cazadores, el Longhaired whippet y el Silken windhound, estos dos últimos con genes de perros pastores en sus ancestros (22, 25, 26, 27, 28, 29).
Varios estudios no han podido demostrar la mutación en otras razas de perros que también tuvieron un origen común con los pastores anteriormente nombrados; es así como el Bearder collie, Australian cattle dog, Greyhound, pastor belga tervueren, pastor de anatolia, Kelpie, Borzoi, Irish wolfhound y el Elo se consideran libres del gen mutado (22, 27, 30). Igualmente, evaluaciones en más de 100 razas no emparentadas con las anteriores tampoco han encontrado la mutación.
Estudios en los que se evaluaron microsatélites revelan que la mutación ABCB1-1▲ se heredó de un mismo origen en todas las razas afectadas, al parecer el efecto fundador se dio en un perro que se estima vivió en el Reino Unido a mediados de 1800, el cual influyó en el desarrollo de las razas de pastores europeos y que a partir de estos se derivaron las tres razas portadoras de origen norteamericano, ya que el Shetland sheepdog de origen inglés, se tomo como referencia para fijar ciertas características en el McNab y el Longhaired whippet, así como este último figuró en la creación del Silken windhound (31).
El objetivo de una terapia consiste en producir un efecto farmacológico específico sin producir efectos adversos; pero es muy difícil de predecir que tan efectiva o que tan segura será una medicación en un paciente particular, ya que múltiples factores influencian la respuesta del individuo, como la edad, el estado de salud, la especie, las medicaciones concurrentes. Sin embargo, todos estos factores no son suficientes para explicar el grado de variación observado entre pacientes. Esta disparidad de respuestas es el resultado de diferencias genéticas en los procesos farmacocinéticos y farmacodinámicos.
La farmacogenética, que es el estudio de los determinantes genéticos en la respuesta a los fármacos, ayuda a aclarar muchas de estas diferencias (32). Es por este motivo que la farmacogenética se ha venido incorporando a las revisiones y estudios de aplicación de nuevos medicamentos en un esfuerzo por incrementar la seguridad y efectividad de los mismos (33).
Inicialmente, se creía que la absorción de fármacos en el tracto gastrointestinal estaba influenciada solo por las características fisicoquímicas del medicamento y el subsiguiente metabolismo hepático. Sin embargo, descubrimientos recientes demuestran que fenómenos metabólicos en la célula intestinal y bombas de eflujo en el enterocíto, ambas dependientes de los genes del individuo, alteran enormemente la biodisponibilidad del fármaco. Es así como los perros homocigotos para la mutación ABCB1-1▲, donde carecen totalmente de la glucoproteína P funcional, tendrán un incremento en la absorción de los fármacos sustratos para la misma, una disminución en los fenómenos de excreción biliar y renal, así como un acceso incrementado a zonas protegidas como cerebro, testículos y feto, volviéndoles altamente sensibles a intoxicaciones por los mismos (32).
La relación entre genotipo heterocigoto (ABCB1/ABCB1-1▲) y efectos adversos farmacológicos en perros ha recibido poca atención. Estos se consideraban más resistentes que los homocigotos para la mutación, sin embargo, evaluaciones recientes dicen que esto no es del todo cierto, ya que se detectan tasas de excreción biliar disminuidas e incremento en las vidas medias plasmáticas de los fármacos en estos perros (34). Un estudio que evaluó la eliminación de fármacos radiomarcados sustratos de la GpP, demostró que dicha excreción se encontraba altamente disminuida en pacientes homocigotos para la mutación ABCB1-1▲ y que bajaba ligeramente en los heterocigotos, comparados contra perros sin la mutación (35).
Una de las reacciones adversas mas entendidas en perros ABCB1-1▲ es la neurotoxicidad inducida por el efecto de las lactonas macrociclicas (ivermectina y sus similares) al tener acceso ilimitado al cerebro. Un perro sin la mutación mostrará concentraciones de estos fármacos en cerebro entre 1/10 a 1/100 de las que se encuentran en plasma; mientras el perro sin GpP tendrá valores 20 veces superiores en cerebro comparados con las cifras plasmáticas (14). Este exceso de medicamento a nivel cerebral inducirá síntomas como ataxia, depresión, somnolencia, midriasis, salivación, tremores, coma y muerte.
Un perro sin la mutación, tolera dosis de ivermectina de 2500mcg/kg sin exhibir toxicidad, un heterocigoto sufre toxicidad si recibe dosis seriadas de 600mcg/kg, mientras un homocigoto para la mutación sufrirá toxicósis grave con una dosis única de 120mcg/kg (17). Debido a que una sola dosis de ivermectina es suficiente para mantener niveles plasmáticos del fármaco durante 25 días (36), las dosis seriadas se convierten en altamente riesgosas para los heterocigotos. Otras dosis toxicas las podemos apreciar en la siguiente tabla (17):

La milbemicina se considera segura para heterocigotos (37). La intoxicación por moxidectina solo se ha reportado en Australian shepherd y se sospecha que además de la mutación ABCB1-1▲, la alteración en otros receptores como el ABCG2 (antes BCRP) (10) y la alteración en la expresión de CYP3A (34) puedan estar involucrados.
Con excepción de la ivermectina, las intoxicaciones por otras lactonas macrociclicas generalmente se deben al uso de dosis excesivas o terapias prolongadas como las que se usan para el manejo de ciertas dermatitis parasitarias (38, 39, 40).
También se han confirmado otras intoxicaciones medicamentosas, por diversidad de moléculas no relacionadas, pero que tienen en común ser sustratos de GpP. La loperamida es un opioide que disminuye el peristaltismo al ocupar receptores periféricos, pero que no posee efectos centrales, dado que la barrera hematoencefálica la mantiene alejada de los receptores cerebrales. En ratones MDR1 (-/-) una dosis de loperamida logra niveles cerebrales del fármaco 10 veces superiores a la de ratones no mutados, con signos como excitación, caminar en círculo y cola erecta (2). En el Collie también se reporta frecuentemente intoxicación por loperamida, con signos de sobredosis de opioides como salivación, depresión, ataxia, debilidad y coma (24, 41, 42).
La domperidona es un antagonista dopaminérgico que no cruza la barrera hematoencefalica y actúa como antiemético al bloquear receptores periféricos; cuando se administra a ratones MDR1 (-/-) estos se tornan severamente letárgicos (2). También se ven casos de importante toxicidad hematológica y gastrointestinal con el uso de citotóxicos que son sustratos de GpP (vincristina, vinblastina, doxorrubicina, dactinomicina y taxanos), siendo los perros homocigotos para ABCB1-1▲ altamente sensibles y los heterocigotos de riesgo moderado (10, 43, 44). En perros que recibían vincristina, se encontró que de aquellos con la mutación (tanto homocigotos como heterocigotos) el 75 % desarrollaban neutropenia y 62,5 % trombocitopenia a pesar de usar las dosis habitualmente recomendadas; mientras que en los perros que portaban el gen silvestre, la neutropenia fue del 11 % y la trombocitopenia del 4 % (45). Se cree que la mayor responsable de este incremento altamente significativo de la toxicidad es una drástica disminución en la excreción biliar de estos medicamentos (35), de la misma manera, la ausencia de GpP en riñón incrementa grandemente la nefrotoxicidad de la doxorrubicina (33) y se recomienda que todo perro que sea de una de las razas en donde se ha reportado la mutación debería ser genotipificado antes de iniciar un protocolo de quimioterapia (44).
La absorción de digoxina en intestino está altamente influenciada por la presencia de GpP (10), existen reportes de perros ABCB1-1▲ que muestran vómitos abundantes y anorexia después de las dosis habituales de digoxina, así como estados de confusión, ataxia y cambios de comportamiento con dosis terapéuticas de mexiletina (46). También se han reportado depresión respiratoria severa en estos perros con el uso de acepromacina y butorfanol (33).
El eje hipotálamo-hipofisiario-adrenal (HHA) funciona distinto en perros ABCB1-1▲, manteniendo niveles inferiores de cortisol plasmático, esto debido a que la GpP en la barrera hematoencefálica dificulta el acceso del cortisol al cerebro; en los perros con la mutación, se necesitan niveles muy inferiores de cortisol plasmático para provocar una retroalimentación negativa sobre el hipotálamo y bloquear el eje HHA, provocando que los perros con la mutación tengan una mala tolerancia al estrés (33, 47, 48).
La baja expresión de GpP funcional en cerebro no solo contribuye a un incremento en la sensibilidad de efectos tóxicos de xenobióticos, sino que puede contribuir a largo plazo a incrementar el riesgo de padecer enfermedades neurodegenerativas. Recientemente, se ha descubierto que existen cambios fisiológicos en la expresión de GpP que van asociados a la edad, mostrando que perros mayores de 100 meses, disminuyen en 72 % la expresión de GpP cerebral con respecto a los perros menores de 36 meses; analizando esto, se sabe que los pacientes de mayor edad tienen más tendencia a sufrir reacciones adversas a medicamentos y se asumía que el incremento en los niveles plasmáticos era debido a disfunciones renales y hepáticas que alteraban los procesos de excreción; sin embargo, estos estudios sugieren que alteraciones en los mecanismos de eflujo de la barrera hematoencefálica pueden estar altamente implicados en las reacciones medicamentosas adversas de pacientes ancianos (49).
Las alteraciones en la expresión de GpP en placenta exponen a los fetos a niveles más altos de xenobióticos y por consiguiente, a mayor probabilidad de malformaciones (3). Cuando se trataron hembras de ratón MDR1 (-/-) con un homólogo de la ivermectina, nacieron con paladar hendido el 100 % de los fetos homocigotos para la mutación, el 30 % de los heterocigotos y el 0 % de los que no tenían la mutación (9).
Otra situación a tener en cuenta es que en pacientes heterocigotos o incluso en aquellos sin la mutación, se pueden disminuir enormemente las cantidades de GpP por fármacos que inhiben su expresión (1). La actividad de esta GpP puede ser inhibida farmacológicamente por fenómenos de regulación transcripcional o postranscripcional, mediante procesos que alteran la estabilidad de mRNA (16).
Para los años 70 se conocía que los niveles plasmáticos de digoxina se incrementaban cuando se administraba concomitantemente quinidina, la que ahora se sabe es una fuerte inhibidora de la GpP (5). Es así como un heterocigoto o un paciente sin mutación se comportara como un perro ABCB1-1▲ cuando se administran inhibidores de la GpP por tiempo suficiente (50), esto se ha confirmado al encontrarse una disminución en la excreción biliar de fármacos sustratos de GpP después de un tratamiento con ketoconazol (35); también se logró incrementar los niveles de rodamina radiomarcada dentro células mononucleares sanguíneas de perros después del tratamiento con verapamilo (51).
Entendiendo estos fenómenos de la co-medicación, se han reportado intoxicaciones en perros heterocigotos y en perros sin mutación por la combinación de milbemicina con ketoconazol (34), ivermectina con ketoconazol y digoxina con verapamilo (10).
Las intoxicaciones son una causa muy frecuente de consulta al médico veterinario, y, aunque los insecticidas y plaguicidas son la causa más común de envenenamiento en los pacientes veterinarios, cada día se reconocen más las reacciones adversas medicamentosas y las sobredosis de fármacos como causa de morbimortalidad en animales, representando hasta un 25 % de las consultas en centros de intoxicaciones. Muchas de estas intoxicaciones se asocian al uso indebido de medicamentos aprobados para otras especies, como es el uso en perros y gatos de fármacos manufacturados para humanos; o se deben al consumo de sobredosis ya sea de manera accidental tras administración por parte del propietario o por el comportamiento curioso de la mayoría de las mascotas que las llevan a un consumo inadvertido del fármaco; sin embargo, también se reportan muchas reacciones adversas a medicamentos, manejados en las especies, así como a las dosis que están recomendadas por los fabricantes o por los organismos de control. Muchas de estas adversidades tienen explicación en cambios farmacocinéticos, asociados a patologías concomitantes o a co-medicaciones e interacciones farmacológicas; sin embargo, gran número de veces la causa de una mala reacción a un medicamento quedaba sin establecer y se definía como una reacción idiosincrática. En los últimos años, con el perfeccionamiento de técnicas de biología molecular y de genética, se descubrió que muchos de los cambios farmacocinéticos y, por ende, muchas de las variaciones en las vidas medias plasmáticas, en los volúmenes de distribución y en las velocidades de excreción, se debían a variaciones genéticas y a polimorfismos o mutaciones involucrados en los procesos de absorción, distribución, metabolismo y excreción de medicamentos. Es así como nace el concepto de farmacogenética, que está permitiendo la individualización de las terapias en la medicina humana y dilucidando muchas de las causas de las idiosincrasias farmacológicas. La farmacogenética veterinaria es un área que apenas está empezando a surgir, pero que ha logrado grandes avances, como la determinación de la mutación del gen ABCB1, la cual provoca una inactividad de una bomba de eflujo de membrana, la glicoproteína P, con importantes alteraciones en los procesos farmacocinéticos para los fármacos sustratos de dicha glicoproteína.
1. Mealey K, Greene S, Bagley R, Gay J, Tucker R, Gavin P. et al. P-glycoprotein contributes to the blood-brain but not blood-cerebrospinal fluid barrier in a spontaneous canine P-glycoprotein knockout model. Drug Metabolism and Disposition 2008; 36: 1073-1079. [ Links ]
2. Schinkel A. P-Glycoprotein, a gatekeeper in the blood-brain barrier. Advance Drug Delivery Reviews 1999; 36: 179-194. [ Links ]
3. Fromm M. Importance of P-glycoprotein at blood-tissue barriers. TRENDS in Pharmacological Sciences 2004; 25 (8): 423-429. [ Links ]
4. Ueda K, Cardalleri C, Gottesman M, Pastan I. Expression of a full-length cDNA for the human "MDR1" gene confers resistance to colchicines, doxorubicin and vinblastine. Proc. Nalt. Acad. Sci. USA 1987; 84: 3004-3008. [ Links ]
5. Fromm M. Importance of P-glycoprotein for drug disposition in humans. European Journal of Clinical Investigation 2003; 33: 6-9. [ Links ]
6. Thiebaut F, Tsuruo T, Hamada H, Gottesman M, Pastan I, Willingham M. Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues. Proc. Natl. Acad. Sci. 1987; 84: 7735-7738. [ Links ]
7. Fromm M. P-glycoprotein: A defense mechanism limiting oral bioavailability and CNS accumulation of drugs. International Journal of Clinical Pharmacology and Therapeutics 2000; 38: 69-74. [ Links ]
8. Loscher W, Potschka H. Role of drug efllux transporters in the brain for drug disposition and treatment of brain diseases. Progress in Neurobiology 2005; 76: 22-76. [ Links ]
9. Lankas G, Wise LD, Cartwright M, Pippert T, Umbenhauer D. Placental P-glycoprotein deficiency enhances susceptibility to chemically induced birth defects in mice. Reproductive Toxicology 1998; 12 (4): 457-463. [ Links ]
10. Schrickx J, Fink-gremmels J. Implications of ABC transporters on the disposition of typical veterinary medicinal products. European Journal of Pharmacology 2008; 585: 510-519. [ Links ]
11. Geyer J, Doring B, Godoy J, Leidolf R, Moritz A, Petzinger E. Frequency of the nt230(del4) MDR1 mutation in collies and related dogs breeds in Germany. J. Vet. Pharmacol. Therap. 2005; 28: 545-551. [ Links ]
12. Dean M. The genetics of ATP-binding cassette transporters. Methods in Enzymology 2005; 400: 409-429. [ Links ]
13. Klintzsch S, Meerkamp K, Doring B, Geyer J. Detection of the nt230(del4) MDR1 mutation in dogs by a fluorogenic 5'nuclease TaqMan allelic discrimination method. The Veterinary Journal 2010; 185: 272-277. [ Links ]
14. Geyer J, Doring B, Godoy J, Moritz A, Petzinger E. Development of a PCR-based diagnostic test detecting a nt230(del4) MDR1 mutation in dogs: Verification in a moxidectin-sensitive Australian shepherd. J. Vet. Pharmacol. Therap. 2005; 28: 95-99. [ Links ]
15. Mealey K, Meurs K, Breed distribution of the ABCB1-1▲ (multidrug sensitivity) polymorphism among dogs undergoing ABCB1 genotiping. Journal of the American Veterinary Medical Association 2008; 233: 921-924. [ Links ]
16. Menez C, Mselli-Lakhal L, Foucaud-Vignault M, Balaguer P, Alvinerie M, Lespine A. Ivermectin induces P-glycoprotein expression and function through mRNA stabilization in murine hepatocyte cell line. Biochemical Pharmacology 2012; 83: 269-278. [ Links ]
17. Mealey K. Canine ABCB1 and macrocyclic lactones: Heartworm prevention and pharmacogenetics. Veterinary Parasitology 2008; 158: 215-222. [ Links ]
18. Lespine A, Menez C, Bourguinat C, Prichard R. P-glycoproteins and other multidrug resistance transporters in the pharmacology of anthelmintics: Prospects for reversing transport-dependent anthelmintic resistance. International Journal of Parasitology: Drugs and Drug Resistance 2011; 10: 1-18. [ Links ]
19. Hugnet C, Bentjen S, Mealey K. Frequency of the mutant MDR1 allele associated with multidrug sensitivity in a sample of collies from France. J. Vet. Pharmacol. Therap. 2004; 27: 227-229. [ Links ]
20. Mealey K, Munyard K, Bentjen S. Frequency of the mutant MDR1 allele associated with multidrug sensitivity in a sample of herding breed dogs living in Australia. Veterinary Parasitology 2005; 131: 193-196. [ Links ]
21. Roulet A, Puel O, Gesta S, Lepage J, Drag M, Soll M. et al. MDR1-deficient genotype in collie dogs hypersensitive to the P-glycoprotein substrate ivermectin. European Journal of Pharmacology 2003; 460: 85-91. [ Links ]
22. Gramer I, Leidolf R, Doring B, Klintzsch S, Kramer E, Yalcin E. et al. Breed distribution of the nt230(del4) MDR1 mutation in dogs. The Veterinary Journal 2011; 189: 67-71. [ Links ]
23. Mealey K, Bentjen S, Gay J, Cantor G. Ivermectin sensitivity in collies is associated with a deletion mutation of the MDR1 gene. Pharmacogenetics 2001; 11: 727-733. [ Links ]
24. Kitamura Y, Koto H, Matsuura S, Kawabata T, Tsuchiya H, Kusuhara H. et al. Modest effect of impaired P-glycoprotein on the plasma concentration of fexofenadine, quinidine and loperamide following oral administration in collies. Drug Metabolism and Disposition 2008; 36: 807-810. [ Links ]
25. Nelson O, Carsten E, Bentjen S, Mealey K. Ivermectin toxicity in an Australian shepherd dog with the MDR1 mutation associated with ivermectin sensitivity in collies. J Vet Intern Med. 2003; 17: 354-356. [ Links ]
26. Geyer J, Klintzsch S, Meerkamp M, Wohlke A, Distl O, Moritz A. et al. Detection of the nt230(del4)MDR1 mutation in White Swiss Shepherd dogs: Case reports of doramectin toxicosis, breed predispositions, and microsatellite analysis. J. Vet. Pharmacol. Therap. 2007; 30: 482-485. [ Links ]
27. Fecht S, Wohlke A, Hamann H, Distl O. Analysis of the canine MDR1 - 1▲ mutation in the dog breed Elo. J. Vet. Med. A. 2007; 54: 401- 405. [ Links ]
28. Baars C, Leeb T, Klopmann T, Tipold A, Potschka H. Allele-specific polymerase chain reaction diagnostic test for the functional MDR1 polymorphism in dog. The Veterinary Journal 2008; 177: 394-397. [ Links ]
29. Tappin S, Goodfellow M, Peters I, Day M, Vall E, Bentjen S. et al. Frequency of the mutant MDR1 allele associated with multidrug sensitivity in dogs in the United Kingdom. In BSAVA congress, scientific proceedings, veterinary programs; 2008. [ Links ]
30. Mealey K, Bentjen S, Waiting D. Frequency of the mutant MDR1 allele associated whit ivermectin sensitivity in a sample population of collies from the northwestern United States. American Journal of Veterinary Research 2002; 63: 479-481. [ Links ]
31. Neff M, Robertson K, Wong A, Safra N, Broman K, Slatkin M. et al. Breed distribution and history of canine MDR1-1▲, a pharmacogenetic mutation that marks the emergence of breeds from the collie lineage. PNAS 2004; 101 (32): 11725-11730. [ Links ]
32. Mealey K. Pharmacogenetics. Vet Clin Small Anim. 2006; 36: 961- 973. [ Links ]
33. Martinez M, Modric S, Sharkey M, Troutman L, Walker L, Mealey K. The pharmacogenomics of P-glycoprotein and its role in veterinary medicine. J. Vet. Pharmacol. Therap. 2008; 31: 285-300. [ Links ]
34. Sherman J. Understanding the impact of P-glycoprotein mutation on canine health. The Veterinary Journal 2011; 190: 13-14. [ Links ]
35. Coelho J, Tucker R, Mattoon J, Roberts G, Waiting D, Mealey K. Biliary excretion of technetium-99m-sestamibi in wild-type dogs and in dogs with intrinsic (ABCB1 -1▲ mutation) and extrinsic (ketoconazole treated) P-glycoprotein deficiency. J. Vet. Pharmacol. Therap. 2009; 32: 417-421. [ Links ]
36. Gokbulut C, Karademir U, Boyacioglu M, McKellar Q. Comparative plasma dispositions of ivermectin and doramectin following subcutaneous and oral administration in dogs. Veterinary Parasitology 2006; 135: 347-354. [ Links ]
37. Barbet J, Snook T, Gay J, Mealey K. ABCB1-1▲ (MDR1-1▲) genotype is associated with adverse reaction in dogs treated with milbemycin oxime for generalized demodicosis. Journal Compilation. ESVD and ACVD 2008; 20: 111-114. [ Links ]
38. Yas-natan E, Shamir M, Kleinbart S, Aroch I. Doramectin toxicity in a collie. The Veterinary Record 2003; 153: 718-720. [ Links ]
39. Paul A, Hutchens D, Firkins L, Borgstrom M. Dermal safety study with imidacloprid/moxidectin topical solution in the ivermectin sensitive collie. Vet Parasitol 2004; 121: 718-720. [ Links ]
40. Sherman J, Paul A, Firkins L. Evaluation of the safety of spinosad and milbemycin 5-oxime orally administered to collies with the MDR1 gene mutation. Am J Vet Res. 2010; 71: 115-119. [ Links ]
41. Hugnet C, Cadore J, Buronfosse F, Pineau X, Mathet T, Berny P. Loperamide poisoning in the dog. Vet Hum Toxicol. 1996; 38: 31-33. [ Links ]
42. Sartor L, Bentjen S, Trepanier L, Mealey K. Loperamide toxicity in a collie with the MDR1 mutation associated with ivermectin sensitivity. J. Vet Intern Med. 2004; 18: 117-118. [ Links ]
43. Mealey K, Northrup N, Bentjen S. Increased toxicity of P-glycoprotein substrate chemotherapeutic agents in a dog with the MDR1 deletion mutation associated with ivermectin sensitivity. J am Vet Med Asso. 2003; 223: 1453-1455. [ Links ]
44. Vail D. Supporting the veterinary cancer patient on chemotherapy: Neutropenia and gastrointestinal toxicity. Top Companion Anim Med. 2009; 24 (3): 122-129. [ Links ]
45. Mealey K, Fidel J, Gay J, Impellizeri J, Clifford C, Bergman P. ABCB1-1▲ polymorphism can predict hematology toxicity in dogs treated with vincristine. J. Vet Intern Med. 2008; 22: 996-1000. [ Links ]
46. Henik R, Kellum H, Bentjen S, Mealey K. Digoxin and mexiletine sensitivity in a collie with the MDR1 mutation. J Vet Intern Med. 2006; 20: 415-417. [ Links ]
47. Mealey K. Therapeutic implications of the MDR 1 -gen. J. Vet. Pharmacol. Therap. 2004; 27: 257-264. [ Links ]
48. Mealey K, Gay J, Martin L, Waiting D. Comparison of the hypothalamic-pituitary-adrenal axis in MDR1- 1▲ and MDR1 wild-type dogs. Journal of Veterinary Emergency and Critical Care 2007; 17: 61-66. [ Links ]
49. Pekcec A, Schneider EL, Baumgartner W, Stein VM, Tipold A, Postchka H. Age-dependent decline of blood-brain barrier P-glycoprotein expression in the canine brain. Neurobiology of Aging 2011; 32: 1477-1485. [ Links ]
50. Mealey K. A new tool that detects ivermectin and other drugs sensitivities in dogs. Vet Med. 2004; 99: 419-426. [ Links ]
51. Kawabata A, Momoi Y, Inoue-murayama M, Iwasaki T. Canine MDR1 gene mutation in Japan. J. Vet. Med. Sci. 2005; 67: 1103-1107. [ Links ]













