Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.13 no.2 Manizales July/Dec. 2014
FREE RADICAL SCAVENGING CAPACITY OF ESSENTIAL OIL AND ETHANOLIC EXTRACTS OF YACÓN (Smallanthus sonchifolius Poepp. & Endl) H. Robinson, CULTIVATED IN COLOMBIA
Dary Luz Mendoza Meza2
Loreinys Parra Flórez2
Sergio Loza Rosas2
1 Investigación financiada con recursos del Grupo de Investigación de Productos Naturales y Bioquímica de Macromoléculas de la Universidad del Atlántico.
2 Grupo de Investigación en Productos Naturales y Bioquímica de Macromoléculas. Programa de Química. Universidad del Atlántico. Km 7 antigua vía a Puerto Colombia (Barranquilla, Atlántico, Colombia). Correo electrónico: darymendoza@mail.uniatlantico.edu.co
Introducción: El Smallanthus sonchifolius es un cultivo andino con importantes propiedades medicinales y nutricionales, usado principalmente como hipoglucemiante. El objetivo de este estudio fue determinar la actividad captadora de radicales libres del aceite esencial y fracciones fenólicas de un extracto etanólico de hojas de yacón, cultivado en Colombia. Materiales y Métodos: El aceite esencial de las hojas se extrajo mediante hidrodestilación asistida por radiación de microondas y se analizó usando cromatografía de gases acoplada a espectrometría de masas (CG-EM). También se separaron fracciones fenólicas de diferente polaridad desde un extracto etanólico de las hojas usando la resina Amberlita XAD-2. Los compuestos fenólicos totales se determinaron con el reactivo de Folin-Ciocalteu y analizados mediante cromatografía líquida acoplada a espectrometría de masas (HPLC-EM). La actividad antioxidante se evaluó usando los radicales DPPH (2,2-difenil-1-picrilhidracilo) y ABTS [2,2-azino-bis (3-etilbenzotiazolina-6-sulfonato]. Resultados y Discusión: El aceite esencial mostró actividad captadora del radical ABTS (CE50 = 2,11 mg/ml). Los compuestos mayoritarios identificados en el aceite esencial fueron: Sabineno (40,75%), D-Germacreno (15,36%), Cariofileno (9,93%) y 1-Terpinen-4-ol (5,51%). El contenido de fenoles totales en las fracciones separadas con Amberlita XAD-2 fue: F1 (H2O) > F2 (H2O/MeOH, 1:1 v/v) > F3 (MeOH). Todas las fracciones presentaron actividad captadora del DPPH• y ABTS•+. Los ácidos fenólicos identificados por HPLC-EM fueron derivados de los ácidos quínico, cafeoilquínico, dicafeoilquínico, dicafeoilglucárico, cafeoiltartárico e hidroxiferúlico. En conclusión, las hojas de yacón cultivado en Duitama (Boyacá) contienen metabolitos secundarios capaces de proteger a las células frente al estrés oxidativo inducido por radicales libres.
Palabras clave: Smallanthus sonchifolius, aceite esencial, extracto etanólico, antioxidantes, ABTS, DPPH.
ABSTRACTIntroduction: Smallanthus sonchifolius is an Andean crop with important medicinal and nutritional properties, used mainly as a hypoglycemic. The aim of this study was to determine free radical scavenging activity of essential oil and phenolic fractions of an ethanolic extract of yacón leaves grown in Colombia. Materials and Methods: The essential leaf oil was extracted through hydrodistillation assisted by microwave radiation and was analyzed using gas chromatography coupled with mass spectrometry (GC-MS). Phenolic fractions of different polarity were also separated from an ethanolic leaf extract using Amberlite XAD-2 resin. The total phenolic compounds were determined with the Folin-Ciocalteu reagent and analyzed using liquid chromatography coupled with mass spectrometry (HPLC-MS). The antioxidant activity was evaluated using DPPH radicals (2,2-diphenyl-1-picrylhydrazyl) and ABTS [2,2-azino-bis (3-ethylbenzothiazoline-6-sulphonate]. Results and Discussion: The essential oil showed the ABTS radical scavenging activity (EC50 = 2.11 mg / ml). The major compounds identified in the essential oil were: Sabinene (40.75%), D-germacrene (15.36%), Caryophyllene (9.93%) and 1-Terpinen-4-ol (5.51%). The total phenolic content in the fractions separated on Amberlite XAD-2 was F1 (H2O) > F2 (H2O/MeOH, 1:1 v/v) > F3 (MeOH). All fractions showed scavenging activity with DPPH• and ABTS•+. Phenolic acids identified using HPLC-SM were quinic, hidroxiferulic, caffeoylquinic, dicaffeoylquinic, dicaffeoilglucaric and caffeoiltartaric derivatives. In conclusion, yacón leaves grown in Duitama (Boyacá) contain secondary metabolites able to protect cells against oxidative stress induced by free radicals.
Key words: Smallanthus sonchifolius, essential oil, ethanolic extract, antioxidants, ABTS, DPPH.
La diabetes mellitus es una enfermedad crónica degenerativa con alta incidencia y prevalencia a nivel mundial (1). Según datos de la Asociación Americana de Diabetes (ADA), cerca de 371 millones de personas en todo el mundo (5,26% de la población mundial) la padecen (2). Adicionalmente, la Organización Mundial de la Salud (OMS) estima que para el año 2030, habrá cerca de 366 millones de personas diabéticas en el mundo, por lo que se predice que la enfermedad alcanzará dimensiones de auténtica epidemia (3).
En la actualidad existe evidencia suficiente que sustenta la relación entre los radicales libres y las enfermedades degenerativas crónicas, como la diabetes mellitus (4-6). Se conoce que defectos en los mecanismos de defensa antioxidante, radicales libres y estrés oxidativo pueden ser responsables de la diabetes mellitus misma y sus complicaciones (7-9), razón por la cual los antioxidantes pueden coadyuvar en su prevención y/o tratamiento (10, 11).
Smallanthus sonchifolius (Poepp. & Endl.) H. Robinson (Asteraceae), es un arbusto andino originario de Perú, que se encuentra en toda Sudamérica desde Venezuela hasta Argentina (12); sus hojas y raíces son reconocidas por tener propiedades antioxidantes, antimicrobianas e hipogluceminantes (12-14). Investigaciones realizadas con partes aéreas de variedades de yacón cultivadas en varios países andinos han descrito un alto contenido de ácidos fenólicos y flavonoides, los cuales pueden contribuir a la actividad antidiabética de la planta; estos compuestos son derivados del ácido cafeico, quínico, ferúlico y el flavonoide quercetina (15-17).
En Colombia, el yacón se cultiva principalmente en municipios del altiplano cundiboyacense y del Eje Cafetero, donde es utilizado principalmente como forraje, desaprovechándose el potencial de este cultivo como fuente de metabolitos con actividad biomédica. Por lo anterior, el propósito de este trabajo fue contribuir a la caracterización química y determinación de la actividad antioxidante de las hojas del yacón que se cultiva en Colombia.
Material vegetal
Las hojas de yacón se recolectaron de cultivos establecidos en la vereda Tocogua, aledaña al municipio de Duitama, Boyacá (Latitud 5º49'30,31" N, Longitud 73º2'24,55" O). La identidad botánica de la especie fue confirmada en el Herbario Nacional de Colombia, adscrito al Instituto de Ciencias Naturales de la Universidad Nacional, sede Bogotá (Código de Barras COL000362397, No. Catálogo 547142).
Extracción y caracterización del aceite esencialPara la obtención del aceite esencial se seleccionaron hojas maduras en buen estado fitosanitario. La extracción se realizó por hidrodestilación asistida por radiación de microondas, siguiendo el procedimiento descrito previamente (18). Para la extracción de cada muestra se realizaron 6 ciclos de extracción de 10 min cada uno, a una potencia de 840 W, con intervalos de 2 min de reposo antes de cada ciclo. El análisis de composición química del aceite fue realizado en un cromatógrafo Agilent Technologies Inc. GC System 7890A, acoplado a un detector selectivo de masas Agilent Technologies Inc. GC System 5975C VL MSD, equipado con una columna capilar de fase estacionaria 5% fenil-poli (metilsiloxano). La identificación de las sustancias se hizo mediante comparación de sus espectros de masas con aquellos dados por las librerías de CG-MS NIST MS Search 8.0 con la ayuda del software MSD ChemStation E.02.00.493 de Agilent Technologies Inc. La cuantificación de los componentes se realizó usando n-tetradecano (Dr. Ehrenstorfer GmbH, Augsborg, Alemania) como estándar interno (istd), relacionando las áreas de este y del compuesto de interés con las concentraciones de los dos.
Actividad antioxidante del aceite esencialFue evaluada mediante el ensayo del ABTS descrito por Re y colaboradores (19). Se preparó la solución del catión radical ABTS•+ y diluciones seriadas del aceite esencial en metanol (desde 300 a 2 mg/ml). De cada dilución se tomaron 100 ul y se mezclaron con 1 ml de la solución del ABTS•+, la absorbancia de la mezcla fue registrada luego de 7 min, en un equipo UV-VIS (Génesis 20) a 734 nm. Las lecturas se compararon con un blanco (metanol) y la actividad captadora de radicales libres se expresó como porcentaje de inhibición (% I) y como la concentración efectiva que neutraliza el 50% del radical (CE50). Además, se estudio la actividad del Sabineno (Sigma-Aldrich, CAS No. 546-79-2), un compuesto mayoritario en el aceite esencial. Como control del ensayo se utilizó a-tocoferol (Sigma-Aldrich, CAS No. 10191-41-0).
Obtención de extractos etánolicosUna muestra de 250 g de hojas secas de yacón se sometió a un proceso de maceración hasta pulverización y extracción con etanol absoluto, durante 15 días bajo refrigeración. El extracto se filtró y se concentró a presión reducida a 50ºC y 36 rpm, en un equipo Laborata 4000 (Heidolph®). El reconocimiento de flavonoides se realizó mediante el ensayo de Shinoda, mientras que los fenoles se identificaron con el ensayo de FeCl3 (20).
Separación de ácidos fenólicos y flavonoidesEsta se realizó por cromatografía de columna (40 x 2 cm), usando la resina Amberlita XAD-2 (Sigma, 20-60 mesh), con una velocidad de flujo del solvente de 10 ml/min (21). Se agregó a la columna 1 g del extracto etanólico total de hojas de yacón, los compuestos se eluyeron con 20 ml de H2O, 20 ml de la mezcla H2O:MeOH (1:1, v/v) y 20 ml de MeOH. La presencia de fenoles y compuestos antioxidantes en los eluidos fue evaluada en cromatoplacas de Silica-Gel F254, usando como fase móvil la mezcla de n-butanol-ácido acético-agua (4:1:5, v/v/v). Las cromatoplacas se revelaron con una solución del radical 2,2-difenil-1-picrilhidrazilo (DPPH, Calbiochem®) a la concentración 0,5 M.
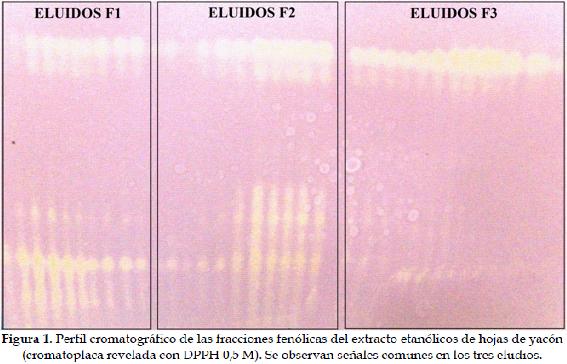
Cuantificación de fenoles totalesSe realizó mediante el método de Folin-Ciocalteu descrito por Blainski y colaboradores (22) con algunas modificaciones. Un volumen de 2 ml de los eluidos se mezcló con 2,5 ml del reactivo Folin-Ciocalteu (Panreac Química S.L.U., Barcelona, España). La mezcla se incubó a temperatura ambiente por 2 min, seguidamente se adicionaron 2 ml de carbonato de sodio al 7,5% y posterior incubación a 50ºC por 15 min. Los datos de absorbancia de la muestra a 765 nm se interpolaron en una curva de calibración estándar de ácido gálico (r² = 0,985) y se expresaron como mg de ácido gálico equivalente (mg AGE).
Ensayo de captación del DPPH•Se preparó una solución metanólica del radical DPPH de concentración 0,1 mM (23). Un volumen de 50 ul del extracto total de cada fracción se mezcló con 2 ml del DPPH•, la mezcla se incubó por 30 min en oscuridad, seguidamente se leyó la absorbancia a 517 nm, frente a un blanco. Los datos de absorbancia de las muestras se interpolaron en una curva de calibración estándar de Troloxâ (Sigma, CAS No. 53188-07-1) y se expresaron como mM de Equivalentes Trolox (ET). También se calculó el porcentaje de captación del DPPH• (% CR) vs tiempo (estudio cinético), utilizando la siguiente fórmula:

Donde, Ab Control corresponde a la absorbancia de la mezcla de reacción sin la muestra, y Ab Muestra es la absorbancia de cada eluido.
Ensayo de captación del ABTS•+El radical catiónico ABTS•+ (Sigma-Aldrich®, CAS No. 30931-67-0) se generó a partir de la reacción del ácido 2,2'-azino-bis (3-etilbenzotiazolín)-6-sulfónico con persulfato de potasio (Fluka-Sigma-Aldrich®, CAS No. 77727-21-1). Se mezclaron partes iguales de una solución metanólica de ABTS 7 mM con una solución acuosa de persulfato potásico 2,45 mM; la mezcla se mantuvo en oscuridad, a temperatura ambiente durante 16 horas para la formación del radical. Un volumen de 100 ul de cada fracción se mezcló con 1 ml de la solución del ABTS•+ (Ab734 = 0,7), la mezcla se incubó por 10 min en oscuridad, seguidamente se leyó la absorbancia a 517 nm, frente a un blanco. Los datos de absorbancia de las muestras se interpolaron en una curva de calibración estándar de Trolox y se expresaron como mM de Equivalentes Trolox (ET). También se calculó el porcentaje de captación del ABTS•+ (% CR) vs tiempo.
Análisis de las fracciones fenólicas por HPLC-EMPara la identificación de los compuestos presentes en los eluidos F1, F2 y F3 se realizó un análisis de cromatografía líquida de alta resolución acoplada a espectrometría de masas (HPLC-EM), en un equipo Agilent 1100 G1956A VL-LC con detector selectivo de masas, usando la columna Zorbax Rapid Resolution Eclipse Plus Stable Bond Poroshell XDB-C18 de 100 mm x 4,6 mm d.i y 3,5 um de tamaño de partícula.
El protocolo consistió de una fase móvil binaria. La composición de la fase A fue 10% (v/v) de CH3CN en H2O y 0,05% (v/v) de CH3-COOH; y, la composición de la fase B fue 90% (v/v) de CH3CN en H2O y 0,05% (v/v) de CH3-COOH. La elución de la columna se llevó a cabo con el siguiente gradiente lineal: 0,0 min 100% de la fase A con una velocidad de flujo de 0,5 ml/min – 39,0 min 100% de la fase B con una velocidad de flujo de 0,5 ml/min – 40,0 min 100% de la fase B con una velocidad de flujo de 1,0 ml/min – 41,0 min 100% de A con una velocidad de flujo de 1,0 ml/min – 46,0 min 100% de A con una velocidad de flujo de 1,0 ml/min – 47,0 min 100% de A con una velocidad de flujo de 0,5 ml/min. Durante el escaneo del espectro de masa la velocidad de flujo fue de 0,5 ml/min. El volumen de inyección de la muestra fue de 10 ul.
La fuente de ionización usada fue electrospray (ESI) de polaridad negativa. El rango de masas fue desde 50 hasta 1500 m/z; una Misa Precisión de ± 0,13 u, las cuales están dentro del rango de masas calibradas; una Misa Axis Estabilidad de ± 0,13 hasta poco más 8 horas; una velocidad de barrido: 2500 u/s y una sensibilidad SIM: min 400 ul en ESI, APCI o actualizar a 1000 L/min. La interpretación de los espectros de masa se realizó por comparación con los espectros reportados en la literatura.
Análisis de datosLos ensayos de determinación del contenido de fenoles totales y de actividad captadora de radicales libres DPPH• y ABTS•+ se realizaron por triplicado, los datos obtenidos se sometieron a un análisis estadístico univariado utilizando medidas de frecuencia, pruebas de tendencia central y de dispersión, usando el paquete estadístico SPSS Statistics 19 para Windows de IBM (SPSS Inc., an IBM Company, Chicago, H, IL, USA).
Aceite esencial de hojas de yacón
El rendimiento de la extracción del aceite esencial fue 0,363 ml/kg de hoja seca. La cromatografía de gases separó 35 componentes, de los cuales 96,2% fueron identificados. Los quimiotipos principales fueron monoterpenos (50,8%) y sesquiterpenos (31,1%). La Tabla 1 presenta los compuestos identificados por CG/EM.
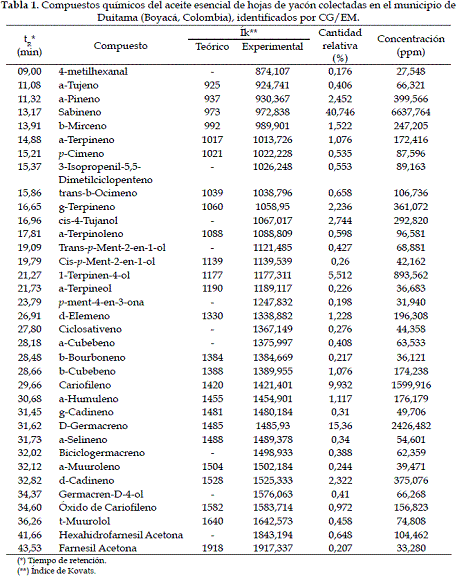
El ensayo ABTS•+ demostró que el aceite esencial de hojas de yacón presenta actividad captadora de radicales libres (CE50 = 2,11 mg/ml). El máximo % CR se obtuvo a una concentración de aceite esencial de 17,5 mg/ml (% I = 97,2±0,91%); en comparación, el % CR por el a-tocoferol fue menor (% I = 43,2±1,06% a 17,5 mg/ml). Adicionalmente, se estableció que el Sabineno no contribuye a la capacidad captadora del ABTS•+, obteniéndose un valor de inhibición máxima del 2,7±1,13% a la concentración de 300 mg/ml.
Fracciones fenólicas del extracto etanólico de hojas de yacónSe obtuvieron tres fracciones de la columna de Amberlita XAD-2, a saber: fracción eluida con H2O (F1); fracción eluida con MeOH/H2O (F2); fracción eluida con MeOH (F3). La presencia de compuestos con actividad antioxidante fue evidenciada en todas las fracciones, mediante cromatografía en capa fina revelada con DPPH• 0,5 M (Figura 1).
Cuantificación de fenoles totales
La Figura 2 presenta la curva de calibración con ácido gálico para el ensayo de Folin-Ciocalteu.
El contenido de fenoles totales en las fracciones eluidas de la Amberlita se muestra en la Tabla 2, con el siguiente orden de elución: F1 > F2 > F3.

Ensayo del DPPH
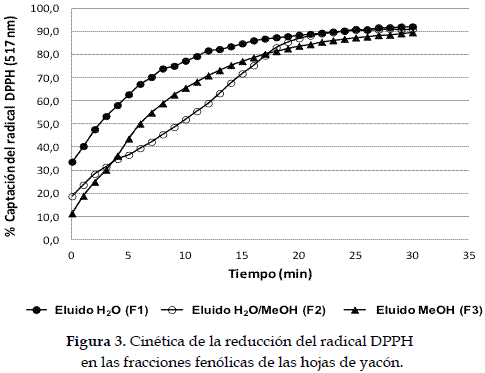
Las tres fracciones fenólicas eluidas de la columna Amberlita XAD-2 presentaron actividad captadora del DPPH•, siendo la fracción F1 (eluido con H2O) la que presentó mayor actividad a los 30 min de reacción (Tabla 3).

Los resultados de la evaluación de la capacidad reductora del DPPH• con relación al tiempo, sugieren la presencia de compuestos con mayor capacidad antioxidante en la fracción eluida con H2O, observándose que la reducción del 50% del DPPH• se alcanza, aproximadamente, a los 3 min de reacción (Figura 3).
Ensayo del ABTS
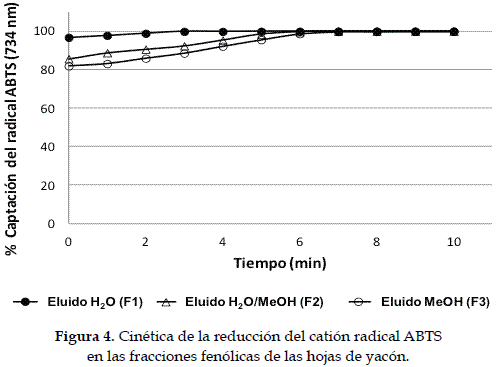
Los resultados de captación del ABTS•+ son consistentes con lo observado en la reacción con DPPH•. Todas las fracciones eluidas de la columna de Amberlita XAD-2 mostraron actividad captadora de este radical, observándose mayor poder reductor en las fracciones F1 (eluido con H2O) y F2 (eluido con H2O/MeOH) a los 10 minutos de reacción (Tabla 4).

Adicionalmente, la evaluación de la capacidad reductora del ABTS•+ con relación al tiempo, sugiere que no hay diferencia entre las fracciones, observándose reducción de cerca del 90% del ABTS•+ antes de 2 min de reacción (Figura 4).
Análisis de las fracciones fenólicas por HPLC-EM
Se evidenció la presencia de ácidos fenólicos en forma de glucósidos y agliconas, en todas las fracciones del extracto etanólico de hojas de yacón eluidas de la columna Amberlita XAD. Los iones pseudomoleculares comunes en las tres fracciones fueron consistentes con derivados del ácido quínico, cafeico y ferúlico (Tabla 5).
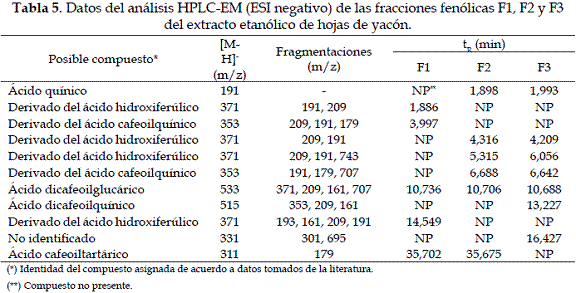
A continuación se presenta el análisis de cada compuesto:
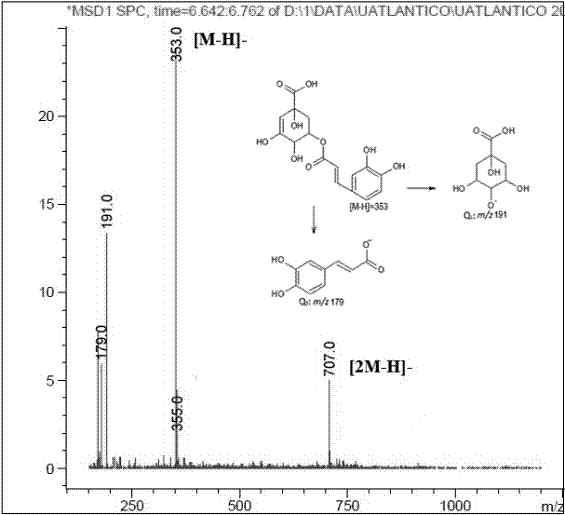
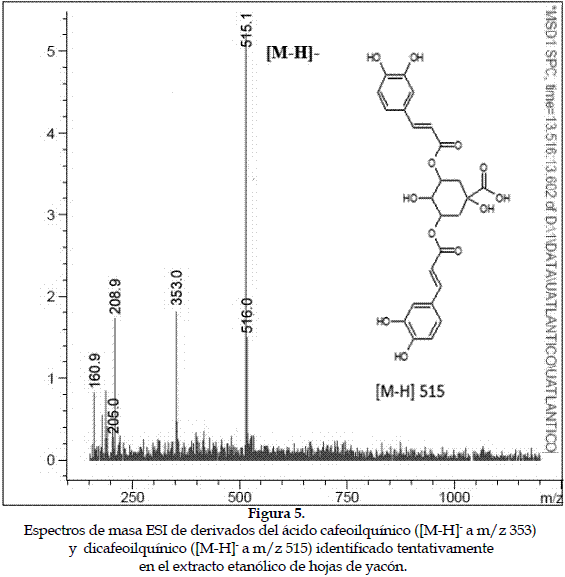
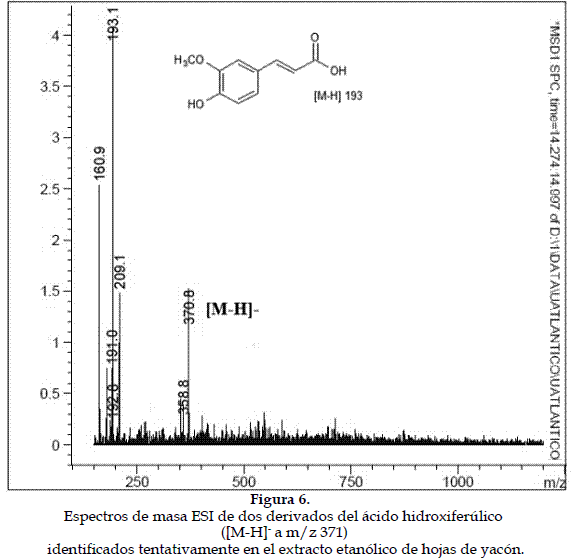
a) Caracterización de los derivados del ácido cafeoilquínico: Estos presentan un ion pseudomolecular [M-H]- a m/z 353 y productos iónicos a m/z 173 ([ácido quínico-H-H2O]-), acompañado por fragmentos secundarios a m/z 179 ([M-H-ácido quínico]-) y m/z 191 ([M-H-ácido cafeico]-) (24). Otro compuesto es el ácido dicafeoilquínico, el cual se caracteriza por presentar un ión pseudomolecular [M-H]- a m/z 515, un producto iónico que corresponde a la forma desprotonada del ácido cafeoilquínico (m/z 353) y señales a m/z 209 ([ácido quínico-H+H2O]-) y m/z 161 ([ácido cafeico-H-H2O]-) (25) (Figura 5).
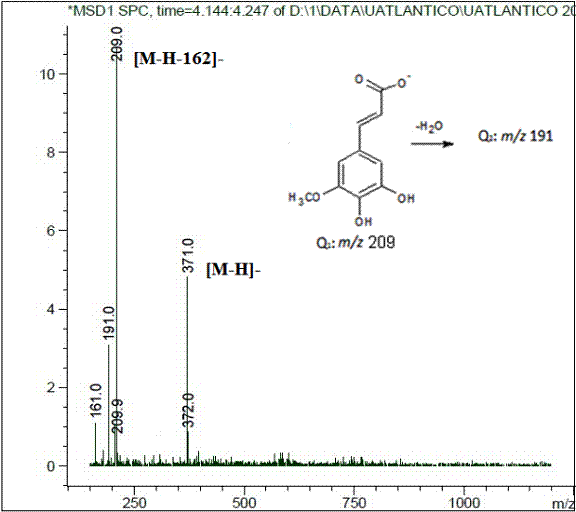
b) Caracterización de los derivados del ácido hidroxiferúlico: Estos compuestos presentan un ión pseudomolecular con [M-H]- a m/z 371, cuyo patrón de fragmentación es consistente con el descrito por Simirgiotis y colaboradores (26), para los isómeros glicosilados del ácido cinámico que presentan un grupo CH3O- y dos grupos OH- sustituidos en el anillo aromático (ácido hidroxi-isoferúlico o ácido hidroxiferúlico). La fragmentación de estos compuestos produce iones de m/z 209 ([M-H-162]-) y m/z 191 ([M-H-162-H2O]-), debido a la pérdida de una unidad de azúcar hexosa [hexosa-H2O] (Figura 6). El producto iónico de 193 unidades de masa atómica (uma) corresponde a la molécula desprotonada del ácido ferúlico (PM = 194 Dalton).
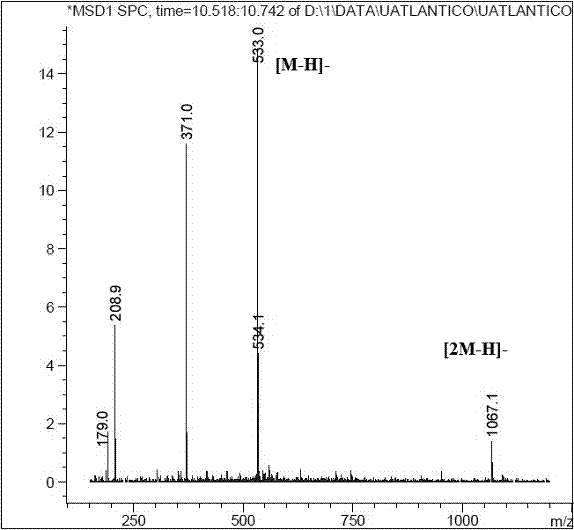
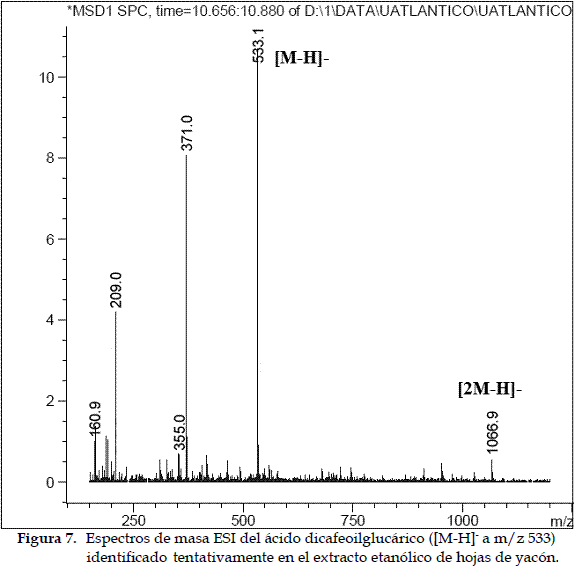
c) Caracterización del ácido dicafeoilglucárico: Este compuesto presenta un ión pseudomolecular con [M-H]- a m/z 533 y tres productos iónicos a 371, 209 y 191 uma. Un compuesto con patrón de fragmentación similar fue descrito previamente como ácido dicafeoilglucárico (27). El producto iónico de m/z 209 se interpretó como un ácido aldárico de seis átomos de carbono (ácido glucárico, C6O8H10), el cual sufre una deshidratación subsiguiente liberándose un fragmento de m/z 191 [209-H2O]-. La pérdida de dos fragmentos de 162 uma, la primera desde el m/z 533 a 371 y la segunda desde el m/z 371 a 209, fue interpretado como la pérdida de dos grupos cafeoilos (C9O3H6) diferentes; este patrón de fragmentación sugiere la presencia de dos isómeros del ácido dicafeoilglucárico (Figura 7).
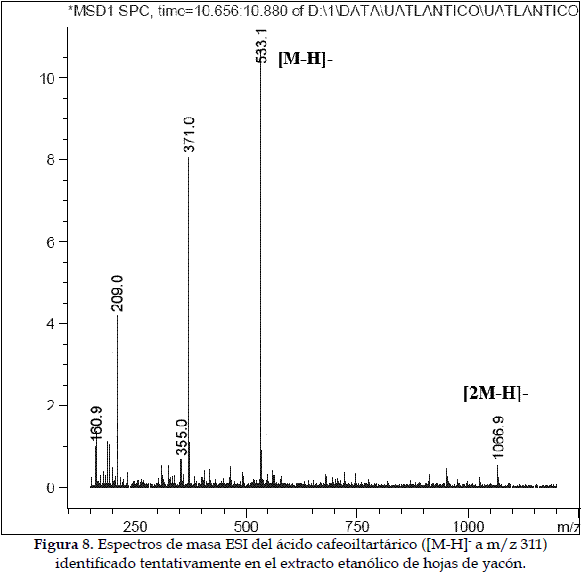
d) Caracterización del ácido cafeoiltartárico: Este compuesto presenta un ión pseudomolecular [M-H]- con m/z 311; su fragmentación genera un producto iónico a m/z 179 ([M-H - tartárico]-), descrito previamente en la literatura (27). (Figura 8).
En Colombia, son escasos los estudios de caracterización química de variedades de yacón que son cultivadas o que crecen en forma silvestre. En este trabajo se demostró que, tanto el aceite esencial como el extracto etanólico de las hojas de yacón cultivadas en la vereda Tocogua del municipio de Duitama (Boyacá), poseen actividad captadora de radicales libres.
La composición química del aceite esencial obtenido difiere de la descrita previamente en variedades de yacón cultivadas en Ecuador (28) y China (29). En la variedad ecuatoriana, los compuestos volátiles fueron aislados por microextracción en fase sólida, identificándose principalmente b-pineno, cariofileno y g-cadineno; el aceite esencial de la variedad cultivada en China se obtuvo por hidrodestilación y se identificaron b-felandreno (26,3%), b-cubeneno (17,7%), b-cariofileno (14%) y b-bourboneno (10,2%), mayoritariamente. La diferencia en la composición puede estar asociada con factores abióticos relacionados con el sitio de cultivo.
Se ha demostrado que metabolitos presentes en el aceite esencial de hojas de yacón poseen actividad antioxidante. Ruberto y Baratta, describieron la actividad antioxidante de los hidrocarburos monoterpénicos a-Terpinoleno, a-Terpineno y g-Terpineno, usando el método de inhibición de la oxidación del ácido linoleico; este estudio también reportó una leve actividad antioxidante del (+)-Sabineno (30). Otros trabajos describieron la actividad antioxidante de los monoterpenos a-pineno (31) y p-cimeno (32). Lo anterior sugiere que estos metabolitos podrían actuar sinérgicamente en el proceso de captación del ABTS•+.
La actividad captadora de radicales libres en las fracciones fenólicas del extracto etanólico de hojas de yacón se relacionó positivamente con el contenido de fenoles totales. Las moléculas identificadas tentativamente en las fracciones fenólicas fueron derivadas de los ácidos cafeoilquínico, dicafeoilglucárico, hidroxiferúlico, cafeoiltartárico y dicafeoilquínico. La mayoría de estos compuestos habían sido descritos en extractos de hojas de yacón cultivados en otros países andinos (16, 17). Valentová y colaboradores reportaron ácido cafeico, cafeoilquínico y ferúlico en extractos de hojas obtenidos con acetato de etilo (33), posteriormente estos ácidos fueron confirmados mediante HPLC acoplado a un sistema de detección electroquímica (HPLC-ECD), identificándose además el ácido gálico y gentísico (34). Otro estudio, describió el análisis de tres isómeros del ácido dicafeoilquínico y un derivado del ácido cafeoilquínico de identidad desconocida (PM = 562 Dalton), mediante HPLC acoplado a masa (16). Estos ácidos fenólicos también se detectaron en las antenas, cálices y tubérculos de yacón (35).
Investigaciones recientes presentan evidencia de que los ácidos clorogénico, cafeico, ferúlico e isómeros del dicafeoilquínico son inhibidores de enzimas digestivas de los carbohidratos, como la alfa-amilasa y la alfa-glucosidasa (36, 37), lo que ofrecería una explicación del efecto hipoglucemiante de los extractos y productos preparados con base en hojas de yacón. Por otra parte, se plantea que los ácidos fenólicos presentes en las hojas de yacón podrían contrarrestar los procesos de peroxidación de lipoproteínas plasmáticas, membranas de eritrocitos y tejidos en individuos diabéticos.
En conclusión, los resultados de este estudio sugieren que las plantas de yacón cultivadas en el departamento de Boyacá deberían ser exploradas como fuente de compuestos antioxidantes con potencial uso en la prevención de las complicaciones de la diabetes mellitus.
1. Isla P. Chronic complications of diabetes mellitus. Recommendations from the American Diabetes Association 2011. Prevention and management. Rev Enferm 2012; 35(9):46-52. [ Links ]
2. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2008; 31(1):55-60. [ Links ]
3. Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res Clin Pract 2010; 87(1):4-14. [ Links ]
4. Dixon SJ, Stockwell BR. The role of iron and reactive oxygen species in cell death. Nat Chem Biol 2014; 10(1):9-17. [ Links ]
5. Crujeiras AB, Díaz-Lagares A, Carreira MC, Amil M, Casanueva FF. Oxidative stress associated to dysfunctional adipose tissue: a potential link between obesity, type 2 diabetes mellitus and breast cancer. Free Radic Res 2013; 47(4):243-56. [ Links ]
6. Mohora M, Vîrgolici B, Paveliu F, Lixandru D, Muscurel C, Greabu M. Free radical activity in obese patients with type 2 diabetes mellitus. Rom J Intern Med 2006; 44(1):69-78. [ Links ]
7. Muhammad S, Bierhaus A, Schwaninger M. Reactive oxygen species in diabetes-induced vascular damage, stroke, and Alzheimer's disease. J. Alzheimers 2009; 16:775-78. [ Links ]
8. Mrowicka M. Free-radical reactions in diabetes mellitus. Pol Merkur Lekarski 2005; 19(112):571-6. [ Links ]
9. Ryu GR, Lee E, Chun HJ, Yoon KH, Ko SH, Ahn YB, et al. Oxidative stress plays a role in high glucose-induced activation of pancreatic stellate cells. Biochem Biophys Res Commun 2013; 439(2):258-63. [ Links ]
10. Zatalia SR, Sanusi H. The role of antioxidants in the pathophysiology, complications, and management of diabetes mellitus. Acta Med Indones 2013; 45(2):141-7. [ Links ]
11. Alam MM, Meerza D, Naseem I. Protective effect of quercetin on hyperglycemia, oxidative stress and DNA damage in alloxan induced type 2 diabetic mice. Life Sci 2014; 109(1):8-14. [ Links ]
12. Valentová K, Ulrichová J. Smallanthus sonchifolius and Lepidium meyenii - prospective Andean crops for the prevention of chronic diseases. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2003; 147(2):119-30. [ Links ]
13. Choi JG, Kang OH, Lee YS, Oh YC, Chae HS, Obiang-Obounou B, et al. Antimicrobial activity of the constituents of Smallanthus sonchifolius leaves against methicillin-resistant Staphylococcus aureus. Eur Rev Med Pharmacol Sci 2010; 14(12):1005-9. [ Links ]
14. De Almeida Paula HA, Abranches MV, De Luces Fortes Ferreira CL. Yacón (Smallanthus sonchifolius): a food with multiple functions. Crit Rev Food Sci Nutr 2015; 55(1):32-40. [ Links ]
15. Valentova K, Cvak L, Muck A, Ulrichova J, Simanek V. Antioxidant activity of extracts from the leaves of Smallanthus sonchifolius. Eur J Nutr 2003; 42(1):61-6. [ Links ]
16. Simonovska B, Vovk I, Andrensek S, Valentová K, Ulrichová J. Investigation of phenolic acids in yacón (Smallanthus sonchifolius) leaves and tubers. J Chromatogr A 2003; 1016(1):89-98. [ Links ]
17. Xiang Z, He F, Kang TG, Dou DQ, Gai K, Shi YY, et al. Anti-diabetes constituents in leaves of Smallanthus sonchifolius. Nat Prod Commun 2010; 5(1):95-8. [ Links ]
18. Combariza MY, Blanco C, Stashenko EE, Shibamoto T. Limonene concentration in lemon (Citrus volcameriana) peel oil as a function of ripeness. J High Resol Chromatogr 1994; 17(9):643-6. [ Links ]
19. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 1999; 26:1231-7. [ Links ]
20. Siddiqui S, Verma A, Rather AA, Jabeen F, Meghvansi K. Preliminary phytochemical analysis of some important aromatic plants. Adv Biol Res 2009; 3(5-6):188-95. [ Links ]
21. Osler KH, Goodwin R. A general use of Amberlite XAD-2 resin for the purification of flavonoids from aqueous fractions. J Nat Prod 1983; 47(1):188. [ Links ]
22. Blainski A, Lopes GC, de Mello JC. Application and analysis of the folin ciocalteu method for the determination of the total phenolic content from Limonium brasiliense L. Molecules 2013; 18(6):6852-65. [ Links ]
23. Goyal AK, Middha SK, Sen A. Evaluation of the DPPH radical scavenging activity, total phenols and antioxidant activities in Indian wild Bambusa vulgaris "Vittata" methanolic leaf extract. J Nat Pharm 2010; 1:40-45. [ Links ]
24. Chen HJ, Inbaraj BS, Chen BH. Determination of Phenolic Acids and Flavonoids in Taraxacum formosanum Kitam by Liquid Chromatography-Tandem Mass Spectrometry Coupled with a Post-Column Derivatization Technique. Int J Mol Sci 2012; 13(1):260-85. [ Links ]
25. Harrinson H, Mitchell T, Peterson JK, Wechter P, Majetich GF, Snook ME. Contents of caffeoylquinic acid compounds in the storage roots of sixteen sweetpotato genotypes and their potential biological activity. J Amer Soc Hort Sci 2008; 133(4):492-500. [ Links ]
26. Simirgiotis MJ, Caligari PDS, Schmeda-Hirschmann G. Identification of phenolic compounds from the fruits of the mountain papaya Vasconcellea pubescens A. DC. grown in Chile by liquid chromatography-UV detection-mass spectrometry. Food Chemistry 2009; 115:775-84. [ Links ]
27. Lorenz P, Conrad J, Bertrams J, Berger M, Duckstein S, Meyer U, et al. Investigations into the Phenolic Constituents of Dog's Mercury (Mercurialis perennis L.) by LC-MS/MS and GC-MS analyses. Phytochem. Anal 2012; 23(1):60-71. [ Links ]
28. Adam M, Juklová M, Bajer T, Eisner A, Ventura KJ. Comparison of three different solid-phase microextraction fibres for analysis of essential oils in yacón (Smallanthus sonchifolius) leaves. J Chromatogr A 2005; 1084(1-2):2-6. [ Links ]
29. Li J, Lan H, Zheng M, Rong T. GC-MS analysis of the chemical constituents of the essential oil from the leaves of yacón (Smallanthus sonchifolia). Front Agric China 2009; 3(1):40-2. [ Links ]
30. Ruberto G, Baratta MT. Antioxidant activity of selected essential oil components in two lipid model systems. Food Chemistry 2000; 69:167-74. [ Links ]
31. Huang CC, Wang HF, Chen CH, Chen YJ, Yih KH. A study of four antioxidant activities and major chemical component analyses of twenty-five commonly used essential oils. J Cosmet Sci 2011; 62(4):393-404. [ Links ]
32. Sahin Basak S, Candan F. Effect of Laurus nobilis L. Essential Oil and its Main Components on a-glucosidase and Reactive Oxygen Species Scavenging Activity. Iran J Pharm Res 2013; 12(2):367-79. [ Links ]
33. Valentová K, Sersen F, Ulrichová J. Radical scavenging and anti-lipoperoxidative activities of Smallanthus sonchifolius leaf extracts. J Agric Food Chem 2005; 53(14):5577-82. [ Links ]
34. Jirovský D, Horáková D, Kotoucek M, Valentová K, Ulrichová J. Analysis of phenolic acids in plant materials using HPLC with amperometric detection at a platinum tubular electrode. J Sep Sci 2003; 26:739-42. [ Links ]
35. Lachman J, Hejtmánková A, Dudjak J, Fernández EC, Pivec V. Content of polyphenolic antioxidants and phenolcarboxylic acids in selected organs of yacón [Smallanthus sonchifolius (Poepp. et Endl.) H. Robinson]. In: Blatná J, Horna A, editors. Vitamins 2003, Proceeding of Conf. Pardubice, Czech Republic, 15-17 September 2003. Pardubice: Univerzita Pardubice; 2003. p. 89-97. [ Links ]
36. Oboh G, Agunloye OM, Adefegha SA, Akinyemi AJ, Ademiluyi AO. Caffeic and chlorogenic acids inhibit key enzymes linked to type 2 diabetes (in vitro): a comparative study. J Basic Clin Physiol Pharmacol 2014 May 12. [ Links ]
37. Dalar A, Türker M, Zabaras D, Konczak I. Phenolic composition, antioxidant and enzyme inhibitory activities of Eryngium bornmuelleri leaf. Plant Foods Hum Nutr 2014; 69(1):30-6. [ Links ]













