Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.13 no.2 Manizales July/Dec. 2014
MAIN REPAIR MECHANISMS FOR DAMAGES IN THE DNA MOLECULE
Yaliana Tafurt Cardona1
Maria Aparecida Marin Morales2
1 MSc. Estudiante de doctorado del programa de Biología Celular y Molecular. Laboratorio de Mutagénesis Ambiental. Instituto de Biociencias. Universidad Estadual Paulista "Júlio de Mesquita Filho" - campus de Rio Claro/SP, Brasil.
2 Ph.D. Profesor Asociado. Laboratorio de Mutagénesis Ambiental. Instituto de Biociencias. Universidad Estadual Paulista "Júlio de Mesquita Filho"- campus de Rio Claro/SP, Brasil. Dedicación exclusiva en investigación y docencia. Correo electrónico: mamm@rc.unesp.br
Las células cuentan con mecanismos complejos que vigilan la integridad del ADN, activando mecanismos de reparación cuando hay deficiencias o errores durante la replicación. Una consecuencia potencial de los daños son las alteraciones permanentes en la estructura del ADN que pueden generar mutaciones, transformación carcinogénica y muerte celular. Estos son atribuidos a diferentes agentes endógenos como los radicales libres de oxígeno (RLO) provenientes de la respiración, los cuales son considerados el centro de la carcinogénesis y el envejecimiento por daño genómico; agentes exógenos como la luz ultravioleta que inducen dímeros de pirimidina y la radiación ionizante que produce una gran variedad de daños sobre las bases, muchos de ellos por efecto indirecto.
También se encuentran las genotoxinas presentes en los alimentos, humo de tabaco y agentes quimioterapéuticos, con grandes cualidades para alterar la estructura de la molécula ADN e interferir con su expresión. De esta manera, cerca de 105 lesiones espontáneas por día son inducidas en nuestros genes, en donde los mecanismos de reparación detectan daños y perturbaciones durante el crecimiento y división celular. Esto es posible gracias a las funciones específicas de reconocimiento, corrección o eliminación de daños que asegura la integridad del genoma. En este artículo se presentan los principales mecanismos de reparación del ADN, su relación y activación de acuerdo al tipo de daño.
Palabras clave: reparación directa, reparación indirecta, quiebres en doble cadena, reparación inducida.
ABSTRACTCells have complex mechanisms that monitor DNA integrity that activate repair mechanisms when there are deficiencies or errors during replication. A potential result of the damage is a permanent alteration in DNA structure that can generate mutations, carcinogenic transformation and cell death. These are attributed to different endogenous agents such as oxygen free radicals (OFR) from respiration, which are considered the center of carcinogenesis and aging process due to genomic damage; exogenous agents, such as ultraviolet light, induce pyrimidine dimers and ionizing radiation that produce a variety of damage on the bases, many by indirect effect.
Genotoxins present in food, tobacco and chemotherapeutic agents are also found with high potential in altering the DNA molecule structure and interfering with its expression. Thus, around 105 spontaneous lesions are induced per day in our genes, where the repair mechanisms can detect damages and disturbances during cell growth and division. This is possible thanks to the specific recognition, correction or elimination of damage functions, ensuring the integrity of the genome. In this article the main mechanisms of DNA repair, as well as their relationship and activation according to the type of damage, are presented.
Key words: direct repair, indirect repair, double-strand breaks repair, induced repair.
Los daños en el ADN pueden generar cambios en la expresión de genes, crecimiento celular e incluso tumores (1, 2). Estos daños pueden ser atribuidos a diversos procesos metabólicos endógenos, que producen radicales libres de oxígeno (RLO) y nitrógeno (RLN) altamente reactivos, que alteran bases y atacan directamente el ADN (3). Además de estos agentes generados endógenamente encontramos los agentes genotóxicos exógenos, tales como la luz ultravioleta y otros tipos de radiación (X, y, rayos cósmicos), aminas aromáticas, hidrocarburo de arilo, cloruro de vinilo y ciertos metales que generan, directamente o indirectamente, daños en la molécula de ADN (4, 5). Se ha estimado que cada célula puede experimentar hasta 105 lesiones espontáneas en un día, lo cual indica que la molécula de ADN es constantemente agredida y alterada por distintos factores (6).
Las células cuentan con mecanismos complejos que vigilan la integridad del ADN activando vías de reparación, básicamente cuando ocurren errores durante la replicación celular. De esta forma, la respuesta celular por daños en el ADN y su reparación es mediada por vías de señalización, que requiere múltiples proteínas sensoras, transductoras y efectoras, en una red de interacción de diferentes vías de reparo (7, 8). Los procesos de reparación del ADN reconocen, remueven y reparan errores en la molécula, constituyendo los principales mecanismos celulares que garantizan la estabilidad genética y, consecuentemente, la propia supervivencia de la célula (9). A continuación se presenta una revisión de los principales mecanismos de reparación de la molécula de ADN en los seres vivos y su activación frente a agentes genotóxicos, que pueden tornarse mutagénicos si no son reparados correctamente.
La reparación directa es realizada por la acción de una única enzima capaz de reparar la lesión, sin necesidad de substituir la base dañada. Así, la estructura original de la molécula del ADN revierte la lesión. Existen tres mecanismos en la reparación directa: fotorreactivación, alquiltransferencia y desmetilación oxidativa (10).
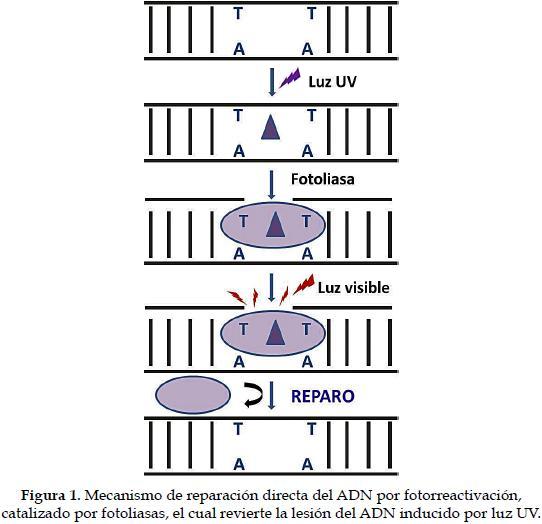
a) FotorreactivaciónLa radiación UV (longitud de onda entre 250 y 320 nm), puede ocasionar alteraciones químicas en las bases del ADN. Los fotoproductos de estas reacciones originan los dímeros de pirimidinas ciclobutano (CPD), pirimidina (6,4) y pirimidonina (6,4 PP) que causan efectos deletéreos como la inhibición de la replicación y de la transcripción, el aumento en la aparición de mutaciones, la detención del ciclo celular y la muerte celular (11). Los efectos mutagénicos generados por la radicación UV son invertidos por un proceso llamado fotorreactivación (Figura 1), catalizado por una fotoliasa, que posee dos cromóforos que captan un fotón, cuya energía es utilizada para revertir el dímero, es decir quiebra el enlace covalente entre las pirimidinas reparando el daño en el ADN (12). Las fotoliasas han sido encontradas en bacterias, hongos, plantas y vertebrados, excepto en mamíferos placentarios (13). El genoma humano tiene dos genes CRY (genes que codifican para la proteína cryptochroma) homólogos a las fotoliasas, los cuales codifican fotorreceptores de luz en la regulación del ritmo circadiano, pero no en la fotorreactivación de daños al DNA (14).
b) Alquiltransferencia
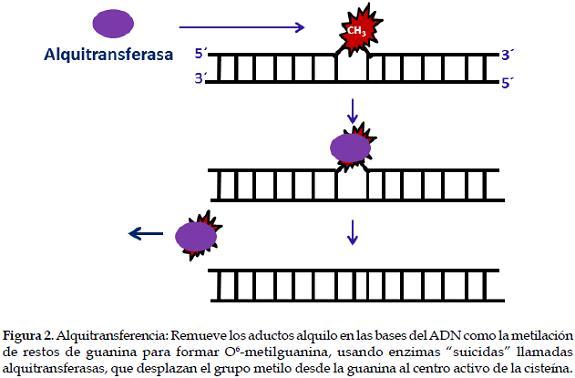
Este mecanismo es reconocido por la remoción de aductos alquilo en las bases del ADN. Generalmente estos grupos son incorporados al ADN como agentes químicos alquilantes (compuestos electrofílicos altamente reactivos con afinidad por centros nucleofílicos en macromoléculas orgánicas) (15) como el metil-metano-sulfonato (MMS) o enzimáticos (metilasas) (10). Una de las alteraciones más conocidas en el ADN es la metilación de restos de guanina para formar O6-metilguanina para lo cual la célula utiliza enzimas "suicidas" llamadas alquitransferasas, que desplazan el grupo metilo desde la guanina al centro activo de la cisteína, llevando a la inactivación irreversible de la proteína O6-metilguanina-ADN metiltransferasa (MGMT) (16, 17) (Figura 2).
c) Desmetilación oxidativa
Este tipo de reparación remueve daños por metilaciones en el ADN que pueden ser citotóxicas y con frecuencia presentan acción mutagénica, causada por compuestos nocivos que se producen de forma endógena como estrés oxidativo, inflamación, peroxidación de lípidos, infecciones y otros procesos metabólicos naturales como la alteración de la microbiota intestinal (18, 19). Todos los organismos tienen múltiples estrategias de reparación para contrarrestar daños al ADN, como por ejemplo las alquilaciones (20), esta respuesta ha sido ampliamente estudiada en E. coli, específicamente la proteína AlkB, la cual se encarga de desmetilar oxidativamente las bases lesionadas, revertiéndolas para adenina y citosina respectivamente, liberando el grupo metilo en formaldehído (21). Esta forma de reparación ha sido conservada desde las bacterias hasta el hombre, en el que han sido identificados homólogos de AlkB, como ABH1, ABH2 y ABH3 (22, 23).
Los sistemas de reparación indirecta son aquellos que intervienen sobre el ADN, durante la replicación (fase S del ciclo celular), transcripción o sobre hebras de ADN fragmentadas. La ADN polimerasa y algunos de los componentes moleculares del mecanismo de replicación, llevan a cabo la supervisión de la copia recién sintetizada (24). Puesto que el ADN se replica de una forma semi-conservativa, cada hebra de esta molécula genera una nueva, lo cual permite que los errores introducidos durante la replicación puedan ser corregidos por los mecanismos de reparación por escisión de la lesión (25). Por lo tanto, si los nucleótidos en una hebra presentan un daño, pueden ser eliminados utilizando como molde a la cadena complementaria para la síntesis de la reparación. Existen tres mecanismos en la reparación indirecta: reparación por escisión de bases o BER (Base Excision Repair), reparación por escisión de nucleótidos o NER (Nucleotide Excision Repair) y reparación por apareamiento erróneo (Mitsmach Repair). El principio de los tres mecanismos de reparación implica: corte, empalme de la región dañada e inserción de nuevas bases, seguido por la ligación de la cadena (26).
a) Reparación por escisión de bases - BER (Base Excision Repair)Es una vía de reparación del ADN que corrige daños oxidativos, derivados de la alquilación celular y despurinizaciones espontáneas. Es utilizada por la célula para la protección contra daños y pérdidas de bases generando sitios apurínicos o apirimidínicos, más conocidos como sitios AP (27), los cuales pueden ser mutagénicos y citotóxicos si no son reparados correctamente, tornándose una amenaza para la viabilidad celular e integridad genómica puesto que pueden bloquear la replicación o la transcripción (28). A lo largo de la evolución la célula ha seleccionado mecanismos para preservar y reducir el daño en el ADN, tal es el caso de la reparación BER, donde la base alterada es retirada del ADN por enzimas llamadas glicosilasas, que reconocen y remueven la escisión de bases con daños específicos (29). En células de mamíferos existen 11 diferentes tipos de glicosilasas que presentan características y modos de acción diferentes (30), las cuales rompen el enlace glicosídico que une la base con el azúcar, originando un sitio AP. Después de ser retirada la base por la acción de la glicosilasa específica, el sitio AP es reconocido por una AP-endonucleasa de la clase II, una enzima capaz de eliminar el resto del nucleótido ya sea por eliminación Beta o por hidrólisis produciendo un corte (31); posteriormente, una exonucleasa degrada el corte y deja un espacio en la cadena que es reparado por la ADN polimerasa y finalmente sellado por la ligasa, que restaura la integridad de la molécula (32, 33) (Figura 3).
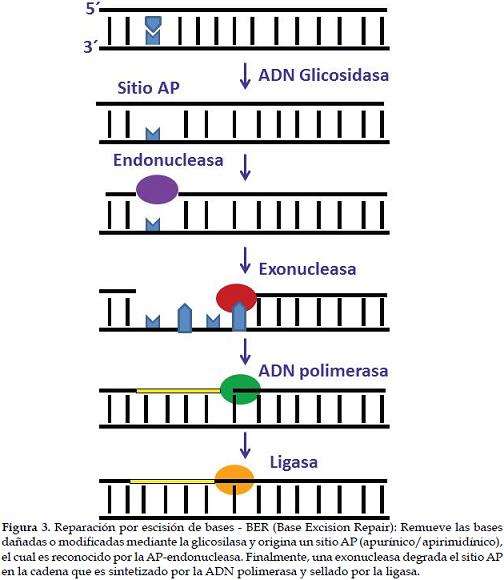
En cada célula humana se generan diariamente aproximadamente 10.000 sitios AP que son reparados por una máquina proteica, el reparosoma, formado por cuatro proteínas que actúan así: la UDG (Uracil-DNA glicosilasa, que elimina el uracilo), APE1 (AP-endonucleasa humana, que corta la cadena azúcar-fosfato y funciona como un factor de reducción-oxidación (redox) y mantiene los factores de transcripción en un estado activo reducido (32), la polimerasa B (que introduce el nucleótido que faltaba) y la ligasa (que sella el corte) (34, 35).
b) Reparación por escisión de nucleótidos - NER (Nucleotide Excision Repair)Es un mecanismo versátil que ha sido ampliamente estudiado en los seres humanos. Repara daños en el ADN causados por la radiación UV, agentes mutagénicos, quimioterapia, entre otros (36). En este mecanismo de reparación participan diferentes proteínas, 4 en procariotas (UvrA, UvrB, UvrC y UvrD) (37) y más de 30 en mamíferos (36).
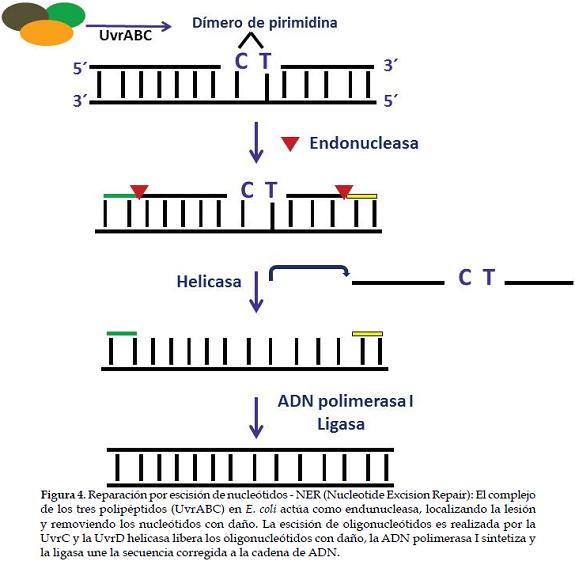
El complejo de polipéptidos (UvrABC) actúa como endunucleasa, localizando la lesión y removiendo los nucleótidos con daño (2). El proceso inicia con la proteína UvrA que es la primera en unirse y reconocer el daño en el ADN el cual no es especifico, debido a que identifica una distorsión en la molécula de ADN y no la secuencia errónea de nucleótidos, lo que permite corregir una amplia variedad de daños (37). Por lo tanto, la lesión es reconocida por un complejo de heterodímeros compuesto por dos moléculas UvrB con un dímero de UvrA2 (complejo UvrA2+UvrB2) que causa la desnaturalización local de la lesión. Posteriormente, UvrB se adhiere al sitio de la lesión y se disocia de UvrA2 (38). UvrC se une a la cadena con daño, promoviendo dos escisiones en la misma (37). Finalmente, UvrD (helicasa II) remueve el segmento de oligonucleótidos lesionados y la ADN polimerasa I sintetiza los correctos que son unidos por la ligasa (39) (Figura 4).
El mecanismo NER en eucariotas presenta las siguientes etapas: realiza un reconocimiento del daño en el ADN, donde actúan al menos 4 complejos diferentes (XPC, DDB, XPA y RPA) que cumplen con esta función. Posteriormente, reclutan complejos de reparación a través de la acción de las helicasas (XPB y XPD), induciendo una incisión en la hebra con daño por acción de las nucleasas (XPG y ERCC1-XPF), en un fragmento de 24 a 32 nucleótidos (40). Posteriormente, la síntesis y ligación son realizadas por la ADN polimerasa I y la ligasa (39).
En eucariotas existen dos alternativas de reparación NER, global genome repair (GGR) y transcription coupled repair (TCR). Estas vías son iniciadas de manera diferente conforme al daño del ADN. El GGR es un proceso aleatorio que se produce lentamente, activado en regiones que no transcriben, mientras el TCR es un proceso que está estrechamente relacionado con la RNA polimerasa II, altamente específico y eficiente el cual es activado en zonas de transcripción (36). La deficiencia de estas vías de reparación está relacionada al síndrome de Cockayne (CS), xeroderma pigmentoso (XP), cáncer e inestabilidad genómica (27).
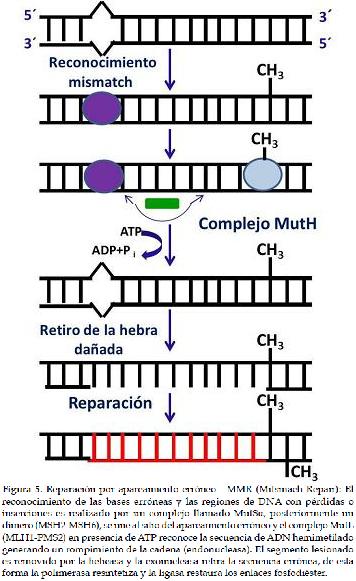
c) Reparación por apareamiento erróneo - MMR (Mitsmach Repair)El mecanismo de reparación de errores de apareamiento (MMR), es responsable de remover las bases desapareadas, causadas por daños espontáneos, desaminación de bases, oxidación, metilación y daños en los procesos de replicación o recombinación (41). La importancia del MMR radica en mantener la estabilidad genómica y reducir las mutaciones durante la replicación, puesto que individuos con mutaciones relacionadas al MMR, presentan una alta predisposición de tumores, síndromes y cáncer (42).
El MMR en eucariotas y en la mayoría de las bacterias dirige la reparación de la hebra con error, mediante el reconocimiento de las discontinuidades de cadena (43). En E. coli este sistema ha sido completamente reconstruido in vitro, involucrando tres proteínas especificas (MutS, MutL, y MutH) que aumentan la precisión de la replicación del ADN de 20-400 veces (44). El MMR presenta complejas reacciones que comprometen múltiples proteínas, el reconocimiento de la lesión es realizado por un complejo llamado MutSa, compuesto por la unión de dos proteínas homólogas que forman un dímero (MSH2-MSH6), el cual se une al sitio del apareamiento erróneo (41). Posteriormente, el complejo MutL (MLH1-PMS2) en presencia de ATP, reconoce la secuencia de ADN hemimetilado generando un rompimiento de la cadena debido a su actividad de endonucleasa. El segmento lesionado es removido por la helicasa UvrD y degradado por una exonucleasa, finalmente la síntesis y ligación es realizada por ADN polimerasa III y la ADN ligasa (45) (Figura 5).
Uno de los daños más severos al ADN, son los cortes en cadena doble (DSB), los cuales surgen por múltiples causas, tanto endógenas como exógenas (46). Los DSB pueden inducir inestabilidad genómica por translocaciones y pérdida de material genético, entre otros (47). En eucariotas un DSB no reparado puede provocar la inactivación de un gen esencial, lo cual es suficiente para inducir muerte celular por apoptosis (48). Las células contienen toda una maquinaria enzimática encargada de realizar con alta efectividad la reparación de DSB (49). Sin embargo, cuando este sistema falla o alguna proteína esencial no está presente, el corte puede persistir y provocar alteraciones importantes en el genoma (50). Existen dos vías principales para la reparación de DSB, la recombinación homóloga y la recombinación de extremos no homólogos, las cuales son libres y propensas a errores respectivamente (51).
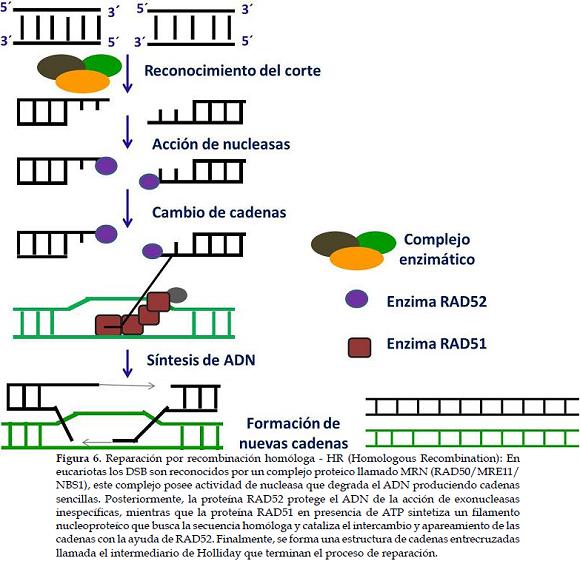
a) Reparación por recombinación homóloga - HR (Homologous Recombination)Este sistema detecta y repara daños generados por agentes químicos, físicos y radicales libres derivados de un DSB especialmente en la fase G2 del ciclo celular (52). La eficiencia de los reparos se debe a la proximidad entre las cromátidas hermanas que tienen información idéntica, de esta forma es activada una cascada de reacciones junto con las proteínas de reparo que bloquean el ciclo celular (53).
Los mecanismos moleculares de la recombinación homóloga en humanos aún son complejos, sin embargo han sido identificadas las proteínas como XRCC2, XRCC3, RAD51B, RAD51C, RAD51 (52) y las que reconocen los DSB conocidas como quinasas ATR y ATM; esta última atrajo la atención de los investigadores cuando se descubrió que su pérdida o inactivación es la responsable de la enfermedad genética humana conocida como ataxia-telangiectasia (54, 55).
En levaduras los DSB son reconocidos por un complejo proteico llamado MRN (RAD50/MRE11/NBS1) (56), actúa junto a la nucleasa Mre11 que degrada el ADN produciendo cadenas sencillas (57). Posteriormente, la proteína RAD52 protege el ADN de la acción de exonucleasas inespecíficas (proteínas o enzimas que cortan el ADN) uniéndose a los extremos de las cadenas (58). Así, la proteína RAD51 en presencia de ATP sintetiza un filamento nucleoproteíco que busca la secuencia homóloga y cataliza el intercambio y apareamiento de las cadenas con la ayuda de RAD52 (59); en humanos Rad51 es homóloga a RecA en bacterias (60). Durante esta etapa, la proteína RAD54 estimula a RAD51 en el alineamiento de cadenas, de esta forma es sintetizada la cadena, empleando como molde la secuencia homóloga que repara la información pérdida durante el DSB (61). Finalmente, se forma una estructura de cadenas entrecruzadas conocida como el intermediario de Holliday que corta y liga el proceso de reparación de forma adecuada, evitando rearreglos cromosomales (62) (Figura 6).
b) Reparación por extremos no homólogos - NHEJ (Non-Homologous End-Joining)
La reparación de quiebres de doble cadena en organismos superiores se da por extremos no homólogos, este tipo de reparación permite la unión de cadenas por sus extremos, y no necesita de secuencia complementaria u homóloga para su unión (63). El sitio de corte es reconocido por un complejo heterodímero de dos proteínas KU70 y KU80, que protegen el ADN de la acción de exonucleasas y mantienen unidas las cadenas. Posteriormente, el heterodímero es asociado por acción catalíca a la quinasa (DNA-Pkcs) que se activa por la interacción de la cadena sencilla con el DSB (64), la ligasa IV (enzima que une extremos de ADN) y XRCC4 llevan a cabo la unión de las cadenas. Finalmente, el procesamiento de los DSB es realizado por el complejo MRE11-Rad50-NBS1, que tiene actividad de exonucleasa, endonucleasa y helicasa (65) (Figura 7).

En el humano esta vía es muy eficiente para reparar DSB; sin embargo, puede provocar rearreglos cromosomales (66).
Todos los organismos pueden sufrir ataques masivos en su material genético por diversos agentes que pueden alterar la estructura química básica del ADN, como la luz ultravioleta, metabolitos, especies reactivas de oxígeno, entre otras (6). Este tipo de daños dispara mecanismos de respuesta inmediata en el ADN, que se caracterizan por tener niveles superiores de proteínas implicadas en reparación y recombinación (67). La inducción de la respuesta celular al daño implica la activación de los sistemas de puntos de control del ciclo celular, reparación del ADN, cambios en expresión génica, reconstrucción de la cromatina y apoptosis (68). En procariotas una de estas opciones es la respuesta SOS (por la señal internacional de auxilio "Save Our Souls") o sistema de emergencia celular, que ante la detección de agentes genotóxicos incrementa la expresión de un grupo de genes cuya función es la de reparar el daño en el ADN, y conferir a la célula más oportunidades de sobreponerse y sobrevivir en condiciones de estrés (69). SOS es una respuesta de emergencia celular, que consiste en inducir la expresión de más de 60 genes implicados en la reparación del ADN, y mediada por el circuito RecA/LexA (70) encargado de regular y modular importantes funciones bacterianas en procesos de reparación, con el objetivo de restaurar la división celular y con ello garantizar su supervivencia (71). La proteína LexA es un regulador negativo que reconoce una secuencia consenso en el operador, causando una represión transcripcional de todos los genes SOS, incluido su propio gen. El represor LexA se proteoliza induciendo la expresión génica SOS gracias a la presencia de RecA, el regulador positivo del circuito que es activado mediante la unión de las cadenas sencillas de ADN con ATP, después de la interacción con moléculas de señalización (72). Finalmente, una vez reparados los daños, RecA se inactiva y LexA reprime nuevamente los genes del operador (70, 73).
Según la evidencia científica, la baja tasa de mutación que existe es un indicativo de la eficiencia en los sistemas de reparo del ADN, junto a los mecanismos de señalización para detectar daños (2). La reparación eficiente de estas lesiones es, por lo tanto, un importante prerrequisito para mantener la integridad del material genético, permitiendo la identificación de agentes carcinogénicos, genotóxicos y mutagénicos en el ser humano, donde la célula integra una estrategia global para reparar daños espontáneos y ambientales, que conllevan a la inestabilidad genómica (74). Por lo tanto, estos mecanismos de reparación actúan como defensa frente a carcinógenos ambientales, fármacos terapéuticos, respuesta celular y susceptibilidad individual a agentes tóxicos.
Los autores agradecen al programa de apoyo a estudiantes de doctorado del exterior (PAEDEX/AUIP/PROPG).
1. Chang DJ, Cimprich KA. DNA damage tolerance: when it's OK to make mistakes. Nat Chem Biol 2009; 5(2):82-90. [ Links ]
2. Poirier MC, Weston A. DNA Damage, DNA Repair, and Mutagenesis. In: Joseph R. Bertino, editor. Encyclopedia of Cancer. Second Edition. New York: Academic Press; 2002. p. 79-87. [ Links ]
3. Watson NB, McGregor WG. Cellular Responses to DNA Damage. In: Charlene A. McQueen, editor. Comprehensive Toxicology. Second Edition. Oxford: Elsevier; 2010. p. 377-402. [ Links ]
4. Kryston TB, Georgiev AB, Pissis P, Georgakilas AG. Role of oxidative stress and DNA damage in human carcinogenesis. Mutat Res 2011; 711(1-2):193-201. [ Links ]
5. Hartwig A, Schwerdtle T. Interactions by carcinogenic metal compounds with DNA repair processes: toxicological implications. Toxicology Letters 2002; 127(1-3):47-54. [ Links ]
6. Hoeijmakers JHJ. DNA damage, aging, and cancer. N Engl J Med 2009; 361(15):1475-85. [ Links ]
7. O'Connor MJ, Martin NMB, Smith GCM. Targeted cancer therapies based on the inhibition of DNA strand break repair. Oncogene 2007; 26(56):7816-24. [ Links ]
8. Harper JW, Elledge SJ. The DNA Damage Response: Ten Years After. Molecular Cell 2007; 28(5):739-45. [ Links ]
9. Wilson III DM, Wong H-K, McNeill DR, Fan J. DNA Repair. In: Geoffrey J. Laurent, Steven D. Shapiro, editors. Encyclopedia of Respiratory Medicine. Oxford: Academic Press; 2006. p. 30-37. [ Links ]
10. Agnez-Lima LF, Medeiros SRB, Marquez RCP, Pinheiro MM, Menck CFM. Processos de reparo de DNA: garantindo a estabilidade do material genético. In: Valter Kuchenbecker, Director. Mutagênese Ambiental. 1st ed. Universidade Luterana do Brasil: ULBRA; 2003. p. 49-80. [ Links ]
11. Thompson CL, Sancar A. Photolyase/cryptochrome blue-light photoreceptors use photon energy to repair DNA and reset the circadian clock. Oncogen 2002; 21(58):9043-56. [ Links ]
12. Deisenhofer J. DNA photolyases and cryptochromes. Mutat Res 2000; 460(3-4):143-9. [ Links ]
13. Thiagarajan V, Villette S, Espagne A, Eker APM, Brettel K, Byrdin M. DNA repair by photolyase: a novel substrate with low background absorption around 265 nm for transient absorption studies in the UV. Biochemistry 2010; 49(2):297-303. [ Links ]
14. Sancar A. Cryptochrome: the second photoactive pigment in the eye and its role in circadian photoreception. Annu Rev Biochem 2000; 69:31-67. [ Links ]
15. Hazlehurst LA, Dalton WS. De Novo and Acquired Resistance to Antitumor Alkylating Agents. In: Teicher BA, editor. Cancer Drug Resistance. Humana Press; 2006. p. 377-89. [ Links ]
16. Margison GP, Povey AC, Kaina B, Koref S, F M. Variability and Regulation of O6-Alkylguanine-DNA Alkyltransferase. Carcinogenesis 2003; 24(4):625-35. [ Links ]
17. Pegg AE, Dolan ME, Moschel RC. Structure, Function, and Inhibition of O6-Alkylguanine-DNA Alkyltransferase. Progress in Nucleic Acid Research and Molecular Biology. Academic Press; 1995. p. 167-223. [ Links ]
18. Nakamura J, Mutlu E, Sharma V, Collins L, Bodnar W, Yu R, et al. The endogenous exposome. DNA Repair (Amst) 2014. p. 3-13. [ Links ]
19. Barnes DE, Lindahl T. Repair and Genetic Consequences of Endogenous DNA Base Damage in Mammalian Cells. Annual Review of Genetics 2004; 38(1):445-76. [ Links ]
20. Sedgwick B, Lindahl T. Recent progress on the Ada response for inducible repair of DNA alkylation damage. Oncogene 2002; 21(58):8886-94. [ Links ]
21. Duncan T, Trewick SC, Koivisto P, Bates PA, Lindahl T, Sedgwick B. Reversal of DNA alkylation damage by two human dioxygenases. Proc Natl Acad Sci USA 2002; 99(26):16660-5. [ Links ]
22. Drabløs F, Feyzi E, Aas PA, Vaagbø CB, Kavli B, Bratlie MS, et al. Alkylation damage in DNA and RNA-repair mechanisms and medical significance. DNA Repair (Amst) 2004; 3(11):1389-407. [ Links ]
23. Aas PA, Otterlei M, Falnes PO, Vågbø CB, Skorpen F, Akbari M, et al. Human and bacterial oxidative demethylases repair alkylation damage in both RNA and DNA. Nature 2003; 421(6925):859-63. [ Links ]
24. Yang C-G, Garcia K, He C. Damage Detection and Base Flipping in Direct DNA Alkylation Repair. Chembiochem 2009; 10(3):417-23. [ Links ]
25. Subba Rao K, Loeb LA. DNA damage and repair in brain: relationship to aging. Mutation Research/DNAging 1992; 275(3-6):317-29. [ Links ]
26. Friedberg EC. DNA damage and repair. Nature 2003; 421(6921):436-40. [ Links ]
27. Hoeijmakers JH. Genome maintenance mechanisms for preventing cancer. Nature 2001; 411(6835):366-74. [ Links ]
28. Brooks B, O'Brien TJ, Ceryak S, Wise JP, Wise SS, Wise JP, et al. Excision repair is required for genotoxin-induced mutagenesis in mammalian cells. Carcinogenesis 2008; 29(5):1064-9. [ Links ]
29. Schärer OD, Jiricny J. Recent progress in the biology, chemistry and structural biology of DNA glycosylases. BioEssays 2001; 23(3):270-81. [ Links ]
30. Christmann M, Tomicic MT, Roos WP, Kaina B. Mechanisms of human DNA repair: an update. Toxicology 2003; 193(1-2):3-34. [ Links ]
31. Kazak L, Reyes A, Holt IJ. Minimizing the damage: repair pathways keep mitochondrial DNA intact. Nat Rev Mol Cell Biol 2012; 13(10):659-71. [ Links ]
32. Wiederhold L, Leppard JB, Kedar P, Karimi-Busheri F, Rasouli-Nia A, Weinfeld M, et al. AP Endonuclease-Independent DNA Base Excision Repair in Human Cells. Molecular Cell 2004; 15(2):209-20. [ Links ]
33. Slupphaug G, Kavli B, Krokan HE. The interacting pathways for prevention and repair of oxidative DNA damage. Mutat Res 2003; 531(1-2):231-51. [ Links ]
34. Hakem R. DNA-damage repair; the good, the bad, and the ugly. The EMBO Journal 2008; 27(4):589-605. [ Links ]
35. Tomkinson AE, Chen L, Dong Z, Leppard JB, Levin DS, Mackey ZB, et al. Completion of base excision repair by mammalian DNA ligases. In: Kivie Moldave SM, editor. Progress in Nucleic Acid Research and Molecular Biology. Academic Press; 2001. p. 151-64. [ Links ]
36. Leibeling D, Laspe P, Emmert S. Nucleotide excision repair and cancer. J Mol Histol 2006; 37(5-7):225-38. [ Links ]
37. Truglio JJ, Croteau DL, Van Houten B, Kisker C. Prokaryotic Nucleotide Excision Repair: The UvrABC System. Chem Rev 2006; 106(2):233-52. [ Links ]
38. Truglio JJ, Karakas E, Rhau B, Wang H, DellaVecchia MJ, Van Houten B, et al. Structural basis for DNA recognition and processing by UvrB. Nat Struct Mol Biol 2006; 13(4):360-4. [ Links ]
39. Kad NM, Wang H, Kennedy GG, Warshaw DM, Van Houten B. Collaborative Dynamic DNA Scanning by Nucleotide Excision Repair Proteins Investigated by Single-Molecule Imaging of Quantum-Dot-Labeled Proteins. Mol Cell 2010; 37(5):702-13. [ Links ]
40. Wood RD, Mitchell M, Lindahl T. Human DNA repair genes, 2005. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis 2005; 577(1-2):275-83. [ Links ]
41. Modrich P, Lahue R. Mismatch Repair in Replication Fidelity, Genetic Recombination, and Cancer Biology. Annual Review of Biochemistry 1996; 65(1):101-33. [ Links ]
42. Harfe BD, Jinks-Robertson S. DNA mismatch repair and genetic instability. Annu Rev Genet 2000; 34:359-99. [ Links ]
43. Fukui K. DNA Mismatch Repair in Eukaryotes and Bacteria. J Nucleic Acids 2010, 1-16. [ Links ]
44. Schaaper RM. Base selection, proofreading, and mismatch repair during DNA replication in Escherichia coli. J Biol Chem 1993; 268(32):23762-5. [ Links ]
45. Hsieh P. Molecular mechanisms of DNA mismatch repair. Mutation Research/DNA Repair 2001; 486(2):71-87. [ Links ]
46. Orozco MC, Farías R, Loeza P, Santoyo G. Cancer: The importance of repairing DNA double strand breaks and perspectives from the pharmacogenomics. Revista Mexicana de Ciencias Farmacéuticas 2010; 2:7-14. [ Links ]
47. Lips J, Kaina B. DNA double-strand breaks trigger apoptosis in p53-deficient fibroblasts. Carcinogenesis 2001; 22(4):579-85. [ Links ]
48. Rich T, Allen RL, Wyllie AH. Defying death after DNA damage. Nature 2000; 407(6805):777-83. [ Links ]
49. Lieberman HB. DNA damage repair and response proteins as targets for cancer therapy. Curr Med Chem 2008; 15(4):360-7. [ Links ]
50. Haber JE. Partners and pathways: repairing a double-strand break. Trends in Genetics 2000; 16(6):259-64. [ Links ]
51. Pâques F, Haber JE. Multiple Pathways of Recombination Induced by Double-Strand Breaks in Saccharomyces cerevisiae. Microbiol Mol Biol Rev 1999; 63(2):349-404. [ Links ]
52. Thompson LH, Schild D. Homologous recombinational repair of DNA ensures mammalian chromosome stability. Mutat Res 2001; 477(1-2):131-53. [ Links ]
53. Frankenberg-Schwager M, Gebauer A, Koppe C, Wolf H, Pralle E, Frankenberg D. Single-strand annealing, conservative homologous recombination, nonhomologous DNA end joining, and the cell cycle-dependent repair of DNA double-strand breaks induced by sparsely or densely ionizing radiation. Radiat Res 2009; 171(3):265-73. [ Links ]
54. Lavin MF. Ataxia-telangiectasia: from a rare disorder to a paradigm for cell signalling and cancer. Nat Rev Mol Cell Biol 2008; 9(10):759-69. [ Links ]
55. Khanna KK, Jackson SP. DNA double-strand breaks: signaling, repair and the cancer connection. Nat Genet 2001; 27(3):247-54. [ Links ]
56. Iijima K, Ohara M, Seki R, Tauchi H. Dancing on damaged chromatin: functions of ATM and the RAD50/MRE11/NBS1 complex in cellular responses to DNA damage. J Radiat Res 2008; 49(5):451-64. [ Links ]
57. D'Amours D, Jackson SP. The MRE11 complex: at the crossroads of DNA repair and checkpoint signalling. Nat Rev Mol Cell Biol 2002; 3(5):317-27. [ Links ]
58. Aylon Y, Kupiec M. DSB repair: the yeast paradigm. DNA Repair (Amst) 2004; 3(8-9):797-815. [ Links ]
59. Conway AB, Lynch TW, Zhang Y, Fortin GS, Fung CW, Symington LS, et al. Crystal structure of a Rad51 filament. Nat Struct Mol Biol 2004; 11(8):791-6. [ Links ]
60. Van Komen S, Petukhova G, Sigurdsson S, Stratton S, Sung P. Superhelicity-Driven Homologous DNA Pairing by Yeast Recombination Factors Rad51 and Rad54. Molecular Cell 2000; 6(3):563-72. [ Links ]
61. Li X, Heyer W-D. RAD54 controls access to the invading 3'-OH end after RAD51-mediated DNA strand invasion in homologous recombination in Saccharomyces cerevisiae. Nucleic Acids Res 2009; 37(2):638-46. [ Links ]
62. Constantinou A, Davies AA, West SC. Branch Migration and Holliday Junction Resolution Catalyzed by Activities from Mammalian Cells. Cell 2001; 104(2):259-68. [ Links ]
63. Cahill D, Connor B, Carney JP. Mechanisms of eukaryotic DNA double strand break repair. Front Biosci 2006; 11:1958-76. [ Links ]
64. Hammarsten O, DeFazio LG, Chu G. Activation of DNA-dependent protein kinase by single-stranded DNA ends. J Biol Chem 2000; 275(3):1541-50. [ Links ]
65. Maser RS, Monsen KJ, Nelms BE, Petrini JH. hMre11 and hRad50 nuclear foci are induced during the normal cellular response to DNA double-strand breaks. Mol Cell Biol 1997; 17(10):6087-96. [ Links ]
66. Gunn A, Bennardo N, Cheng A, Stark JM. Correct end use during end joining of multiple chromosomal double strand breaks is influenced by repair protein RAD50, DNA-dependent protein kinase DNA-PKcs, and transcription context. J Biol Chem 2011; 286(49):42470-82. [ Links ]
67. Rodríguez-Beltrán J, Rodríguez-Rojas A, Guelfo JR, Couce A, Blázquez J. The Escherichia coli SOS Gene dinF Protects against Oxidative Stress and Bile Salts. PLoS One 2012; 7(4). [ Links ]
68. Gaziev AI. Low efficiency of repair of critical DNA damage induced by low doses of radiation. Radiats Biol Radioecol 2011; 51(5):512-29. [ Links ]
69. Janion C. Inducible SOS Response System of DNA Repair and Mutagenesis in Escherichia coli. International Journal of Biological Sciences 2008; 4(6):338-44. [ Links ]
70. Fernández De Henestrosa AR, Ogi T, Aoyagi S, Chafin D, Hayes JJ, Ohmori H, et al. Identification of additional genes belonging to the LexA regulon in Escherichia coli. Mol Microbiol 2000; 35(6):1560-72. [ Links ]
71. Sutton MD, Smith BT, Godoy VG, Walker GC. The SOS response: recent insights into umuDC-dependent mutagenesis and DNA damage tolerance. Annu Rev Genet 2000; 34:479-97. [ Links ]
72. Sermet JH, Breña M, Espinosa J. La respuesta SOS en Escherichia coli. Revista Especializada en Ciencias Químico-Biológicas 2005; 8(2):99-105. [ Links ]
73. Courcelle J, Khodursky A, Peter B, Brown PO, Hanawalt PC. Comparative gene expression profiles following UV exposure in wild-type and SOS-deficient Escherichia coli. Genetics 2001; 158(1):41-64. [ Links ]
74. Bernstein C, Bernstein H, Payne CM, Garewal H. DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis. Mutat Res 2002; 511(2):145-78. [ Links ]













