Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.13 no.2 Manizales July/Dec. 2014
AGGRESSIVE SCALY ERYTRODERMA, ADVERSE REACTION IN A PATIENT TREATED WITH HYDROCHLOROTHIAZIDE: A CASE REPORT
Camilo Guzmán Terán1
Hiltony Villa Dangond2
Omar Torres Ayazo3
1 Químico Farmacéutico. MSc. Estudiante de Doctorado en Medicina Tropical. Profesor Facultad Ciencias de la Salud. Universidad de Córdoba. Montería, Colombia. Autor para correspondencia. Correo electrónico: cguzman40@hotmail.com
2 Químico Farmacéutico. MSc. en farmacia hospitalaria. Profesor Facultad Ciencias de la Salud. Universidad de Córdoba. Montería, Colombia.
3 Químico. MSc. Profesor Facultad Ciencias de la Salud. Universidad de Córdoba. Montería, Colombia.
Se describe un caso clínico de un hombre de 69 años, hipertenso que recibió tratamiento con hidroclorotiaziada 25 mg día y desarrolló una reacción adversa compatible con una eritrodermia descamativa. El paciente experimentó mejoría clínica y resolución total de sus problemas cutáneos cuando finalizó el uso de la hidroclorotiazida.
Palabras clave: diurético, urticaria, eritema, farmacovigilancia (fuente: DeCS).
ABSTRACTThe clinical case of a 69 year old man having high blood pressure who was treated with hydrochlorothiazide at 25 mg per day and who developed an adverse reaction compatible with scaly erythroderma is described. The patient underwent clinical recovery and total solution to his skin problems when the use of hydrochlorothiazide was susupended.
Key words: diuretic, urticaria, erythema, pharmacovigilance (source: MeSH).
Se estima que las reacciones adversas a medicamentos (RAM) ocupan entre el cuarto a sexto lugar de los factores que causan la muerte en Estados Unidos (1). En muchos países las RAM representan más del 10% del número total de casos de hospitalización (2). En adultos, las reacciones adversas son más comúnmente reportadas en edades medias y en pacientes con historia de consumo concomitante de varios medicamentos (3, 4). La presencia de enfermedades crónicas, malignas, inmunodeficiencias e infecciones virales severas agravan el problema (5).
La hidroclorotiazida es un diurético tiazídico frecuentemente usado en el tratamiento de presión sanguínea alta y edema de origen cardiaco, hepático y renal. Existe evidencia de reacciones adversas en productos que contienen hidroclorotiazida en etapa post-comercialización (6), sin embargo en la literatura consultada son raros los casos reportados de eritrodermia descamativa, por lo que es pertinente el reporte del caso. La identificación, prevención y manejo de las reacciones adversas se considera un aspecto de importancia en la obtención de los objetivos terapéuticos (5). La farmacovigilancia de reacciones adversas a medicamentos en la etapa de post-comercialización se ha basado generalmente en la presentación de reportes de forma espontánea y en sistemas como la presentación de informes sobre eventos adversos de la FDA (Food and Drugs Agency) en Estados Unidos y en programas de la Organización Mundial de la Salud (OMS) para la monitorización y fiscalización internacional de fármacos (7-9). Se describe un caso de reacción adversa de un paciente de 69 años, hipertenso que recibió tratamiento con hidroclorotiazida 25 mg día y desarrolló una eritrodermia descamativa severa de apariencia similar a la micosis fungoide.
Primer episodio
Paciente masculino, de 69 años de edad con hipertensión arterial, enfermedad renal crónica estadio 2, tratado con losartán 50 mg cada 12 horas, verapamilo 80 mg cada 12 horas, hidroclorotiazida 25 mg día, sin disnea ni dolor de tórax.
Segundo episodioDos meses después el paciente presentó urticaria, xerosis y eritema en zonas expuestas, consultó el servicio de dermatología y se le prescribió tratamiento tópico con una preparado magistral de corticoides y emolientes, no tuvo mejoramiento y fue remitido a medicina interna, se realizó estudio de eritrodermia y síndrome paraneoplásico, en esta etapa presentó urticaria, prurito, edema de cara y pies, eritrodermia descamativa generalizada, alopecia, y queratodermia palmoplantar. Se acompañaba de clínica sistémica con episodios de síncope y colapso, depresión y temblores. Examen físico: talla 173 m, indicé de masa muscular (IMC): 23,18, temperatura 370C, tensión arterial (TA): 120/80 mmHg, frecuencia respiratoria (FC): 82 x min, frecuencia respiratoria (FR): 20 x min. Los resultados de las pruebas de laboratorio fueron los siguientes: eosinofilia, sangre oculta en heces (guayaco o equivalente): normal, coprológico: quistes de Endolimax nana: positivos, antígenos de superficie hepatitis B: negativo; anticuerpos VIH1 y 2: negativo; inmunoglobulina E por EIA: 856,20 (aumentada) serología (prueba no treponémica) RPR en suero: no reactivo, ácido úrico: normal; deshidrogenasa láctica (LDH): 594; fosfatasa alcalina: normal; creatinina en suero: 1,45 mg/dl; albumina normal; hormona estimulante del tiroides (TSH): 1,356 (normal), antígeno específico de próstata (PSA): 2,24 (normal), antígeno de cáncer de ovario (CA 125): 8,20 (normal).
Se evidenciaron lesiones hepáticas en ecografía compatibles con MTX. El TAC abdominal demostró presencia de múltiples lesiones hepáticas de características quísticas y en opinión del internista engrosamiento de la cola del páncreas. Se remite a evaluación por cirugía oncológica y se prescribe metronidazol tableta 500 mg, una cada 8 horas por 7 días, sultamicina tabletas 375 mg, una cada 8 horas durante 7 días. El médico oncólogo ordena TAC abdominal contrastado y descarta la presencia de neoplasias; los quistes hepáticos son benignos y conceptúa que el problema no se debe a esta causa.
Tercer episodioEl paciente acude a otra ciudad con el objeto de tener otro concepto de su estado de salud, es valorado por medicina interna y dermatología, se sospecha de un caso de micosis fungoide, se tomaron muestras de piel de muslo y tórax para estudio patológico, en la descripción microscópica los cortes mostraron piel con híper y paraqueratosis, epidermis ligeramente hiperplásica con focos de espongiosis y en la dermis leve infiltrado inflamatorio perivascular superficial de tipo linfocitario. No se observaron linfocitos intraepidérmicos ni otros cambios que sugieran micosis fungoide ni compromiso por otro linfoma cutáneo. Diagnóstico: hallazgos histológicos compatibles con una eritrodermia. Se prescribió un preparado magistral compuesto por corticoides 0,05%, crema tópica 20 g mezclados con 100 g de vaselina usp, protector solar y se suspendió la hidroclorotiazida; con este esquema el paciente mejoró ostensiblemente hasta desaparecer por completo los efectos adversos.
Se han reportado reacciones adversas en productos que contienen hidroclorotiazida en etapa post-comercialización: hipersensibilidad, reacciones anafilácticas y angioedema que requieren manejo de vías respiratorias y de hospitalización, urticaria edema periférico, aumento de enzimas hepáticas con signos clínicos de disfunción hepática, reacciones adversas cutáneas graves, incluyendo el síndrome de Stevens-Johnson y necrólisis epidérmica tóxica, prurito y eritema (6). En 2007 Rubin et al. (10) señalaron que el lupus eritematoso sistémico inducido por medicamentos fue reportado por primera vez en 1952 asociado con la terapia de hidralazina para la hipertensión maligna. Desde entonces la inducción o exacerbación de características clínicas del lupus eritematoso sistémico por exposición a medicamentos ha sido considerada dentro de este contexto. Otras drogas distintas a la hidralazina, que más frecuentemente han sido implicadas como disparadoras de inducir lupus eritematoso sistémico, incluyen: procainamida, isoniazida, D-penicilamina y quinidina. Sin embargo, varias drogas de diferentes clases han sido reportadas con menor frecuencia. En 1985 Reed et al. (11) reportaron cinco pacientes que no tenían previamente características de lupus eritematoso sistémico (LES) o lupus eritematoso cutáneo y desarrollaron clínica, histopatológica e inmunológicamente lesiones de piel típicas del LES mientras tomaban hidroclorotiazida (HCTZ), las lesiones de piel de estos pacientes se dice que fueron indistinguibles de los del lupus eritematoso subagudo cutáneo (SCLE) y fueron acompañados de algunos auto-anticuerpos (Ro/SS-A y La/SSB) y el tipo de HLA (HLA-DR2 /DR3), que previamente habían sido asociados con SCLE idiopático (12, 13). Las lesiones en piel de estos cinco pacientes se resolvieron espontáneamente después de la suspensión del tratamiento con hidroclorotiazida, sin embargo los anticuerpos Ro/SS-A persistieron en cuatro pacientes. Después de la resolución de la actividad de la enfermedad en la piel, una paciente fue medicada con un diurético tiazídico relacionado y reaparecieron las lesiones en la piel las cuales se resolvieron al suspender el tratamiento.
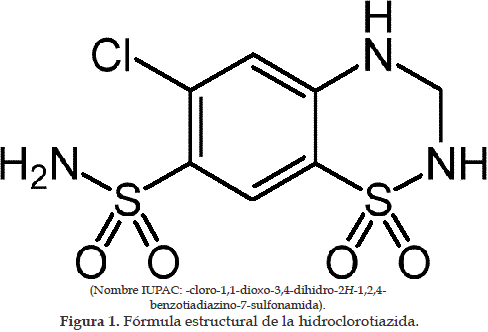
La hidroclorotiazida es un derivado de la sulfonamida con un grupo fenol que tiene como sustituyente un átomo de cloro, aunque es ligeramente soluble en agua este se distribuye predominantemente en los componentes del fluido del compartimento extracelular (13). El átomo de cloro en la hidroclorotiazida tiene el potencial de actuar como un antígeno, podría ser disociado por los rayos UV, creando radicales libres que pueden reaccionar con proteínas lípidos, ADN creando nuevos keratonocitos como antígenos. La formación de metabolitos o liberación de cloro podría también explicar la propensión de la hidroclorotiazida para causar una variedad de erupciones en la piel tras la exposición a la luz (14). La urticaria, picor, edema de cara y pies, al igual que la eritrodermia descamativa generalizada incluyendo la cara que presentó el paciente del caso aquí descrito, fueron probablemente originadas por una reacción de fotosensibilidad que tiene su fundamento en el mecanismo de reacción química antes referenciado, y como lo sugieren los resultados de las pruebas de laboratorio aumentadas (eosinofilia, e inmunoglobulina E).
En cuanto a la queratodermia palmoplantar presentada por el paciente se ha documentado que en más del 80% de los casos de eritrodermia adquirida, es un signo clínico predictivo de psoriasis (15). La alopecia parece estar relacionada con la severidad y duración de la eritrodermia (15). Mientras que los escalofríos podrían estar relacionados con la pérdida constante de fluidos a través de la piel, lo que conllevaría a producir alteraciones electrolíticas y dañar la función renal (15).
Por otro lado, la micosis fungoide (MF) y el síndrome de Sézary (SS) son los linfomas cutáneos más comunes de células T (LCCT) y se ha postulado la hipótesis de que surgen debido a la exposición de las células T de memoria a la estimulación antigénica crónica (15-17). Aunque no se haya probado una relación de causalidad entre el uso de HCTZ en pacientes con LCCT, un estudio realizado en 2013 por Richard et al. (12) encontró una interesante relación entre los dos. En primer lugar, en pacientes de LCCT que estaban medicados con HCTZ, el 65% de ellos o bien iniciaron el consumo del fármaco antes de desarrollar MF o esta aumento en severidad una vez que iniciaron el uso de HCTZ. Además, demostraron que la suspensión de HCTZ en algunos pacientes se asoció con la desaparición o la mejora de sus lesiones de MF.
Finalmente, la farmacovigilancia idealmente debe estar estrechamente vinculada a la regulación de medicamentos, ya que se necesita el apoyo gubernamental para la coordinación y comunicación nacional e internacional (18). En atención a esta estrategia las clínicas, hospitales universitarios, deberían contar con suficientes farmacéuticos y farmacólogos clínicos que respondan a preguntas relacionadas con el reporte espontáneo de reacciones adversas a medicamentos y puedan capitalizar de forma más eficiente el importante papel de los pacientes en la identificación, descripción, y en última instancia evitar el daño de los medicamentos haciendo uso de tecnologías modernas que están siendo exploradas para facilitar la participación de los pacientes alrededor del mundo.
1. Beijer HJ, De Blaey CJ. Hospitalisations caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci 2002; 24:46-54. [ Links ]
2. Dormann H, Mulh-Selbach U, Krebs S, et al. Incidence and costs of adverse drug reactions during hospitalization: Computerized monitoring versus stimulated spontaneous reporting. Drug Saf 2000; 22:161-168. [ Links ]
3. Chang YP, Huang SK, Tao P, Chien CW. A population-based study on the association between acute renal failure (ARF) and the duration of polypharmacy. BMC Nephrology 2012; 13:96. [ Links ]
4. Viktil KK, Blix HS, Moger TA, Reikvam A. Polypharmacy as commonly defined is an indicator of limited value in the assessment of drug related problems. Br J Clin Pharmacol 2007; 63:187-195. [ Links ]
5. Moya Y, Bernal F, Rojas E, Barthel E. Seguimiento fármaco-terapéutico en pacientes ambulatorios con tratamiento anti-retroviral. Rev Chilena Infectol 2012; 29 (4): 412-419. [ Links ]
6. Product Information. Tekturna HCT(R) oral tablets, aliskiren hydrochlorothiazide oral tablets. Novartis Pharmaceuticals Corporation (per FDA), East Hanover, NJ, 2012. [ Links ]
7. Brewer T, Colditz GA. Postmarketing surveillance and adverse drug reactions: current perspectives and future needs. JAMA 1999; 281:824-9. [ Links ]
8. Lindquist M, Edwards IR. The WHO Programme for International Drug Monitoring, its database, and the technical support of the Uppsala Monitoring Center. J Rheumatol 2001; 28:1180-7. [ Links ]
9. Karimi G, Star K, Norén GN, Hägg S. The impact of duration of treatment on reported time-to-onset in spontaneous reporting systems for pharmacovigilance. PLoS One 2013; 8(7):e68938. [ Links ]
10. Rubin RL. Drug-induced lupus. In: Wallace DJ, Hahn B, Dubois EL, et al., eds. Dubois' Lupus Erythematosus. 7th edn. Philadelphia, PA: Lippincott Williams & Wilkins; 2007; 7. [ Links ]
11. Reed BR, Huff JC, Jones SK, et al. Subacute cutaneous lupus erythematosus associated with hydrochlorothiazide therapy. Ann Intern Med 1985; 103:49-51. [ Links ]
12. Richard R, Tigh J, Huen AO, Lee GL, Pozadzides JV, Liu P, Duvic M. Hydrochlorothiazide and Cutaneous T Cell Lymphoma Prospective Analysis and Case Series. Cancer 2013; 119:825-31. [ Links ]
13. Lowe G, Henderson CL, Grau RH, Hansen CB, Sontheimer RD. A systematic review of drug-induced subacute cutaneous lupus erythematosus. British Journal of Dermatology 2011; 164:465-472. [ Links ]
14. Han KD, Bark KM, Heo EP, Lee JK, Kang JS, Kim TH. Increased phototoxicity of hydrochlorothiazide by photodegradation. Photodermatol Photoimmunol Photomed 2000; 16:121-124. [ Links ]
15. Bartolo L, Valverde J, Rojas P, Vicuña D. Eritrodermia adquirida en un adulto. Dermatol Perú 2010; 20(1):116-120. [ Links ]
16. Tan RS, Butterworth CM, McLaughlin H, Malka S, Samman PD. Mycosisfungoidesa disease of antigen persistence. Br J Dermatol 1974; 91:607-616. [ Links ]
17. Campbell JJ, Clark RA, Watanabe R, Kupper TS. Sezary syndrome and mycosis fungoides arise from distinct T-cell subsets: a biologic rationale for their distinct clinical behaviors. Blood 2010; 116:767- 771. [ Links ]
18. Schjott J, Bergman J. Joint medicine-information and pharmacovigilance services could improve detection and communication about drug-safety problems. Drug, Healthcare and Patient Safety 2014; 6:89-92. [ Links ]













