Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.14 no.1 Manizales Jan./June 2015
https://doi.org/10.17151/biosa.2015.14.1.8
DOI: 10.17151/biosa.2015.14.1.8
HEALTH RISK ASSESSMENT IN A LETTUCE (Lactuca sativa) CROP DUE TO IRRIGATION WITH UNTREATED WASTEWATER IN THE MARENGO AGRICULTURAL CENTER (CUNDINAMARCA, COLOMBIA)
Claudia Campos Pinilla2
Ana Milena Contreras3
Fabio R. Leiva4
1 Proyecto financiado por el Ministerio de Medio Ambiente, Vivienda y Desarrollo Territorial.
2 PhD, Departamento de Microbiología, Pontificia Universidad Javeriana. Bogotá, Colombia. Correo electrónico: campos@javeriana.edu.co.
3 Microbiologa Industrial, Departamento de Microbiología, Pontificia Universidad Javeriana. Bogotá, Colombia. Correo electrónico: contreras-ana@javeriana.edu.co
4 PhD, Departamento de Desarrollo Rural, Facultad de Ciencias Agrarias, Universidad Nacional de Colombia. Bogotá, Colombia. Correo electrónico: frleivab@unal.edu.co
La inocuidad de los cultivos de hortalizas, y por consiguiente el riesgo sanitario para el agricultor y el consumidor, está relacionada con la calidad del agua utilizada para riego. El objetivo del presente trabajo fue evaluar el riesgo sanitario debido al riego con aguas residuales sin tratar en un cultivo de lechuga (Lactuca sativa). Para el efecto se analizó la calidad microbiológica del agua utilizada para riego, del suelo y de las lechugas en el Centro Agropecuario Marengo, en una zona agrícola que distribuye alimentos a la capital del país y otros municipios. Se seleccionó un cultivo de lechuga con riego por aspersión y se evaluaron las concentraciones de indicadores de contaminación fecal bacterianos (coliformes fecales y Salmonella spp.), virales (colifagos somáticos) y parasitarios (huevos de helminto). Se encontró que las concentraciones de estos microorganismos superan en algunos casos las propuestas por la normativa (coliformes fecales entre 1,3 x 103-1,4 x 104 UFC/100 ml y 1,2 HHV/L) lo quea puede generar riesgo para la salud de los agricultores y los consumidores. Los valores de Salmonella spp. en las tres matrices estuvieron por debajo del Límite de Cuantificación. Los colifagos no superaron concentraciones de 102 PFP/100 ml en aguas y por 4 g en suelos. Los huevos de helminto 1,2/4 g de suelo y 1,4/kg PF en lechugas.
Palabras clave: hortalizas, patógenos, inocuidad, riego por aspersión.
Innocuousness of vegetable crops and consequently the resultant health risk for farmers and consumers are associated with the quality of water used for irrigation. The objective of this study was to assess the health risks due to irrigation with untreated wastewater in a lettuce crop (Lactuca sativa). The microbiological quality of the water used for irrigation, the soil and the harvest were assessed at the Marengo Agricultural Center, an agricultural area that supplies food to the capital city and other municipalities. A lettuce crop irrigated through sprinkling was selected and concentrations of indicators of bacterial fecal (fecal coliforms and Salmonella spp.), viral (somatic coliphages) and parasitic (helminth eggs) contamination were evaluated. It was found that concentration of these microorganisms in some cases exceeded those proposed in the guidelines (fecal coliforms between 1.3 x 103-1.4 x 104 CFU/100 ml and 1.2 HHV/L) which can generate health risks for farmers and consumers.Salmonella spp. values were below the Limit of Quantitation in all three matrices. Coliphages did not exceed concentrations of 102 PFP/100 ml in water and 4 g in soils. Helminth eggs were 1.2/4 g in soil y 1.4/kg PF in lettuce.
Key words: vegetables, pathogens, innocuousness, sprinkling irrigation.
Para la sostenibilidad de la producción y la sanidad de productos comestibles de origen vegetal es indispensable conocer la calidad del agua utilizada, ya que el uso de agua contaminada genera problemas para la salud del trabajador, el desarrollo del cultivo y la inocuidad del producto final (1, 2).
La evaluación del riesgo es un soporte técnico-científico para la toma de decisiones en áreas como la industria, la salud humana y la agricultura. Éste es un proceso sistemático en el cual se analiza la información disponible para evaluar los potenciales efectos y su magnitud a partir de una cierta acción. Así, es posible evaluar la existencia o no de riesgo de deterioro ambiental y de la calidad de vida de la población (3). La evaluación del riesgo sanitario a causa de las actividades agrícolas ha sido ampliamente usada en los últimos años (4, 5).
El agua utilizada para riego suele provenir de fuentes superficiales, especialmente de ríos los cuales reciben aguas que han tenido un uso previo y presentan diferente tipo y concentración de contaminantes. Un factor clave del riesgo está relacionado con la presencia de microorganismos patógenos en el agua, pero el efecto final depende del tipo de población que se ve afectada y del cultivo que se haya regado (6-8).
La preocupación por la calidad microbiológica de los alimentos regados con aguas contaminadas se ha visto reflejada en las directrices de la OMS (5), así como en el Acta de la Seguridad Alimentaria del Congreso de Estados Unidos, la cual ha delegado en la Administración de Alimentos y Medicamentos la responsabilidad de establecer un mínimo de normas orientadas a asegurar la producción y cosecha de frutas y vegetales que se consumen crudos, y donde se debe minimizar el riesgo por las enfermedades transmitidas por alimentos (9).
Este estudio se realizó con el fin de evaluar el riesgo sanitario debido al riego con aguas residuales sin tratar en un cultivo de lechuga (Lactuca sativa). En este sentido, se determinó la calidad microbiológica del agua utilizada para riego agrícola en la Sabana de Bogotá, así como del suelo y de las lechugas que son comercializadas.
Sitio de estudio
El sitio seleccionado para el muestreo fue el Centro Agropecuario Marengo, perteneciente a la Universidad Nacional y donde se encuentran varios cultivos de hortalizas. Para el riego de sus cultivos este Centro utiliza agua proveniente de uno de los canales del Distrito de Riego de La Ramada, que recibe agua del río Bogotá (uno de lo más contaminados del país). El Distrito cuenta con un área neta para producción agropecuaria de 5500 ha.
Cultivo
Se seleccionó un cultivo de lechuga (Lactuca sativa) por ser una hortaliza que se consume cruda, crece cerca del suelo y es de alto consumo en la alimentación humana.
Muestreo
En un área del cultivo de 3,2 ha, se realizaron 4 muestreos durante un mes, abarcando el periodo de siembra, crecimiento y cosecha de las lechugas. Las muestras recolectadas son las siguientes: 8 muestras de agua proveniente del canal de riego a dos diferentes profundidades (superficie y a la profundidad de la coladera de succión de la bomba del agua), una vez por semana para determinar si se presentaban cambios en la calidad del agua. Las muestras se recolectaron según las recomendaciones de la Asociación Americana de Salud Pública (APHA, por sus siglas en inglés) en recipientes estériles y transportados al laboratorio a 4°C, para ser analizados antes de las 24 horas (10). Se recolectaron 5 muestras compuestas de suelo una vez por semana durante cuatro semanas para un total de 20 muestras de acuerdo con la metodología propuesta por el Instituto Colombiano de Normas Técnicas y Certificación (ICONTEC) en 1997 (11). Durante la primera y tercera semana se recolectaron a 10 cm de profundidad y en la segunda y cuarta semana a 20 cm de profundidad. En este caso se dividía el terreno en X y se recogían las 5 muestras compuestas en cada extremo y en el centro. Las 5 muestras de cada extremo y del centro se mezclaban por separado y se almacenaban en bolsas de plástico para ser transportadas al laboratorio a 4°C. Para el análisis de hortalizas se recolectaron 5 muestras de lechuga al azar un día después del último riego durante dos periodos de cosecha, para un total de 10 muestras. Las muestras fueron trasportadas a 4°C en neveras de icopor y se analizaron el mismo día de la recolección.
Parámetros evaluados y protocolos
Los parámetros utilizados para evaluar la calidad microbiológica del agua, suelos y lechugas se muestran en la Tabla 1.
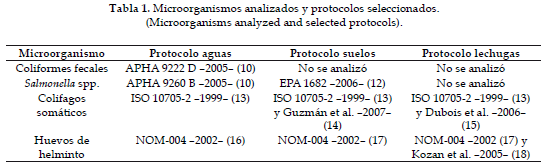
Los resultados del estudio se presentan en las tablas 2, 3 y 4.
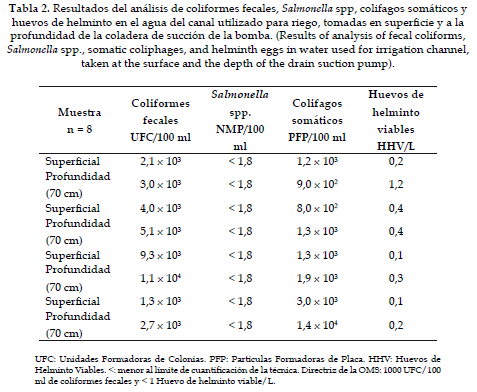
Como se observa en la Tabla 2, las concentraciones de los microorganismos analizados presentan variaciones dependiendo de la profundidad donde se toman las muestras. Sin embargo, las diferencias no superan un orden de magnitud. La concentración aumenta ligeramente a mayor profundidad, ya que los microorganismos tienden a sedimentar y a localizarse en profundidad o en los sedimentos de los canales. Por esta razón es importante realizar los muestreos cercanos al sitio de succión donde se refleja mejor la calidad del agua utilizada para riego.
Las directrices de la Organización Mundial de la Salud –OMS– (5) sugieren que los huevos de helminto deben estar presentes en una concentración ≤ 1 y ≤ 0,5/L cuando hay niños menores de 15 años en las cercanías a los cultivos, y que los coliformes fecales deben estar presentes en concentraciones ≤ 1000/100 ml cuando se trata de riego sin restricción; es decir, para cultivos que se consumen crudos. Estas concentraciones pueden ser alcanzadas tratando el agua residual por sistemas de lagunaje, los cuales son comunes en municipios de países en vías de desarrollo, o por sistemas de lodos activos con desinfección en grandes ciudades.
El riesgo para la población está relacionado con la transmisión de enfermedades de origen hídrico, especialmente diarreas, las cuales son causantes de un alto porcentaje de morbimortalidad en países en vías de desarrollo (19).
Los resultados del agua utilizada para el riego muestran concentraciones de coliformes fecales en superficie entre 1,3 x 103 y 9,3 x 103 UFC/100 ml, y en profundidad entre 2,7 x 103 y 1,1 x 104 UFC/100 ml. La concentración aumenta a mayor profundidad y en todos los casos supera la concentración sugerida por la OMS en el año 2006 (5), con lo cual se incrementa el riesgo sanitario tanto para el agricultor como para el consumidor. Salmonella spp. Se encontró en todos los casos por debajo del límite de cuantificación de la técnica (< 1,8 NMP/1000 ml), con lo cual el riesgo de enfermedad por presencia de este patógeno en el agua, suelo y cultivo es muy bajo. Si bien las directrices de la OMS no contemplan la evaluación de esta bacteria, su análisis es valioso ya que se trata de un patógeno común en alimentos y relacionado con enfermedades de origen hídrico.
La presencia de enterovirus en el agua representa un importante problema de salud pública ya que se encuentran en aguas residuales y tratadas, siendo resistentes a los sistemas de desinfección y a factores ambientales como pérdida de humedad, cambios de temperatura, oxígeno y pH. Se han encontrado concentraciones que van de 5 a 21.0000 unidades/100 ml, por lo que se pueden considerar causantes de enfermedades como diarrea y hepatitis. Su importancia radica en su baja dosis infecciosa y el bajo porcentaje de eliminación por sistemas tradicionales de tratamiento, lo que prolonga su persistencia en el medio ambiente, superando el tiempo de permanencia de las bacterias en iguales condiciones (20).
El análisis de enterovirus requiere de protocolos especializados, largos y costosos por lo que se ha planteado el uso de bacteriófagos como indicadores de contaminación viral de origen fecal, gracias a que son fáciles, rápidos y económicos de identificar y presentan un comportamiento similar a los virus patógenos presentes en aguas residuales de origen doméstico. Por esta razón se proponen como una buena alternativa para evaluar presencia de virus entéricos en aguas y otras matrices ambientales (13).
Los colifagos somáticos se presentaron en una concentración entre 8,2 x 102 y 3,0 x 103 PFP/100 ml en superficie, y entre 9,0 x 102 y 1,4 x 104 UFP/100 ml en profundidad. Nuevamente se observan mayores concentraciones en profundidad y los valores encontrados coinciden con los reportados en aguas residuales con una mediana contaminación de origen fecal. Si bien la OMS no sugiere el análisis de virus, el uso de este indicador alerta sobre la presencia de virus patógenos en el agua y transmisibles al hombre a través de las aguas y los alimentos.
Los huevos de helminto se encuentran en bajas concentraciones y solo en un caso en la muestra tomada a una profundidad de 70 cm superan el límite sugerido por la OMS. Estudios acerca de la evaluación del riesgo por presencia de huevos de helminto realizados por Navarro y Jiménez en 2010, sugieren que los límites propuestos por la OMS son muy restrictivos para países en vías de desarrollo y que es necesario reunir más datos y estudios realizados en cada país para establecer el riesgo tolerable de acuerdo con las condiciones sociales y económicas de cada región (21).
La concentración de Salmonella spp. en las muestras de suelo y a las dos profundidades es menor al límite de cuantificación del protocolo, con lo cual no hay riesgo de transmisión de este patógeno para el agricultor o contaminación de las lechugas. Estos resultados coinciden con las bajas concentraciones encontradas en el agua de riego. Solo se analizó Salmonella spp. en suelos y lechugas ya que evidencia la posible presencia de bacterias patógenas, mientras que coliformes fecales incluyen un grupo de bacterias que no necesariamente lo son.
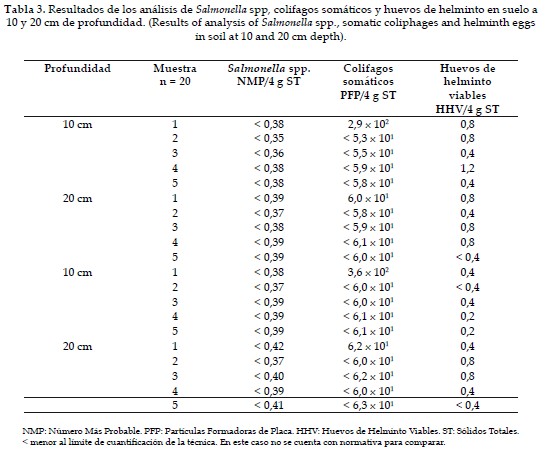
En estudios realizados en Sicilia (Italia) por Indelicato, et al. en 1988 (22), en cultivos de uva regados con aguas residuales, se evaluaron las concentraciones de otro tipo de indicadores de contaminación de origen fecal como coliformes totales (1 x 103-5,5 x 104 NMP/20 g de suelo), coliformes fecales (1,2 x 103-1,2 x 104 NMP/20 g de suelo) y Streptococci faecalis (0-45 NMP/20 g de suelo), mostrando la permanencia de estos microorganismos en el suelo y por consiguiente riesgo para los agricultores que laboran en estos cultivos. El riesgo de contaminación del suelo va a depender de igual forma del sistema de riego utilizado siendo más alto para riego por inundación o aspersión que para el caso del riego por goteo, donde la reducción de los microorganismos es más rápida y el gasto de agua menor (23-25).
Como se observa en la Tabla 3, los colifagos somáticos utilizados como indicadores virales se encuentran en concentraciones por debajo del límite de cuantificación y 3,6 x 102 PFP/4 g de ST. Estos resultados muestran una rápida disminución en la concentración de fagos cuando llegan al suelo y se encuentran con factores ambientales que influyen en su supervivencia. Sin embargo, en el caso de las muestras positivas la concentración encontrada podría ser suficiente para causar infección en el hombre, si tenemos en cuenta que estos indicadores reflejan el comportamiento de virus patógenos. Oron et al. en 2001 (26) encontraron que al aplicar agua por goteo, en concentraciones de 104 PFP/100 ml de colifagos somáticos, se observaban disminuciones de hasta 3 órdenes de magnitud al llegar al suelo.
Con relación a los huevos de helminto en suelos, la concentración encontrada es baja, por lo que representa bajo riesgo sanitario para el agricultor. No se observaron diferencias en las muestras de suelo tomadas a las dos profundidades (4).
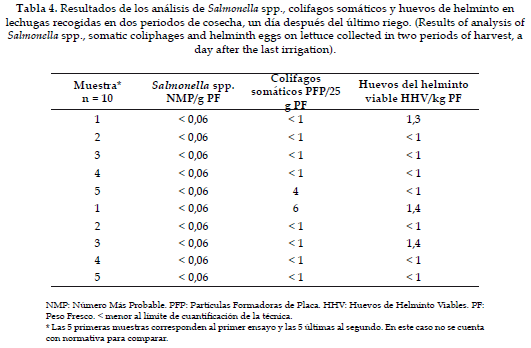
La concentración de Salmonella spp. estuvo en todos los casos por debajo del límite de cuantificación de la técnica, lo que significa riesgo bajo de transmisión de este patógeno por el consumo de estas lechugas. Estos resultados eran de esperarse ya que tampoco se encontró Salmonella spp. en el agua de riego. Sin embargo, se cuenta con reportes como los de Melloul et al. en 2001 (27), quienes al analizar la presencia de Salmonella spp. en el agua de riego encontraron muestras positivas en el 80% de los casos y 85,7% de muestras positivas para este mismo patógeno en lechugas y cilantro.
Como se observa en la Tabla 4, los colifagos somáticos estuvieron la mayoría de las veces por debajo del límite de cuantificación con dos valores de 4 y 6 PFP/25 g de PF. Estas concentraciones son muy bajas y se podría pensar que si la lechuga se lava adecuadamente antes del consumo, el riesgo sanitario es muy bajo.
Estudios realizados por Larkin et al. en 1976 (20), analizando la presencia de poliovirus 1 en lechugas regadas con agua residual, encontraron que permanecían hasta 8 días después de haber sido regadas en concentraciones entre 25 y 01 unidades/g. La estimación de riesgo de infección por norovirus, en personas que consumen alimentos crudos regados con aguas residuales, muestra que este virus requiere el mismo nivel de reducción de patógenos que determinan las directrices de la OMS, es decir 6 unidades logarítmicas para el consumo de 100 g de lechuga cada día y cuando baja el consumo entre 10-12 g, 4 veces a la semana, se requiere una reducción de 5 unidades logarítmicas (28). Dichas reducciones se pueden lograr por medio del tratamiento de las aguas residuales y buenos hábitos de higiene (29).
Bryan e Irving en 1987 (30), evaluaron la concentración de virus del polio en cultivos de cilantro, espinaca, lechuga y tomate irrigados por aspersión con agua residual, encontrando una rápida inactivación en las primeras 48 horas y bajas concentraciones de virus hasta el día 13. Los adenovirus no se detectaron en lechugas 24 horas después del riego.
En el suelo evaluado en este estudio, las concentraciones disminuyen drásticamente y en las lechugas las concentraciones de los indicadores bacterianos y virales son muy bajas. Sin embargo, se encuentran huevos de helminto en baja concentración en dos de las muestras, pero en número suficiente para poder infectar.
La prevalencia de huevos de helminto en aguas residuales de origen doméstico es típica en países en vías de desarrollo. Gupta, et al. en 2009 (8), en India, encontraron un alto porcentaje de muestras positivas para estos parásitos en hortalizas como la lechuga (76%), suelo (24%) y agua sin tratar (20%), evidenciando el alto riesgo de transmisión de enfermedades parasitarias por el consumo de alimentos regados con aguas residuales. De igual forma, Kozan et al. en 2005 (18) encontraron huevos de helminto en un 11,4% de un total de 203 muestras analizadas. El riesgo está relacionado con la baja dosis infectiva ya que un solo huevo puede causar infección, la respuesta inmune no es efectiva y los huevos pueden sobrevivir por periodos prolongados de tiempo en las zonas agrícolas (31).
Uno de los factores a tener en cuenta es el momento en que se realiza la cosecha ya que se ha observado que si se hace días después del último riego, se favorece la disminución de patógenos por acción de los rayos del sol, aumento de la temperatura y pérdida de humedad (16). Estos resultados coinciden con los encontrados en este estudio, donde se observa disminución de la concentración de los indicadores un día después del último riego.
Los indicadores bacterianos, virales y parasitarios utilizados en este estudio sirven para evaluar el riesgo generado por el riego con aguas contaminadas. Sin embargo, la simple recolección de datos no es suficiente para validar las estrategias de mitigación del riesgo si no van acompañados de información relacionada con diferente tipo de cultivos, regiones y diferentes periodos climáticos (32). Este estudio muestra una serie de herramientas que se deben aplicar a investigaciones más amplias, con diferente tipo de cultivos y condiciones climáticas.
Las concentraciones de coliformes fecales (2,7 x 103-1,1 x 104 UFC/100 ml) y huevos de helminto (1,2 HHV/L) encontradas en el agua utilizada para riego, superan las concentraciones sugeridas por la OMS e implican riesgos sanitario para los encargados de los cultivos y los consumidores. En el caso de los suelos se encuentran bajas concentraciones de colifagos somáticos (3,6 x 102 PFP/4 g ST) y de huevos de helminto viables (< 0,4-1,2 HHV/4 g ST), aunque con mayores periodos de supervivencia comparados con las de las bacterias. En las lechugas no se detectó Salmonella spp. y si bien las concentraciones de colifagos somáticos (6PFP/25 g PF) y huevos de helminto viables (1,4 HHV/kg PF) son bajas, no descartan la contaminación para los consumidores si no se cuenta con sistemas de lavado y desinfección eficientes. El estudio evidencia que las prácticas relacionadas con el cultivo de hortalizas conllevan riesgo de tipo microbiológico por la presencia de patógenos que pueden causar alteraciones en la salud de la población.
Al Ministerio de Medio Ambiente y Desarrollo Territorial por el apoyo financiero para el desarrollo del proyecto. A la Facultad de Agronomía de la Universidad Nacional, Bogotá, por permitir el muestreo en el cultivo de lechugas en el Centro Agropecuario Marengo y por la dirección del proyecto.
1. Jiménez B. Irrigation in developing countries using wastewater. International Review for Environmental Strategies 2006; 6(2):229-260. [ Links ]
2. Lopera MM, Hómez HO, Ordónez MM, Pabón H, et al. Guía Ambiental Hortofrutícola de Colombia. Bogotá, D.C.: Ministerio de Ambiente, Vivienda y Desarrollo Territorial - Asohofrucol; 2009. [ Links ]
3. EPA. Guidelines for ecological risk assessment. EPA/630/R-95/002F. Environmental Protection Agency of United States. Federal Register. Washington D.C. 1998; 63(93):26846-26924. [ Links ]
4. Gaspard P, Schwartzbrod J, Glavez L, Dumotier N. Parasitological risk assessment associated with the use of bio solids in agriculture: nematode eggs survival on grass, vegetables. Beneficial reuse of water and biosolids. Water Environmental Federation. Marbella, Spain; 1997. p. 17-27. [ Links ]
5. World Health Organization. Safe use of wastewater, excreta and greywater. Wastewater reuse in agriculture. Volume II. WHO; 2006. p. 182. [ Links ]
6. Asano T, Levine D. Wastewater reclamation, recycling and reuse: an introduction. In: Wastewater reclamation and reuse. Lancaster. Techomic Publishing; 1998. p. 528. [ Links ]
7. Ensink J, Van der Hoek W. Implementation of the WHO guidelines for the safe use of wastewater in Pakistan: balancing risk and benefits. Journal of Water and Health 2009; 07(3):464-468. [ Links ]
8. Gupta N, Khan D, Santra S. Prevalence of intestinal helminth eggs on vegetables grown in wastewater-irrigated areas of Titagarh. Food Control. West Bengal, India 2009; 20(10):942-945. [ Links ]
9. U.S. Food and Drug Administration. Process controls. Code of Federal Regulations Title 21, Part 120.24. U.S. Government Printing Office, Washington, D.C.; 2009. [ Links ]
10. APHA. Standard Methods for the Examination of Water and Wastewater. 21° Ed. Washington: American Public Health Association; 2005. p. 9-53, 55, 113, 118. [ Links ]
11. ICONTEC. Norma Técnica Colombiana. Gestión Ambiental. Toma de muestras del suelo para determinar contaminación. Bogotá, Colombia; 1997. p. 6. [ Links ]
12. Environmental Protection Agency. Method 1682: Salmonella in Sewage Sludge (Biosolids) by Modified Semisolid Rappaport-Vassiliadis Medium. EPA-821-R-06-014. July 2006. p. 48. [ Links ]
13. ISO. Water Quality Detection and enumeration of Bacteriophages. Part 2: Enumeration of somatic coliphages. ISO 10750-2. Geneva, Switzerland; 1999. p. 17. [ Links ]
14. Guzmán C, Jofre J, Blanch A, Lucena F. Development of feasible method to extract somatic coliphages from sludge, soil and treated biowaste. Journal or Virologica Methods 2007; 144(1-2):41-48. [ Links ]
15. Dubois E, Hennechart C, Deboosere N, Merle G, Legeay O, Burger C, Le Calvé M, Lombard B, Ferré V, Traeré O. Intra-laboratory validation of a concentration method adapted for the enumeration of infectious F-specific RNA coliphage, and hepatitis A virus from inoculated leaves of salad vegetables. International Journal of Food Microbiology 2006; 108(2):164-171. [ Links ]
16. Minhas P, Sharma N, Yadav R, Joshi P. Prevalence and control of pathogenic contamination in some sewage irrigated vegetable, forage and cereal grain crops. Biosurce Technology 2006; 97:1174-1178. [ Links ]
17. Norma Oficial Mexicana –NOM–. SEMANART. Anexo V: Método para la cuantificación de huevos de helminto en lodos y biosólidos. Protección Ambiental: Lodos y biosólidos. Especificaciones y límites máximos permisibles de contaminantes para su aprovechamiento y disposición final. Diario Oficial de la Federación; 2002. p. 18-60. [ Links ]
18. Kozan E, Gonenc B, Sarimenhmetoglu O, Aycicek H. Prevalence of helminth eggs on raw vegetables used for salads. Food Control 2005; 16:239-242. [ Links ]
19. Kindzierski W, Gabos S. Health effects associated with wastewater treatment, disposal and reuse. Water Environment Research 1996; 68(4):818-826. [ Links ]
20. Larkin E, Tierney J, Sullivan R. Persistence of virus on sewage-irrigated vegetables. Journal of Environmental Engineering Division 1976; 102:29-35. [ Links ]
21. Navarro I, Jiménez B. Approaches to evaluate and develop health risk-based standards using available data. In: Wastewater Irrigation and Health. Ottawa. IDRC Publishes; 2010. p. 63-89. [ Links ]
22. Indelicato S, Tamburino V, Barbagallo S. Agronomical and health aspects of municipal wastewater irrigation. Proc of the 2nd International Conference on Environmental Protection. Angelo (Italia). 5-7 October 1988. S25-32. [ Links ]
23. Oron G, DeMalach Y, Hoffman Z, Keren Y, Hartman H, Plazner N. Wastewater disposal by subsurface trickle irrigation. Water Science and Technology 1990; 23:2149-2158. [ Links ]
24. Oron G, DeMalach Y, Hoffman Z, Manor Y. Effect of effluent quality and application method on agricultural productivity and environmental control. Water Science and Technology 1992; 26(7-8):1593-1601. [ Links ]
25. Rosas I, Báez A, Coutiño M. Bacteriological quality of crops irrigated with wastewater in the Xochimilco plots, Mexico city, Mexico. Applied and Environmental Microbiology 1984; 47(5):1074-1079. [ Links ]
26. Oron G, Armon R, Mandelbaum R, Manor Y, Campos C, Gillerman L, Salgot M, Gerba C, Klein I, Enriquez C. Secondary wastewater disposal for crop irrigation with minimal risk. Water Science and Technology 2001; 43(10):139-146. [ Links ]
27. Melloul A, Hassani L, Rafouk L. Salmonella contamination of vegetables irrigated with untreated wastewater. World Journal of Microbiology and Biotechnology 2001; 17:207-209. [ Links ]
28. Mara D, Sleigh A. Estimation of norovirus infection risks to consumers of wastewater-irrigates food crops eaten raw. Journal of Water and Health 2010; 8(1):39-43. [ Links ]
29. Mara D, Sleigh A. Estimation of norovirus and Ascaris infection risk to urban farmers in developing countries using wastewater for crop irrigation. Journal of Water and Health 2010; 8(3):572-576. [ Links ]
30. Bryan K, Irving L. Virus survival on vegetables spray-irrigated with wastewater. Water Research 1987; 21(81):57-63. [ Links ]
31. Blumental U, Mara D, Peasey A, Ruiz-Palacios G, Stott R. Guidelines for the microbiological quality of treated wastewater used in agriculture: recommendations for revising WHO guidelines. Bulletin World Health Organization 2000; 78(9):1104-1116. [ Links ]
32. Harris L, Bender J, Bihn E, Blesssington T, Danyluk M, Delaquis P, et al. A framework for developing research protocols for evaluation of microbial hazards and controls during production that pertain to the quality of agriculture water contacting fresh produce that may be consumed raw. Journal of Food Protection 2012; 75(12):2251-2273. [ Links ]













