Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.15 no.1 Manizales Jan./June 2016
https://doi.org/10.17151/biosa.2016.15.1.3
DOI: 10.17151/biosa.2016.15.1.3
PRESENCE OF RABIES VIRUS IN BLOODSUCKING BATS IN COLOMBIA (CIÉNAGA DE ORO AND SAHAGÚN, CÓRDOBA)
Cesar Betancur Hurtado1
Alfonso Calderón Rangel2
Virginia Consuelo Rodríguez R3
1 MVZ, M. Sc. Departamento de Ciencias Pecuarias, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba. Grupo de Biotecnología email: betanci@yahoo.com ORCID: 0000-0001-7617-2202
2 MVZ, M. Sc. Departamento de Ciencias Pecuarias, Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba. Instituto de Investigaciones Biológicas del Trópico (IIBT). Estudiante Doctorado en Medicina Tropical, SUECaribe. e-mail: acalderonr@correo.unicordoba.edu.co ORCID: 0000-0001-7617-2202
3 Bacterióloga, M. Sc. Programa de Bacteriología, Facultad de Ciencias de la Salud, Universidad de Córdoba. Grupo de investigaciones Microbiológicas y Biomédicas de Córdoba (GIMBIC). e-mail: vrodriguez@correo.unicordoba.edu.co ORCID: 0000-0002-0295-4647
El objetivo de este estudio fue determinar la presencia de virus rábico en poblaciones de D. rotundus mediante la técnica de la inmunofluorescencia directa. Por medio de un estudio epidemiológico descriptivo de corte transversal y de un muestreo por conveniencia, se seleccionaron fincas en Ciénaga de Oro y hagún (Córdoba), donde se observó la presencia de murciélagos hematófagos por la visualización de mordeduras en bovinos y equinos, y se implementó la captura de D. rotundus mediante el atrapamiento con redes de niebla. En las 33 salidas, se capturaron 250 D. rotundus. Se tomaron 100 especímenes a los cuales se les practicó la eutanasia con el fin de detectar el virus de la rabia; los demás especímenes fueron tratados con un anticoagulante tópico y liberados con el fin de controlar la población de D. rotundus.
Las capturas de los murciélagos hematófagos y las técnicas de diagnóstico se implementaron con el acompañamiento de funcionarios de la Oficina de Epidemiología del ICA (Córdoba), dentro del programa de control de la rabia bovina. Sólo el 13% de D. rotundus procedentes de diferentes zonas rurales de Sahagún fueron positivos por la inmunofluorescencia directa y ninguna muestra fue positiva por la prueba biológica. Se debe continuar realizando vigilancia epidemiológica y control poblaciones de D. rotundus e implementar programas de vacunación masiva en animales de compañía y de interés zootécnico; así como también de educación a la población para la concientización de riesgos y de los beneficios ecológicos de la fauna silvestre; siendo estas las mejores herramientas para prevenir la transmisión.
Palabras clave: Lyssavirus, quirópteros, salud pública, vigilancia epidemiológica, zoonosis.
The objective of this study was to determine the presence of Rabies virus in D. rotundus populations through the direct immunofluorescence technique. Using a descriptive cross-sectional epidemiological study and of a convenience sampling. Farms in Ciénaga de Oro and Sahagún (Córdoba) were selected where the presence of bloodsucker bats was detected because of bites in cattle and horses, and the capture of D. rotundus was implemented using trapping with mist nets.
A total of 250 D. rotundus were caught in the 33 journeys, and 100 specimens were taken which underwent euthanasia to detect the rabies virus. The rest of the samples were treated with a topic anticoagulant and set free to control D. rotundus population. The capture of bloodsucking bats and the diagnosis techniques were carried out with the support of public servants from the epidemiology office of ICA (Colombian acronym for Colombian Institute of Agriculture) - Cordoba as part of the bovine rabies control program.
Only 13% of the D. rotundus coming from different rural areas of Sahagún were positive for direct immunofluorescence, and no sample was positive for the biological test. Epidemiological watch and D. rotundus populations control must continue as well as the implementation of massive vaccination programs for escort animals and those of zootechnical concern and of educational programs to the community to raise awareness of risks and the ecological benefits of wildlife as the best tools to prevent transmission.
Key words: Chiroptera, epidemiological surveillance, Lyssavirus, public health, zoonoses.
La rabia es una enfermedad infecciosa viral, cuyo órgano diana es el sistema nervioso central (SNC) que afecta a humanos y animales y produce una encefalitis aguda fatal (1). Esta enfermedad es de ocurrencia mundial, exceptuando la Antártida. En Asia, África y América Latina se presenta una alta mortalidad, en algunos países de estas zonas no se disponen de planes obligatorios de vacunación y de prevención en los hospederos y la profilaxis siguiente a la exposición humana en muchos casos no está disponible (2). Esta patología es producida por virus neurotrópicos, de genoma ARN, perteneciente a la familia Rhabdoviridae, género Lyssavirus, en forma de bala, envueltos, de cadena sencilla, no segmentado, de polaridad negativa compuesto por cerca de 12.000 nucleótidos que codifican para cinco proteínas estructurales: N, P, M, G y L (3).
Dentro del género Lyssavirus, se incluyen 14 genotipos que son: Aravan virus, Australian bat lyssavirus, Bokeloh bat lyssavirus, Duvenhage virus, European bat lyssavirus, Ikoma lyssavirus, Irkut virus, Khujand virus, Lagos bat virus, Mokola virus, Rabies virus, Shimonibat virus, West Caucasian bat virus (4). Son hospederos de virus de la rabia, los órdenes Carnívora y Quiróptera; los cuales infectan a otros mamíferos incluyendo al hombre; de ahí su trascendencia como zoonosis (5).
Epidemiológicamente, la rabia presenta dos ciclos: el urbano y el selvático o salvaje (6). En Colombia, la transmisión del ciclo urbano se ha vinculado principalmente con la mordedura de perros infectados en áreas urbanas (7) y el ciclo silvestre o salvaje por las mordeduras de murciélagos (8, 9,10).
Los murciélagos son un grupo ecológico de gran importancia dentro de cualquier ecosistema, ya que prestan servicios ambientales como: controladores de poblaciones de insectos, favorecen la regeneración de bosques por la polinización y dispersión de semillas (11). Sólo hay tres especies de murciélagos hematófagos o vampiros (Desmodus rotundus, Diaemus youngi y Diphyllae ecaudata) que se sitúan entre el Trópico de Cáncer en México, hasta el Trópico de Capricornio en Argentina (12). D. rotundus se alimenta de grandes mamíferos y las especies D. youngi y D. ecaudata son escasas y se alimentan de sangre de aves. En ambientes naturales, la totalidad de las especies de murciélagos perchan en troncos, ramas, cuevas, grietas y hojas; los albergues naturales donde habita el D. rotundus son árboles, huecos, y en menor proporción, grietas y cuevas (12); donde D. rotundus puede habitar solo o compartiendo el hábitat con especies, como: Carollia perspicillata, Phyllostomus hastatus, Saccopteryx bilineata, Trachops cirrhosus, Noctilio albiventris, Lonchophyla thomasi, Uroderma bilobatum, Artibeus lituratus y Molossus molossus (13).
Las poblaciones de murciélagos vampiros están distribuidas desde México hasta Argentina y son importantes reservorios de la rabia en América Latina (14). En Colombia se han reportado las tres especies hematófagas mediante la captura en redes de niebla, siendo muy esporádica D. ecaudata por su ecología y condiciones geográficas (15). Se ha detectado a través de estudios de secuenciamiento genético, virus rábico asociado a murciélagos insectívoros en tres perros domésticos y un humano (16). En Uruguay se determinó que la AgV3 se asoció con brotes de rabia paralítica bovina, donde los murciélagos no hematófagos (T. brasiliensis, Myotis sp, Lasiurus sp) fueron implicados (17). La mayoría de los casos de rabia humana en USA están asociados a murciélagos insectívoros, por ejemplo en California, se reportó un caso fatal de rabia humana, donde se determinó que el vector fue Tadarida brasiliensis(18).
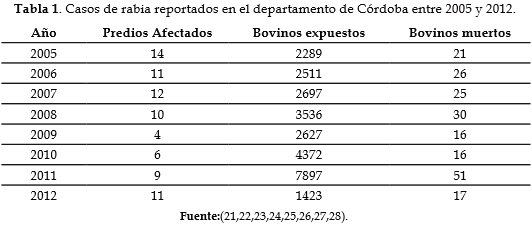
Para el sistema de información y vigilancia epidemiológica del Instituto Colombiano Agropecuario (ICA), el departamento de Córdoba es endémico por la presentación de rabia silvestre, ya que se han presentado brotes y casos fatales en bovinos (tabla 1) y durante el 2014, hasta noviembre se reportaron 230 casos de rabia silvestre en Colombia, de los cuales 12 correspondieron a Córdoba y Sucre y para el 2015 hasta la semana veinte (19,20). Esta casuística tiene repercusiones económicas en la producción bovina y puede producir riesgos en la población humana. El objetivo de este estudio fue determinar la presencia virus rábico en poblaciones de D. rotundus mediante la técnica de la inmunofluorescencia directa (IFD), en la subregión del medio Sinú.
Tipo y zona de estudio
Se implementó un estudio epidemiológico descriptivo de corte transversal en la subregión del Medio Sinú que involucró a los municipios de Ciénaga de Oro y Sahagún.
Selección de la muestraPor medio de un muestreo por conveniencia, se seleccionaron fincas donde se observó la presencia de murciélagos hematófagos en bovinos y equinos por la visualización de mordeduras, se implementó la captura mediante el atrapamiento con redes de niebla (previo acostumbramiento); las redes se revisaron periódicamente para retirar animales sin interés para el estudio. Para realizar el muestreo de cada tres ejemplares de D. rotundus capturados, uno era tomado para detectar por inmunofluorescencia directa (IDF) el virus rábico y los otros 2 eran retenidos e impregnados con un anticoagulante (warfarina) y liberados posteriormente con el fin de controlar la población silvestre; de acuerdo con las directrices del Programa Nacional de Control de Rabia del ICA. La clasificación taxonómica se implementó con base en las claves establecidas (29).
Toma de las muestrasDe acuerdo con el muestreo se seleccionaron 100 individuos de D. rotundus, a los cuales se les aplicó una asociación de acetilpromacina más ketamina para la toma de datos morfométricos y comprobar que estos especímenes eran D. rotundus. La eutanasia se hizo en el Laboratorio de Diagnóstico del ICA en Cereté, donde se extrajo el cerebro tras un corte más o menos a 1 cm de la línea media, buscando el Asta de Amón, con el fin de hacer tres impresiones en láminas portaobjetos. La IFD se implementó de acuerdo con los protocolos establecidos por el Centro de Diagnóstico del ICA en Cereté (30).
Análisis estadísticoSe elaboró una base de datos en formato Excel, donde se registraron datos cuantitativos y cualitativos para estadística descriptiva.
Aspectos éticosLas capturas de los murciélagos hematófagos se hicieron con el apoyo de funcionarios de la Oficina de Epidemiología del ICA en Cereté, dentro del programa de control de la rabia bovina; quienes tuvieron en cuenta los procedimientos de toma de muestra, manejo y conservación, las normas éticas, técnicas, científicas y administrativas para la investigación en animales, según la ley 84 (31).
En los 33 sitios de capturas realizadas en Ciénaga de Oro y Sahagún, se atraparon 250 D. rotundus y de estos, se colectaron 100 especímenes para detección por IFD, entre los que sólo 13 fueron positivos; los demás individuos fueron tratados con un anticoagulante tópico y liberados con el fin de controlar la población de D. rotundus.
De los 100 D. rotundus enviados para el diagnóstico del virus de la rabia por IFD, sólo el 13% procedentes de las zonas rurales de Sahagún (Córdoba) fueron positivos. Estos portadores pueden trasmitir el virus por sus prácticas alimenticias al morder e infectar animales de interés zootécnico, ocasionando la rabia paresiante; lo que ha sucedido consecutivamente en el departamento de Córdoba, según los datos de la Oficina de Vigilancia Epidemiológica del ICA (tabla 1). Un estudio retrospectivo clasificó al municipio de Sahagún (Córdoba) como de alto riesgo por concentrar las mayores tasas de incidencia (32). Evidencias del virus rábico por IFD han sido reportadas en Perú, en especímenes del género D. rotundus (33).
Los murciélagos hematófagos infectados también pueden buscar su fuente alimentaria en humanos e infectarlos, conllevando a una zoonosis. Casos de rabia silvestre en humanos han sido evidenciados en Colombia, por mordedura de murciélagos hematófagos en dos indígenas embera, menores de edad, fallecidos y procedentes del municipio del Bajo Baudó (Chocó), donde se tipificó la variante 3 asociada a murciélagos hematófagos (8,34); o por accidentes en áreas urbanas (cancha de baloncesto) como ocurrió en Floridablanca (Santander) donde se diagnosticó post mortem encefalitis rábica, y se constató que el fallecimiento se produjo como consecuencia de la mordedura en una de sus manos al tomar un murciélago, siendo una agresión espontánea del quiróptero (35). Igualmente en Santander de Quilichao (Cauca), donde se implicó al ciclo silvestre por trasmisión de un gato (36).
Casos fatales han sido reportados en: Bolivia en una paciente humana por mordedura de un perro (37). En México, donde la variante antigénica V5 de murciélago hematófago fue implicada, por mordedura inadvertida de un vampiro, facilitada por una vivienda precaria colindante a una cueva de quirópteros (38). En Jujuy (Argentina), un caso de rabia transmitida por perro y mediante técnicas moleculares se determinó que fue la misma variante que circuló en esa región desde el inicio del brote en 2003 (39). En Ecuador un brote de rabia selvática en comunidades indígenas amazónicas (40) y el último caso de rabia humana en Colombia, se presentó en la semana epidemiológica 41 de 2015, en un niño de 9 años en el municipio El Colegio (Cundinamarca), donde el diagnostico se confirmó por IFD y RT-PCR (41). La tendencia en Colombia (16,42), al igual que en otros países como Perú (43) y Brasil (44,45), es el incremento de casos humanos, en los que se ha evidenciado su origen silvestre.
En Colombia, se ha aislado virus rábico de Eptesicus brasiliensis o murciélagos insectívoros (46), y se reportó en una mujer un caso fatal de rabia humana que involucrarse a un felino, donde la variante viral se asoció a Tadarida brasiliensis; siendo la primera evidencia de riesgo de transmisión de rabia en zonas urbanas por murciélagos (47). También por inmunofluorescencia indirecta se encontraron asociaciones entre virus rábico (V3) vampiro y V4 (Tadarida) en murciélagos caseros como M. molossus y E. brasiliensis que estaban compartiendo nichos ecológicos en áreas urbanas y que la dispersión entre V3 está dada por la deforestación y arquitectura urbana que provee refugios, contribuyendo al contacto del hombre con estos reservorios (48) que proveen hábitats artificiales y posibilitan el contacto entre especies (49).
Los autores agradecen el Dr. Gustavo Dueñas Gómez (qepd), funcionario de la Oficina de Epidemiología del ICA (Córdoba), por su valiosa colaboración sin la cual este trabajo no fuese posible y a los demás funcionarios del ICA que colaboraron durante el desarrollo de este trabajo; también a los estudiantes Enrique Javier Avilés Bohórquez y Samir José Bula Calle.
Se detectó la presencia de virus rábico en el muestreo realizado. Se debe continuar realizando vigilancia epidemiológica y control de poblaciones de D. rotundus con el fin de reducir el riesgo en salud pública humana y veterinaria. Implementar vacunación masiva preventiva en animales domésticos y de interés zootécnico. Iniciar un plan de educación dirigido a la población en relación a los riesgos y los beneficios ecológicos de la fauna silvestre; siendo estas las mejores herramientas para prevenir la transmisión de la rabia en áreas endémicas.
1. Beltrán FJ, Dohmen FG, Del Pietro H, Cisterna DM. Diagnosis and molecular typing of rabies virus in samples stored in inadequate conditions. J Infect Dev Ctries. 2014; 8(8):1016-1021. [ Links ]
2. Knobel DI, Cleaveland S, Coleman PG, Fevre EM, Meltzer MI, Miranda MEG, Shaw A, Zinsstag J, Meslin FX. Re-evaluating the burden of rabies in Africa and Asia. Bull World Health Organ. 2005; 83(5):360-368. [ Links ]
3. Johnson N, Aréchiga CN, Aguilar SA. Vampire bat rabies: ecology, epidemiology and control. Viruses. 2014; 296(5):1911-1928. [ Links ]
4. King AMQ, Adams MJ, Carstens EB, Lefkpwitz E. Virus Taxonomy. Classification and Nomenclature of Viruses, Ninth Report of the International Committee on Taxonomy of Viruses.2012. Academic Press an Imprint of Elsevier, USA. [ Links ]
5. Páez A, Rey G, Agudelo C, Dulce A, Parra E, Díaz GH, Heredia D, Polo L. Brote de rabia urbana transmitida por perros en el distrito de Santa Marta, Colombia, 2006-2008. Biomédica. 2009; 29:424-436. [ Links ]
6. Center for Food Security & Public Health (CFSPH). Institute for International Cooperation IN Animal Biologics (IICAB). 2009. Rabia Hidrofobia, Lyssa. [Consultado 13 de enero 2015]. Disponible en: http://www.cfsph.iastate.edu/Factsheets/es/rabia.pdf [ Links ]
7. Alvis N. De la rabia humana de origen canino y otras vergüenzas. Rev MVZ Córdoba. 2006; 11:779-780. [ Links ]
8. Valderrama J, García I, Figueroa G, Rico E, Sanabria J, Rocha N, Parra E, Saad C, Páez A. Brotes de rabia humana transmitida por vampiros en los municipios de Bajo y Alto Baudó, departamento del Chocó, Colombia 2004-2005. Biomédica. 2006; 26:387-396. [ Links ]
9. Escobar E. La rabia: crónica de una experiencia. Medicina. 2005; 27:249-255. [ Links ]
10. Instituto Nacional de Salud. Rabia. Guía práctica para la atención de personas agredidas por un animal potencialmente transmisor de rabia. Serie de notas e informes técnicos No. 4. Sexta Edición. Bogotá: Instituto Nacional de Salud; 2002. [ Links ]
11. Jones G, Jacobs DS, Kunz TH, Willig MR, Racey PA. Carpe noctem: the importance of bats as bioindicators. Endang Species Res 2009; 8:93-115 [ Links ]
12. Greenhall AM, Joermann G, Schmidt U. Desmodus rotundus. Mammal species. 1983; 202:1-6. [ Links ]
13. Sampedro AC, Martínez C, Mercado AM, Osorio S, Otero I, Santos LM, et al. Refugios, período reproductivo y composición social de las poblaciones de Desmodus rotundus (Geoffroy, 1810) (Chiroptera: Phyllostomidae), en zonas rurales del departamento de Sucre, Colombia. Caldasia. 2008; 30:127-3414. [ Links ]
14. Torres C, Lema C, Dohmen FG, Beltrán F, Novaro L, Russo S, Freire MC, Velasco VA, Mbayed VA, Cisterna DM. Phylodynamics of vampire bat-transmitted rabies in Argentina. Mol Ecol. 2014; 23(9):2340-2352. [ Links ]
15. Sarmiento RM, Brito GEM. 2003. Hallazgo de murciélago de la especie Diphylla ecaudata en Colombia. Informe Quincenal Epidemiológico Nacional. 8(4):63-68. [Consultado 13 de enero 2015]. Disponible en: http://www.ins.gov.co/iqen/IQUEN/IQEN%20vol%2008%202003%20num%204.pdf [ Links ]
16. Páez A, Núñez C, García C, Boshell J. Molecular epidemiology of rabies epizootics in Colombia: evidence for human and dog rabies associated with bats. J Gen Virol. 2003; 84:795-802. [ Links ]
17. Guarino H, Castilho JG, Souto J, Oliveira RDEN, Carrieri ML, Kotait I. Antigenic and genetic characterization of rabies virus isolates from Uruguay. Virus Res. 2013;173(2):415-420. [ Links ]
18. Dyer JL, Wallace R, Orciari L, Hightower D, Yager P, Blanton JD. Rabies surveillance in the United States during 2013. J Am Vet Med Assoc. 2014;245:1111-1123. [ Links ]
19. Instituto Colombiano Agropecuario. (ICA). Boletín epidemiológico semanal de alertas para acción inmediata. Mensuales 2014, 2015. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/Boletines.aspx [ Links ]
20. Instituto Colombiano Agropecuario. (ICA). Sanidad Animal Informe del 2010. [Consultado 11 de febrero de 2015]. Disponible en: http://www.ica.gov.co/home.aspx [ Links ]
21. López SCDI, Romero CR, Morales LM, Vásquez PA, Cairo RA, Turati MJ, Mora GRM, Céspedes PR. Frecuencia de infección por rabia en murciélagos. La Habana, Cuba, enero 2012 a diciembre 2013. [ Links ]
22. Instituto Colombiano Agropecuario (ICA). 2005. Colombia, Sanidad Animal. 2005. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/getattachment/4b322f44-1380-4481-84c9-cf5078cd14f8/1.aspx [ Links ]
23. Instituto Colombiano Agropecuario (ICA). 2006. Colombia, Sanidad Animal. 2006. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/getattachment/e2e4ba97-a885-4b85-ba55-19188b37d6de/2.aspx [ Links ]
24. Instituto Colombiano Agropecuario (ICA). 2007. Colombia, Sanidad Animal. 2007. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/getattachment/499b52b5-c483-4024-adc5-a51dbd85a99b/2007.aspx [ Links ]
25. Instituto Colombiano Agropecuario (ICA). 2008. Colombia, Sanidad Animal. 2008. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/getattachment/e205da92-1991-4de4-b412-29d6dae2ae40/2008-(1).aspx [ Links ]
26. Instituto Colombiano Agropecuario (ICA). 2009. Colombia, Sanidad Animal. 2009. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado13 de enero 2015]. Disponible en: http://www.ica.gov.co/getattachment/7b0e7f6a-4c43-4dff-be39-ab9f4d1b0e0a/2009.aspx [ Links ]
27. Instituto Colombiano Agropecuario (ICA). 2010. Colombia, Sanidad Animal. 2010. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/getattachment/5822cada-667f-4541-8b86-c0258be04b64/2010.aspx [ Links ]
28. Instituto Colombiano Agropecuario (ICA). 2011. Colombia, Sanidad Animal. 2011. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/home.aspx [ Links ]
29. Instituto Colombiano Agropecuario (ICA). 2012. Colombia, Sanidad Animal. 2012. Sistema de Información y Vigilancia Epidemiológica. Informe Técnico. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/home.aspx [ Links ]
30. Linares OJ. Mamíferos de Venezuela. Sociedad Conservacionista Audubon de Venezuela, Caracas 1998. p.691. [ Links ]
31. Instituto Colombiano Agropecuario (ICA). 2004. POE para la toma y envío de muestras para el diagnóstico de la encefalitis rábica. Proceso de protección y regulación pecuaria. Grupo de control y erradicación de riesgos zoosanitarios. Rabia silvestre. MP-AT-2-6.7. [Consultado 13 de enero 2015]. Disponible en: http://www.ica.gov.co/getdoc/3fb2014b-848a-4cff-b4ab-13ce936dd4a8/MP-RS-02-Toma-y-envio-de-muestras-para-rabia.aspx [ Links ]
32. Congreso de Colombia. 1989. Ley 84. Por la cual se adopta el estatuto nacional de protección de los animales y se crean unas contravenciones y se regula lo referente a su procedimiento y competencia. [Consultado 13 de enero 2015]. Disponible en: http://www.alcaldiabogota.gov.co/sisjur/normas/Norma1.jsp?i=8242 [ Links ]
33. Brito HDM, Brito SE, Villalobos AR. Distribución geográfica del riesgo de rabia de origen silvestre y evaluación de los factores asociados con su incidencia en Colombia, 1982-2010. Rev Panam Salud Pública. 2013; 33(1):8-14. [ Links ]
34. García AF, Holgado JW, Aguilar AEG, Quispe FMM. IFD para la detección del virus de la rabia en murciélagos del distrito de Huanipaca, Abancay. Situa. 2004; 13(2):5-9. [ Links ]
35. Parra EA, Neira M, Roa D. Rabia humana por virus tipo 3, Bajo Baudó, Chocó. Biomédica 2004; 24:237-238. [ Links ]
36. Badillo R, Mantilla JC, Pradilla G. Encefalitis rábica humana por mordedura de murciélago en un área urbana de Colombia. Biomédica. 2009; 29:191-203. 24 [ Links ]
37. Páez A, Polo L, Constanza NDH, Rodríguez M, Agudelo C, Parra E, Paredes A, Moreno T, Rey G. Brote de rabia humana transmitida por gato en el municipio de Santander de Quilichao, Colombia, 2008. Rev. Salud pública. 2009; 11(6): 931-943. [ Links ]
38. Velasco VH, Arellano MMP, Salazar FJ. Rabia Humana. A propósito de un caso. Rev Soc Bol Ped. 2004; 43(2):89-94 [ Links ]
39. Gómez CS, Ortiz AML, Jiménez RE, De Los Santos BS, Marín PE. Estudio de caso de rabia humana transmitida por murciélago hematófago en Yucatán, México. Rev Biomed. 2005; 17:118-122. [ Links ]
40. Gury DF, Baspineiro B, Gury G, Martínez L, Miranda MR, Cisterna DM. Diagnóstico de un caso de rabia humana en Jujuy, 2008. Medicina. 2009; 69: 643-646. [ Links ]
41. Romero SN, Escobar N, Utzet M, Feijoo CM, Martin M. Sylvatic rabies and the perception of vampire bat activity in communities in the Ecuadorian Amazon. Cad. Saúde Pública, Rio de Janeiro. 2014; 30(3):669-674. [ Links ]
42. Rabia silvestre: Un Caso en Mesitas del Colegio, Cundinamarca. 2015. [Consultado 13 de enero 2015]. Disponible en: http://elpacientecolombiano.com/ [ Links ]
43. Núñez MC, Bonelo PA, Hernández RC, Zapata OJ, Torres VG. Dispersión del virus rabia en áreas urbanas de Colombia asociada a especies de murciélagos que comparten refugios. Rev. Asoc. Col. Cienc. 2010; 22:68-72. [ Links ]
44. Páez A, Núñez C, García C, Boshell J. Epidemiología molecular de epizootias de rabia en Colombia, 1994-2002: Evidencia de rabia humana y canina asociada con quirópteros. Biomédica. 2003; 23:19-30. [ Links ]
45. Condori CRE, Streicker DG, Cabezas SC, Velasco VA. Enzootic and epizootic rabies associated with vampire bats, Peru. Emerg Infect Dis. 2013; 19(9):1463-1469. [ Links ]
46. Carnieli P, Fahl WDO, Castilho JG, Oliveira RDN, Macedo CI, Durymanova E, Ungar De SJE, Carrieri ML, Kotait I, Rodrigo SPJ, Morato RG, Spíndola RO, Lindenrberg MM. Characterization of rabies virus isolated from canids and identification of the main wild canid host in northeastern Brazil. Virus Research. 2008; 131(1):33-46. [ Links ]
47. Queiroz LH, Favoretto SR, Cunha EM, Campos AC, López MC, De Carvalho C, Iamamoto, K, Araújo DB, Venditti LL, Ribeiro ES, Pedro WA, Durigon EL. Rabies in southeast Brazil: a change in the epidemiological pattern. Arch Virol. 2012;157(1):93-105. [ Links ]
48. Núñez MC, Aldaz JJ, Escobar H, Cuadros ME. Primer hallazgo de rabia silvestre en el murciélago insectívoro Eptesicus brasiliensis en Cali, Colombia. Flev. Asoc. Col. Cienci. Biol. 1985; 12(1):57-61. [ Links ]
49. Walteros-Acero DM, Castro-Duran A. Rabia humana y rabia animal: situación actual en Colombia período epidemiológico quinto de 2012. Informe de evento. Reg-R02.001.4000-001. Subdirección de Vigilancia y Control en Salud Pública, Instituto Nacional de Salud, 2012. 28p [ Links ]
Como citar este artículo: Betancur Hurtado C, Calderón Rangel A, Rodríguez VC. Presencia de virus rábico en murciélagos hematófagos en Colombia (Ciénaga de Oro y Sahagún, Córdoba). Revista Biosalud 2016; 15(1): 17-24. 10.17151/biosa.2016.15.1.3 ISSN 1657-9550 (Impreso) ISSN 2462-960X (En línea)





![9-[(E)-2-phenylethenyl]anthracene AND 9-[(E)-2-(naphthalen-2-yl)ethenyl] anthracene AS TRAPS FOR SINGLET OXYGEN: PHOTOSENSITIZED OXIDATION AND PHOTODYNAMIC EFFECT ON Leishmania tarentolae PARASITES](/img/en/next.gif)








