Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.15 no.2 Manizales July/Dec. 2016
https://doi.org/10.17151/biosa.2016.15.2.8
DOI: 10.17151/biosa.2016.15.2.8
Blastocystis sp: EVIDENCE OF ITS PATHOGENIC ROLE
Viviana Taylor-Orozco1
Alison López-Fajardo2
Ineselena Muñoz-Marroquín2
Mario Hurtado-Benítez2
Karina Ríos-Ramírez3
1 Ph.D. Profesor Facultad de Salud. Grupo de investigación Microbiología Médica y Enfermedades Infecciosas. Universidad Santiago de Cali, Cali, Colombia. viviana.taylor00@usc.edu.co, vivianataylor@gmail.com
2 Estudiantes de 6to año Programa de Medicina. Facultad de Salud. Universidad Santiago de Cali, Cali, Colombia. alilopezfajardo@gmail.com; inenamu@gmail.com; alejo_usa@yahoo.com
3 MSc. Profesor Programa de Bacteriología y Laboratorio Clínico. Facultad de Salud. Grupo de Investigación BIOGEN. Universidad de Santander, Sede Cúcuta, Colombia. YE.RIOS@mail.udes.edu.co
Blastocystis sp. es un parásito de distribución mundial, que se transmite por vía fecal-oral, colonizando el tracto gastrointestinal, tanto de animales como de humanos. Existen múltiples factores que favorecen su transmisión tales como el pobre saneamiento, el consumo de alimentos contaminados y la propagación de vectores. Este parásito ha despertado gran interés científico y clínico en los últimos años, por su potencial asociación con enfermedad; sin embargo, no ha sido posible establecer con exactitud su rol patógeno. También ha sido considerado agente oportunista, por su alta prevalencia en pacientes inmunosuprimidos, específicamente en aquellos con VIH/SIDA y cáncer. Actualmente, en el GenBank se han descrito secuencias de 33 subtipos (STs) diferentes, si bien en la literatura solo se encuentran reportados 17 subtipos hasta el momento, de los cuales 9 han sido aislados en el ser humano. Aunque buena parte de los estudios reportan a ST3 como el de mayor prevalencia, unos cuantos autores sugieren predominio de ST1 y ST4 en ciertas zonas, indicando que algunos subtipos varían dependiendo de la distribución geográfica. Varios de estos STs se han relacionado directamente con sintomatología gastrointestinal aguda y crónica e incluso con manifestaciones clínicas extraintestinales, encontrándose con mayor frecuencia el ST3 en pacientes sintomáticos, generalmente seguido de ST1 y en algunos casos de ST2. Además, se han reportado infecciones mixtas, de las cuales la más común se ha presentado entre los ST1 – ST3. En Latinoamérica, y particularmente en Colombia, se han desarrollado pocas investigaciones orientadas a identificar y definir la prevalencia, coinfección y potencial patógeno de las diferentes formas y subtipos conocidos de Blastocystis sp., por lo cual el conocimiento que se tiene hasta el momento es escaso e inespecífico, requiriéndose más estudios que permitan obtener mayor información al respecto.
Palabras clave: Blastocystis sp., patogenicidad, subtipos, sintomatología, coinfección.
Blastocystis sp. is a globally distributed parasite which is transmitted by the fecal-oral route by colonizing the gastrointestinal tract of both animals and humans. There are many factors which allow its transmiBion such as poor sanitation, the consumption of contaminated food and vectors propagation. This parasite has awakened scientific and clinical interest in recent years because of its aBociation with disease. However, its pathogen role has not been accurately established. Also, it has been considered as an opportunistic agent due to its high prevalence in immunosuppreBed patients, specifically in those with HIV / AIDS and cancer. Currently, in GenBank database the sequences of 33 different subtypes (STs) have been described even though only 17 subtypes are reported in the literature so far, from which nine have been isolated in humans. Although many studies indicate the subtype 3 (ST3) as the most prevalent, some authors suggest the predominance of ST1 and ST4 in particular areas, suggesting that some subtypes vary depending on the geographical distribution. Several of these STs have been directly related to acute and chronic gastrointestinal symptoms and even with clinical extraintestinal manifestations, being ST3 found with more frequency in symptomatic patients followed by ST1 and ST2 in some cases. Furthermore, mixed infections have been reported of which the most common has been present between ST1 - ST3. In Latin America, and particularly in Colombia, little research has been developed that aims to identify and define the prevalence, coinfection, and pathogenic potential of different forms and known subtypes of Blastocystis sp., therefore the knowledge at hand so far is scarce and unspecific, requiring more studies which allow obtaining more information about it.
Key words: Blastocystis sp., pathogenicity, subtypes, symptoms, coinfection.
Blastocystis sp. es un parásito ubicuo que coloniza aproximadamente mil millones de personas en todo el mundo. Afecta tanto a animales como al ser humano y su vía de transmisión es fecal oral, ya sea de humano a humano o de animal a humano, pues aún no se ha documentado la transmisión de humano a animal (1). Existen factores que aumentan la transmisión de este microorganismo, entre los cuales se encuentran el pobre saneamiento, la disposición inadecuada de basuras, el contacto con animales domésticos sin usar las medidas de bioseguridad, el consumo de alimentos contaminados o agua sin hervir (2) y la propagación por vectores (3, 4).
Este eucarionte unicelular intestinal, descrito hace cien años aproximadamente (5), es el único parásito intestinal humano perteneciente al reino Chromista, en el cual también se encuentran las algas marrones y las diatomeas (6). Diferentes estudios moleculares han comprobado una extensa variabilidad genética en aislados provenientes de mamíferos, aves, anfibios y humanos (2), razón por la cual la denominación Blastocystis hominis ha sido reemplazada por Blastocystis sp. Si bien en la literatura solo se encuentran reportados 17 subtipos (STs) hasta la fecha, de los cuales nueve han sido aislados en el ser humano, actualmente en el GenBank se han descrito secuencias de 33 subtipos diferentes; sin embargo, las secuencias de los subtipos 18 al 33 son parciales y no hay genomas completos, razón por la cual es mejor hasta el momento referirse al parásito como Blastocystis sp. subtipos 1 al 17 (7, 8).
La patogenicidad de Blastocystis sp. en humanos permanece aún en controversia, aunque varios autores lo designan como patógeno (8). Las infecciones sintomáticas donde no se identifica otro agente infeccioso presente además de Blastocystis sp., se conocen como Blastocystosis o enfermedad de Zierdt-Garavelli, en honor a dos de los investigadores que más han estudiado este parásito (9, 10). Estas infecciones tienen diversas presentaciones clínicas que van desde dolor abdominal con diarrea crónica persistente y recalcitrante a terapia con antiparasitarios, hasta afectaciones dermatológicas (11, 12, 13). La diversidad de sintomatología y patogenicidad, incluyendo su relación con síndrome del intestino irritable (SII), parece ser explicada por las variaciones en la virulencia, dependiente del subtipo aislado (11, 14, 15).
Blastocystis sp. es un parásito entérico cosmopolita, con amplia distribución mundial (16), reportándose casos en diversas regiones del globo, como Brasil (40%), Argentina (27,7%), Cuba (38,5%), Indonesia (60%) y Egipto (33%) (17). En Colombia las investigaciones sobre Blastocystis sp. han realizado principalmente en población infantil, con prevalencias que oscilan entre 22 y 38% (18, 19), siendo los reportes en población adulta realmente escasos, al igual que los estudios dirigidos a identificar y definir simultáneamente la prevalencia, coinfección y potencial patógeno de las diferentes formas y subtipos conocidos, razón por la cual el conocimiento que se tiene hasta el momento en esta área es limitado, situación que plantea la necesidad de realizar más estudios que permitan obtener mayor información al respecto, con el fin de crear estrategias de promoción y prevención encaminadas a contribuir en las políticas actuales de salud pública del país.
Para la elaboración de esta revisión y localización de los documentos bibliográficos se utilizaron varias fuentes documentales. Se realizó una búsqueda desde junio de 2014 a septiembre de 2015, de artículos publicados durante el periodo 2002-2015, en las bases de datos Pubmed, Medline, Scopus, Lilacs, Science Direct, SciELO y Ovid, utilizando y combinando los descriptores: Blastocystosis, Blastocystis, subtypes, morfology, coinfection, prevalence, pathogenicity, pathogenic evidences, pathogenic mechanisms, immune pathology. Se obtuvieron aproximadamente 80 registros y se seleccionaron 67 artículos entre investigaciones originales, revisiones, monografías y tesis.
Blastocystis sp. fue considerado inicialmente como levadura, después como un protozoo cercano a los flagelados y posteriormente a las amebas. Sin embargo investigaciones actuales, basadas en el estudio filogenético del BU-rADN (gen que codifica para el ARN de la subunidad pequeña del ribosoma), han ubicado a este microorganismo dentro del reino Chromista, subreino Chromobiota, infrarreino Heterokonta o Stramenopiles, subphylum Opalinata, clase Blastocystea y género Blastocystis (5, 6). Este parásito con un tamaño variable de 5 a 200 micrómetros de diámetro, tiene como característica importante su polimorfismo, descrito inicialmente por microscopia electrónica (20). Presenta 6 formas diferentes que corresponden a las morfologías ameboide, vacuolar, granular, quística, multivacuolar y avacuolar (21); cada una de estas formas se encuentra dependiendo de la muestra tomada y del método usado para su observación. Por ejemplo, la forma vacuolar es aislada con mayor frecuencia en muestras de heces fecales frescas, las granulares se encuentran tanto en cultivos in vitro como en muestras fecales frescas y la ameboide se observa en cultivos in vitro o en heces de pacientes con diarrea (22). Se puede afirmar que se han desarrollado una serie de estudios en este parásito, con el fin de describir la variación en su morfología o genética, y a la vez su influencia en el desarrollo o no de sintomatología en pacientes inmunocomprometidos o inmunocompetentes (21).
La morfología ameboide se considera como una forma intermedia entre la vacuolar y la quística (9); se describe la presencia de dos tipos, una que es la que presenta una sola vacuola central y otra que posee múltiples vacuolas; a su vez se ha descrito que estas poseen la capacidad de ingerir bacterias, son de fácil multiplicación y tienen signos de actividad metabólica (19, 21). Según algunas investigaciones realizadas, se hallan con mayor frecuencia en pacientes sintomáticos, razón por la cual muchos autores proponen esta morfología como indicador de patogenicidad (23).
En un estudio del año 2013, Rajamanikam et al. evaluaron a un grupo de 10 personas en el área rural de Malasia, de las cuales 5 eran sintomáticas y 5 asintomáticas. Se cultivaron las heces en medio Jones durante 10 días y se aplicaron dos pruebas específicas que fueron el ensayo de azocaseína para la cuantificación colorimétrica de la actividad de la proteasa y gelatina SDS para detección de actividad proteasa, con el fin de determinar las formas más prevalentes del Blastocystis sp. en heces y definir su patogenicidad. Los hallazgos de esta investigación fueron muy específicos ya que la forma ameboide fue la de mayor prevalencia en pacientes que presentaban sintomatología gastrointestinal (dolor abdominal, flatulencia y diarrea), con valores que variaron entre 11% y 18%. En este estudio además, se identificaron los siguientes factores de patogenicidad asociados a esta forma: a) La presencia de proteasas en la membrana del parásito, las cuales tienen dos mecanismos de acción; el primer mecanismo se fundamenta en la degradación de la inmunoglobulina A (IgA) presente en tracto gastrointestinal y el segundo mecanismo es la activación de citoquinas. Todo esto lleva a la alteración de las funciones de protección básicas del sistema gastrointestinal, que son la de barrera y la inmunológica, facilitando de esta manera la colonización de estos parásitos y posterior desarrollo de sintomatología gastrointestinal; b) La estructura de la forma ameboide se caracteriza por la presencia de una membrana con alta capacidad de adherencia a cualquier tipo de epitelio, lo cual facilita considerablemente la unión y posterior liberación de las proteasas en tracto gastrointestinal; c) Las formas ameboides han demostrado ser responsables de la inmersión de bacterias, que luego podrían sobrevivir y replicarse dentro de los lisosomas y fagosomas; sin embargo, el rol patógeno de las bacterias aún sigue siendo controversial (23).
En otra investigación del 2010 realizada por Elwakil et al. en un grupo de ratones a quienes se les inoculó Blastocystis sp., con el fin de evaluar la patogenicidad de este microorganismo y su asociación con la morfología, se encontró que todos los ratones que habían sido previamente inoculados con el parásito presentaron sintomatología intestinal; en el análisis histopatológico, se hallaron infiltrados de Blastocystis sp. en forma de agregados vacuolares, tanto en la lámina propia como en la submucosa y en las capas musculares del colon; también se evidenció reacción inflamatoria severa (linfocitos, histiocitos, eosinófilos y polimorfo nucleares), sin embargo, no se hallaron ulceraciones o displasia. Todos estos signos y síntomas se explicaron por la capacidad de adhesión al epitelio del microorganismo y a la presencia de una toxina diarreogénica; la diferencia con el estudio realizado en pacientes, en Malasia, fue la forma del parásito que se halló con mayor frecuencia, ya que en este caso fue la quística, aunque no se menciona la diferencia en términos de prevalencia de esta forma respecto a las otras (24).
Para determinar la relación de las morfologías restantes con el desarrollo de sintomatología gastrointestinal, se han realizado estudios que se centran en las características estructurales de la forma quística. Se encontró que estas formas poseen una pared que cumple la función de resistencia, evitando el daño de organelas y facilitando así la sobrevida del quiste en el ambiente, razón por la cual se considera como la forma transmisible de parásito; esta pared también posee una cubierta externa fibrilar, lo que la diferencia de la forma quística de varios protozoos intestinales. Adicionalmente, se afirma que el quiste en su interior tiene cinco estructuras similares a células hijas encerradas, las cuales al parecer sufren un proceso parecido a la esporulación, estando de esta manera asociada a la presentación de síntomas gastrointestinales, ya que se observan con mayor frecuencia en pacientes con síntomas crónicos (25).
Como se muestra previamente, existen varios estudios que evidencian claramente el rol patógeno de Blastocystis sp. asociado a su morfología; sin embargo, la patología al parecer no se asocia con algunas de las formas que presenta el parásito. En otro estudio de 2006 realizado en Malasia por Tan et al., se identificó la forma granular de Blastocystis sp., entre los días 2 a 6 de cultivo de las heces de pacientes asintomáticos, con una prevalencia que varió entre 2,7% y 38% (22), resultados que muestran que esta morfología puede no estar asociada a sintomatología y que su rol patógeno es discreto, requiriéndose así más estudios que permitan confirmar este tipo de hallazgos.
La infección por Blastocystis sp.continuamente cursa con otros microorganismos intestinales asociados a patogenicidad (parásitos, bacterias y virus); por tanto, la sintomatología causada por este parásito ha despertado gran interés como tema de estudio en los últimos años. En una investigación desarrollada en Hungría por Bálint et al., entre los años 2005-2013, en un grupo de 80 pacientes con Blastocystis sp., se observó que el síntoma principal fue dolor abdominal (50%), seguido de sangre en las heces (13,6%), y con menor frecuencia, otros síntomas como meteorismo, pérdida de peso, manifestaciones cutáneas y prurito (26). Se concluyó que la sintomatología causada por este parásito es inespecífica y que además el cuadro clínico es similar al que presentan los pacientes con infección gastrointestinal por otros gérmenes, lo cual hace más difícil el diagnóstico oportuno.
Se han realizado varios estudios dirigidos a determinar los patógenos que comúnmente cursan con infecciones por Blastocystis sp. (Tabla 1). En una investigación del 2013 realizada en Sidney por Roberts et al., con 91 muestras de heces positivas para este parásito, se encontró que 22% (20/91) de estas muestras presentaban coinfección con otro microorganismo, siendo más común la coinfección con protozoarios como Giardia intestinalis, Dientamoeba fragilis y Endolimax nana y con bacterias como Campylobacter jejuni. En menor proporción se aislaron Entamoeba coli, Entamoeba histolytica/dispar, Shigella flexneri, Cryptosporidium sp. y Clostridium difficile (27). En otra investigación del 2005 realizada por Graczyk et al. en población escolar en Zambia, África, se aisló Blastocystis sp. y Endolimax nana simultáneamente en 43% de las 93 muestras analizadas. Es importante resaltar que en esta investigación no se encontró relación entre Blastocystis sp. y otros gérmenes, por tanto, se consideró que las bajas condiciones de higiene y la vía de transmisión podrían ser factores que favorecieran la coinfección con Endolimax nana en particular (28).
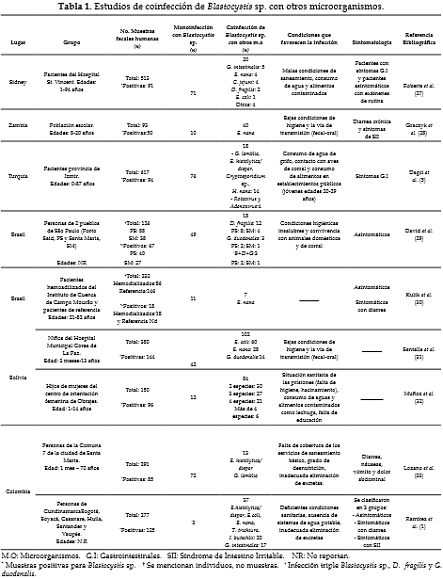
En un estudio de 2014 desarrollado por Dagci et al. en Turquía, se observó que 15,2% (94/617) del total de muestras analizadas fueron positivas para Blastocystis sp. En el 80,9% (76/94) de estas muestras se encontró únicamente este patógeno, mientras que en el 19,1% (18/94) restante se halló coinfección con otros microorganismos. De estas últimas muestras, el 14,8% (14/94) estuvieron relacionadas con parásitos intestinales como Giardia lamblia, Entamoeba histolytica/dispar, Cryptosporidium sp., Hymenolepis nana y Enterobius vermicularis y el porcentaje restante cursó con infecciones por virus como Rotavirus y Adenovirus (5). Esta investigación se caracterizó por reportar una alta prevalencia de monoinfección por Blastocystis sp. y además, añadió la asociación de este parásito con virus, lo cual ha sido poco estudiado hasta el momento.
En Suramérica existen pocas investigaciones destinadas a identificar la coinfección entre Blastocystis sp. y otros gérmenes. Una de las más recientes fue desarrollada por David et al. entre 2011y 2013 en un grupo de 126 personas de dos municipios de São Paulo, Brasil; se detectó como microorganismo más frecuente Blastocystis sp. con una prevalencia de 45% (40/88) en Porto Said y de 71% (27/38) en Santa Maria. En ambas regiones se determinó coinfección con Dientamoeba fragilis, Giardia duodenalis e incluso infección triple en tres individuos del total analizados (29). En otro estudio de 2008 realizado también en Brasil por Kulik et al., en pacientes con hemodiálisis atendidos en el Instituto do Cuenca de Campo Mourão, se encontró coinfección en 38,9% (7/18) de los individuos positivos para Blastocystis sp., de los cuales dos presentaban diarrea, hallándose una fuerte asociación de Blastocystis sp. con Endolimax nana (30).
En una investigación desarrollada por Santalla et al. en niños del Hospital Municipal Corea en La Paz, Bolivia, entre los años 2010-2011, se encontró BlastocystiBp. en 37,9% (144/380) del total de muestras analizadas; esta prevalencia es alta comparada con la obtenida para otros microorganismos como Endolimax nana y Entamoeba coli. También se reportó coinfección en 70,8% (102/144) de las muestras positivas para Blastocystis sp, asociada principalmente con Entamoeba coli, Endolimax nana y Giardia duodenalis (31). Otro estudio realizado también en La Paz por Muñoz et al. en 2008, analizó 150 muestras de heces, demostrando una alta tasa de coinfección de Blastocystis sp. con otros microorganismos; el mayor porcentaje se observó con Entamoeba coli y Endolimax nana con valores estadísticamente significativos (32). Estas investigaciones demuestran claramente una alta tasa de parasitismo intestinal en niños menores de 15 años, con un elevado porcentaje de coinfección por dos o más parásitos, siendo altamente frecuente la presencia de Blastocystis sp. como una clara muestra de las deficientes condiciones higiénicas de estas poblaciones.
En Colombia se han desarrollado diferentes estudios que evidencian la asociación de Blastocystis sp. con otros microorganismos. En una investigación realizada en la ciudad de Santa Marta por Lozano et al. en 2004, se analizó la coinfección de Blastocystis sp. con otros parásitos patógenos en 291 personas. Se examinaron heces diarreicas al microscopio, observándose que en 39,5% (115/291) de las muestras, la prueba para enteroparásitos resultó positiva y de estas el 62,6% (72/115) presentaron únicamente Blastocystis sp., el 26,09% (30/115) presentaron otros parásitos y 11,3% (13/115) de las muestras presentaron Blastocystis sp. asociado con otros parásitos, siendo los más frecuentes Entamoeba histolytica/dispar y Giardia lamblia, aunque no se reporta la relación numérica de dichas coinfecciones (33).
Otro estudio en Colombia del año 2013, realizado por Ramírez et al., encontró que de un total de 277 muestras de heces fecales humanas, el 45,1% (125/277) fueron positivas para Blastocystis sp. Los pacientes infectados con este parásito y que presentaron diarrea, fueron clasificados en 3 grupos: en el primer grupo se incluyeron 20 pacientes con poliparasitismo intestinal; el segundo grupo estuvo conformado por 17 pacientes coinfectados con Giardia intestinalis y en el último grupo se ubicaron los 3 pacientes sin coinfección (1).
Se puede afirmar que en los estudios de coinfección reportados hasta el momento, los parásitos que se han asociado con mayor frecuencia a Blastocystis sp. Son Endolimax nana, Giardia intestinalis (también denominada duodenalis o lamblia) y Entamoeba histolytica/dispar, es decir, protozoarios que comparten características como la vía de transmisión (27) y el cuadro clínico (29). Además, se evidencia que Blastocystis sp. no solo puede convivir con otros microorganismos, sino que puede encontrarse relacionado con infecciones polimicrobianas persistentes y de difícil manejo en poblaciones vulnerables, por sus deficientes condiciones socioeconómicas y educativas, que promueven el establecimiento de este tipo de problemáticas complejas.
Las infecciones oportunistas son causadas por agentes que normalmente se convierten en patógenos sólo cuando se debilita el sistema inmune del huésped, situación asociada al consumo crónico de corticoides, post-trasplante, diagnóstico de VIH/SIDA o cáncer en manejo o no con quimioterapia. Todo esto se encuentra descrito en varios estudios realizados para determinar la relación entre la inmunosupresión, la presencia de parásitos inocuos y el desarrollo de sintomatología gastrointestinal (17).
Se han desarrollado varias investigaciones en diferentes lugares del mundo encaminados a determinar la relación existente entre VIH/SIDA y la presencia de microorganismos como Blastocystis sp., como agente causal de infecciones gastrointestinales. En este tipo de pacientes, específicamente se ha encontrado supresión de la respuesta inmunológica en la mucosa intestinal, lo cual impide que se dé el mecanismo de defensa frente a cualquier agente infeccioso, haciéndolo de esta manera más susceptible a diferentes tipos de infecciones (8). En Venezuela, Rivero et al. en el 2013, analizaron 56 muestras de heces de pacientes VIH positivos, con edades entre 21-79 años, quienes presentaban sintomatología gastrointestinal (diarrea, dolor abdominal y pérdida de peso entre otros). Este estudio reportó una alta prevalencia de infección por protozoos (82,26%), comparada con la producida por helmintos (12,74%), además de una elevada frecuencia de Blastocystis sp. (17,6%), ocupando el segundo lugar, precedido de Microspora, la cual se consideró como el patógeno más común (33,3%) (34).
Este aspecto ha sido de mayor interés en países asiáticos como China y Malasia. En 2012 Tian et al. encontraron que en China el 19,2% de los 302 individuos con VIH en su investigación, estaban infectados por Blastocystis sp., prevalencia alta comparada con la de otros parásitos hallados en las heces de estos pacientes. Estos datos muestran que en efecto, el estado de inmunosupresión asociado al VIH, aumenta la susceptibilidad de los individuos para desarrollar infecciones gastrointestinales por microorganismos como Blastocystis sp. (35). Por su parte, Tan et al. en el año 2009, desarrollaron una investigación en Malasia con 247 pacientes con VIH y 311 con cáncer (colon, cérvix, leucemia). Los resultados obtenidos en el primer grupo arrojaron una prevalencia de infección por Blastocystis sp. de 19,8% (49/247), mientras que en pacientes con cáncer, fue del 7,7% (25/311). La prevalencia mayor en individuos con VIH respecto a los de cáncer, podría estar ligado al régimen terapéutico del segundo grupo de pacientes, lo cual sería un aspecto bastante interesante de abordar, teniendo en cuenta que no hay un esquema terapéutico establecido para el tratamiento de Blastocystis sp. y a la susceptibilidad diferencial entre los subtipos del parásito a los distintos agentes farmacológicos usados para combatir las parasitosis (36).
Otro estudio realizado en Malasia en 2012 por Chandramathi et al. mostró otra perspectiva respecto a la prevalencia de Blastocystis sp. en individuos con cáncer colorrectal y de mama. Se realizaron muestreos antes del tratamiento sin encontrarse microorganismos; después de iniciado el tratamiento, se identificó la presencia de Blastocystis sp. y Microsporidium en heces, con mayor frecuencia durante los ciclos de quimioterapia intermedia; esto podría explicarse por la acción citotóxica de los medicamentos usados en la quimioterapia, que causan efectos negativos en la respuesta inmune normal del individuo y generan un estado de inmunosupresión (37).
Recientemente, Pipatsatitpong et al. realizaron en Tailandia la búsqueda de Blastocystis sp. en 503 niños y en personal de un centro de cuidado infantil en donde conviven tanto niños inmunocompetentes como niños con VIH, para los cuales, el centro funciona como un hospicio. El parásito se encontró en 13,6% de los participantes y como hallazgos particulares de esta investigación, Blastocystis sp. se encontró en mayor medida en adultos y por otro lado, no fue encontrado en niños con VIH. Si se tiene en cuenta que a Blastocystis sp. se le ha considerado oportunista, este último hallazgo podría llevar a replantear esta denominación; sin embargo, los autores reportan que los niños estaban bajo terapia antirretroviral y no puede descartarse por tanto, que esta variación respecto a otros reportes en población con VIH, se deba a que estos fármacos presenten actividad sobre la viabilidad del parásito o ejerzan algún efecto protector en el organismo de estos individuos (38).
Hasta el momento de la realización de esta revisión, no se encontraron evidencias directas acerca de la acción de agentes retrovirales o anticancerosos sobre Blastocystis sp.
Blastocystis sp. se reconoce actualmente como un complejo de subtipos (STs) que no han sido caracterizados como especies independientes debido a su diversidad genética (7, 28, 39). Recientemente se reveló que distintos STs de Blastocystis sp. colonizan al ser humano, otros mamíferos y a pájaros; sin embargo, hasta el momento no se han reportado estudios que relacionen de manera exclusiva cada subtipo con un hospedero específico (1).
El uso del BU-rADN de Blastocystis sp. ha permitido establecer la gran diversidad genética de los aislados en humanos y distinguir estos de los aislados de otros hospederos. Esta herramienta ha permitido asignar 17 genotipos del parásito a partir de diversos hospederos; varios genotipos más (hasta el 33) no han sido publicados, pero pueden ser revisados en la base de datos GenBank con la denominación de STs (40).
De los nueve subtipos que se han logrado identificar en humanos, cuatro de ellos son los más comunes (ST1, ST2, ST3, ST4), y conforman por lo menos el 90% de todos los aislados que involucran subtipificación (41). Los subtipos restantes que se han reportado en humanos, se han registrado de manera esporádica; pero podrían evidenciar el rol zoonótico de este parásito. ST5 es muy común en ganado bovino y porcino, ST6 y ST7 están relacionados con aves, ST8 es común en primates y respecto a ST9 faltan evidencias de su rol en humanos (40).
De acuerdo con la distribución geográfica de los distintos subtipos, la información en efecto varía de una región a otra. En la mayoría de estudios realizados en Europa, los STs más comunes han sido el 1, 2, 3 y 4. En el caso de Suramérica, hay escasos datos disponibles sobre los STs de Blastocystis sp. En esta parte del continente americano se ha observado que la colonización humana es más común con los STs 1, 2 y 3, mientras que el ST4 aún no ha sido detectado en humanos en esta zona; sin embargo, este subtipo ha sido aislado en primates, lo que confirmaría su existencia en Suramérica, al menos en el entorno silvestre (1). Según lo reportado, la mayoría de investigaciones realizadas en el mundo, han identificado al ST3 como el más predominante; a excepción de algunos estudios realizados en España (42), Dinamarca (43) y Nepal (44) donde el ST4 ha sido el más prevalente y otros en Libia (45) y Brasil (46) donde se documentó el ST1 como el predominante; lo cual demuestra que los STs de Blastocystis sp. varían dependiendo de la distribución geográfica, el parásito, el hospedero, entre otros factores.
Para ampliar la información al respecto, Souppart et al. en 2009 realizaron un análisis de la epidemiología molecular de aislados de Blastocystis sp. en el norte de Francia. A partir de muestras de materia fecal de 40 individuos que resultaron positivos para el parásito por microscopía, encontraron que ST3 fue el subtipo prevalente del parásito en 53,5% de las muestras analizadas, seguidos de ST1 (25,6%), ST2, ST4 y ST7 (47).
En 2012, Forsell et al. realizaron la subtipificación de aislados de Blastocystis sp. en materia fecal de pacientes suecos. Se identificaron 72 muestras positivas para Blastocystis sp. y se identificaron 5 subtipos (ST1, ST2, ST3, ST4 y ST7), siendo ST3 el más prevalente en 47,6% de todos los aislados, seguido de ST4 con un 20,6% (48).
En Holanda, Bart et al, en 2013, encontraron Blastocystis sp. en 107 de 442 individuos muestreados, siendo ST3 el de mayor predominio (42%), seguido de ST1 y ST2 ambos con una frecuencia de 22%. ST4 al igual que en otros reportes europeos presentó relativa frecuencia, encontrándose en 12% de los individuos infectados; mientras que ST6 y ST7 fueron aislados independientemente de dos pacientes (49).
El ST3 también fue el subtipo más común en Italia según la investigación realizada por Meloni et al. en 2011, donde se analizaron heces obtenidas de 34 pacientes con Blastocystis sp., que presentaron una distribución de subtipos en orden de frecuencia, así: ST3 (47,1%), ST2 (20,6%), ST4 (17,7%), ST1 (8,8%), STs 7 y 8 (2,9%); identificándose dos infecciones mixtas con ST1 - ST3 y ST2 - ST3 (50). A pesar de no ser un estudio de muestras numerosas, los hallazgos reflejan una tendencia similar a los demás reportes europeos de prevalencia del parásito e incluye un aspecto importante respecto a la variabilidad genética del parásito, que es la posibilidad de encontrar más de un subtipo infectando a un mismo individuo.
A pesar del número de estudios que registran a ST3 como prevalente en un mismo continente, en Europa también se ha observado discrepancia en su distribución, como se mencionó en este mismo apartado. En Dinamarca, ST4 resultó ser el más frecuente en humanos. De un total de 25 muestras positivas para Blastocystis sp., 19 correspondieron a ST4, seguido de 4 individuos con ST2, mientras que ST1 y ST3 se encontraron cada uno en un paciente. Esto es similar a lo observado por Domínguez et al. en 2009 en España, entre los cuales se encontró una prevalencia muy significativa de ST4 (94,1%) (43, 44).
Al ser Turquía un país transcontinental (parte de su territorio es europeo y parte asiático), el trabajo de Dogruman-Al et al. en 2009, es importante para establecer pequeños cambios en la distribución de Blastocystis sp. Si bien ST3 fue el más común de los subtipos aislándose en 57,6% de las muestras analizadas, el ST4 desaparece del panorama y son ST1 y ST2 los que empiezan a cobrar protagonismo como subtipos únicos y como infección mixta en más del 10% de los casos (51). Dadas las características geográficas, podría pensarse que esta distribución estaría influenciada de cierta manera por efectos migratorios y por la actividad económica en la zona.
Los reportes de Blastocystis sp. en Asia provienen en mayor medida de Irán, Malasia, Tailandia y Nepal. Si bien ST3 es el subtipo mayormente aislado en este continente, la aparición de subtipos provenientes de animales en población humana, muestra el potencial zoonótico de este parásito en la región. En Tailandia por ejemplo, se llegó a encontrar ST7 en 17,9% de las muestras positivas para Blastocystis sp., según el estudio de Jamtertom et al. en 2013 y curiosamente en Nepal, la prevalencia de ST4 (84,1%) sobrepasa cualquier reporte publicado hasta el momento sobre este subtipo (44, 52).
Respecto a Oceanía, el trabajo de Roberts et al. del 2012, provee datos importantes provenientes de la población australiana. Se encontró ST3 en 43,9% de las muestras analizadas, seguido de ST1 (30,76%), ST4 (13,18%), ST2 (5,49%), y en menor proporción los ST6, ST7 y ST8 con 3, 1 y 2 aislamientos respectivamente, que representan al 6,59% restante (8).
La información acerca del continente africano se limita a los estudios de Abdulsalam et al. (2013), Souppart et al. (2010) y Alfellani et al. (2013) en Libia, Egipto y Nigeria respectivamente; en estos estudios se encontraron los subtipos ST1, ST2 y ST3, encontrándose en orden de frecuencia en Egipto y Nigeria los subtipos ST3, ST1 y ST2, mientras que en Libia el ST1 fue aislado con mayor frecuencia, seguido de ST2 y ST3 (41, 45, 53).
En América, el estudio reciente de David et al. confirma el predominio no solo de Blastocystis sp. como uno de los patógenos más aislado en heces fecales humanas, sino de ST3 como el más común seguido de ST1 y ST2; ST7 y ST6 se hallaron casi en igual proporción que en el continente asiático (30).
En otra investigación desarrollada en la comunidad indígena Tapirapé, ubicada en la región amazónica de Brasil conocida como Mato GroBo, se hallaron 66 muestras de heces positivas para Blastocystis sp. La mayoría de los aislamientos correspondieron a ST1, seguido de ST2 y finalmente ST3. Como se mencionó, la diferencia esencial de este estudio con la mayoría de los publicados, radica en la alta prevalencia del ST1 que fue evidenciada en la población humana evaluada.
En cuanto a las investigaciones realizadas en Colombia sobre subtipos de Blastocystis sp., una de las más relevantes se llevó a cabo en el 2013, dirigida a determinar la distribución de los subtipos según los diferentes hospederos teniendo como referencia muestras obtenidas de siete regiones del país (Cundinamarca, Bogotá, Boyacá, Casanare, Huila, Santander y Vaupés). Se recolectaron muestras de heces fecales positivas para Blastocystis sp. al examen microscópico, correspondientes a 277 de origen humano, 52 de aves, y 117 de mamíferos (25 reses, 40 zarigüeyas, 40 perros, 10 ratas y 2 monos aulladores). Las muestras fueron analizadas y secuenciadas por PCR y los subtipos observados con mayor frecuencia correspondieron al ST1 (34%) y ST2 (23%), y en menor proporción a los STs 3 (11,4%), 4 (0,8%), 6 (19,8%) y 8 (10,5%). Llamó la atención que los STs más comunes en humanos, también lo fueron en los mamíferos domesticados (ST1, ST2, ST3) y por el contrario los menos aislados se detectaron en su mayoría en pájaros y marsupiales (ST6, ST8). En cuanto a los STs 4 y 8, según los hallazgos de este estudio, se encontraron relacionados con el ciclo de vida silvestre del parásito (17).
Es importante tener en cuenta que el escaso número de investigaciones que se han desarrollado en Latinoamérica, y específicamente en Colombia, ha limitado el conocimiento acerca de la prevalencia y distribución geográfica de los diferentes subtipos de Blastocystis sp. en nuestro medio y de su asociación con sintomatología y patogenicidad.
Aunque han aumentado el número de estudios que citan a Blastocystis sp. como un patógeno emergente, todavía el debate sobre su estado permanece abierto, debido probablemente al hecho de que se puede encontrar tanto en pacientes sintomáticos como asintomáticos (7, 54, 55).
En humanos, la infección por Blastocystis sp. puede causar síntomas como diarrea, dolor abdominal, flatulencia, náuseas, vómito, constipación, pérdida de peso o fatiga y la severidad puede variar desde formas agudas a crónicas (7, 11). Tan et al. en 2010 y Scanlan en 2012, concluyeron que una posible forma de explicar estas diferencias, podría recaer en la diversidad genética del parásito, expuesta previamente; sin embargo, no hay evidencias contundentes acerca de una relación directa entre dichos síntomas y la presencia de varios subtipos del parásito (11, 55, 56).
En los últimos años, gran parte de los esfuerzos se han dirigido a confirmar el potencial patogénico de Blastocystis sp., no solo como causante de sintomatología gastrointestinal, sino también como agente desencadenante de cuadros de hipersensibilidad y cáncer.
Jones et al. en 2009, analizaron la posible asociación entre pacientes sintomáticos con infecciones por Blastocystis sp. ST1 y ST3. Participaron 21 individuos, habitantes del área metropolitana de Corvallis (Oregon, EUA) que presentaban sintomatología variable (fatiga, depresión, rash cutáneo, artralgias, constipación, dolor abdominal y diarrea y con diagnóstico médico de infección por Blastocystis sp. Los investigadores encontraron que 9 de los 21 participantes, fueron positivos para Blastocystis sp. , y que 6 de estos estaban infectados con ST3; mientras que uno se encontraba infectado con ST1, sugiriendo a estos subtipos del parásito como causantes de sintomatología y que podría haber una asociación entre Blastocystis sp. con enfermedad gastrointestinal crónica (57).
Por su parte, Moosavi et al. en 2012, determinaron la variabilidad genética de aislados de Blastocystis sp. en individuos sintomáticos y asintomáticos en Irán. Se usaron en este estudio 420 muestras de materia fecal de las cuales 287 provenían de individuos con sintomatología gastrointestinal y 133 de individuos asintomáticos. De las 420 muestras analizadas, 15,2% fueron positivas por microscopía y 23,8% por cultivo. Se encontraron cuatro subtipos a partir de la PCR realizada a las muestras positivas (ST1, ST2, ST3 y ST5), y de estos el más prevalente fue ST3 representado en el 53% de las muestras positivas, seguido de ST1. Entre los hallazgos más interesantes en este estudio, se encontró que 33% de las muestras positivas tenía más de un subtipo presente. Al comparar estos resultados con la presencia de sintomatología, se pudo apreciar que ST1 y la combinación ST1-ST3 fueron más prevalentes en los sintomáticos en comparación a los individuos asintomáticos, lo que hace pensar que estos dos subtipos podrían estar estrechamente relacionados con el rol patogénico de Blastocystis sp. en humanos (58).
El Safadi et al. en 2014 analizaron muestras de heces de 93 niños de Senegal, en donde la totalidad de las muestras fueron positivas para Blastocystis sp. En este estudio, ST3 fue el subtipo más común para Blastocystis sp. presente en 49,5% de los casos, seguido de ST1 presente en 28,2%, ST2 20,4% y ST4 1,9%. Además de estos hallazgos, los investigadores reportaron coexistencia de varios subtipos en un mismo individuo, siendo los que más resaltaron ST2/ST3 en 3 individuos y ST1/ST2/ST3 en 2. Al tener en cuenta que más de la mitad de los niños poseían síntomas, es posible pensar que el parásito tuviera relación con los trastornos gastrointestinales reportados, en especial el subtipo ST3 (59).
La mayor atención sobre el potencial patogénico de Blastocystis sp. ha recaído en la sospecha de estar involucrado como agente en síndrome de intestino irritable (SII), de hecho, Poirier et al. en 2012, reportaron una interesante incidencia del parásito en individuos con SII respecto a población sana; los estudios de Yakoob et al. (2010), Fouad et al. (2011) y Jimenez et al. (2012), reportaron alta frecuencia de ST1 y ST3, pero no establecieron si Blastocystis sp. era el único agente de tipo infeccioso encontrado en estos pacientes (54, 60, 61, 62).
Alfellani et al. en 2013, por su parte, encontraron a ST4 como el más común en pacientes con SII del Reino Unido, con un estudio en el cual, además, se trató de mostrar la variación en la distribución de los STs en diferentes partes del mundo. Al comparar las muestras procedentes de África, con las obtenidas en este estudio, se encontró que otros subtipos son más prevalentes, concordando con reportes previos. A pesar de las discrepancias, sería posible decir que la sola presencia del parásito en individuos sintomáticos podría indicar que estaría involucrado en alguna medida con la patofisiología de SII; sin embargo, es importante profundizar en estudios que determinen el papel real de Blastocystis sp. en esta enfermedad (41).
Tanto ST2 como ST3 han sido motivo de estudio en individuos con desórdenes cutáneos como urticaria; sin embargo, la mayor parte de la información al respecto proviene de reportes de casos individuales de pacientes a los cuales se les ha encontrado al parásito como único agente patógeno (63, 64, 65). Recientemente, en Argentina, Casero et al. investigaron la asociación de subtipos de Blastocystis sp. con la presencia de urticaria, siendo esta una manifestación clínica no muy común en pacientes infectados. ST3 fue detectado en 71,6% de las muestras analizadas seguidas en orden de frecuencia por ST1, ST6 y ST2 en menor proporción. De las muestras positivas para el subtipo 3, el 71.4% correspondieron a pacientes sintomáticos, lo que da fuertes indicios de este subtipo como causal de esta manifestación en individuos infectados (66).
Estudios in vitro intentaron demostrar el efecto de antígenos de diferentes subtipos de Blastocystis sp. sobre la proliferación de células de cáncer de colon, HCT116. Kumarasamy et al. en 2013 encontraron que el subtipo 3 es capaz de desencadenar una alta proliferación de células cancerígenas, aumentando citoquinas del perfil Th2, especialmente TGF-B, y la producción de Catepsina B, lo que lleva a postular que el parásito podría exacerbar la proliferación al debilitar la respuesta inmune celular. De igual manera, la disminución de IFN-y y de la expresión de p53 por efecto de los antígenos de Blastocystis sp., hacen sugerir su participación en carcinogénesis (67). Este hallazgo hace pensar en la posibilidad de que Blastocystis sp. pueda tener algún tipo de participación en neoplasias gastrointestinales y amerita que más estudios sean desarrollados alrededor de este supuesto.
A pesar de todas las evidencias de las que se disponen hasta el momento, relacionar a Blastocystis sp. con enfermedad continúa siendo un reto para los investigadores en este campo. La amplia diversidad genética del parásito es un obstáculo para desarrollar un modelo animal que permita resolver el dilema de su patogenicidad, dado que no todos los subtipos son capaces de infectar a humanos o a otros hospederos. Así mismo, es necesario generar investigaciones con criterios de inclusión y exclusión más rigurosos en donde se tengan en cuenta, entre otras cosas, todos los posibles orígenes de los síntomas de los individuos que hagan parte de estos estudios.
Se han determinado como las principales fuentes de infección de Blastocystis sp. para niños en edad escolar, el consumo de alimentos contaminados como la lechuga, el contacto con animales domésticos no vacunados y la ingesta de agua del grifo.
El rol patógeno de Blastocystis sp. asociado a morfología está principalmente relacionado con la forma ameboide, debido a la capacidad de adhesión de esta forma del parásito al epitelio intestinal, su metabolismo activo, la facilidad de ingerir bacterias y la presencia de proteasas que degradan la IgA y afectan el sistema inmune del huésped, haciéndolo más susceptible al desarrollo de sintomatología de origen intestinal o extraintestinal. La forma de Blastocystis sp. con menor implicación patógena encontrada en la mayoría de los casos es la granular, porque solo ha sido hallada con alta prevalencia en pacientes asintomáticos.
El cuadro clínico desarrollado en personas infectadas por Blastocystis sp., es inespecífico, varía con la edad y además los síntomas se pueden clasificar en gastrointestinales o extraintestinales. De acuerdo con los resultados de los diferentes estudios revisados, los síntomas gastrointestinales predominantes son: diarrea, dolor abdominal, vómito, constipación y fiebre; mientras que el síntoma extraintestinal hallado con mayor frecuencia es la urticaria, asociada principalmente a la morfología ameboide del ST3.
En gran parte de las heces con Blastocystis sp. se encuentran concomitantemente otros microorganismos de mayor patogenicidad. La asociación con otros protozoarios puede variar con la edad, ya que en escolares se encuentra conviviendo con Endolimax nana, mientras que en adultos, hay coinfecciones con Entamoeba histolytica/dispar, Endolimax nana y Giardia lamblia. Blastocystis sp. también es considerado en algunos estudios como un microorganismo oportunista, ya que se presenta con alta prevalencia en pacientes inmunocomprometidos, bien sea por VIH/SIDA o cáncer principalmente de colon, recto y mama, superando incluso en frecuencia a otros microorganismos con mayor índice de patogenicidad como Entamoeba histolytica/dispar.
De acuerdo con los estudios realizados hasta el momento, se ha establecido que el ST3 es el subtipo más prevalente en los aislamientos de muestras de heces fecales humanas en diferentes países alrededor del mundo. Además, no se ha establecido una relación directa de este subtipo con la ubicación geográfica, a diferencia de otros como el ST1, ST2 y ST4 que presentan variaciones importantes de acuerdo al país donde se han realizado las investigaciones.
Existen pocos estudios acerca de la patogenicidad asociada a subtipos del Blastocystis sp. en Colombia, razón por la cual sería importante desarrollar investigaciones que permitan establecer la relación de este microorganismo con la aparición de síntomas tanto gastrointestinales como extraintestinales y los subtipos involucrados en este tipo de sintomatología, teniendo en cuenta poblaciones con diferentes rangos de edad, sexo, entre otras variables, que pueden ser determinantes en los resultados obtenidos y que pueden permitir aportar nueva información al respecto.
Los autores agradecen a la Universidad Santiago de Cali y a la Universidad de Santander (UDES), sede Cúcuta.
1. Ramírez J, Sánchez L, Bautista D, Corredor A, Flórez A, Stensvold C. Blastocystis subtypes detected in humans and animals from Colombia. Infect Genet Evol. 2014; 22:223-228. [ Links ]
2. Barahona R, Maguiña V, Náquira V, Terashima I, Tello R. Blastocystosis humana: estudio prospectivo, sintomatología y factores epidemiológicos asociados. Rev gastroenterol Peru. 2003; 23: 29-35. [ Links ]
3. Cárdenas M, Martínez R. Protozoarios parásitos de importancia en salud pública transportados por Musca domestica Linnaeusen Lima, Perú. Rev peru biol. 2004; 11:149-153. [ Links ]
4. Quiceno J, Bastidas X, Rojas D, Barayona M. La mosca doméstica como portador de patógenos microbianos, en cinco cafeterías del norte de Bogotá. Rev UDCA Act & Div Cient. 2010; 13: 23-29. [ Links ]
5. Dagci H, Kurt Ö, Demirel M, Mandiracioglu A, Aydemir S, Saz U, et al. Epidemiological and diagnostic features of Blastocystis Infection in symptomatic patients in Izmir province, Turkey. Iranian J Parasitol. 2014; 9:519-529. [ Links ]
6. Muñoz V, Frade C. Blastocystis Hominis: parásito enigmático. Cuad - Hosp Clín. 2005; 50:1-5. [ Links ]
7. Tan K. New insights on classification, identification and clinical relevance of Blastocystis spp. Clin Microbiol Rev. 2008; 21: 639-665. [ Links ]
8. Abu-Madi M, Aly M, Behnke JM, Clark CG, Balkhy H. The distribution of Blastocystis subtypes in isolates from Qatar. Parasit Vectors. 2015; 8: 465. [ Links ]
9. Tan S, Singh M, Yap E. Recent advances in Blastocystis hominis research: hot spots in terra incognita. Int J Parasitol. 2002; 32: 789-804. [ Links ]
10. Domínguez M. Heterogenicidad genética de Blastocystis hominis: implicaciones patogénicas [tesis doctoral]. Valencia: Universidad de Valencia. Departamento de Microbiología y Ecología; 2003. [ Links ]
11. Tan K, Mirza H, Teo J, Wu B, Macary P. Current views on the clinical relevance of Blastocystis spp. Curr Infect Dis Rep. 2010; 12:28-35. [ Links ]
12. Nagel R, Cuttell L, Stensvold C, Mills P, Bielefeldt H, Traub R. Blastocystis subtypes in symptomatic and asymptomatic family members and pets and response to therapy. Intern Med J. 2012; 42:1187-1195. [ Links ]
13. Hameed D, Hassanin O, Zuel-Fakkar N. Association of Blastocystis hominis genetic subtypes with urticaria. Parasitol Res. 2011; 108:553-560. [ Links ]
14. Eroglu F, Genc A, Elgun G, Koltas I. Identification of Blastocystis hominis isolates from asymptomatic and symptomatic patients by PCR. Parasitol Res. 2009; 105:1589-1592. [ Links ]
15. Boorom K, Smith H, Nimri L, Viscogliosi E, Spanakos G, Parkar U, Li L-H, Zhou X-N, Ok U, Leelayoova S, Jones M. Oh my aching gut: irritable bowel syndrome, Blastocystis, and asymptomatic infection. Parasit Vectors. 2008; 1:40. [ Links ]
16. Zapata J, Rojas C. Una actualización sobre Blastocystis sp. Revista Grastrohnup. 2012; 14: 94-100. [ Links ]
17. Tan S. New Insights on classification, identification, and clinical relevance of Blastocystis spp. Clin Microbiol Rev. 2008; 21: 639-665. [ Links ]
18. Londoño A, Mejía M, Gómez J. Prevalencia y factores de riesgo asociados a parasitismo intestinal en preescolares de zona urbana en Calarcá, Colombia. Rev salud pública. 2009; 11: 72-81. [ Links ]
19. Londoño A, Loaiza J, Lora F, Gómez J. Frecuencia y fuentes de Blastocystis sp. en niños de 0 a 5 años de edad atendidos en hogares infantiles públicos de la zona urbana de Calarcá, Quindío. Rev Biomédica. 2014; 34:218-227. [ Links ]
20. Stenzel D, Boreham P. Blastocystis hominis Revisited. Clin Microbiol Rev. 1996; 9: 563-584. [ Links ]
21. Basak S, Rajurkar M, Mallick S. Detection of Blastocystis hominis: a controversial human pathogen. Parasitol Res. 2014; 113: 261-265. [ Links ]
22. Tan T, Suresh K. Predominance of amoeboid forms of Blastocystis hominis in isolates from symptomatic patients. Parasitol Res. 2006; 98: 189-193. [ Links ]
23. Rajamanikam A, Govind S. Amoebic forms of Blastocystis spp. - evidence for a pathogenic role. Parasit Vectors. 2013; 6: 295. [ Links ]
24. Elwakil H, Hewedi I. Pathogenic potential of Blastocystis hominis in laboratory mice. Parasitol Res. 2010; 107: 685-689. [ Links ]
25. Mehlhorn H, Tan S, Yoshiwaka H, editors. Blastocystis: Pathogen or Passenger? 1a ed. Berlin: Springer; 2012. [ Links ]
26. Bálint A, Dóczi I, Bereczki L, Gyulai R, Szucs M, Farkas K. Do not forget the stool examination cutaneous and gastrointestinal manifestations of Blastocystis sp. infection. Parasitol Res. 2014; 113: 1585-1590. [ Links ]
27. Roberts T, Stark D, Harkness J, Ellis J. Subtype distribution of Blastocystis isolates identified in a Sydney population and pathogenic potential of Blastocystis. Eur J Clin Microbiol Infect Dis. 2013; 32: 335-343. [ Links ]
28. Graczyk T, Shiff C, Tamang L, Munsaka F, Beitin A, Moss W. The association of Blastocystis hominis and Endolimax nana with diarrheal stools in Zambian school-age children. Parasitol Res. 2005; 98: 38-43. [ Links ]
29. David EB, Guimarães S, De Oliveira A, Goulart T, Nogueira G, Moraes A. Molecular characterization of intestinal protozoa in two poor communities in the State of São Paulo, Brazil. Parasit Vectors. 2015; 8: 103. [ Links ]
30. Kulik R, Falavigna D, Nishi L, Marques S. Blastocystis sp. and other intestinal parasites in hemodialysis patients. Braz J Infect Dis. 2008; 12: 338-341. [ Links ]
31. Santalla J, Montaño W. Frecuencia de Blastocystis sp. y otros parásitos intestinales en niños entre 3 meses a 13 años provenientes del Hospital Municipal Corea de la Ciudad de El Alto [tesis]. Bolivia: Universidad Mayor de San Andrés; 2013. [ Links ]
32. Muñoz V, Borda M, Churqui C, Frade C. Intestinal parasites in children of incarcerated mothers of Center at the Feminine Orientation of Obrajes, La Paz Bolivia: High prevalence of Blastocystis hominis. Biofarbo. 2009; 17: 39-46. [ Links ]
33. Lozano S. Presencia de Blastocystis hominis como agente causal de enfermedades gastrointestinales en la comuna 7 (Gaira) del Distrito de Santa Marta. DUAZARY. 2005; 2: 37-40. [ Links ]
34. Rivero Z, Hernández A, Bracho A, Salazar S, Villalobos R. Prevalencia de microsporidios intestinales y otros enteroparásitos en pacientes con VIH positivo de Maracaibo, Venezuela. Rev. Biomédica. 2013; 33: 538-545. [ Links ]
35. Tian L, Chen J, Wang T, Cheng G, Steinmann P, Cai Y, et al. Co-infection of HIV and intestinal parasites in rural area of China. Parasites and vectors. 2012; 5:1-7. [ Links ]
36. Tan T, Suresh K, Ong S. Genetic variability of Blastocystis sp. Isolates obtained from cancer and HIV/AIDS patients. Parasitol Res. 2009; 105: 1283-1286. [ Links ]
37. Chandramathi S, Suresha K, Bustam A, Kuppusamyc U. Infections of Blastocystis hominis and microsporidia in cancer patients: are they opportunistic? Trans R Soc Trop Med Hyg. 2012; 106: 267-269. [ Links ]
38. Pipatsatitpong D, Leelayoova S, Mungthin M, Aunpad R, Naaglor T, Rangsin R. Prevalence and Risk Factors for Blastocystis Infection Among Children and Caregivers in a Child Care Center, Bangkok, Thailand. Am J Trop Med Hyg. 2015; 93:310-315. [ Links ]
39. Badparva E, Sadraee J, Kheirandish F, Frouzandeh M. Genetic diversity of human Blastocystis isolates in Khorramabad, Central Iran. Iran J Parasitol. 2014; 9:44-49. [ Links ]
40. Clark C, van der Giezen M, Alfellani M, Stensvold C. Recent developments in Blastocystis research. Adv Parasitol. 2013;82:1-32 [ Links ]
41. Alfellani M, Stensvold C, Vidal A, Onuoha E, Fagbenro A, Clark C. Variable geographic distribution of Blastocystis subtypes and its potential implications. Acta Trop. 2013; 126: 11-18. [ Links ]
42. Domínguez M, Guna R, Muñoz C, Gómez M, Borrás R. High prevalence of subtype 4 among isolates of Blastocystis hominis from symptomatic patients of a health district of Valencia (Spain). Parasitol Res. 2009; 105:949-955. [ Links ]
43. Stensvold C, Christiansen D, Olsen K, Nielsen H. Blastocystis sp. subtype 4 is common in Danish Blastocystis-positive patients presenting with acute diarrhea. Am J Trop Med Hyg. 2011; 84:883-885. [ Links ]
44. Lee I, Tan T, Tan P, Nanthiney D, Biraj M, Surendra K, Suresh K. Predominance of Blastocystis sp. subtype 4 in rural communities, Nepal. Parasitol Res. 2012; 110:1553-1562. [ Links ]
45. Abdulsalam A, Ithoi I, Al-Mekhlafi H, Al-Mekhlafi A, Ahmed A, Surin J. Subtype Distribution of Blastocystis Isolates in Sebha, Libya. PLoS ONE. 2013; 8: e84372. [ Links ]
46. Malheiros A, Stensvold C, Clark C, Braga G, Shaw J. Short Report: Molecular Characterization of Blastocystis Obtained from Members of the Indigenous Tapirapé Ethnic Group from the Brazilian Amazon Region, Brazil. Am.J.Trop.Med.Hyg. 2011; 85: 1050-1053. [ Links ]
47. Souppart L, Sanciu G, Cian A, Wawrzyniak I, Delbac F, Capron M, Dei-Cas E, Boorom K, Delhaes L, Viscoqliosi E. Molecular epidemiology of human Blastocystis isolates in France. Parasitol Res. 2009; 105:413-421. [ Links ]
48. Forsell J, Granlund M, Stensvold C, Clark C, Evengard B. Subtype analysis of Blastocystis isolates in Swedish patients. Eur J Clin Microbiol Infect Dis. 2012; 31:1689-1696. [ Links ]
49. Bart A, Wentink E, Gilis H, Verhaar N, Wassenaar C, Van Vugt M et al. Diagnosis and subtype analysis of Blastocystis sp. in 442 patients in a hospital setting in the Netherlands. BMC Infect Dis. 2013; 23: 389. [ Links ]
50. Meloni D, Sanciu G, Poirier P, El Alaoui H, Chabé M, Delhaes L et al. Molecular subtyping of Blastocystis sp. isolates from symptomatic patients in Italy. Parasitol Res. 2011; 109:613-619. [ Links ]
51. Dogruman-Al F, Yoshikawa H, Kustimur S, Balaban N. PCR-based subtyping of Blastocystis isolates from symptomatic and asymptomatic individuals in a major hospital in Ankara, Turkey. Parasitol Res. 2009; 106: 263-268. [ Links ]
52. Jantermtor S, Pinlaor P, Sawadpanich K, Pinlaor S, Sangka A, Wilailuckana C et al. Subtype identification of Blastocystis spp. Isolated from patients in a major hospital in northeastern Thailand. Parasitol Res. 2013; 112:1781-1786. [ Links ]
53. Souppart L, Moussa H, Cian A, Sanciu G, Poirier P, El Alaoui H. et al. Subtype analysis of Blastocystis isolates from symptomatic patients in Egypt. Parasitol Res. 2010; 106:505-511. [ Links ]
54. Poirier P, Wawrzyniak I, Vivares C, Delbac F, El Alaoui H. New insights into Blastocystis spp: A potential link with irritable bowel syndrome. PLoS Pathog. 2012; 8: e1002545-e1002545. [ Links ]
55. Scanlan P. Blastocystis: past pitfalls and future perspectives. Trends Parasitol. 2012; 28: 327-334. [ Links ]
56. Ozyurt M, Kurt O, Molbak K, Nielsen H, Haznedaroglu T, Stensvold C. Molecular epidemiology of Blastocystis infections in Turkey. Parasitol Int. 2008; 57: 300-306 [ Links ]
57. Jones M, Whipps C, Ganac R, Hudson N, Boroom K. Association of Blastocystis subtype 3 and 1 with patients from an Oregon community presenting with chronic gastrointestinal illness. Parasitol Res. 2009; 104: 341-345. [ Links ]
58. Moosavi A, Haghighi A, Mojarad E, Zayeri F, Alebouyeh M, Khazan H, Kazemi B, Zali M. Genetic variability of Blastocystis sp. isolated from symptomatic and asymptomatic individuals in Iran. Parasitol Res. 2012; 111:2311-2315. [ Links ]
59. El Safadi D, Gaayeb L, Meloni D, Cian A, Poirier P, Wawrzyniak I, Delbac F, Dabboussi F, Delhaes L, Seck M, Hamze M, Riveau G, Viscogliosi E. Children of Senegal River Basin show the highest prevalence of Blastocystis sp. ever observed worldwide. BMC Infect Dis. 2014; 14: 164. [ Links ]
60. Yakoob J, Jafri W, Beg M, Abbas Z, Naz S, Islam M, et al. Blastocystis hominis and Dientamoeba fragilis in patients fulfilling irritable bowel syndrome criteria. Parasitol Res. 2010; 107: 679-684. [ Links ]
61. Fouad S, Basyoni M, Fahmy R, Kobaisi M. The pathogenic role of different Blastocystis hominis genotypes isolated from patients with irritable bowel syndrome. Arab J Gastroenterol. 2011; 12: 194-200. [ Links ]
62. Jimenez D, Martinez W, Reyes J, Ramirez M, Arroyo S, Romero M, et al. Blastocystis infection is associated with irritable bowel syndrome in a Mexican patient population. Parasitol Res. 2012; 110: 1269-1275. [ Links ]
63. Vogelberg C, Stensvold C, Monecke S, Ditzen A, Stopsack K., Heinrich U, et al. Blastocystis sp. subtype 2 detection during recurrence of gastrointestinal and urticarial symptoms. Parasitol Int. 2010; 59: 469-471. [ Links ]
64. Zuel N, Abdel D, Hassanin O. Study of Blastocystis hominis isolates in urticaria: A case-control study. Clin Exp Dermatol. 2011; 36: 908-910. [ Links ]
65. Katsarou A, Vassalos C, Tzanetou K, Spanakos G, Papadopoulou C, Vakalis N. Acute urticaria associated with amoeboid forms of Blastocystis sp. subtype 3. Acta Derm Venereol. 2008; 88: 80-81. [ Links ]
66. Casero R, Mongi F, Sánchez A, Ramírez J. Blastocystis and urticarial: Examination of subtypes and morphotypes in an unusual clinical manifestation. Acta Trop. 2015; 148: 156-161. [ Links ]
67. Kumarasamy V, Kuppusamy U, Samudi C, Kumar S. Blastocystis sp. Subtype 3 triggers higher proliferation of human colorectal cancer cells, HCT116. Parasitol Res. 2013; 112: 3551-3555. [ Links ]














