Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biosalud
Print version ISSN 1657-9550
Biosalud vol.16 no.1 Manizales Jan./June 2017
https://doi.org/10.17151/biosa.2017.16.1.8
DOI: 10.17151/biosa.2017.16.1.8
QUANTIFICATION OF VITAMIN D: FROM RESEARCH TO CLINICAL PRACTICE
Norma Serrano Díaz1
Elizabeth Guío Mahecha2
Alejandra González3
Laura Plata Paredes4
Doris Cristina Quintero Lesmes5
Silvia Becerra Bayona6
1 Magíster. Directora de Investigación, Desarrollo e Innovación HIC-FCV. Investigador Asociado (UNAB). Piedecuesta. Colombia. normaserrano@fcv.org
2 Magíster. Coordinadora del Laboratorio de Medicina Genómica y Metabolismo HIC – FCV. Piedecuesta. Colombia. elizabethguio@fcv.org
3 Química. Profesional de Apoyo del Laboratorio de Medicina Genómica y Metabolismo HIC – FCV. Piedecuesta. Colombia. alejandra.gonzalez.hurtado@gmail.com
4 Química. Profesional de Apoyo del Laboratorio de Medicina Genómica y Metabolismo HIC – FCV. Piedecuesta. Colombia. lauraplata@fcv.org
5 Doctorado. Directora del Grupo de investigación Estudios Epidemiológicos y de Salud Pública – FCV. Piedecuesta. Colombia. dorisquintero@fcv.org
6 Doctorado. Profesora Titular – Universidad Autónoma de Bucaramanga (UNAB). Colombia. sbecerra521@unab.edu.co
Las formas biológicamente activas de la vitamina D se han convertido en elementos de gran relevancia en la práctica clínica y la investigación, por lo tanto, su análisis se ha incrementado en años recientes. La vitamina D tiene un papel esencial en la regulación del metabolismo del calcio y fósforo; adicionalmente, esta vitamina es considerada un posible factor preventivo para diversas enfermedades crónicas como la diabetes mellitus tipo 2, algunos tipos de cáncer, cardiovasculares, autoinmunes, enfermedad pulmonar obstructiva crónica y la pre-eclampsia. Debido al posible papel en estas enfermedades y a los pocos estudios comparativos que se han realizado entre éstas y los niveles de vitamina D, los investigadores y clínicos están interesados en usar técnicas confiables y específicas que permitan determinar las concentraciones de vitamina D en el plasma. Sin embargo, no se ha establecido cuál es el mejor biomarcador que refleja la suficiencia de vitamina D y su función, ni tampoco cuál es la mejor técnica para su adecuada cuantificación. El objetivo de esta revisión es describir brevemente el metabolismo de la vitamina D y los retos que existen para su adecuada cuantificación con fines de investigación traslacional.
Palabras clave: vitamina D, investigación clínica, metabolitos de vitamina D, ergocalciferol, colecalciferol
The analysis of the biologically active forms of vitamin D has increased in the last decades, becoming a relevant tool in the clinical practice and investigation. Vitamin D plays an essential role in regulating the metabolism of calcium and phosphorous. In addition, this vitamin is considered a potential preventive factor in a wide range of chronical diseases such as cardiovascular and autoimmune diseases, different kinds of cancer, type 2 diabetes, chronical obstructive pulmonary disease, and pre-eclampsia. Due to the possible role that vitamin D has in these diseases and the few existing comparative studies which have been conducted between these diseases and the vitamin D levels, clinicians and researchers are interested in using reliable and specific techniques to quantify the concentrations of vitamin D in plasma. Nevertheless, in the scientific literature reviewed have not been established which is the best biomarker that indicates the sufficiency and function of vitamin D nor which is the most appropriate technique for adequate quantification. The goal of this review is to briefly describe the metabolism of vitamin D and the current challenges for its proper quantification and use in translational research.
Key words: vitamin D, clinical research, vitamin D metabolites, ergocalciferol, cholecalciferol.
La vitamina D (VD) junto con las vitaminas A, E y K, es considerada una vitamina liposoluble que actúa como una hormona esteroide en una gran variedad de funciones fisiológicas, en especial en la regulación del metabolismo del calcio y fósforo (1, 2). La deficiencia severa de VD conlleva a varios trastornos que incluyen desmineralización de los huesos, raquitismo, osteoporosis y fracturas patológicas en adultos. La mayoría de los órganos del cuerpo, tales como páncreas, estómago, genitales, cerebro y piel, poseen receptores para esta vitamina (3-5), la cual puede obtenerse naturalmente por dos mecanismos: la síntesis que ocurre en la piel por la exposición a la radiación ultravioleta B de la luz solar (UV-B, 290-320 nm), y su obtención a partir de fuentes de la dieta, incluyendo alimentos fortificados y suplementos. Los alimentos ricos en VD incluyen pescados grasos, yema de huevo, aceite de hígado de pescado y algunos tipos de hongos. Sin embargo, es difícil obtener suficiente VD de los alimentos no enriquecidos por su bajo contenido o su uso infrecuente; por lo tanto, la mayor parte de la vitamina D que se encuentra circulante en el cuerpo se obtiene de los alimentos enriquecidos, la exposición a la luz solar y suplementos (6).
Durante las dos últimas décadas, un gran número de estudios se han centrado en investigar las funciones biológicas de la VD y su nivel sanguíneo óptimo, encontrando una correlación positiva entre la deficiencia de VD con los tres problemas de salud más prevalentes en el mundo: enfermedad cardiovascular, cáncer y enfermedades respiratorias (7-9). Aunque anteriormente se consideró que la deficiencia de esta vitamina era un problema común sólo de los países que carecían de un clima soleado la mayor parte del año, los resultados de investigación confirman cada vez más que la deficiencia de VD es un problema de salud pública (10), incluso en países que disfrutan de una temperatura cálida la mayor parte del año (11). Por consiguiente, la necesidad de cuantificar esta vitamina en forma precisa para lograr establecer una asociación no espuria entre un fenotipo determinado y los niveles sanguíneos de VD, se ha convertido en un reto, en especial con fines de investigación traslacional. Actualmente, se han propuesto diferentes métodos para llevar a cabo esta cuantificación, pero aún se deben superar obstáculos que están determinados por las propiedades físicas y químicas de esta vitamina, la normalización incompleta de la medición y las limitaciones de las técnicas que se utilizan (12). El objetivo de esta revisión es describir brevemente los métodos y los biomarcadores actuales que se emplean para la cuantificación de la VD junto con los retos que existen para obtener una adecuada cuantificación y su aplicación en la investigación traslacional.
Metabolismo de la vitamina DLa VD se encuentra naturalmente en dos formas principales: vitamina D2 (ergocalciferol) y vitamina D3 (colecalciferol) (Figura 1A). La vitamina D2 se puede obtener de las plantas que están sometidas a la radiación ultravioleta y por la suplementación dietética. La vitamina D3 se obtiene, en su mayor parte, por síntesis endógena a partir de la exposición al sol y solo una pequeña cantidad a partir de los alimentos derivados de animales (13). La síntesis endógena se ve influenciada por muchos factores, tales como grosor y color de la piel, el tiempo de exposición al sol y la temporada (14). En la capa de Malpighi de la piel expuesta a la radiación UV, entre 280 nm y 315 nm, la pro-vitamina D3 y pro-vitamina D2 (7-dehidrocolesterol y ergosterol, respectivamente) se transforman en pre-vitamina D que mediante la temperatura corporal normal sufre una isomerización de sus dobles enlaces, para formar VD. A diferencia de los suplementos dietarios, la exposición continua a la radiación UV no conduce a toxicidad por VD, debido a que el exceso de pre-vitamina D se convierte en lumisterol y taquisterol, formas inactivas, proceso que se invierte cuando los niveles de pre-vitamina D caen (15). Una vez formada, la VD pasa de las células de la piel a la circulación sanguínea donde se acopla a una proteína específica (a1-globulina), llamada proteína de unión a la vitamina D (VDBP) para su transporte en plasma; esta proteína se considera el principal transportador de todos los metabolitos VD. En el hígado la VD, por medio de enzimas del citocromo P450 hepático, especialmente CYP27A y CYP2R1, es metabolizada a 25-hidroxivitamina D [25(OH) D], también conocida como calcidiol (15). La 25(OH) D, viaja por circulación hacia los riñones y a otros tejidos, para su posterior hidroxilación. En los riñones, la CYP27B1 (25-hidroxivitamina D-1a-hidroxilasa), convierte el calcidiol en 1,25-dihidroxivitamina D [1,25(OH)2D], principal metabolito activo de la VD también llamado calcitriol (16). Diferentes células, entre ellas macrófagos activados, queratinocitos y células óseas, producen localmente 1,25(OH)2D (16,17) (Figura 1B).
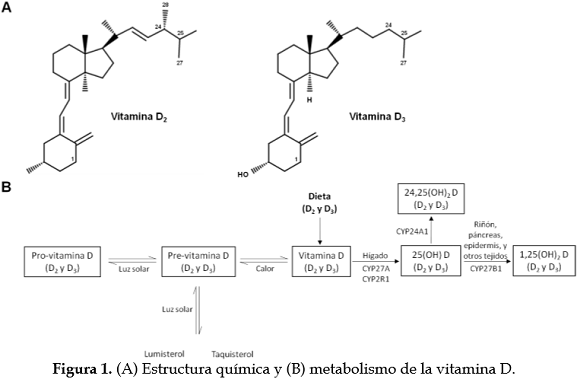
A continuación, la 1,25(OH)2D se une al receptor de la vitamina D (VDR), que se expresa en muchos tipos de células. Por medio de esta unión, la VD ejerce sus acciones biológicas tales como, favorecer la absorción de calcio intestinal, diferenciación celular, secreción de insulina, regulación de la expresión de genes, osteoblastogénesis, entre otras (18-20). Si bien la mayor cantidad de 1,25(OH)2D es sintetizada principalmente en el riñón, por medio de estimulación de la hormona paratiroidea (PTH), ante niveles elevados de 1,25(OH)2D se dispara una realimentación negativa, haciendo que disminuya la producción de PTH por la glándula paratiroides. A su vez, esto incrementa la síntesis de CYP24A1, enzima que convierte 1,25(OH)2D3 a la forma inactiva, conocida como ácido calcitroico, el cual es soluble en agua y eliminado por la bilis (16). A su vez, la enzima CYP24A1 metaboliza la 25(OH) D a 24,25(OH)2 D, evitando su activación (Figura 1B). Otros factores, tales como niveles de fósforo, calcio y factor de crecimiento de fibroblastos, pueden tener efectos positivos o negativos en la síntesis de 1,25(OH)2D en el riñón (19).
BiomarcadoresEn el metabolismo de la VD, por los menos seis metabolitos (biomarcadores), son blanco de cuantificación y asociación con fenotipos particulares: 25(OH)D3, 25(OH)D2, 3-epi-25(OH) D3, 1,25(OH)2D3, 1,25(OH)2D2, y 24,25(OH)2D3 (Tabla 1). Sin embargo, la 25-hidroxivitamina D [25(OH)D], se considera el mejor biomarcador para evaluar el estado de la VD en la sangre (21). Este metabolito tiene varias ventajas como indicador bioquímico debido a que: i) refleja tanto la producción endógena de VD como el consumo por dieta, ii) es un metabolito inactivo, por lo tanto no es altamente regulado, iii) la concentración de 25(OH)D, es relativamente alta en comparación con otros metabolitos, por ejemplo, su concentración es 1.000 veces más alta que la del 1,25-(OH)2D (principal metabolito activo), y iv) tiene una vida media relativamente larga, cerca de tres semanas (2).
Los niveles de 25(OH) D3 son generalmente más altos que los de 25(OH)D2 (22). No obstante, esta evaluación simplificada no tiene en cuenta los efectos dinámicos de los metabolitos tales como 1,25(OH)2D, que es la forma más activa de la vitamina o de metabolitos intermedios, como 24,25(OH)2D3, el cual se consideraba un compuesto sin actividad biológica. Hoy se conoce que este metabolito intermedio, tiene un papel crucial en la formación de hueso y en la reparación de las fracturas óseas (23). La disminución de la actividad de 24,25(OH)2D3, se ha asociado con un riesgo mayor de mortalidad en pacientes renales (24).
Por lo tanto, la correlación entre VD y fenotipos salud/enfermedad, requiere de una evaluación íntegra de los diferentes metabolitos VD y el fenotipo a estudiar, 'quimiotipos', para lo cual se requiere de técnicas de metabolómica capaces de identificar y cuantificar en grado analítico, tanto los metabolitos abundantes como aquellos que estén presentes en baja concentración, en el torrente sanguíneo (Tabla 1).

Técnicas para la cuantificación de vitamina D
La 25-hidroxivitamina D [25(OH)D] se ha reportado como el biomarcador que mejor refleja el estado de la VD (21). Este biomarcardor incluye la cantidad total de dos metabolitos de la VD que se encuentran en la circulación: 25-hidroxivitamina D3[25(OH)D3], metabolito derivado principalmente de la vitamina D3 producido por la acción de la luz solar en la piel, y 25-hidroxivitamina D2 [25(OH)D2], metabolito derivado del consumo de plantas en la dieta. La 25(OH)D tiene una vida media estimada de aproximadamente 2 a 3 semanas, y refleja información sobre el estado de VD procedente de la producción endógena, como también por fuente de la dieta y suplementos. Sin embargo, la VD que se almacena en otros tejidos del cuerpo, no se refleja en la cuantificación de 25(OH)D en suero o plasma (25). Por el contrario, aunque la 1,25(OH)2D es la forma más activa de VD, la cuantificación de los niveles presentes en suero o en plasma pueden no indicar con precisión el estado de VD del individuo debido a su corta vida media (15 horas), la cual está estrechamente regulada por la PTH y la ingesta de calcio y fosfato; como resultado, los niveles séricos de 1,25(OH)2D pueden reportarse como normales en individuos con deficiencia de vitamina D (26).
En las últimas décadas se han propuesto diferentes ensayos que están disponibles actualmente, para medir los niveles de VD. Dentro de estos ensayos se incluyen: radioinmunoensayo, ensayo competitivo de unión a proteínas (CPBA), cromatografía líquida de alta resolución (HPLC), y espectrometría de masas en tándem acoplada a cromatografía líquida (LC-MS/MS) (27). Las primeras cuantificaciones de 25(OH) D, se realizaron por medio de la técnica CPBA, utilizando como aglutinante la proteína de unión a VD (DBP por sus siglas en inglés de vitamin D binding protein). La ventaja de este ensayo está en que la DBP reconoce tanto la 25(OH)D2 como la 25(OH)D3, pero su principal limitación radica en que no los puede discriminar de los otros metabolitos de la VD, incluyendo la 24,25(OH)2D. Sin embargo, este metabolito, el cual es más polar, por lo general representa sólo entre el 10-15% de la concentración total de 25(OH)D.
En 1985, se desarrolló un radioinmunoensayo (RIA) para detectar 25(OH)D. Al igual que la CPBA, este ensayo reconoce en su medición tanto 25(OH)D2 como 25(OH)D3, sin distinguirlos de la 24,25(OH)2D y otros metabolitos polares. De esta manera, tanto el CPBA como los ensayos RIA típicamente sobreestiman los niveles de 25(OH)D en aproximadamente un 10-20% (27). A pesar de estas limitaciones,el ensayo RIA reporta menores coeficientes de variación (CV) intra e interensayo. Simultáneamente, con el fin de eliminar la interferencia causada por los diferentes metabolitos de la VD, se empezó a desarrollar la cromatografía preparativa sencilla para separar la 25(OH)D de los metabolitos más polares que interferían en los otros ensayos. Adicionalmente, a mediados de la década de 1970 se empezó a utilizar cromatografía líquida de alta resolución (HPLC), como técnica para cuantificar los niveles de 25(OH)D. Esta técnica incluía la extracción de lípidos del suero, seguido de cromatografía preparativa y posteriormente, la fracción de 25(OH)D era utilizada para llevar a cabo la HPLC. Este método fue considerado el gold standard, sin embargo, la técnica como tal, es compleja y no fue acogida por los laboratorios de referencia para muestras clínicas (28). No obstante, se propuso usar la cromatografía líquida en conjunto con la espectrometría de masas en tándem (LC-MS/MS), y se logró hacer una cuantificación diferenciada entre 25(OH)D2, 25(OH)D3 y 1,25(OH)2D (29), aislándolos de los otros metabolitos.
A partir de las diferentes técnicas y ensayos propuestos para la cuantificación de VD, actualmente se aceptan dos tipos de grupos de técnicas para evaluar el estado de esta vitamina: 1) métodos de inmunoensayo, los cuales utilizan anticuerpos dirigidos que reconocen específicamente las formas de la 25(OH)D de la vitamina D2 y D3 y 2) métodos de detección físicos (cromatográficos), los cuales separan la 25(OH)D2 y 25(OH)D3, teniendo en cuenta sus respectivas propiedades químicas. Cada grupo de técnicas tiene sus ventajas y desventajas, sin que exista hoy un consenso real acerca de la mejor técnica a utilizar tanto en investigación como en la práctica clínica de rutina para hacer una adecuada cuantificación de VD (Tabla 2).

Inmunoensayos: Los ensayos disponibles bajo esta metodología son fácilmente automatizados y proporcionan un tiempo de respuesta corto con un equipo fácil de usar y disponible a bajo costo. Adicionalmente, diversos kits comerciales se han desarrollado para este tipo de ensayos y se encuentran disponibles. Estos kits utilizan anticuerpos que se unen a la 25(OH) D, produciendo una señal quimioluminiscente que permite cuantificar la concentración del analito presente en la solución estudiada. Estos anticuerpos reconocen, con la misma afinidad, dos compuestos diferentes, la 25(OH) D2 y 25(OH)D3. Por lo tanto, solo tienen la capacidad de medir el total de 25(OH)D. Como resultado, diferentes compañías se han enfocado en mejorar la selectividad de esta técnica para cuantificar independientemente estos dos metabolitos. Particularmente, la compañía Roche, recientemente empezó a comercializar un inmunoensayo de electroquimioluminiscencia que funciona con las plataformas 'Elecsys' y 'Cobas E', el cual es específico para detectar solamente 25(OH)D3 (30, 31).
Métodos físicos de detección: En la actualidad están disponibles dos métodos que emplean detección directa de VD, no inmunológica:HPLC y LC-MS/MS. La medición de metabolitos de la VD por cromatografía líquida de alto rendimiento (HPLC), incorpora una columna de separación seguida de un sistema de detección, el cual incluye un rango amplio de opciones. Es importante aclarar que el término HPLC se restringe, generalmente, a los procedimientos que tienen detector UV o electroquímico. Por el contrario, si el HPLC está vinculado a detectores de masas, el procedimiento se denomina comúnmente LC-MS/MS. Antes de inyectar la muestra en la columna de separación, requiere una etapa inicial de purificación. En esta etapa inicial, las posibles sustancias que pueden contaminar e interferir en la HPLC y LC-MS/MS, como los lípidos y las proteínas, son eliminadas, y el metabolito de interés es purificado. La técnica de purificación más sencilla es la extracción líquido/líquido, la cual usa diferentes disolventes orgánicos para realizar la purificación. Alternativamente, también se han empleado procedimientos de rompimiento de las proteínas simples, seguido de una extracción en fase sólida (SPE).
Por otra parte, aunque la extracción y separación de VD por cromatografía conducirá inevitablemente a pérdida del analito, esta pérdida puede ser corregida mediante la inclusión de un estándar interno. Este estándar interno debe ser indistinguible del analito durante el proceso de extracción y purificación, y su elección es, en cierta medida, establecida por el procedimiento de cuantificación. Los estándares internos deuterados son un buen ejemplo para los procedimientos que emplean espectrometría de masas. Estos estándares deuterados son ideales debido a que, además de ser detectables, son químicamente idénticos al metabolito estudiado. A su vez, el uso de estos estándares permite que los efectos relacionados, no solo con el proceso de extracción y purificación sino también con la matriz en la que se encuentran las muestras, puedan ser compensados. Por el contrario, cuando se utilizan otros tipos de sistemas de detección, tales como absorción de luz y propiedades electroquímicas, generalmente se selecciona un estándar interno que tiene propiedades químicas similares a las del analito, y no está presente en las muestras biológicas. Por consiguiente, la cuantificación con HPLC es menos precisa que la que se realiza con LC-MS/ MS. A pesar de esta limitación, ambos métodos cromatográficos permiten cuantificar tanto la 25(OH)D2 como la 25(OH)D3 con alta precisión, en comparación con los inmunoensayos. Sin embargo, estas metodologías son más complejas, con tiempos de respuestas más largos, y requieren personal altamente calificado para el manejo de equipos cuyo costo es mayor, por lo tanto, son menos populares que los inmunoensayos (30, 31) (Tabla 2).
Dada la variedad de metodologías disponibles para la medición de 25(OH)D, la elección del mejor método, es un reto, especialmente teniendo en cuenta que en los últimos años se ha incrementado la necesidad de esta medición, tanto en la asistencia médica como en investigación. Varios autores continúan recomendando los inmunoensayos que se ejecutan en plataformas automatizadas como la técnica de preferencia, dado la comodidad y alto rendimiento de la prueba, en especial cuando se requiere analizar con regularidad un gran número de muestras. Mientras estos autores sugieren que la cuantificación de 25(OH)D por inmunoensayo sigue siendo el método de elección por razones de conveniencia, velocidad y costo (12), otros autores argumentan que estos ensayos, si bien sencillos y de alto rendimiento, han sacrificado el rigor analítico de la cuantificación y, por lo tanto, sólo proporcionan datos para indicar el estado relativo de vitamina D en términos semicuantitativos (25, 32).
En contraste, los ensayos para cuantificar VD por medio de LC-MS/MS, emplean una separación cromatográfica (LC) para aislar la 25(OH)D2 y 25(OH)D3 y, un sistema para detectar y cuantificar estos compuestos específicos de manera individual (MS/MS). Esto es particularmente relevante, si se tiene en cuenta que existen diferencias en la actividad biológica y la toxicidad de las vitaminas D2 y D3. La absorción intestinal de la vitamina D2 es menor que la de la vitamina D3. El aclaramiento de 25(OH)D2 de la circulación es más rápido que el de 25(OH)D3, lo que cual puede ser dado por la menor afinidad de 25(OH)D2 a la proteína de unión a la VD. Asimismo, existen algunas diferencias en el metabolismo de estas dos formas de vitamina D; de este modo, la concentración sérica de 25(OH)D2 no puede ser equiparable a la de 25(OH)D3. Hay pocas fuentes de vitamina D2 en la dieta, la cual se encuentra principalmente en los hongos silvestres, mientras que la vitamina D3 es la forma usada principalmente en suplementos y alimentos fortificados y además, es la forma predominante que surge de la síntesis cutánea. La medición de 25(OH)D2 podría ser importante a nivel individual, particularmente en investigación, en especial en ensayos clínicos donde la intervención sea la suplementación con vitamina D2. Si un paciente está recibiendo altas dosis de ergocalciferol, la cuantificación de 25(OH)D2, potencialmente puede revelar el grado de adherencia del paciente al tratamiento. Adicionalmente, esta metodología tiene mayor sensibilidad, exactitud y precisión (31).
Por otra parte, la cuantificación por medio de LC-MS/MS, además de permitir cuantificar de manera independiente 25(OH)D2 y 25(OH) D3, también podría permitir identificar con alta especificidad y cuantificar, 3-epi-25(OH) D3 y 1,25(OH)2D3 (33-36). Por consiguiente, este método es considerado hoy el recomendado para la medición del estado de VD, tanto en investigaciones como en la asistencia clínica; y los expertos recomiendan que debe llevarse a cabo en un laboratorio con experiencia adecuada, competente y con historia registrada de buen rendimiento (31).
Valores de referenciaEl estado de la VD se mide tradicionalmente por medio de la concentración sérica de 25-hidroxivitaminaD [25(OH)D], la forma principalmente circulante de VD. Sin embargo, existe controversia sobre los niveles de 25(OH) D y su asociación con el estado óptimo de VD (37). El Instituto de Medicina de Estados Unidos considera que una concentración por encima de 20 ng/mLde 25(OH)D(50 nmol/L), incluso en condiciones de mínima exposición al sol, representa un estado óptimo de vitamina D en la población general. Además, niveles más altos no han mostrado, de forma consistente, conferir mayores beneficios, desafiando el concepto de que "más es mejor". Particularmente, concentraciones séricas de 25(OH)D por encima de 30 ng/mL (75 nmol/L), no se han asociado con un mayor beneficio y se han identificado riesgos para algunos resultados en los niveles de 25(OH)D, por encima de 50 ng/mL (125nmol/L) (38). Adicionalmente, la Endocrine Society considera que una concentración por encima de 30 ng/mL es más apropiada para los pacientes con trastornos óseos, renales o digestivos (38). Igualmente, el Instituto de Medicina de Estados Unidos y la Endocrine Society concuerdan en que una concentración <10-12 ng/mL de 25(OH) D (25-30 nmol/L), refleja deficiencia severa de VD asociada con un riesgo de raquitismo, osteomalacia o dolor difuso.
Sobre esta base, un reciente estudio estimó la prevalencia de deficiencia de VD, utilizando datos normalizados de la concentración de 25(OH)D en suero, encontrando que la deficiencia de VD se extiende por toda Europa en tasas de prevalencia que cumplen con los criterios de una pandemia (39), la cual se entiende como, "una epidemia que ocurre en todo el mundo, o en un área muy amplia, que cruza fronteras internacionales y por lo general afecta a un gran número de personas" (40). Adicionalmente, una revisión reciente de la literatura, que incluye estudios de poblaciones en el mundo, (Europa, Oriente Medio, África, Asia, Oceanía, América del Norte y Sudamérica), evidencia que la deficiencia de VD tiene una alta prevalencia en el mundo entero, especialmente en el Medio Oriente y Asia (niveles de 25(OH) D inferiores a 25 nmol/L). En esta revisión, se toma como valor de referencia concentraciones séricas de 25(OH)D superiores a 20 ng/mL, como nivel de suficiencia de VD. Específicamente, la deficiencia de VD fue más común en los grupos de riesgo específicos, tales como, mujeres embarazadas y sus recién nacidos, siendo aún mayor en mujeres afro-americanas y sus neonatos. También se encontraron niveles bajos de VD en niños, en especial con obesidad. En los adultos se encontró una mayor prevalencia en personas mayores, especialmente en aquellas que viven en hogares para personas de edad avanzada. En inmigrantes no occidentales que emigran a los países en latitudes más altas con radiación UV-B limitada, se encontró un alto riesgo de deficiencia de VD. En los Estados Unidos se encontraron diferencias significativas entre grupos étnicos, blancos no hispanos e hispanos y afro-descendientes. Los factores de riesgo más relevantes para la deficiencia de VD, encontrados en esta revisión, incluyen la escasa exposición solar, pigmentación de la piel, el uso de protector solar, extensión de piel cubierta por la ropa y una dieta baja en pescado y productos lácteos (37).
Asimismo, una revisión sistemática publicada posteriormente sobre el estado de la vitamina D en la población, basada en la evaluación de la mediana o media de los valores de 25(OH)D, mostró un alto grado de variabilidad entre los estudios, los países y las regiones analizadas. En esta revisión no se encontraron diferencias significativas por edad o por sexo en los valores de 25(OH)D, pero sí se observaron diferencias por región, con los valores significativamente mayores en Norteamérica que en Europa o el Medio Oriente/región de África. En contraste con la revisión anteriormente mencionada, el presente estudio no encontró diferencias significativas en los valores de 25(OH)D para los niños/adolescentes, adultos y ancianos. Sin embargo, en los análisis estratificados por región geográfica, se observaron diferencias importantes relacionadas con la edad de niños/ adolescentes para la región de Asia/Pacífico, quienes tenían valores más bajos de 25(OH)D que los grupos de mayor edad. De igual forma, al analizar los datos por región, se encontró que las mujeres tienden a tener valores más bajos de 25(OH)D, especialmente en el Oriente Medio/ África y Asia/Pacífico. La media de los valores más altos de 25(OH)D se observaron en general en América del Norte, un hallazgo que podría ser explicado por la fortificación de rutina de varios alimentos (por ejemplo, leche, zumos de frutas y cereales) en los Estados Unidos. Esta revisión sistemática reafirma el hallazgo de valores significativamente más bajos de 25(OH) D, en adultos mayores institucionalizados comparados con los adultos mayores que viven en comunidad (41).
El patrón común de las diferentes revisiones sobre el estado de la VD poblacionalmente, es la alta heterogeneidad de los informes, lo cual dificulta su comparabilidad. Por lo tanto, se hace necesario continuar investigando sobre patrones internacionales que permitan establecer a nivel poblacional y dentro de los subgrupos poblacionales claves, la deficiencia de VD, con el fin de establecer políticas de salud pública pertinentes para fomentar un adecuado estado nutricional de vitamina D, prevenir los estados de deficiencia y controlar las consecuencias que tiene para la salud, un estado inadecuado de VD.
De la investigación a la práctica clínicaLa VD ha ganado mucha atención en la investigación y la práctica clínica como un posible factor preventivo para una amplia gama de enfermedades crónicas, como la diabetes mellitus tipo 2, algunos tipos de cáncer, cardiovasculares, autoinmunes, enfermedad pulmonar obstructiva crónica y la pre-eclampsia. La VD tiene efectos, bien conocidos, en el metabolismo del calcio y está tradicionalmente vinculada a la prevención del raquitismo en los niños. También está claro que la deficiencia de VD causa la pérdida ósea a través de hiperparatiroidismo secundario (42). En la última década, varios estudios observacionales han mostrado asociaciones entre 25(OH)D3, la principal forma circulante de VD y el riesgo de enfermedades crónicas (43). Esto ha conducido a un incremento notable no solo en la medición de 25(OH)D3 para determinar el estado de VD, sino también a la ingesta de suplementos de VD, frecuentemente con dosis diarias por encima de los valores de referencia y del límite superior tolerable (UL), a pesar de la evidencia de un efecto limitado (13, 44, 45) y los efectos perjudiciales para la salud que pueden tener cantidades que sobrepasen este límite de toxicidad. De acuerdo con las Dietary References Intakes (DRIs)(46), 4.000 UI es el nivel máximo de seguridad de ingesta diaria de vitamina D. Sin embargo, dosis de hasta 10.000 UI no han demostrado causar toxicidad en individuos sanos (47). Aunque la toxicidad por vitamina D es una situación muy extraña, el aumento en el uso de los suplementos puede conducir a un aumento de estos casos. Algunos estudios han demostrado causar toxicidad en los seres humanos con una ingesta diaria que osciló entre 40.000-100.000 UI equivalente a 1.000-2.500 microgramos (48, 49).
Con base en la evidencia publicada, se puede concluir que los suplementos de VD en combinación con el consumo de calcio, disminuyen la incidencia de fracturas en personas de edad avanzada (50). Sin embargo, parece no existir suficiente evidencia que apoye el uso de VD en la prevención de enfermedades crónicas, aunque haya una alta plausibilidad biológica (51). Un reciente meta-análisis de un consorcio de ocho estudios prospectivos de cohortes, conducidos en diferentes países europeos y Estados Unidos, evaluó la asociación pronóstica entre las concentraciones séricas de 25(OH)D con mortalidad por causa cardiovascular y por cáncer, con especial atención a diferencias de potencial entre los países, sexos, grupos de edad, y la estación en la cual se midió el estado de VD. El análisis concluyó que la suplementación con VD en un promedio de 4,4 años, logró una discreta disminución en la mortalidad por cualquier causa cardiovascular o por cáncer en individuos con antecedentes de cáncer, de 11,4% a 11% (RR 0,94 IC del 95%: 0,91 a 0,98). Estas asociaciones fueron consistentes a través de los países, sexos, grupos de edad, y las estaciones en las cuales se tomó la muestra de sangre, aunque los valores de corte para los cuartiles de 25(OH)D variaron entre los análisis. No obstante, estos resultados no se consideran lo suficientemente robustos como para recomendar la suplementación generalizada de VD (52).
El perfil metabólico de la vitamina D es una herramienta prometedora a usar en estudios de asociación entre los niveles de ésta y la aparición y desarrollo de diferentes enfermedades. Actualmente, diversas metodologías están disponibles para la cuantificación de vitamina D, siendo el RIA el procedimiento de preferencia por su fácil automatización y bajo costo. Sin embargo, esta técnica no es específica para distinguir los diferentes metabolitos, y no es flexible para cuantificarlos simultáneamente. Por el contrario, la LC-MS/MS permite la medición íntegra de diferentes biomarcadores de vitamina D, incluyendo la 25(OH) D2, 25(OH) D3, 1,25(OH)2 D2, y 1,25(OH)2 D3, con la limitante de ser una técnica especializada, compleja, y que requiere personal calificado para el manejo del equipo. Los metabolitos que ha sido posible diferenciar, gracias al uso de LC-MS/MS, se han convertido en un factor de diagnóstico importante para evaluar el estado poblacional de la VD . No obstante, existe una alta heterogeneidad entre los diferentes estudios publicados a causa de la no concordancia ocasionada, no solo por las técnicas usadas para la medición de vitamina D, sino también por los biomarcadores analizados. Por lo tanto, es necesario establecer la técnica de LC-MS/ MS como método universal y de preferencia de cuantificación de VD, con el fin de llegar a un consenso sobre los metabolitos de VD a usar, que representen mejor el estado nutricional de esta vitamina, y así, establecer asociaciones de la deficiencia de VD con la presencia de enfermedades y su impacto poblacional.
1. Plum LA, DeLuca HF. Vitamin D, disease and therapeutic opportunities. Nat Rev Drug Discov. 2010; 9(12):941-955. [ Links ]
2. Albahrani AA, Greaves RF. Fat-soluble vitamins: clinical indications and current challenges for chromatographic measurement. Clin Biochem Rev. 2016; 37(1):27-47. [ Links ]
3. Roth J, Bonner-Weir S, Norman AW, Orci L. Immunocytochemistry of vitamin D-dependent calcium binding protein in chick pancreas: exclusive localization. Endocrinology. 1982; 110(6):2216-2218. [ Links ]
4. Norman AW, Deluca HF. From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health. Am J Clin Nutr. 2008; 88(2):491S-499S. [ Links ]
5. Sullivan SS, Rosen CJ, Halteman WA, Chen TC, Holick MF. Adolescent girls in Maine are at risk for vitamin D insufficiency. J Am Diet Assoc. 2005; 105(6):971-974. [ Links ]
6. Rathish N, Arun M. Vitamin D: the "sunshine" vitamin. J Pharmacol Pharmacother. 2012; 3(2):118-126. [ Links ]
7. McGreevy C, Williams D. New insights about vitamin D and cardiovascular disease: a narrative review. Ann Intern Med. 2011; 155(12):820-826. [ Links ]
8. Fleischer AB Jr, Fleischer SE. Solar radiation and the incidence and mortality of leading invasive cancers in the United States. Dermatoendocrinol. 2016; 8(1):e1162366. [ Links ]
9. Solidoro P, Bellocchia M, Facchini F. The immunobiological and clinical role of vitamin D in obstructive lung diseases. Minerva Med. 2016; 107(3 Suppl 1):12-19. [ Links ]
10. Mithal A, Wahl DA, Bonjour JP, Burckhardt P, Dawson Hughes B, Eisman JA, et al. IOF Committee of Scientific Advisors (CSA) Nutrition Working Group. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int. 2009; 20(11):1807-1820. [ Links ]
11. Ardawi MS, Sibiany AM, Bakhsh TM, Qari MH, Maimani AA. High prevalence of vitamin D deficiency among healthy Saudi Arabian men: relationship to bone mineral density, parathyroid hormone, bone turnover markers, and lifestyle factors. Osteoporos Int. 2012; 23(2):675-686. [ Links ]
12. Black LJ, Anderson D, Clarke MW, Ponsonby AL, Lucas RM. Analytical bias in the measurement of serum 25-hydroxyvitamin D concentrations impairs assessment of vitamin D status in clinical and research settings. PLoS One. 2015; 10(8):e0135478. [ Links ]
13. Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab. 2011; 96(1):53-58. [ Links ]
14. Amiot-Carlin MJ. Digestion and absorption of lipophilic food micronutrients. In: McClements DJ, Decker EA, editors. Designing functional foods: measuring and controlling food structure breakdown and nutrient absorption. Boca Raton, FL, USA: CRC Press; 2009. [ Links ]
15. Mostafa WZ, Hegazy RA. Vitamin D and the skin: focus on a complex relationship: a review. J Adv Res. 2015; 6(6):793-804. [ Links ]
16. Schuster I. Cytochromes P450 are essential players in the vitamin D signaling system. Biochim Biophys Acta. 2010; 1814(1):186-199. [ Links ]
17. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014; 21(3):319-329. [ Links ]
18. White JH. Regulation of intracrine production of 1,25-dihydroxyvitamin D and its role in innate immune defense against infection. Arch Biochem Biophys. 2012; 523(1):58-63. [ Links ]
19. Cândido FG, Bressan J. Vitamin D: link between osteoporosis, obesity, and diabetes? Int J Mol Sci. 2014; 15(4):6569-6591. [ Links ]
20. Panda DK, Miao D, Bolivar I, Li J, Huo R, Hendy GN, et al. Inactivation of the 25-hydroxyvitamin D 1alphahydroxylase and vitamin D receptor demonstrates independent and interdependent effects of calcium and vitamin D on skeletal and mineral homeostasis. J Biol Chem. 2004; 279(16):16754-16766. [ Links ]
21. Seamans KM, Cashman KD. Existing and potentially novel functional markers of vitamin D status: a systematic review. Am J Clin Nutr. 2009; 89(6):1997S-2008S. [ Links ]
22. Wolpowitz D, Gilchrest BA. The vitamin D questions: how much do you need and how should you get it? J Am Acad Dermatol. 2006; 54(2):301-317. [ Links ]
23. van Driel M, van Leeuwen JP. Vitamin D endocrine system and osteoblasts. Bonekey Rep. 2014; 3:493. [ Links ]
24. Bosworth CR, Levin G, Robinson-Cohen C, Hoofnagle AN, Ruzinski J, Young B, et al. The serum 24,25-dihydroxyvitamin D concentration, a marker of vitamin D catabolism, is reduced in chronic kidney disease. Kidney Int. 2012; 82(6):693-700. [ Links ]
25. Holick MF. Vitamin D status: measurement, interpretation, and clinical application. Ann Epidemiol. 2009; 19(2):73-78. [ Links ]
26. Wacker M, Holick MF. Vitamin D - effects on skeletal and extraskeletal health and the need for supplementation. Nutrients. 2013; 5(1):111-148. [ Links ]
27. Zerwekh JE. Blood biomarkers of vitamin D status. Am J Clin Nutr. 2008; 87(4):1087S-1091S. [ Links ]
28. Hollis BW. The determination of circulating 25-hydroxyvitamin D: no easy task. J Clin Endocrinol Metab. 2004; 89(7):3149-3151. [ Links ]
29. Guo T, Taylor RL, Singh RJ, Soldin SJ. Simultaneous determination of 12 steroids by isotope dilution liquid chromatography-photospray ionization tandem mass spectrometry. Clin Chim Acta. 2006; 372(1-2):76-82. [ Links ]
30. Wallace AM, Gibson S, de la Hunty A, Lamberg-Allardt C, Ashwell M. Measurement of 25-hydroxyvitamin D in the clinical laboratory: current procedures, performance characteristics and limitations. Steroids. 2010 Jul; 75(7):477-488. [ Links ]
31. de la Hunty A, Wallace AM, Gibson S, Viljakainen H, Lamberg-Allardt C, Ashwell M. UK Food standards agency workshop consensus report: the choice of method for measuring 25-hydroxyvitamin D to estimate vitamin D status for the UK national diet and nutrition survey. Br J Nutr. 2010; 104(4):612619. [ Links ]
32. Carter GD, Jones JC. Use of a common standard improves the performance of liquid chromatographytandem mass spectrometry methods for serum 25-hydroxyvitamin-D. Anal Clin Biochem. 2009; 46(Pt 1):79-81. [ Links ]
33. Aronov PA, Hall LM, Dettmer K, Stephensen CB, Hammock BD. Metabolic profiling of major vitamin D metabolites using Diels-Alder derivatization and ultra-performance liquid chromatography-tandem mass spectrometry. Anal Bioanal Chem. 2008; 391(5):1917-1930. [ Links ]
34. Ding S, Schoenmakers I, Jones K, Koulman A, Prentice A, Volmer DA. Quantitative determination of vitamin D metabolites in plasma using UHPLC-MS/MS. Anal Bioanal Chem. 2010; 398(2):779-789. [ Links ]
35. Fang H, Yu S, Cheng Q, Cheng X, Han J, Qin X, et al. Determination of 1,25-dihydroxyvitamin D2 and 1,25-dihydroxyvitamin D3in human serum using liquidchromatography with tandem mass spectrometry. J Chromatogr B AnalytTechnol Biomed Life Sci. 2016; 1027:19-26. [ Links ]
36. Wang Z, Senn T, Kalhorn T, Zheng XE, Zheng S, Davis CL, et al. Simultaneous measurement of plasma vitamin D3 metabolites including 4B,25-dihydroxyvitamin D(3) using liquid chromatographytandem mass spectrometry. Anal Biochem. 2011; 418(1):126-133. [ Links ]
37. van Schoor NM, Lips P. Worldwide vitamin D status. Best Pract Res Clin Endocrinol Metab. 2011; 25(4):671-680 [ Links ]
38. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Endocrine, evaluation, treatment, and prevention of vitamin D deficiency: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96(7):1911-1930. [ Links ]
39. Cashman KD, Dowling KG, Skrabáková Z, Gonzalez-Gross M, Valtueña J, De Henauw S, et al. Vitamin D deficiency in Europe: pandemic? Am J Clin Nutr. 2016 Apr; 103(4):1033-1044. [ Links ]
40. Last J. A dictionary of epidemiology. 4th ed. Oxford (United Kingdom): Oxford University Press; 2001. [ Links ]
41. Hilger J, Friedel A, Herr R, Rausch T, Roos F, Wahl DA, et al. A systematic review of vitamin D status in populations worldwide. Br J Nutr. 2014; 14; 111(1):23-45. [ Links ]
42. Bouillon R, Van Schoor NM, Gielen E, Boonen S, Mathieu C, Vanderschueren D, et al. Optimal vitamin D status: a critical analysis on the basis of evidence-based medicine. J Clin Endocrinol Metab. 2013; 98(8):E1283-1304. [ Links ]
43. Theodoratou E, Tzoulaki I, Zgaga L, Ioannidis JPA. Vitamin D and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomised trials. BMJ. ross 2014; 348:g2035. [ Links ]
44. Lamberg-Allardt C, Brustad M, Meyer HE, Steingrimsdottir L. Vitamin D - a systematic literature review for the 5th edition of the Nordic Nutrition Recommendations. Food Nutr Res. 2013; 57:22671. [ Links ]
45. Health Council of the Netherlands. Evaluation of dietary reference values for vitamin D. 46 The Hague: Health Council of the Netherlands, 2012; publication no. 2012/15E. [ Links ]
46. Murphy SP, Poos MI. Dietary reference intakes: summary of applications in dietary assessment. Public Health Nutr. 2002; 6A:843-849. [ Links ]
47. Hathcock JN, Shao A, Vieth R, Heaney R. Risk assessment for vitamin D. Am J Clin Nutr. 2007; 85(1):6-18. [ Links ]
48. Kaptein S, Risselada AJ, Boerma EC, Egbers PH, Nieboer P. Life-threatening complications of vitamin D intoxication due to over-the-counter supplements. Clin Toxicol (Phila). 2010; 48(5):460-462. [ Links ]
49. Lowe H, Cusano NE, Binkley N, Blaner WS, Bilezikian JP. Vitamin D toxicity due to a commonly available "over the counter" remedy from the Dominican Republic. J Clin Endocrinol Metab. 2011; 96(2):291-295. [ Links ]
50. The DIPART (Vitamin D Individual Patient Analysis of Randomized Trials) Group. Patient level pooled analysis of 68500 patients from seven major vitamin D fracture trials in US and Europe. BMJ. 2010; 340:b5463. [ Links ]
51. Autier P, Boniol M, Pizot C, Mullie P. Vitamin D status and ill health: a systematic review. Lancet Diabetes Endocrinol. 2014; 2(1):76-89. [ Links ]
52. Schottker B, Jorde R, Peasey A, Thorand B, Jansen EH, Groot L, et al. Vitamin D and mortality: metaanalysis of individual participant data from a large consortium of cohort studies from Europe and the United States. BMJ. 2014; 348:g3656. [ Links ]
Como citar este artículo: Serrano N, Guío E, González A, Plata L, Quintero DC, Becerra S. Cuantificación de vitamina D: de la investigación a la práctica clínica. Revista Biosalud 2017; 16 (1): 67-79 DOI: 10.17151/biosa.2017.16.1.8














