INTRODUCCIÓN
Las hormonas sexuales (testosterona y estradiol), en especial este último, desempeñan un papel importante en la fisiología normal y patológica del organismo humano. Hay abundante evidencia que muestra que el impacto de los estrógenos va más allá de las gónadas y se extiende a la fisiología del sistema cardiovascular, esquelético, óseo, nervioso, presión sanguínea, sistema inmune y metabolismo de los lípidos, entre otros 1-4. Es reconocido que existen diferencias de sexo en el efecto de las hormonas esteroides sobre estos y otros sistemas y que estas diferencias se manifiestan desde edades muy tempranas y se mantienen a lo largo de la vida de hombres y mujeres 1. El estradiol, el principal estrógeno, es tal vez la más potente y simple molécula en los humanos; se le ha demostrado un sinnúmero de acciones sobre casi todos los órganos y sistemas del cuerpo a través de muchas vías. Entre otras, se ha referenciado que el estradiol tiene efecto cardioprotector no solo por su acción en el metabolismo de los lípidos 5-7, sino también por su modulación sobre el endotelio 8,9. También se ha relacionado con sistemas que regulan la presión sanguínea 10,11. En las mujeres el efecto cardioprotector de los estrógenos y la modulación sobre la presión sanguínea, se pierde cuando se llega a la menopausia 12, donde los niveles de estradiol son muy bajos.
Los estrógenos ejercen su acción a través de dos tipos de receptores: receptores de estrógenos alfa (ESR1) y receptores de estrógenos beta (ESR2) 4,9,13, los cuales son traslocados al núcleo y regulan la expresión de genes blanco a través de diversos mecanismos, llamados mecanismos genómicos, que son lentos; pero los estrógenos también pueden actuar más rápido a través de mecanismos no genómicos que involucran vías de señalización celular 14,15. Ambos tipos de receptores tienen isoformas o polimorfismos que exhiben diferentes modelos de expresión y función en los tejidos 5. El gen receptor de estrógenos ESR1 está constituido por 140 kb de ADN, distribuidos en ocho exones que codifican para una proteína ácida de 595 aminoácidos de un peso molecular aproximado de 66 KDa 16. Varios polimorfismos de nucleótido único (SPN) han sido identificados en el ESR1, aunque el mejor caracterizado es el polimorfismo XbaI, el cual es identificado por la enzima de restricción XbaI. Este está localizado en el primer intrón del gen ESR1; el sitio de restricción involucra una transición de una A por una G en la posición 351 17,18.
Varios estudios han demostrado que la variación genética de los receptores de estrógenos está asociada con las enfermedades cardiovasculares en ambos sexos 3,8,9. Estos receptores de estrógenos pueden modular el riesgo cardiovascular indirectamente a través de las alteraciones del metabolismo de los lípidos y la glucosa 19-21, o directamente a través de sus efectos sobre el endotelio 8,11.
Siendo que los estrógenos ejercen acciones sobre el sistema cardiovascular, se hace necesario identificar en niños y adolescentes, como estrategia de prevención, las relaciones de los niveles de esta hormona con factores como lípidos plasmáticos y presión sanguínea que predisponen al desarrollo de la enfermedad cardiovascular 22,23. La identificación de factores de riesgo cardiovascular en edades tempranas puede ayudar a prevenir el desarrollo de estas enfermedades en la edad adulta.
El objetivo de este estudio fue analizar en niños, niñas y adolescentes de diferentes grupos de edad, la posible relación entre los niveles plasmáticos de estradiol, la presión sanguínea, los lípidos y el polimorfismo del ESR1.
MATERIALES Y MÉTODOS
Tipo de estudio
Estudio descriptivo de corte transversal, con una muestra representativa de la población escolarizada del departamento del Quindío (escolares de 8-18 años). La selección se estableció por conglomerados de colegios públicos, mediante un muestreo aleatorio simple.
Se excluyeron del estudio los escolares que en el momento de la toma de muestra presentaron endocrinopatías o enfermedades crónicas o agudas. El consentimiento informado fue firmado por los padres o adultos responsables de los escolares. La investigación fue aprobada por el Comité de Bioética de la Universidad del Quindío.
Determinaciones bioquímicas
Las muestras de sangre se tomaron por venopunción en un tubo sin anticoagulante para la obtención del suero y un tubo con EDTA para la extracción del ADN. Los niveles de estradiol en suero se midieron con el kit Estradiol (E2) Enzyme Immunoassay Test (BioCheck). Brevemente, el ensayo se realizó en placa de 96 pozos, se adicionaron 100 µl del reactivo conjugado de estradiol-HPR en cada pozo, luego se adicionaron 50 µl de antiestradiol (E2), se mezcló durante 30 segundos y se incubó a temperatura ambiente durante 90 minutos. Después se lavó cinco veces con agua destilada y se adicionaron 100 µl del reactivo
TMB, luego se incubó a temperatura ambiente durante 20 minutos; la reacción fue detenida adicionando 100 µl de solución Stop, para leer a 450 nm. El perfil lipídico se cuantificó por métodos enzimáticos colorimétricos estándar de la línea Sera-Pak® Plus (Bayer S.A.), siguiendo el protocolo propuesto por el fabricante.
Polimorfismo XbaI del receptor de estrógenos
La extracción del ADN se realizó utilizando el kit Wizard Genomic DNA Purification. Siguiendo las indicaciones del fabricante. El polimorfismo XbaI del gen receptor de estrógenos ESR-1 fue amplificado por PCR durante 35 ciclos; utilizando las siguientes condiciones: desnaturalización a 94°C por 30 segundos, el alineamiento a 61°C por 40 segundos y la extensión a 37°C por 90 segundos (24); usando las siguientes secuencias de Primers: Forward 5´CTCTACATGTTCCTAAAGAGG3´ y Reward 5´CGATTATCTGAATTTGGCCTGG3´. La visualización del producto de PCR se realizó en un gel de agarosa al 2%, esperando como resultado una banda de 596 pb.
Luego, este producto de PCR fue digerido con la enzima de restricción XbaI. Se tomaron 5 µl del producto amplificado, se le añadieron 2 µl de buffer y 0,5 µl de la enzima de restricción XbaI; las muestras fueron incubadas a 37°C durante 40 minutos. Los resultados de la digestión fueron visualizados en geles de agarosa al 2%. La presencia de dos bandas con tamaños moleculares de 226 pb y 370 pb indicaba un homocigoto para el genotipo AA; la presencia de tres bandas de 226 pb, 370 pb y 596 pb indicaba un individuo heterocigoto con un genotipo AG y la presencia de una sola banda de 596 pb indicaba un individuo homocigoto para el alelo normal con un genotipo GG (24).
Análisis estadístico
El análisis estadístico se realizó utilizando SPSS v.18.0. Se determinó la normalidad de las variables cuantitativas mediante la prueba de Kolmogorov-Smirnov. Para las frecuencias genotípicas del polimorfismo se realizó una prueba de Chi cuadrado. Se relacionaron las diferentes variables clínicas (perfil lipídico, presión arterial, índice de masa corporal) con los niveles de estradiol en suero y el polimorfismo XbaI del gen ESR-1 así como el polimorfismo XbaI con las concentraciones de estradiol usando la prueba de Kruskal-Wallis y correlación de Pearson, y para las variables con distribución normal se aplicó un modelo lineal general. Se asume como valor estadísticamente significativo cuando el valor p < 0,05.
RESULTADOS
Características generales de la población
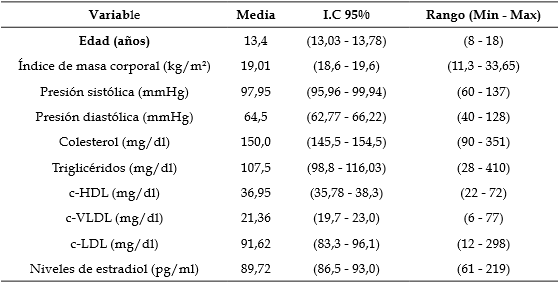
La muestra poblacional total estudiada fue de 213 escolares, de los cuales 89 eran niños (41,8%) y 124 niñas (58,2%). En la Tabla 1 se describen las variables generales de estudio en la población, evidenciando una edad promedio de 13 años, el índice de masa corporal dentro de los rangos normales para la edad, al igual que la presión arterial. En cuanto al perfil lipídico, el colesterol total, triglicéridos, VLDL y LDL, fueron normales según los valores de referencia internacional 25, pero los valores del HDL fueron bajos.
Niveles de estradiol y variables bioquímicas, fisiológicas y antropométricas
Se encontraron diferencias significativas entre las concentraciones de estradiol en suero con respecto al género (p = 0,00), observándose concentraciones más altas de estradiol en las niñas (91,86 pg/ml) que en los niños (78,39 pg/ml).
Por otro lado, se encontró que las concentraciones de estradiol aumentan con la edad de los niños y adolescentes (p = 0,0001), esta diferencia es más notable entre el grupo de niños menores de 10 años y los otros dos grupos (Figura 1).
Con respecto a las concentraciones de estradiol en suero y los componentes del perfil lipídico, se observó una relación inversamente proporcional y estadísticamente significativa entre estradiol, triglicéridos y el c-VLDL (Tabla 2). Sin embargo, los niveles de estradiol en suero solo explican el 5% de la variabilidad de los niveles de los triglicéridos y el c-VLDL.
Tabla 2 Relación entre las concentraciones de estradiol con el perfil lipídico y la presión arterial
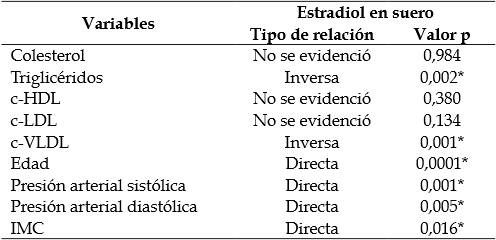
* Relación estadísticamente significativa entre las variables, con p-valor <0,05.
Por otro lado, los resultados muestran una relación directamente proporcional y estadísticamente significativa entre concentración de estradiol y la presión arterial sistólica y diastólica (p = 0,001 y p = 0,005, respectivamente); la variación en la presión arterial sistólica fue explicada solo en un 10% por la variable predictora (niveles de estradiol).
Finalmente, la relación de los niveles de estradiol con el IMC es estadísticamente significativa (p = 0,016), siendo esta relación directamente proporcional.
Polimorfismo XbaI del receptor ESR1
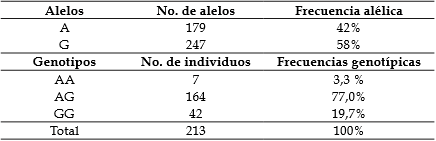
La Tabla 3 describe la frecuencia de cada genotipo y alelo en la población. Los datos muestran que la población no está en equilibrio Hardy-Weinberg para el polimorfismo XbaI del gen del ESR1, (X² = 83,83); valor que no se encuentra dentro del rango de aceptación.
Niveles de estradiol y polimorfismo XbaI
Los resultados muestran que no hay relación entre niveles de estradiol y polimorfismo XbaI (p = 0,97); sin embargo, los niveles más altos de estradiol se presentaron en individuos portadores del genotipo GG (Tabla 4).
Polimorfismo XbaI y perfil lipídico
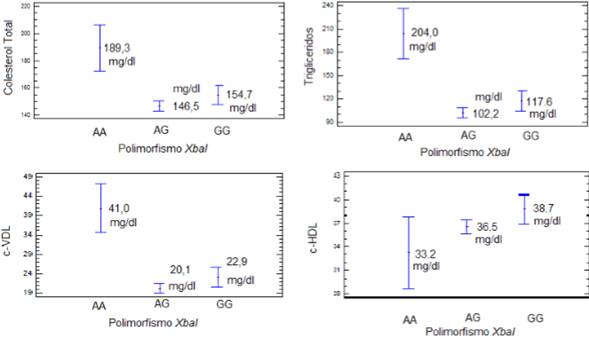
La Figura 2 muestra la relación entre los genotipos del polimorfismo XbaI del receptor ESR1 y los parámetros del perfil lipídico. Se encontraron diferencias significativas en los niveles de triglicéridos y c-VLDL con respecto a los genotipos del polimorfismo (p = 0,016 y p = 0,015, respectivamente); los individuos con genotipo AA presentaron los valores más altos de los dos tipos de lípidos. El análisis, usando un modelo lineal generalizado para relacionar el polimorfismo XbaI del receptor ESR1 con cada uno de los componentes del perfil lipídico, mostró que el polimorfismo XbaI no afecta los niveles de c-LDL. Sin embargo, las variables como colesterol total, triglicéridos, c-HDL y c-VLDL fueron influenciadas por el polimorfismo del gen receptor de estrógenos.
DISCUSIÓN
En este trabajo se investigaron los niveles de estradiol y su relación con el género, la edad, la presión arterial, los lípidos plasmáticos y el polimorfismo XbaI del gen del receptor ESR1 de estrógenos.
El presente trabajo evidenció diferencias en la concentración de estradiol por género, de manera que las niñas tenían mayores niveles de la hormona que los niños; hay evidencia de que los niveles de estradiol son muy bajos antes del inicio de la pubertad tanto en niños como en niñas, pero aún en esta etapa los nivel de esta hormona son más altos en las niñas que en los niños; en la pubertad estas diferencias se acrecientan entre ambos sexos 26-30 y permanecen hasta que la mujer alcanza la menopausia, donde los niveles de estrógenos disminuyen significativamente 31 hasta ser similares a los de los hombres.
De igual forma, en este trabajo se evidenciaron diferencias en la concentración del estradiol con la edad, aumentando significativamente a medida que aumentaba la edad de los grupos, pero siendo menor la diferencia entre los grupos de 11-14 y 15-18 años, edad en la que se ha alcanzado y pasado la pubertad 28,32. Estos datos también confirman resultados previos que describen un aumento de estradiol con la edad hasta alcanzar sus niveles de adulto en la preadolescencia y adolescencia 26, para volver a cambiar en la mujer en la menopausia 29,31, donde los niveles de estradiol disminuyen hasta alcanzar valores muy similares a los niveles en hombres 31. Se conoce que los estrógenos a través de sus receptores ejercen efectos importantes en los órganos reproductivos y en otros órganos y sistemas en hombres y mujeres 1; los niveles de estrógenos en sangre son responsables de la mayoría de las diferencias de género, especialmente en embriogénesis 33, pubertad y adolescencia 28, de allí que lo niveles plasmáticos de estrógenos estén relacionados con el ciclo vital de humanos y mamíferos 26,27,29.
Esta investigación también encontró una relación directa entre niveles de estrógenos y presión arterial sistólica y diastólica. En un trabajo anterior Landázuri et al. 34 habían descrito un aumento de la presión sistólica y diastólica con la edad en niños, niñas y adolescentes de los mismos rangos de edad, que los del presente estudio; sin embargo, en ese trabajo no se midieron los estrógenos, pero podría asumirse que si los estrógenos aumentan con la edad (presente trabajo) y la presión aumenta con la edad 34, exista una relación directa entre estrógenos, edad y presión. Así se conoce que hombres y mujeres comienzan la pubertad entre 9 y 12 años 32,35 y que este periodo está acompañado por un incremento en las hormonas sexuales, testosterona en hombres y estradiol en mujeres 32, estas hormonas influyen sobre diversos sistemas que regulan presión arterial como el sistema renina angiotensina aldosterona 23,36, y la osmolaridad, entre otros 37; además los estrógenos ejercen efectos directos sobre las células vasculares del músculo liso, también inhiben la proliferación celular e inducen la vasodilatación mediante la regulación de la permeabilidad iónica de la membrana y la modulación de factores de relajación derivados del endotelio 10,11. Se han identificado receptores de estrógenos funcionales en células de músculo liso vascular y también se han demostrado sitios específicos de unión de estrógenos en el endotelio 5; por tal motivo, no es sorprendente que en este trabajo se encontrara una relación directa entre estrógenos y presión arterial sistólica y diastólica.
Este trabajo también muestra una relación de los niveles de estrógenos con los triglicéridos y las VLDL, una lipoproteína rica en triglicéridos. Aquí, se observó que los individuos con concentraciones altas de estradiol mostraban concentraciones bajas de triglicéridos y c-VLDL. Evidencia científica muestra que los estrógenos tienen una amplia variedad de efectos sobre el perfil de lípidos en hombres y mujeres 19,21, y se describen cambios significativos en los niveles de lípidos en suero y de lipoproteínas durante la pubertad 38-41.
Al respecto de niveles de estradiol y lípidos en edultos, Brynhildsen y Hammar 19 demostraron que en mujeres que tomaban una combinación de estradiol/noretisterona, después de 24 semanas, el CT, la lipoproteína a, Lp(a) y c-VLDL disminuyeron significativamente, más que en las que tomaban placebo. Similar a lo encontrado en el presente estudio, excepto por la Lp(a) que no fue medida. Por otro lado, se conoce que un papel importante de los estrógenos, tanto endógenos como exógenos es elevar las concentraciones de c-HDL y disminuir las concentraciones de c-LDL 42,43, a través de un mecanismo que aumenta, por un lado, la captación de LDL 43 y por otro lado el ARN mensajero de los receptores de c-LDL 42-44, aunque en el presente trabajo no se evidenció efecto sobre c-HDL y c-LDL. Sin embargo, es de anotar que los estudios anteriormente descritos se han hecho sobre población adulta con enfermedad o cambios hormonales y que la relación entre hormonas esteroides y el metabolismo lipídico en niños y adolescentes puede ser diferente, como lo demostró un estudio reciente 45 en el que se encontró que el número y tamaño de las lipoproteínas están más fuertemente relacionados con la estructura y la función vascular que los lípidos tradicionales en adolescentes que en adultos, y su medición puede ser mejor predictor de riesgo cardiovascular en adolescentes que en adultos.
Por otro lado, en este trabajo también se evaluó el efecto del polimorfismo del receptor de estrógenos sobre los lípidos plasmáticos, pues hay controversia sobre esta influencia; así, varios estudios han mostrado una relación entre los polimorfismos XbaI y PvuII y los lípidos plasmáticos, y otros no 5,17,46,47. En el presente estudio se encontró relación entre el polimorfismo y los triglicéridos y el c-VLDL. Al respecto, la evidencia muestra que el efecto de las mutaciones en los receptores depende de los grupos étnicos, la edad y el género. En un estudio multiétnico/multirracial de mujeres caucásicas de edad media en Estados Unidos, no se encontró asociación entre ESR1 y niveles de lípidos 48. Mientras en un estudio con mujeres chinas se encontró asociación entre los polimorfismos XbaI y PvuII con CT y c-LDL 49. Aunque el presente estudio no mostró una relación entre los niveles de estradiol y el polimorfismo, similar a lo reportado en otros estudios de poblaciones brasileras 50 y chinas 51, sí se evidenció una relación inversa entre los niveles de estradiol, los triglicéridos y c-VLDL, y de estos dos últimos con el polimorfismo del receptor. Si bien es posible que las mutaciones en el receptor no modifiquen los niveles de estrógenos, pues estos dependen de su síntesis y metabolismo, sí es posible que el polimorfismo del receptor modifique los niveles de lípidos a través de mecanismos en las vías de señalización, que modifican la transcripción de enzimas y proteínas que median el metabolismo de las lipoproteínas 38,44.
Este estudio presenta varias limitaciones, una de ellas es que no tuvo en cuenta las variaciones de estradiol con el ciclo hormonal en las niñas, principalmente en aquellas de los dos últimos grupos (10-14 y 15-18 años). Otra limitación es la conocida influencia sobre los niveles endógenos de hormonas sexuales que tienen factores exógenos como pubertad precoz, o disruptores endocrinos presentes en la dieta diaria 32, que tampoco fueron considerados en este trabajo.
En conclusión, este trabajo evidencia la relación entre niveles de estrógenos, edad, presión sanguínea y lípidos plasmáticos, de igual forma demuestra una relación entre el polimorfismo XbaI del ESR1 y los niveles de lípidos. Aunque se requieren más estudios para evidenciar los mecanismos que expliquen estas relaciones.