INTRODUCCIÓN
Las enfermedades neurodegenerativas y las demencias constituyen un problema en el ámbito de la salud pública mundial, siendo un grupo de enfermedades con una alta prevalencia, pues se estima que alrededor de 46 millones de personas viven globalmente con algún tipo de estos trastornos. Las enfermedades neurodegenerativas se caracterizan por un deterioro progresivo y a menudo irreversible de las células del sistema nervioso central, dicho progresión termina en la generación de algún tipo de demencia, donde esta última se identifica esencialmente por un deterioro cognitivo que afecta diversos dominios como la memoria, la función ejecutiva, las habilidades interpersonales, entre otros, que en conjunto limitan el desempeño de las actividades cotidianas de los sujetos afectados 1,2.
Con presentaciones clínicas dispares entre los tipos de enfermedades, pero en ocasiones superpuestas, los trastornos neurodegenerativos y las demencias pueden ser difíciles de diagnosticar correctamente. Sin embargo, los mecanismos de daño que conducen al desarrollo de demencia poseen un patrón de lesión funcional, anatómica y temporal diferencial para cada tipo 2,3. En vista de explotar estos perfiles discriminatorios, las técnicas de neuroimagen plantean un buen potencial de apoyo con el diagnóstico clínico y la monitorización de la progresión de la enfermedad, haciendo una transición del rol tradicional de apoyo orientado a descartar causas tratables, hacia el de aproximación diagnóstica contribuyendo en la diferenciación entre distintos tipos de afecciones neurodegenerativas, como por ejemplo, la enfermedad de Alzheimer (EA), la demencia frontotemporal (DFT) y el deterioro cognitivo leve (DCL).
La EA es un trastorno cerebral neurodegenerativo progresivo que causa una alteración significativa de la estructura y la función del cerebro normal. Representa el tipo de demencia más común en los adultos mayores y cursa con una alteración grave en la memoria y en la funcionalidad de la persona. Desde el punto de vista neuropatológico se caracteriza por una pérdida progresiva de neuronas corticales, especialmente células piramidales, las cuales median funciones cognitivas superiores 2,4. Entre las principales manifestaciones de la EA se encuentra un decremento en las funciones cognitivas, como la toma de decisiones, la ejecución de actividades cotidianas y posibles cambios en el comportamiento de los sujetos. Aunque el síntoma predominante de la EA en el 95% de los casos es el trastorno de memoria 5,6.
Respecto al diagnóstico de la EA, prima el acercamiento clínico basado en criterios establecidos por consorcios de especialistas y expertos en áreas de neurociencias, epidemiología, biología, entre otros, como el Diagnostic and Statistical Manual of Mental Disorders (DSM-IV), o los descritos en el National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer’s Disease and Related Disorders Association (NINCD-SADRDA), que hacen hincapié en la evaluación de las funciones cognitivas de los pacientes. Debido a que biomarcadores provenientes de imagenología aún no son aceptados en el arsenal clínico, el examen patológico directo del tejido cerebral derivado de la biopsia o la autopsia es el estándar o patrón de referencia, siendo hasta el momento el único método definitivo para establecer un diagnóstico de EA 1,7.
Por otro lado, se encuentra el DCL, una condición patológica asociada al envejecimiento, marcada por una disminución mantenida de las funciones cognitivas, la cual no es lo suficientemente severa como para ser considerada una demencia. Aun así, el DCL se suele definir como la etapa de pre-demencia asintomática, que se caracteriza por un deterioro objetivo en la cognición, que no tiene la gravedad suficiente para limitar a las personas en el desarrollo de sus actividades cotidianas 4,8. El origen en el decremento de las funciones intelectuales se describe como multifactorial, y se menciona que su progreso marca la diferencia entre el envejecimiento normal y la aparición de la demencia. Al igual que en la EA, los criterios empleados para detectar la presencia de esta enfermedad (usualmente los establecidos por Petersen et al.) son de índole semicuantitativa, puesto que se basan en la evaluación de deterioro cognitivo en pruebas neuropsicológicas, pero también en la observación de autonomía en las funciones de la vida diaria y en las habilidades sociales 8.
La DFT engloba un conjunto de enfermedades que afecta las regiones frontales y temporales del cerebro. Estas regiones están involucradas, entre otras funciones, en regular nuestra conducta (región frontal) y nuestras capacidades lingüísticas (región temporal). El daño puede conducir a habilidades intelectuales reducidas y cambios en la personalidad, la emoción y el comportamiento 9,10. Los síntomas de la DFT dependen de qué áreas específicas del cerebro son dañadas. Cuando los lóbulos frontales se ven afectados en primera instancia, los principales cambios se dan en la personalidad y el comportamiento, y da lugar a un subtipo de la DFT, llamada de variante comportamental. En cambios, cuando los lóbulos temporales se ven afectados primero, hay una pérdida de habilidades lingüísticas, derivándose dos subtipos de DFT donde el lenguaje se ve afectado estas son, la afasia primaria progresiva y la demencia semántica 9,11,12. Así como en la EA, el abordaje para el diagnóstico de la DFT se da a nivel clínico, tomando a consideración principalmente los criterios dados por el Frontotemporal Dementia Criteria Consortium (FTDC).
Los avances científicos asociados al desarrollo de biomarcadores en las neuroimágenes plantean la posibilidad de caracterizar los diferentes fenotipos de los trastornos neurodegenerativos. Esto mediante la búsqueda de patrones diferenciadores en aspectos estructurales y funcionales, que apoyen y mejoren la precisión del proceso diagnóstico. Una de las modalidades más ampliamente aceptadas tanto en investigación como en rutina clínica es la resonancia magnética estructural (RMs), y en las últimas dos décadas la tomografía por emisión de positrones (PET por sus siglas en inglés), y la resonancia magnética de difusión (dMRI) han tomado fuerza en este campo.
La adquisición de imágenes por RM es una técnica no invasiva que permite obtener información sobre la estructura de la región anatómica bajo estudio sin el uso de radiación ionizante. Esta se basa esencialmente en el aprovechamiento del fenómeno físico de la resonancia magnética, ejercido sobre los protones que se encuentran en el agua de los tejidos. Se utilizan imanes capaces de producir un fuerte campo magnético que obliga a los protones a alinearse con este, posteriormente se envían pulsos de radiofrecuencia que lleva a los portones a desalinearse del campo magnético y se libera cierta energía, los sensores del resonador captan dicha energía, los datos son procesados y se reconstruyen cortes de la región estudiada en los tres planos anatómicos usuales: sagital, coronal y transversal 5,13.
La RM suele emplearse para la obtención tanto de imágenes estructurales como funcionales, las imágenes funcionales de RM pueden considerarse como aquellas que proveen información fisiológica dinámica, mientras que las imágenes estructurales de RM (que se tratarán en la presente revisión) proporcionan información anatómica estática, permitiendo observar posibles alteraciones en los tejidos (ver figura 1) 13,14.
PET es una técnica de imagenología asociada a la medicina nuclear. Esta proporciona información acerca de la actividad fisiológica del organismo in-vivo a través del uso de un marcador radioactivo también llamado radioligando, el cual puede ser administrado por vía intravenosa, oral o respiratoria. Este radioligando se distribuye en las células de los órganos o tejidos diana de interés, presentando mayor acumulación en áreas con niveles altos de actividad bioquímica, y, por ende, la retención del ligando se ve influenciada por la tasa metabólica celular 15,16.
La técnica se basa en la detección de la radioactividad de los trazadores, debido a una aniquilación entre un positrón emitido por el elemento en cuestión y un electrón del organismo, dicha colisión produce energía en forma de fotones gamma. Los tomógrafos son capaces de detectarlos y a partir de estos construir la imagen. En un estudio PET, las regiones de mayor actividad metabólica aparecen en la imagen como puntos o zonas brillantes, puesto que tienen mayor afinidad por el radioligando (ver figura 1). PET permite análisis cuantitativos útiles para el monitoreo de los cambios relativos a lo largo del tiempo, a medida que evoluciona un proceso de enfermedad, o en respuesta a un estímulo específico, por ello es ampliamente usada en áreas como la neurología, en oncología y, en menor medida, en cardiología y otras especialidades 4,15,17.
Las imágenes de resonancia de difusión (dMRI) son una variante de la RM convencional, en la que se pretende mapear la difusión tridimensional de las moléculas de agua en las fibras de sustancia blanca del cerebro, monitoreando su desplazamiento aleatorio natural (random walk) debido a la energía térmica presente en ellas. Básicamente, esta técnica utiliza gradientes de campo adicionales en secuencia convencional de resonancia, con el fin de etiquetar el espacio en una dirección determinada durante un intervalo de tiempo finito, y codificar cualquier desplazamiento de núcleos de hidrógeno transportados por moléculas de agua en esa dirección 18,19.
Particularmente, el fenómeno de difusión de las moléculas de agua en las fibras nerviosas es anisotrópico, es decir, varía según la dirección en que se examine. Observándose mayor difusión en la dirección longitudinal de las fibras que en la orientación perpendicular, debido a restricciones que ofrecen la membrana y la vaina de mielina que las recubre. La forma adecuada de abordar esta difusión anisotrópica realmente comenzó con la introducción en el campo de dMRI, del llamado tensor de difusión (una matriz multidimensional). Así la difusión ya no se caracteriza por un solo coeficiente escalar, sino por un tensor simétrico que describe completamente la movilidad molecular a lo largo de cada eje y la correlación entre los desplazamientos a lo largo de estos ejes; acuñando así el término de imágenes por tensor de difusión (DTI por sus siglas en inglés), cuando se toma un enfoque basado en este modelo matemático (ver figura 1) 10,18. De esta manera, el tensor de difusión describe la magnitud, el grado de anisotropía y la orientación de la difusión anisotrópica de las moléculas de agua, permitiendo la estimación de patrones de conectividad de la sustancia blanca en el cerebro, a través de indicadores derivados de este, como la fracción anisotrópica (FA) o la difusividad media (DM). La FA es una medida resumida de integridad microestructural de la sustancia blanca y es sensible a los cambios microestructurales, la DM en tanto es una medida inversa de la densidad de la membrana y se ve afectada principalmente por cambios en la celularidad o aparición de necrosis 10,18.
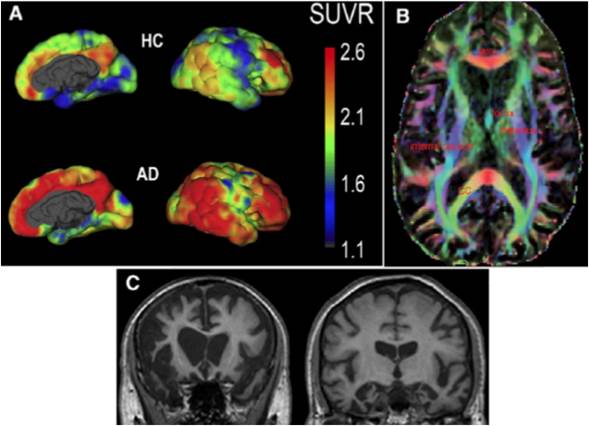
Figura 1 Técnicas de imagenología: A. PET: Representación de la superficie de las imágenes de PET que muestran la distribución regional del radioligando en un control sano y en un paciente con EA, las regiones de coloración rojiza indican mayor afinidad por el radioligando (tomado y modificado de 25). B. DTI: Visualización de datos de imágenes de tensor de difusión. El mapa muestra la dirección principal del tensor de difusión. El color rojo corresponde a la dirección medio-lateral, verde a anteroposterior, y azul a la orientación dorsoventral (tomado y modificado de 65) C. RMs: Ejemplos de imágenes estructurales de resonancia magnética, se muestran dos cortes coronales para casos de demencia frontotemporal confirmados patológicamente (tomado y modificado de 14).
Dentro de este contexto el objetivo de esta revisión temática busca proporcionar una visión general de los hallazgos morfológicos, funcionales y estructurales de neuroimágenes en tres modalidades: tomografía por emisión de positrones (PET), resonancia magnética de difusión (dMRI) y resonancia magnética estructural (RMs), en tres de las afecciones neurodegenerativas más comunes: EA, DCL y DFT. Es de interés discutir la capacidad de la información provista por estas técnicas, en la caracterización del perfil del curso natural de las enfermedades en mención, y por consiguiente de la alternativa que presentan para su diferenciación.
METODOLOGÍA
Se realizó una revisión temática sobre los hallazgos representativos y el potencial diagnóstico de las técnicas de neuroimagen, en tres enfermedades neurodegenerativas. La revisión se llevó a cabo a partir de una adaptación de los lineamientos sugeridos en la metodología PRISMA (www.prisma-statement.org), tomando solo algunos de los criterios allí descritos. La búsqueda de información se efectuó mediante el uso de bases de datos como ScienceDirect, PubMed, SciELO e IEEE durante el mes de febrero del presente año. Las palabras clave empleadas durante la búsqueda fueron: Alzheimer disease, cognitive impairment, frontotemporal dementia, nueroimaging, diffusion mri, diffusion tensor imaging, pet, molecular imaging, structural MRI, image analysis, e igualmente se utilizaron operadores booleanos (AND - OR). Se incluyeron artículos escritos tanto en inglés como en español, búsqueda que arrojó 417 artículos. Asimismo, las referencias de los artículos encontrados se tuvieron en cuenta para buscar potenciales publicaciones de interés. Para filtrar los resultados en primera instancia, con base en el título y el resumen se excluyeron estudios cuyas muestras presentaban sujetos con presentaciones atípicas de la EA, otros tipos de demencia (por fuera de los tres tomados en esta revisión) y otras técnicas de neuroimagen como resonancia magnética funcional, tomografía axial y tomografía computarizada de emisión monofotónica (SPECT), dando lugar a un subtotal de 109 artículos. Para la selección del conjunto final se revisó la sección de métodos y resultados de los 109 artículos, tomando como base para la inclusión del estudio: 1) la discusión sobre el potencial de predicción o clasificación de los trastornos de interés, a partir de las características y métricas de estas técnicas de neuroimagen; 2) que su diseño no estuviese sustentado en el marco de estudios clínicos aleatorizados o ensayos experimentales que evaluasen alguna intervención farmacéutica o biológica con el fin de mostrar alguna relación causal o sobre la enfermedad neurodegenerativa. Con estos criterios la criba final dio lugar a un total de 69 artículos. La figura 2 ilustra el proceso de selección de los artículos.
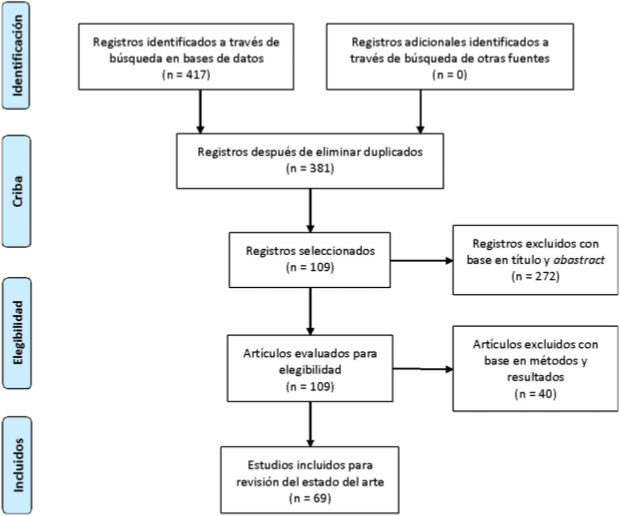
Figura 2 Diagrama de flujo del proceso de selección de artículos después de la búsqueda bibliográfica (elaboración propia).
En cuanto a la presentación de los resultados, se exponen los principales hallazgos estructurales o funcionales de los estudios, de acuerdo con la respectiva técnica de neuroimagen empleada en cada una de las tres enfermedades de interés. Se menciona también el tamaño de la muestra, tiempo de seguimiento (sólo en los estudios que lo reportan), y algunas métricas de análisis y evaluación utilizadas, como correlaciones y características operativas de sensibilidad y especificidad. Finalmente, en la discusión se da concesión a los principales resultados reportados mostrando sus principales fortalezas, igualmente se discuten posibles limitaciones de los estudios, tanto a nivel de la técnica de neuroimagen utilizada, como la presencia de posibles sesgos en los resultados, y la prospectiva que se plantea en el marco investigativo para enfrentar dichas limitaciones como parte de estudios futuros.
RESULTADOS
Neuroimagen en EA
En la actualidad la comunidad clínica se basa en los criterios establecidos por el Institute of Neurological and Communicative Disorders and Stroke and Alzheimer’s Disease and Related Disorders Association (NINDS-ADRDA) para diagnosticar a un paciente como probable de padecer demencia. Estas pautas establecen unos umbrales que deben ser superados para que una persona sea catalogada de sufrir la EA, mientras que el patrón de referencia es la confirmación de la condición mediante análisis post-mortem. Sin embargo, los avances científicos asociados al desarrollo de biomarcadores en las neuroimágenes han mostrado que es posible identificar la EA en una fase prodrómica, es decir, durante el período entre la aparición de los síntomas iniciales y el progreso avanzado de la enfermedad.
PET en la EA
Dos de las modalidades de neuroimagen que han tomado fuerza en las últimas dos décadas son la tomografía por emisión de positrones de amiloide (PET amiloide) y con fluorodesoxiglucosa (FDG-PET) 2,16,20. Las primeras publicaciones relacionadas con el uso de la técnica PET amiloide en la EA se remontan hacia el 2004 21, en la que se empleó el radioligando conocido como Pittsburgh Compound B (PiB). Los radioligandos cruzan fácilmente la barrera hematoencefálica y tienen una alta afinidad por las placas o deposiciones de amiloides, específicamente las de conformaciones B-amiloides. Desde el surgimiento del PiB otros radioligandos se fueron desarrollando variando principalmente en el tiempo de vida media de los mismos 15,21.
La interpretación y el análisis de los resultados de las imágenes PET son diversos entre los investigadores, partiendo del uso de la sustancia gris del cerebelo como referencia (dada su baja presencia de deposiciones de placas de B-Amiloide) para comparar la deposición de placas de amiloide entre los casos y los controles. Así como la relación de valores de captación estandarizados (SUVR por sus siglas en inglés) que mide la actividad en una región de interés específica para determinar la densidad de placa, ajustándose por peso, área superficial y dosis de radioligando amiloide administrado 15,16. Adicionalmente se busca comparar y establecer una posible correlación entre los hallazgos en estas imágenes, la aparición de la sintomatología y las evaluaciones neuropsicológicas.
Varios estudios han encontrado tanto desde un análisis visual como cuantitativo que la captación del radiomarcador es significativamente mayor en los pacientes con EA que en los controles. Resaltando regiones como la porción medial y lateral del lóbulo temporal, así como la parte posterior del giro cingulado 20,22. Al comparar los resultados del análisis visual y cuantitativo de las imágenes PET amiloide con la evidencia histopatológica (patrón de referencia), se obtienen unas características operativas de sensibilidad y especificidad prometedoras y consistentes para ambos análisis, alcanzado valores de 80 - 97% de sensibilidad y 85 - 94% de especificidad 20,22,23. Además, existe concordancia en los patrones de deposición de las zonas afectadas y las características operativas para diferentes ligandos (PiB, 18-Florbetaben) 24. No obstante, aún no se tiene claridad si los enfoques cuantitativos tendrían un valor agregado en comparación con el análisis visual cualitativo. Los enfoques cuantitativos serían beneficiosos si, por ejemplo, los niveles altos de amiloide o algunos patrones regionales de carga de amiloide predijeran un declive cognitivo más acelerado 20,22.
En cuanto al uso de otros radioligandos estudios con PiB y Florbetaben reportan coeficientes de correlación para la asociación entre la captación y las medidas de la carga de placa amiloide regional en la autopsia (cambios histopatológicos). Los estudios con PiB muestran un valor de correlación medio de r = 0,88, mientras que análisis de asociación con trazadores Florbetaben son un poco menores r = 0,69 23,24. Una razón por la que esta correlación es menor que la reportada con PIB podría ser la alta captación inespecífica de materia blanca de los marcadores con Florbetaben, que a su vez podría comprometer la evaluación de la carga de amiloide en la materia gris 16,21,23. También, se debe tener en cuenta la etapa de vida de los pacientes que hacen parte del estudio, puesto que en algunos de estos cuando las imágenes de PET se toman en etapas terminales, es decir, cerca del fallecimiento de la persona, se enfrenta un escenario que podría comprometer la capacidad de los marcadores de PET para identificar la carga de amiloide en el cerebro, debido a la atrofia cerebral avanzada y alteraciones de la circulación sanguínea 16,23. Otra de las patologías principales de la EA y que se hipotetiza es desencadenada por la acumulación de los B-amiloides, es la formación de ovillos neurofibrilares de la proteína tau. Los estudios de esta tau-patología buscan evidenciar una correlación entre los ovillos, la neurodegeneración y el estado cognitivo del paciente, no obstante, hasta hace pocos años las mediciones asociadas a esta proteína tau estaban limitados a análisis sobre métricas obtenidas del líquido cefalorraquídeo 25. Hoy en día se han desarrollado nuevos trazadores capaces de apuntar hacia las neurofibrillas tau, posibilitando el uso de PET en la identificación de regiones cerebrales que presenten medidas anormalmente altas de esta proteína y la sensibilidad de estas en la detección de la EA 6.
Los estudios de tau-PET muestran que las regiones de interés de relevancia en las que la tasa de captación estandarizadas (SUVR) exponen un efecto considerable en los niveles de esta proteína son la amígdala, la corteza occipital lateral, la corteza temporal inferior y el hipocampo, siendo mayor el patrón de retención del radiomarcador en los pacientes con EA en comparación con los controles o los que padecen DCL (figura 3) 26-28. Así mismo se sugiere que estos comportamientos de retención tau pueden ser empleados en el planteamiento de una correlación negativa entre este biomarcador y el deterioro de procesos funcionales y cognitivos como la memoria episódica o el decremento en el desempeño de pruebas neuropsicológicas como el Mini Mental State Examination (MMSE) 28,29. Estos hallazgos mostraron que la retención siguió una distribución topográfica relacionada con los síntomas en el cerebro, es decir, demostraron que los trazadores de PET tau podrían diferenciar a los pacientes con deterioro cognitivo de sujetos normales, a partir de patrones distintivos en una u otra condición.
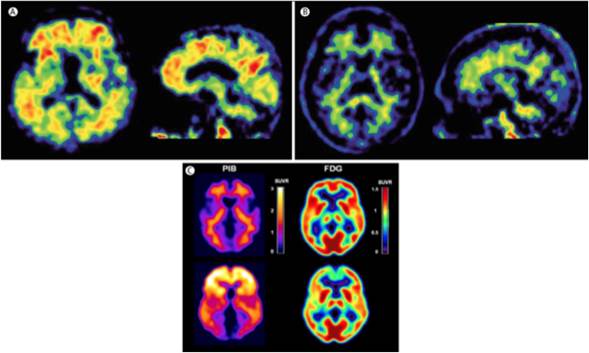
Figura 3 Resultados de imágenes PET en diferentes modalidades donde se muestran los patrones diferenciales de consumo metabólico de glucosa y de deposición de placas B-amiloides pacientes con EA. A) Imágenes de PET florbetaben en corte axial y sagital de un paciente sano. B) Imágenes de PET florbetaben en corte axial y sagital mostrando el hipometabolismo característico de un paciente con EA en las zonas temporales y laterales (tomado y modificado de 20). C) Fila superior - Imagen PiB con resultado negativo y FDG-PET con captación normal de glucosa en un sujeto sano; fila inferior-Imagen PiB con resultado positivo y captación reducida de glucosa patrón característico en EA (tomado y modificado de 32).
En contraste, previo al uso de tau-PET o PET amiloide una de las modalidades ampliamente estudiadas por más de 30 años fue y continúa siendo FDG-PET, esta técnica se utiliza como medida de la tasa de metabolismo cerebral de glucosa, y puede actuar como un marcador de neurodegeneración, puesto que da una idea desde el punto de vista funcional acerca de la actividad neuronal, siendo útil en la EA para detectar el hipometabolismo regional característico de esta enfermedad. Efectivamente las investigaciones con FDG-PET han demostrado que la EA exhibe un patrón regional específico de reducción en la tasa metabólica de glucosa en las áreas parietales, temporales, y en la parte posterior del giro cingulado (ver figuras 3 y 6) 30,31. La extensión de la distribución del hipometabolismo suele variar entre los sujetos y asimetrías en los hemisferios pueden notarse. Igualmente, las tasas de metabolismo reducidas muestran una correlación con las manifestaciones clínicas que aparecen a medida que progresa la demencia, incluyendo las áreas de Broca y Wernicke en las funciones del lenguaje, las regiones visuales bilaterales de procesamiento primario, y superior en las visuoespaciales, así como la corteza prefrontal bilateral en las ejecutivas 30-32. Las interpretaciones de diagnóstico de FDG-PET se hacen generalmente por inspección visual. En la actualidad se ha demostrado que el uso de análisis de mapas estadísticos semicuantitativos mejora la precisión del diagnóstico diferencial y la detección de cambios metabólicos sutiles en pacientes con EA o DCL 30,31. Estos datos apoyan la idea de que la PET con FDG podría ser útil como un predictor de deterioro cognitivo a corto plazo en estudios clínicos y entornos experimentales; sin embargo, FDG-PET se encuentra en la etapa de implementación en la práctica clínica y los estudios en un entorno de atención rutinaria real son escasos 30-32.
dMRI en la enfermedad de Alzheimer
Con un enfoque más estructural se encuentra la técnica de resonancia magnética de difusión (dMRI). Una herramienta puramente cuantitativa cuyas métricas son potenciales biomarcadores del progreso de las alteraciones en la sustancia blanca, que subyacen la EA y otras demencias. Pues a medida que las fibras se degradan debido a la patología, la homogeneidad y densidad de los axones es afectada y por ende se presentan cambios en los procesos de difusión, que se pueden ver reflejados en las métricas de dMRI 18. Los estudios de dMRI en la EA se orientan en general al entendimiento de los mecanismos relacionados con el daño de la sustancia blanca, y tratan de dar respuesta a si los daños son desencadenados por una primera afectación en la sustancia gris (degeneración walleriana), o si esta ocurre de manera independiente. Igualmente trata de mejorar el entendimiento de cuál es la dinámica espacial o temporal de la misma y cómo se relaciona con otros biomarcadores ya sea de neuroimágenes o bioquímicos 18,33.
El análisis de los resultados del DTI derivado de dMRI en pacientes con EA suelen tener dos enfoques principales. El más común basado en el análisis de regiones de interés en el que se definen de manera a priori zonas cerebrales en las que se hipotetiza existe alteraciones de las propiedades de la sustancia blanca. En segunda instancia, se encuentran la morfometría basada en vóxel (VBM por sus siglas en inglés) junto con las estadísticas espaciales basadas en tractos (TBSS por sus siglas en inglés), las cuales evalúan las diferencias de materia blanca vóxel por vóxel, permitiendo un estudio de los patrones de difusión en todo el cerebro y no limitarse a una región 34,35.
La mayoría de los estudios son consistentes en sus resultados sobre pacientes con EA y sujetos de control, donde los primeros exhiben un decremento significativo en la FA y un aumento en la DM de la sustancia blanca de varias regiones cerebrales, incluyendo de zonas de los lóbulos temporal, parietal y frontal, como el cuerpo calloso, el fascículo uncinado, el giro cingulado, el hipocampo y la cápsula externa (ver figura 4) 34,36-38. Específicamente, las disminuciones en FA y los aumentos en DM son indicativos de disminución de mielinización y pérdida de axones, como consecuencia de la neurodegeneración. Es importante mencionar que, si bien en los estudios se ha encontrado que el patrón de distribución de alteraciones de sustancia blanca, a lo largo del tiempo en los sujetos sanos es similar a la de los pacientes con EA, coinciden en que la magnitud o la extensión de los cambios en dichas métricas es menor para los controles 34,35,38.
Los cambios diferenciales en la sustancia blanca corresponden con regiones que se sabe son afectadas por la EA. En particular, una FA menor y una DM mayor en la región del hipocampo son consistentes con la progresión patológica temprana de la EA, así como la pérdida de memoria como preocupación inicial y principal. Esta evidencia científica sugiere el potencial de DTI como biomarcador de la EA, aunque se necesita un seguimiento de varios años de las imágenes y los signos clínicos de EA en diferentes etapas de diagnóstico para evaluar plenamente su utilidad clínica 34,36-38.
RMs en la enfermedad de Alzheimer
Una de las modalidades de neuroimagen más ampliamente utilizada es la RM estructural. En un principio las neuroimágenes estructurales fueron empleadas en las enfermedades neurodegenerativas, como las demencias, con el único propósito de descartar la enfermedad y buscar una explicación alternativa para el deterioro cognitivo evidenciado en los pacientes, por ejemplo, por la presencia de un tumor cerebral o un hematoma. Sin embargo, con el avance y mejora de la tecnología y los protocolos de adquisición de la resonancia magnética estructural, el papel de esta técnica en la demencia cambió gradualmente, de la exclusión de la enfermedad, a la de brindar un gran apoyo para el diagnóstico clínico y la discriminación entre los subtipos de demencia entre ellos la EA 5,13. Recientemente se ha acumulado evidencia que soporta la hipótesis de que el proceso patológico de la EA -y en general de otros subtipos de demencia-, pueden comenzar varios años antes del diagnóstico, por lo que la detección de estos cambios preclínicos representa un papel importante en la estratificación y prevención de la enfermedad 39.
La RM estructural es la principal técnica de neuroimagen de elección en la práctica clínica para apoyar el diagnóstico clínico de la EA y trata de evaluar el proceso de atrofia cerebral a través de medidas morfométricas como el volumen y el grosor cortical. Uno de los retos que enfrenta esta técnica se debe a que los cambios estructurales en el cerebro son un proceso natural asociado al envejecimiento, y que las manifestaciones de dicho proceso son variadas, por lo que estos cambios suelen traslaparse con el espectro de modificaciones presentes en la EA 5,39. Es por esta razón que los estudios de RMs han concentrado esfuerzos en tratar de identificar patrones de anormalidad en el proceso de atrofia cerebral. Las investigaciones muestran enfoques distintos en la búsqueda de estos biomarcadores, principalmente en el hipocampo, la corteza entorrinal, la neocorteza, y finalmente en estructuras subcorticales como la amígdala, el tálamo y los ganglios basales.
Entre los biomarcadores centrales para la detección de la EA, la atrofia del hipocampo es hasta ahora el más validado y empleado en estudios de la progresión de este trastorno. Varios estudios muestran que el volumen del hipocampo se encuentra reducido en los pacientes con EA entre un rango que oscila del 15 - 35 % en comparación con los sujetos sanos, e incluso este presentaba una reducción de volumen de alrededor del 10 - 23 % en pacientes en la etapa de demencia leve de EA 40,41. Adicionalmente estudios de cohortes, y de casos y controles reportan que las tasas anuales de atrofia del hipocampo son de alrededor de 4,5 - 4,7% para los pacientes con EA, y 1,4 - 1,6 % para los controles (ver figura 4). Los individuos que mostraron una mayor tasa de disminución del volumen del hipocampo durante el seguimiento desarrollaron con mayor frecuencia demencia 42,43. Los resultados de las métricas de RMs sobre el volumen del hipocampo muestran correlación con el declive clínico, con la gravedad de los trastornos cognitivos y los déficits de memoria episódica en la EA 42-44. Incluso entre los sujetos que se mantuvieron libres de demencia durante el seguimiento, una disminución más rápida en el volumen del hipocampo estaba relacionada con un peor rendimiento en las pruebas de memoria.
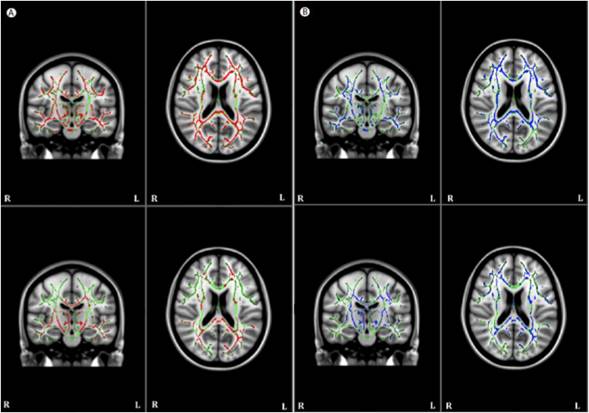
Figura 4 Panel A, Análisis de sustancia blanca que muestra un patrón de anisotropía fraccional (FA) reducida (en rojo) superpuesto en el esqueleto de sustancia blanca (en verde) para individuos con EA (parte superior) en comparación con controles inferiores (parte inferior). Panel B, muestra el patrón de difusividad media (DM) incrementada (en azul) superpuesta en el esqueleto de materia blanca (en verde) en individuos con enfermedad de Alzheimer comparado con sujetos sanos (tomado y modificado de 38).
De igual manera la RMs permite estudiar la atrofia a lo largo de toda la corteza con buena precisión y reproducibilidad. Estudios como los de Tondelli et al., Li et al. 45,46 sugieren un patrón estereotípico de neurodegeneración en la EA, la cual se caracteriza por una disminución temprana del volumen cortical en el lóbulo temporal medio, seguido por una extensión de la atrofia hacia el resto de la corteza con una trayectoria temporal-parietal-frontal, mientras que las regiones motoras son más afectadas en etapas avanzadas de la EA 39,45. Por otro lado, estudios de RMs que se han centrado en la corteza entorrinal (CE), la cual representa un punto de conexión entre la neocorteza y el hipocampo, postulan que tanto el volumen como el grosor de esta zona podría emplearse como un biomarcador de la EA, en la que tanto el nivel de atrofia y la disminución del grosor son mayores en los pacientes con la enfermedad que en sujetos sanos. La atrofia de la CE está relacionada con las funciones cognitivas, en EA, se ha encontrado una relación significativa con la cognición, memoria y lenguaje 45,46.
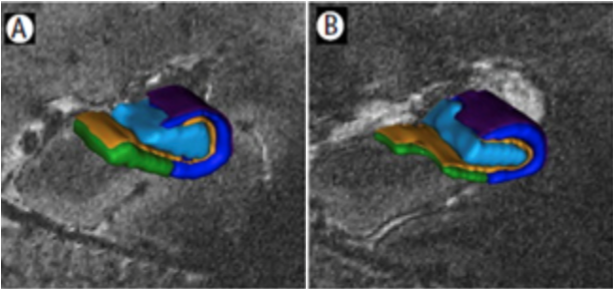
Figura 5 Renderización de 5 subregiones segmentadas en el hipocampo. Se muestra una reducción significativa de sustancia gris en el hipocampo (atrofia) en pacientes con EA (B) en contraste con los volúmenes de las regiones hipocampales en sujetos control sanos (A) (tomado y modificado de 44).
Neuroimagen en DCL
El deterioro cognitivo leve (DCL) hace referencia a un detrimento en la cognición, que se encuentra por encima de lo que suele ocurrir en un deterioro cognitivo normal relacionado con la edad, y que además no lo suficientemente grave como para causar un impedimento en la ejecución de las actividades cotidianas. Si bien, existen seis dominios cognitivos que puede ser afectados por el DCL (aprendizaje y memoria, habilidad social, lenguaje, función visoespacial o función ejecutiva), en general este se asocia a una disminución en la capacidad de aprender nueva información o recuperar información almacenada. Es por esta razón que la mayoría de los estudios abordan este trastorno como amnésico cuando el daño observado es solamente en la capacidad de recordar información, y no amnésico al daño de uno o más de los otros dominios con una conservación buena de la memoria, siendo este último menos común y más difícil de diagnosticar 4,17.
Además, es de gran importancia identificar a individuos con alta probabilidad de desarrollar algún tipo de demencia de manera que puedan ser tratados oportunamente. Las estadísticas evidencian que las personas con DCL tienen una tasa de conversión a EA estimada en un 15% anual. Las medidas ampliamente aceptadas para evaluar dicha progresión se derivan de RMs, PET y líquido cefalorraquídeo, pero recientemente se ha incorporado la técnica de DTI. En décadas anteriores se pensaba en el DCL como un precursor asintomático de la EA, sin embargo, en muchos casos pacientes con DCL no desarrollan EA, pero si otros tipos de demencia. Efectivamente, la mayoría de los casos terminan desarrollando algún trastorno neurodegenerativo, en los cuales se ha observado que pacientes con DCL amnésico son más propensos a padecer de EA o demencia vascular, mientras que los no amnésicos suelen padecer demencia frontotemporal 17.
En cuanto a las técnicas de neuroimagen que abordan esta enfermedad, las dos modalidades de PET más utilizadas en el proceso de diagnóstico de DCL dada su capacidad de otorgar información acerca de la función cognitiva son el PET metabólico (FDG-PET) y la de B-amiloides. Básicamente el rol que cumplen los estudios PET en el DCL se centra en la evaluación de la fisiopatología en relación con los síntomas y la estimación de la probabilidad de conversión a demencia, en general a EA 47,48. Asimismo, la mayoría de los estudios que utilizan DTI en el DCL se enfocan en la estimación de la fracción anisotrópica y la difusividad media de las moléculas de agua en regiones de interés definidas, buscan identificar daños de la microestructura de la sustancia blanca, con el fin de proveer una herramienta prometedora para el diagnóstico diferencial entre DCL, EA y otros trastornos cognitivos 33,37. Mientras que la técnica de RM se centra en la evaluación volumétrica de zonas cerebrales definidas para encontrar estos biomarcadores.
PET en el deterioro cognitivo leve
Desde el punto de vista metabólico estudios con fluorodesoxiglucosa y otros radio-trazadores han mostrado que un hipometabolismo en el lóbulo parietal inferior, el precúneo y el cíngulo posterior (figura 6), pueden actuar como buenos predictores de conversión de DCL a demencia por EA, alcanzando valores de especificidad y sensibilidad mayores al 85% 47-49. En efecto, un estudio reciente con una cohorte grande de 80 pacientes con DCL seguida en promedio por 20 meses encontró que 50 sujetos desarrollaron algún tipo de demencia durante el seguimiento, específicamente 39 se diagnosticaron con EA, 9 con demencia frontotemporal y 1 con demencia de cuerpos de Lewy 47, además la mayoría de pacientes que sufrieron de EA en un principio fueron clasificados como DCL amnésico mientras que los que se convirtieron a demencia frontotemporal primaban los de DCL no amnésico 4,17.
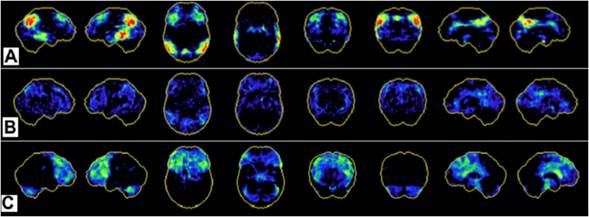
Figura 6 Imágenes de FDG-PET en diferentes tipos de trastornos. A) Paciente con EA el hipometabolismo de glucosa se observa en el área de asociación parietotemporal, el cíngulo posterior, el precúneo y el área de asociación frontal. B) Paciente con DCL el hipometabolismo es sutil se ven pequeñas trazas en el área de asociación parietotemporal, cíngulo posterior, precúneo y área frontal. C) Paciente con demencia frontotemporal (DFT) el hipometabolismo se evidencia en el lóbulo frontal (tomado y modificado de 17).
En contraste, se encuentran los estudios para evaluar la patología B-amiloide, aunque este es un marcador distintivo de la EA, los sujetos con una deposición positiva de placas B-amiloide suelen ser considerados como personas con EA preclínico (sin síntomas) o de padecer e incrementar el riesgo de padecer DCL comparados con un resultado B-amiloide negativo. Los resultados muestran que esta modalidad de PET tiene una alta sensibilidad en la predicción de conversión de DCL a EA u otras demencias entre 75 - 86%, no obstante, su especificidad aún es demasiado laxa oscilando entre 50-85% 16,32,50. Por lo que se suele considerar que aún no tiene el valor clínico aceptable para emplearlo en el arsenal médico para la predicción temprana de desarrollar algún tipo de demencia. Asimismo, los B-amiloide positivos tienen un decremento significativamente más rápido en las pruebas neuropsicológicas de memoria, lenguaje y función ejecutiva, muestran un patrón de lesión de sustancia blanca mayor y un hipometabolismo marcado en la región temporal y el cíngulo 16,51.
dMRI en deterioro cognitivo leve
En el campo de las imágenes por difusión los resultados entre los estudios son consistentes al mostrar un patrón de degeneración de sustancia blanca mayor en pacientes con DCL en comparación con los controles. Se observan alteraciones generalizadas tanto en la FA como en la difusividad media DM en tractos que atraviesan el lóbulo temporal y las regiones cerebrales posteriores (especialmente el cíngulo hipocampal izquierdo), sugiriendo que la patología en esta región incluye alguna forma de degradación de la mielina en los axones (ver figura 7) 19,52,53. Igualmente, desde un análisis global del cerebro la métrica de difusividad radial muestra un incremento significativo en pacientes con DCL amnésico, y desde el enfoque individual la FA mostró correlación significativa con el rendimiento de la memoria, evidenciando que el daño microestructural reflejado en este índice de DTI tiene una correspondencia directa con los síntomas cognitivos predominantes de estos pacientes 52,54. En un estudio reciente 55 en el que se evaluó la capacidad de las métricas de DTI en la diferenciación de DCL amnésico del no amnésico, se encontró que al agregar la FA y la DM a los modelos de predicción que solamente empleaban las medidas de volumen y grosor cortical de algunas regiones de interés, como el cuerpo calloso y el hipocampo, se mejoraba la correcta clasificación de los pacientes, al alcanza una exactitud de hasta el 86% que en un principio solo se encontraba en 64%.
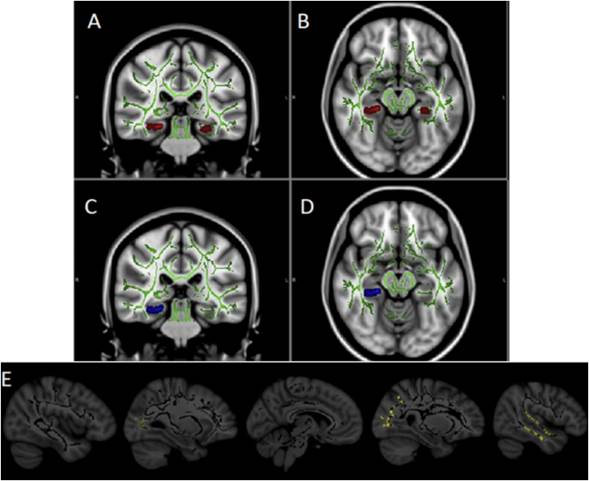
Figura 7 A) y B) la zona coloreada en rojo indica tractos de sustancia blanca con anisotropía fraccional reducida (FA) en la sustancia blanca hipocampal bilateral en pacientes con DCL vs. controles; C) y D) La zona en azul indica la región con menor difusividad radial (DR) en la sustancia blanca hipocampal derecha en DCL vs. Controles (tomado y modificado de 43); E). En amarillo tractos de sustancia blanca muestran aumentos significativos en la difusividad radial (DR) en los pacientes con DCL (tomado y modificado de 52).
Como se evidencia las alteraciones de la integridad de la sustancia blanca son signos tempranos de deterioro cognitivo y de las manifestaciones clínicas amnésicas y no amnésicos del DCL, y no solo muestran un patrón representativo de daño marcado en este tipo de pacientes que se postula como un marcador útil para su discriminación, sino que también se asocian con déficits neuropsicológicos y cognitivos. Las mediciones de DTI en ciertas regiones como el hipocampo, el fórnix, y el giro cingulado pueden otorgar información valiosa a las técnicas convencionalmente aceptadas y aplicadas a nivel clínico, ayudando a detectar la conversión a enfermedad de Alzheimer u otros tipos de demencia en una etapa preclínica temprana.
RMs en deterioro cognitivo leve
Dado que la mayoría de los estudios se enfocan en la conversión de DCL, la naturaleza de los mismos es del tipo de estudios de cohorte, en las que los grupos de sujetos inicialmente sanos o con DCL son sometidos a un seguimiento por un periodo de tiempo establecido. Esto con el fin de determinar cuántos progresan a demencia y cuántos permanecen estables, y a partir de las potenciales diferencias en la volumetría cerebral establecer predictores significativos para la detección temprana 45,56.
Varios estudios de RMs han mostrado resultados similares en la tasa de conversión de pacientes con DCL a EA, a pesar de la diferencia en el tamaño de muestra y el tiempo de seguimiento de la cohorte de estudio, el porcentaje de sujetos que desarrollan demencia oscila entre el 20-35%. Adicionalmente, se observa que los sujetos que se convierten a demencia tienen una reducción mayor en los volúmenes de sustancia gris en la porción medial y lateral del lóbulo temporal, destacándose la afectación del hipocampo, el giro temporal y la corteza entorrinal, de igual manera se ven alteradas estructuras del lóbulo parietal 26,56,57. Los estudios muestran que, si bien desde el punto estadístico en promedio casi todos los volúmenes analizados son menores en los pacientes con DCL que desarrollan demencia, en comparación con los no convertidores, no todas estas regiones presentan el mismo potencial al momento de ser empleados como variables para modelos de predicción. De hecho, existe una convergencia en resaltar que las estructuras con mayor poder para dicha finalidad son el hipocampo de ambos hemisferios y la corteza entorrinal en la que las diferencias entre la especificidad y sensibilidad en la discriminación son debidas principalmente al tamaño de la muestra 26,40,45,56.
Los patrones complejos de atrofia cerebral en estos pacientes con DCL concuerdan también con los patrones de referencia o estándar que son conocidos a nivel de estudios histopatológicos, en la que la secuencia de cambios neuropatológicos empieza por el daño de la corteza entorrinal y el hipocampo y posteriormente, la corteza de los lóbulos temporales en la etapa avanzadas 58. Sin embargo, dado que los pacientes con DCL son un grupo heterogéneo y pueden estar en diferentes etapas del proceso neuropatológico, atrofias de regiones más generalizados como giros de lóbulos temporales y parietales pueden ser muy divergentes a la hora de la caracterización, es por eso por lo que el uso del hipocampo y los volúmenes de la corteza entorrinal parece ser el método óptimo desde una perspectiva de análisis de regiones singulares en RMs.
Neuroimagen en DFT
La degeneración lobular en la región frontotemporal representa un grupo de trastornos clínica y patológicamente heterogéneos, siendo con la EA uno de los trastornos neurodegenerativos que más afecta a adultos menores de 65 años. Tradicionalmente, las manifestaciones clínicas de esta degeneración frontotemporal se han restringido en gran parte en pacientes con desordenes del comportamiento o del lenguaje 59,60. Desde finales de los años 90 se acuñó el término de demencia frontotemporal (DFT) para estos pacientes, la cual de acuerdo con sus diversas manifestaciones clínicas se dividió en tres categorías principales: variante del comportamiento de DFT, afasia progresiva primaria y demencia semántica o variante del lenguaje de la DFT.
Uno de los grandes retos en la DFT es la búsqueda de metodologías para la diferenciación de esta con otras enfermedades como la EA y desórdenes psiquiátricos. Los primeros síntomas de la DFT se caracterizan por la alteración del comportamiento y el lenguaje, mientras que en la EA por ejemplo es típicamente la pérdida de memoria. Sin embargo, ambos trastornos causan una demencia progresiva que carece de signos físicos distintivos en fases avanzadas. Por esta razón suele ocurrir que los pacientes con DFT con frecuencia cumplen los criterios de diagnóstico para la EA. Siendo evidente que la DFT tiene un alto riesgo de ser diagnosticada de manera errónea 59,61.
En los últimos años, la neuroimagen ha contribuido a la caracterización de los distintos fenotipos de la degeneración lobular frontotemporal que desencadena la DFT, uno de los enfoques de neuroimagen más comúnmente utilizados es la resonancia magnética estructural. La RMs tiene como finalidad identificar que cada síndrome clínico se asocia con un patrón específico de atrofia localizado en regiones específicas, y actualmente se usa de forma rutinaria en el trabajo diagnóstico de DFT 14. Biomarcadores adicionales para la discriminación correcta de cada síndrome se encuentran en investigación, especialmente se buscan aquellos que pueden asociarse a las alteraciones específicas de los tractos de sustancia blanca y afectaciones metabólicas, a través de técnicas como dMRI y PET respectivamente 10,12.
PET en demencia frontotemporal
FDG-PET es una de las modalidades empleadas dado su potencial para reconocer patrones de hipometabolismo de glucosa diferenciales en la DFT. Desde una perspectiva general los estudios de PET muestran que la DFT describe un hipometabolismo predominante en regiones anteriores de los lóbulos frontales, la corteza temporal anterior y la corteza cingulada anterior, mientras que la EA exhibe dicha reducción de metabolismo en regiones posteriores, como la corteza de asociación temporoparietal posterior y la corteza cingulada (ver figuras 6 y 8) 59,62. Algunos estudios muestran que estos patrones no deben tomarse a la ligera, debido a que las regiones mencionadas suelen mostrar un comportamiento hipometabólico tanto para pacientes con DFT como para aquellos con EA, por ello se resalta la contribución que puede dar la información correspondiente a la asimetría del metabolismo. La asimetría metabólica hemisférica significativa ocurre en ambos tipos de pacientes, no obstante, los pacientes con DFT suelen mostrar asimetría hemisférica izquierda o derecha, mientras que el hemisferio derecho es más hipometabólico en los sujetos con EA 62,63.
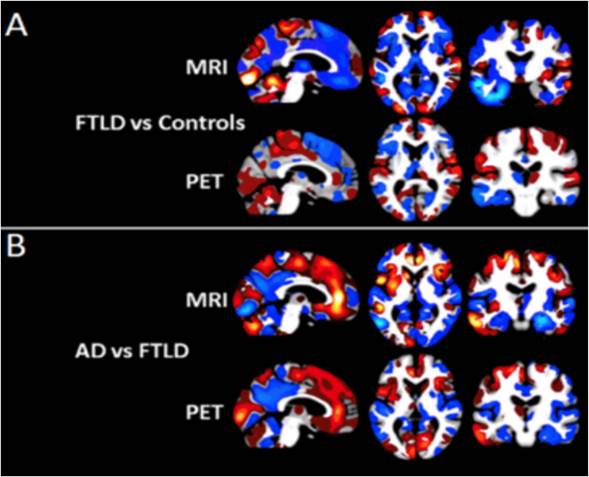
Figura 8 A) DFT vs. Controles: Las regiones en azul indican disminución de la intensidad de la materia gris (fila superior) o reducción de la tasa metabólica (fila inferior) que aumentan la probabilidad de que un paciente se clasifique en el grupo de DFT; B) EA vs. DFT: Las regiones en rojo indican una disminución de la intensidad de la sustancia gris (fila superior) o una tasa metabólica reducida (fila inferior) que aumentan la probabilidad de clasificación en el grupo de DFT, las azules implican lo contrario (tomado y modificado de 63).
Adicionalmente, los estudios han logrado identificar cómo las regiones deterioradas en cada uno de los tres subtipos de DFT tienen un correlato neurocognitivo con los síntomas que manifiestan. La variante comportamental de DFT muestra un hipometabolismo en regiones como el tálamo medial, el surco frontal superior y la ínsula, estos componentes de una red frontomedial encargada de procesos de cognición social. Por su parte, la afasia progresiva primaria involucra una afectación de una red hemisférica izquierda asociada al procesamiento fonológico y sintáctico, extendiéndose a través del área de Broca, la porción superior del lóbulo temporal y los ganglios basales. La demencia semántica es caracterizada por daños bilaterales en la amígdala y el giro temporal a nivel medial, las cuales son áreas cerebrales relacionadas con conocimiento conceptual, procesamiento de información semántica y cognición social 60,61.
En general el enfoque para validar las afectaciones en las regiones cerebrales hipotetizadas en los estudios son las correlaciones y el empleo de técnicas de regresión, en esta última predominan las regresiones logísticas en las que los predictores son las mediciones de tasa de consumo metabólico de glucosa y en ocasiones se complementa con métricas de otras modalidades. La exactitud en la clasificación en general es consistente con estos métodos y se han logrado tasas de correcta clasificación de alrededor del 80-95%, y con valores de sensibilidad y especificidad que oscilan entre 70-85% y 76- 90% respectivamente 60,63,64.
dMRI en demencia frontotemporal
Los estudios recientes muestran un común denominador evidente en la DFT, al evaluar pacientes mediante imágenes ponderadas en difusión, se ha encontrado que la degeneración y cambio en la microestructura de la sustancia blanca en ciertas regiones comunes a DFT y EA, es más marcada en la primera. Es por esta razón, que se han centrado esfuerzos en tratar de comprobar que existen perfiles de sustancia blanca patológicos característicos de la DFT 10,12,65). Estudios realizados acerca de las alteraciones de los tractos de sustancia blanca en este tipo de demencia, contrastan sus resultados con pacientes de control saludables y con EA, evidenciando una patología en la microestructura de la sustancia blanca de mayor extensión en los pacientes con DFT que en los otros grupos, caracterizadas por un aumento en la DM simultáneo con un decremento en la FA (ver figura 9), dichas alteraciones fueron más marcadas en regiones anteriores que posteriores, como el fascículo uncinado, el segmento frontal del cuerpo calloso y el giro cingulado, sin evidenciar una asimetría significativa en cuanto a la presencia de estas alteraciones en los hemisferios 9-11,65.
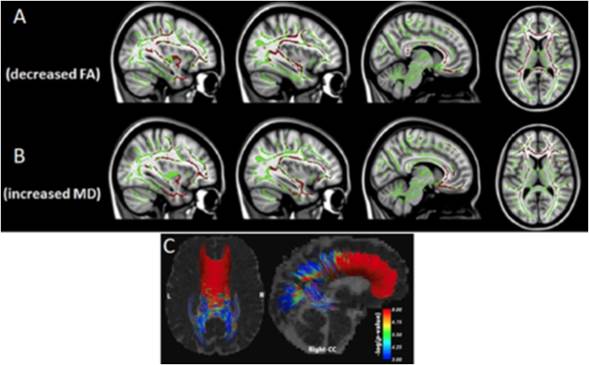
Figura 9 Tractos de sustancia blanca en con FA reducida (A en rojo) en pacientes con DFT en comparación con pacientes con EA; B) Tractos de sustancia blanca con DM aumentada (en rojo) en pacientes con DFT. Para ambos las afectaciones principales son la en la parte anterior del cuerpo calloso y el giro cingulado (tomado y modificado de 59. C) Tractografía del cuerpo calloso en la que las zonas en rojo muestran un incremento significativo de la DM en pacientes con DFT comparado con controles sanos, como se aprecia la zona anterior del cuerpo calloso es donde predomina la alteración (tomado y modificado de 12).
La identificación de estos patrones característicos de anormalidades en los tractos de pacientes con DFT, son de especial importancia para el análisis de las relaciones entre las zonas alteradas y la funciones en las que estas se ven implicadas, en primer lugar, las fibras del fascículo uncinado afectadas en este tipo de pacientes, se asocian a la interpretación de señales afectivas e interpersonales, por lo que su variación suele asociarse a un menor nivel de sociabilidad, mayor ansiedad y desinhibición. En cuanto a la región del giro cingulado, es sabido que este cumple funciones fundamentales en el sistema límbico, y se involucra en el proceso de las respuestas emocionales, conducta y aprendizaje, por lo que su alteración puede estar implicada en la patología del desorden obsesivo-compulsivo y la disfunción ejecutiva 9,10,12.
Algunos estudios muestran el uso de enfoques estadísticos para analizar el potencial de discriminación de dMRI, empleando regresiones lineales o logísticas y las curvas ROC (Receiver Operating Characteristic). Los modelos matemáticos descritos por las regresiones en estos estudios tratan de aproximar una relación de dependencia entre las métricas de difusión y la DFT, con el fin de plantear un posible modelo de predicción 12,11,61,65. Por otro lado, el análisis mediante curvas ROC efectuado en estas investigaciones permite evaluar las características operativas de sistemas de clasificación binarios, es decir, de modelos que a partir de los datos de difusión permiten la división en dos posibles clases (DFT/no DFT), proporcionando herramientas para seleccionar los modelos con la configuración de variables posiblemente óptima 61. Los estudios muestran que las características operativas varían de acuerdo con las regiones cerebrales (y sus métricas) seleccionadas para la clasificación realizada por estos modelos, encontrándose sensibilidades y especificidades de hasta 94% y 78% respectivamente 9,11,12. Cuando solo se emplean métricas de resonancia estructural o funcional la precisión en la clasificación puede variar entre 70% y 85%, dependiendo de las variables usadas y de la región cerebral donde se hace el análisis. En cambio, cuando se recurre a un enfoque que integra también la información de DTI se pueden alcanzar niveles de precisión mayores al 90% en la clasificación 10,11,65 y al mismo tiempo dar un entendimiento de que este síndrome neurodegenerativo, no es un proceso en el que el daño de la sustancia blanca es aislado, sino por el contrario, podría desarrollarse junto con el deterioro de la sustancia gris, como parte de un contexto común.
RMs en demencia frontotemporal
Los estudios de RMs en la variante comportamental de DFT han observado resultados prometedores para diferenciar este subtipo de demencia. Este se presenta con una combinación de atrofia frontal, cortical temporal anterior y subcortical. El gradiente de atrofia es mayor en regiones anteriores que posteriores y la asimetría hemisférica proporciona la mayor especificidad para discriminar la variante comportamental de DFT. Además, en estudios de cohortes de seguimiento se ha podido evidenciar que la tasa de atrofia cerebral es más rápida en los pacientes con este tipo de demencia que en sujetos sanos e incluso en aquellos con EA, alcanzando tasas medias de hasta 3,8% y 2,4% respectivamente, con las diferencias más notables en las regiones cerebrales anteriores 14,66. En contraste en las imágenes de resonancia magnética estructural de pacientes con afasia primaria progresiva se asocia un patrón específico de atrofia focal en la región frontoinsular izquierda y en el lóbulo frontal anterior y ventromedial 14,66,67.
Desde el punto de vista de los métodos de clasificación que usualmente se emplean con métricas de resonancia magnética estructural, se destacan la morfometría basada en vóxeles y modelos de regresiones logísticas. La morfometría basada en vóxel se ha utilizado para identificar regiones cerebrales que difieren al máximo entre sujetos sanos e individuos con DFT, con base en una prueba estadística de vóxel por vóxel de las diferencias en la densidad de tejido, ya sea el volumen o el grosor cortical 66,67. Los estudios resaltan que después de realizar una corrección apropiada para la multiplicidad de comparaciones estadísticas, los grupos de vóxeles próximos espacialmente pueden delinear regiones de interés que potencialmente proporcionan un valor máximo en la clasificación de pacientes. En efecto, se reporta que la capacidad de distinguir correctamente a los pacientes con DFT de los controles varía entre 75 - 94%, dependiendo del volumen o grosor de las porciones de la corteza frontal, temporal y parietal analizadas 66,67. Recientemente, se ha propuesto el uso de algoritmos de reconocimiento de patrones para predecir el diagnóstico individual en cada paciente, de hecho, son pocos los estudios que emplean en sus muestras personas con padecimiento de DFT. Vemuri et al. trataron de identificar patrones de atrofia únicos para tres enfermedades (DFT, EA y demencia con cuerpo de Lewy) mediante el uso de imágenes de resonancia magnética ante-mortem de casos de demencia confirmados, y a partir de estas diseñar un sistema de diagnóstico basado en características de RMs 68. Recurriendo a un algoritmo llamado k-means para agrupar en clústeres la información de las imágenes de resonancia lograron un buen desempeño en comparación con el patrón de referencia de la autopsia y el diagnóstico clínico, alcanzado valores de sensibilidad de 84,4% y especificidad del 93,8% en los pacientes con DFT 68. Por otro lado, uno de los estudios más recientes demostró la capacidad del algoritmo de máquinas de soporte vectorial (SVM) para el diagnóstico de la variante comportamental, a partir de la información de RMs 69. Los análisis proporcionaron resultados muy razonables, variando en precisión entre 78,8% y 84,6%, dependiendo de la región de interés seleccionada. Asimismo, se notó que el uso de todos los vóxeles de las imágenes correspondientes al lóbulo frontal condujo a una mejor precisión de clasificación que el uso de todos los vóxeles del lóbulo temporal, respaldando la conjetura de que la red principal o central afectada se encuentra dentro del lóbulo frontal 67,69.
DISCUSIÓN Y CONCLUSIONES
En el presente texto se realizó una revisión temática de tres de las principales técnicas de neuroimagen (PET, dMRI, RMs) que se emplean para la diferenciación de tres tipos de enfermedades neurodegenerativas (EA, DCL, DFT). Como se ha expuesto es evidente que el avance en el campo de las técnicas de neuroimagen muestra un gran potencial para el establecimiento de biomarcadores discriminatorios a lo largo de la extensa gama de trastornos neurodegenerativos. Estos buscan una complementación e integración de la información de diferentes dominios para apoyar las herramientas clínicamente aceptadas, garantizando una mejor precisión en la determinación de un diagnóstico, y en el mejor de los casos, que de hecho es la meta de dichas técnicas, la predicción y prevención temprana de la aparición de la enfermedad.
La evidencia disponible acerca de la capacidad de las técnicas de neuroimagen en la identificación de información útil para el apoyo diagnóstico ha crecido continuamente en las últimas décadas. Sin embargo, aún se presentan obstáculos en la implementación de estos biomarcadores en el entorno clínico, ya que, no existe un modelo de referencia que identifique una jerarquía en la aparición de estos durante el progreso de las enfermedades. Por ejemplo, en la EA una de las hipótesis que se postula acerca del curso natural de la enfermedad, es la que sugiere una cascada de cambios funcionales seguidos de afectaciones estructurales. En esta cadena de alteraciones en la estructura y función cerebral, algunos autores proponen un cambio en las deposiciones de B-amiloides como etapa inicial de la EA 2,15,23, seguido de atrofia cerebral en regiones de interés particulares como el hipocampo 40,41, y un hipometabolismo de glucosa en zonas similares 29,31, la sinergia de estos eslabones es la que desencadena la aparición de la sintomatología observada en estos pacientes, en particular el deterioro de la memoria episódica. Asimismo, fenómenos de desmielinización y pérdida axonal en la sustancia blanca identificados mediante las métricas de difusión (fracción anisotrópica, difusividad media, entre otras) pudiesen estar limitadas debido a que otros procesos neurobiológicos subyacentes, como la destrucción de neurofibrillas y las alteraciones gliales 34,38, implicados posiblemente en este proceso de degeneración, dan lugar a cambios que no son capturados completamente por esta técnica de difusión.
Teniendo en cuenta lo anterior la certeza con la que se acepten las hipótesis puestas a prueba en los estudios, viene determinada por la validez de los biomarcadores de neuroimagen descritos, y cómo estos pueden ser evaluados. En particular, suelen considerarse dos criterios principales para dicha evaluación: primero, su validez patológica, es decir, si el biomarcador mide los cambios patológicos esperados o no, donde los resultados esperados son los expuestos por una técnica o examen de referencia (como los análisis histopatológicos); y segundo, su validez clínica, es decir, la precisión con la que el biomarcador puede realmente predecir el resultado clínico de un individuo 5,7,34.
En el caso de PET, por ejemplo, los cambios en la deposición de B-amiloide in-vivo observados y cuantificados en estas imágenes concuerdan con análisis post-morten, mostrando una consistencia en el plano patológico 15,17,47. En cuanto al rol en el entorno clínico PET se utiliza como herramienta en las primeras etapas de la demencia. Con un enfoque particularmente atractivo en emplear este método de neuroimagen para predecir, de forma individual, el riesgo de conversión de DCL a EA 47-49. Sin embargo, aunque los hallazgos son prometedores y muestran que puede ser posible, es discutible si PET por sí solo sea capaz de describir adecuadamente el marco de tiempo de conversión de DCL a EA. Esto teniendo en consideración que la acumulación de amiloide probablemente representa un evento temprano en el curso de la enfermedad, que incluso precede a una manifestación explícita de deterioro cognitivo, de manera que la acumulación de amiloide ya podría haber alcanzado una meseta en muchos pacientes con DCL al momento de hacer estudios de imagen molecular 47,51.
Los estudios de RMs también muestran una validez patológica, dado que la atrofia cerebral tal como se visualiza y cuantifica con esta técnica puede, en principio, mostrar la pérdida de componentes del tejido, como neuronas, sinapsis, dendritas, células gliales y vasos sanguíneos. Las disminuciones en los volúmenes de regiones como el hipocampo en la EA, o de las regiones lobulares frontal y temporal en la DFT que se aprecian con la RMs de manera ante-mortem, se correlacionan fuertemente con las estimaciones histopatológicas de los tejidos neuronales en las autopsias 45,46. Sin embargo, la pérdida de células no es necesariamente la única causa de los cambios volumétricos identificados con la RMs, lo que limita su aceptación clínica.
El adelgazamiento de regiones corticales similares al perfil de atrofia en EA o DFT reportados en grupos de sujetos sanos, debido al proceso natural de envejecimiento, se debe principalmente a cambios en la morfología celular y la arquitectura dendrítica, en lugar de pérdida neuronal por causa de una enfermedad 39,45,46. Aunque estas medidas volumétricas en RMs aún no son lo suficientemente precisas para reemplazar las evaluaciones clínicas detalladas para la predicción de la progresión de la enfermedad, se logran mejores estimaciones cuando se combinan los dos tipos de información.
Debido a la validez patológica que muestran los biomarcadores de RMs y PET, estos se han convertido en parte de los ensayos clínicos y algoritmos de diagnóstico en la atención terciaria. No obstante, ninguna de estas técnicas ha demostrado su utilidad en una muestra de pacientes de atención primaria. La atención primaria suele ser el primer punto de contacto para los pacientes con sospecha de demencia y, por lo tanto, brinda una oportunidad única para el diagnóstico precoz. En consecuencia, la aceptación clínica de estos indicadores aún se encuentra en estudio, con el fin de armonizar la integración de la información de evaluación clínica, junto con la función neuronal y la integridad estructural, que podría ayudar a discriminar a los pacientes que enfrentan un deterioro cognitivo inminente 15,16,20,67,68.
La técnica de dMRI por su parte, es cuestionada en mayor medida por sus limitaciones metodológicas, más que por su validez patológica, dado que los estudios son rigurosos al momento de evaluar la correlación que existe entre los resultados de las métricas de difusión y la evidencia proporcionada por la disección post-mortem de fibras de materia blanca. Los inconvenientes principales resaltados en dMRI son el problema de escala y la fidelidad en el modelamiento de las redes cerebrales 18,33. El cuestionamiento referente a la escala se da porque el modelo de difusión trata de representar un fenómeno que ocurre en un mundo micrométrico, mediante una aproximación milimétrica. Mientras, que el modelamiento de las redes cerebrales resalta la dificultad que presenta para la estimación de fibras entrecruzadas pertenecientes a distintas subredes, así como realizar un seguimiento de estas fibras hasta sus terminaciones corticales 18,37. Más allá de estas consideraciones metodológicas, y desde un punto de vista neurocientífico, dMRI ha permitido un mayor entendimiento de la estructura del sistema nervioso, si bien, aún no forma parte del arsenal clínico, se ha establecido como una nueva alternativa de investigación y educación del personal médico, que puede contribuir en una reevaluación de los modelos neurocognitivos, y en última instancia, dar lugar a cambios en la práctica clínica 19,33.
En los resultados discutidos se ha mostrado que los estudios suelen ser consistentes en sus resultados, aun así, entre ellos difieren las metodologías utilizadas, dando lugar a variabilidad en procesos y análisis. Por esta razón es también de interés en el campo de las neuroimágenes buscar la armonización de protocolos, puesto que las diferencias entre estos métodos pueden ser una de las causas en la variabilidad de los hallazgos. Estos inconvenientes son evidentes en las mediciones volumétricas de RMs, así como la estimación de los parámetros de difusión de DM y FA derivados de la dMRI, ya que, estas son sensibles a las variaciones de las configuraciones del escáner usado en cada centro de investigación. Variaciones en el contraste y la resolución de la imagen para RMs, el valor de ponderación en difusión en dMRI, o las diferentes secuencias de pulsos empleadas en la adquisición son las más comunes 33,61. Ante esta variabilidad multicéntrica, en la actualidad se propone un enfoque que puede reducir de manera efectiva estas discrepancias, este método se conoce como phantom-based standarisation. Con esta alternativa se escanea un objeto físico con geometría fija en cada centro de investigación y se utilizan los resultados de imagen para calibrar los protocolos de adquisición entre centros 32,61. Un paso adicional para reducir la variabilidad es el uso de métodos de postprocesamiento de neuroimagen uniformes, en la búsqueda de mayor homogeneidad en la corrección de los artefactos o perturbaciones encontrados con mayor frecuencia durante el proceso de adquisición.
Por otro lado, en lo que concierne al análisis, los estudios muestran un común denominador, en el que se busca establecer vínculos sólidos entre las mediciones identificadas en las diferentes modalidades de neuroimagen y los resultados clínicos. El éxito en establecer dicha relación depende del desarrollo de indicadores que muestren un tamaño de efecto grande, es decir, que soporten una mayor asociación entre las métricas de neuroimagen y la caracterización de la enfermedad en cuestión, que en consecuencia describan la importancia práctica de los hallazgos 4,5,15,38. Existen diversas métricas de análisis, entre ellas se encuentran los coeficientes de correlación (Cohen, Pearson), o también valores resultantes de pruebas estadísticas, como los valores P, t, z, entre otros. La diferencia principal entre estos radica en que los coeficientes de correlación permiten la descripción de la intensidad de un efecto, independientemente del tamaño de la muestra 70. Mientras que, los estadísticos se relacionan en mayor medida con la presencia de un efecto (significancia estadística), y no con su magnitud (tamaño de efecto), y además son dependientes del tamaño de la muestra empleada en el estudio 70. De manera que los estudios cuyos análisis se basan en dichas métricas, son más susceptibles de presentar un sesgo en sus interpretaciones, puesto que son dependientes del tamaño de la cohorte. En consecuencia, factores relacionados con el diseño del estudio, como la selección del tamaño de muestra, juegan un papel esencial tanto en la capacidad de la investigación para detectar el efecto de interés, como en la validez de los resultados, e incluso si llegasen a ser válidos desde el punto de vista numérico, se debe tener un gran cuidado al momento de interpretar los resultados para establecer una significancia clínica. En otras palabras, es posible que algunos estudios presenten significancia estadística en sus resultados si se obtiene una muestra lo suficientemente grande, incluso cuando es poco probable que el efecto de interés tenga importancia en la práctica clínica 70.
Ante esta posible introducción de sesgos durante el análisis de los resultados, un enfoque alternativo es integrar los efectos con los resultados clínicos, combinándolos en un solo modelo que permita hacer una predicción, en lugar de trabajar con pruebas estadísticas para cada vóxel por separado. Este enfoque es común en el ámbito clínico, por ejemplo, múltiples factores, como la dieta, el ejercicio y los niveles hormonales, se combinan en modelos de riesgo de enfermedad. En el caso de las neuroimágenes los modelos se estiman a partir de las mediciones realizadas sobre estas, pero el principio es el mismo. En efecto, algunos estudios recurren a modelos de regresiones multivariadas 66,67, y en la actualidad la tendencia es el uso de algoritmos de aprendizaje de máquina y de reconocimiento de patrones 68,69 para integrar la información del cerebro en los modelos predictivos. Los tamaños de los efectos se evalúan a través de la aplicación prospectiva del modelo en pacientes nuevo. De manera que, si el modelo tiene la capacidad de realizar una predicción única para cada paciente, y este se pone a prueba en muestras de pacientes independientes de las utilizadas para derivar el modelo, entonces las estimaciones del tamaño del efecto son menos susceptibles de presentar sesgo.
Teniendo en cuenta este posible déficit de aceptación clínica (y en ocasiones estadística) en los resultados de los estudios, el uso de un enfoque multimodal se plantea como una característica importante de las investigaciones más recientes 60,62,63. Su aplicación en cohortes de pacientes presintomáticos puede ayudar en la localización de regiones iniciales de alta vulnerabilidad y la posible distribución de los daños en etapas posteriores de estos trastornos, gracias a la contribución en conjunto de la información de la conectividad estructural y funcional que permiten una comprensión más amplia de los cambios y afectaciones neuronales 35,47,48,65. Así el enfoque multimodal representa una gran herramienta para el hallazgo de puntos de intervención terapéutica adecuados para que estos puedan implementarse posteriormente en ensayos clínicos de posibles fármacos o tratamientos.
Si bien los estudios revisados en este documento muestran patrones característicos de atrofia cerebral, cambios en el metabolismo de ciertas zonas de la corteza, y alteraciones en los fenómenos de difusión, para cada una de las enfermedades neurodegenerativas de interés, el impacto a un nivel macro en las propiedades organizacionales del cerebro no se suele discutir con la importancia que si se le da a un enfoque convencional basado en el análisis regional. Es por esta razón que las investigaciones recientes y futuras deben considerar la discusión tomando también otro paradigma, como la conectómica, que posibilite una perspectiva integradora de la organización topológica de la corteza cerebral y como esta es afectada por las enfermedades neurodegenerativas 9,36,38. Se parte así de un análisis regional, hacia una comprensión a mayor escala de la progresión de los trastornos.
En síntesis, el uso de las técnicas de neuroimagen tanto funcionales como estructurales, en investigaciones con individuos asintomáticos o con un estado clínico de afectación no tan severo para ser considerado demencia, como es el caso del DCL, provee una ventana temporal importante con el fin de identificar posibles anormalidades en la estructura y conectividad cerebral, que permitan predecir el advenimiento de las fases preclínicas de la EA, DFT y otras enfermedades. Asimismo, el estudio con pacientes previamente diagnosticados con EA o DFT, son de gran utilidad para comprender las regiones en las que se focaliza el daño neuronal y su posible progresión. Por último, aún se deben centrar esfuerzos en seguir evaluando y validando las métricas de estas técnicas de neuroimagen, buscando reducir las posibles discrepancias entre estudios, a través de enfoques multimodales que puedan caracterizar mejor el espectro de acción de las enfermedades, colaboraciones multicentro para enfrentar la variabilidad demográfica, y la armonización de las metodologías y parámetros de adquisición y análisis de las imágenes.
LIMITACIONES
Como todo trabajo, la presente revisión tiene ciertas limitaciones en cuanto a los temas tratados y al desarrollo de su contenido. En primera instancia la base de la revisión se da a partir de estudios observacionales retrospectivos y de estudios longitudinales (en lo que refiere a seguimiento de los pacientes por un tiempo determinado), no se han tomado en consideración estudios clínicos aleatorizados o ensayos experimentales. De manera, que los tópicos aquí discutidos no pretenden dar una asociación de causalidad, sino que se centran en mostrar las potenciales relaciones entre los biomarcadores de neuroimagen y el curso natural de los trastornos neurodegenerativos, así como su utilidad para la discriminación; Por otro lado, los estudios seleccionados no están exentos de presentar un sesgo de informe (reporting bias), pues si bien estos fueron seleccionados dado que cumplían los criterios descritos en la metodología, no es posible asegurar que la publicación de sus resultados de investigación, se hayan visto influenciados por la naturaleza y dirección de los mismos.














