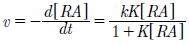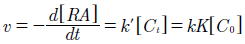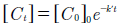1. INTRODUCCIÓN
La industria textil se ha caracterizado por crear un impacto negativo por la contaminación del medio ambiente al verter sus aguas residuales con diversos tipos de colorantes; poniendo así en riesgo la flora y la fauna de la región y hasta la salud humana1), (2. Uno de estos colorantes es el rojo de alizarina, Fig. 1, una antraquinona altamente soluble en agua, contaminante recalcitrante y duradero, sintetizado por sulfonación de alizarina3.
La contaminación del agua por colorantes ha obligado a la búsqueda intensiva de mejores tecnologías de tratamiento, sin embargo, los métodos convencionales son poco prácticos a la hora de eliminar contaminantes orgánicos y aquellos métodos que han mostrado cierto grado de eficiencia, resultan ser altamente costosos, debido a la compra periódica de reactivos y a la generación de lodos que deben ser tratados posteriormente4. Con el fin de optar por nuevos métodos, se han estudiado diversas alternativas para realizar la degradación de colorantes orgánicos, entre ellos se encuentran los procesos de oxidación avanzada5-7. En estos procesos se produce el radical hidroxilo, un poderoso oxidante que garantiza mayor y mejor depuración de las aguas contaminadas8.
Entre los procesos de oxidación avanzada se encuentra el proceso Fenton, a través de este método se puede eliminar una amplia variedad de contaminantes orgánicos, debido a la oxidación del ion Fe(II) a Fe(III), descomponiendo a su vez el peróxido de hidrógeno (H2O2) y produciendo radicales hidroxilo9. La velocidad de esta reacción se puede optimizar si emplea radiación UV/visible, este método es conocido como proceso foto-Fenton10; este tipo de reacciones ofrece la posibilidad de utilizar la radiación solar como fuente primaria de energía, lo que le otorga al proceso un significativo valor ambiental. Una desventaja que se ha presentado durante la implementación de este proceso es el uso del catalizador en forma de polvo, lo que hace que se deba realizar un proceso posterior para la recuperación del catalizador11), (12. En este trabajo utilizamos la modalidad de películas delgadas de tetracarboxifenilporfirina de hierro (III) adsorbida sobre el dióxido de silicio con el fin de estudiar la decoloración del rojo de alizarina, mediante un proceso foto-Fenton heterogéneo inducido con luz visible, recuperando de manera fácil y rápida el fotocatalizador para su posterior reutilización.
2. METODOLOGÍA
2.1 Reactivos y equipos
Todos los reactivos usados en este trabajo fueron de grado analítico, los espectros UV-Vis fueron medidos en un espectrofotómetro Hewlett-Packard 8453. Los espectros FT-IR (KBr) fueron medidos en un espectrómetro Bruker Tensor 27. Los espectros de fluorescencia fueron medidos en un espectrofluorímetro Shimadzu RF-5301PC.
2.2 Preparación y caracterización del catalizador
Para la síntesis de la tetracarboxifenilporfirina se añadieron 30 mmol de pirrol previamente destilado a una mezcla de 4-carboxibenzaldehido (30 mmol), ácido propíonico (105 mL) y nitrobenceno (45 mL). La mezcla fue calentada a 120˚C durante 1 h. El solvente se removió por destilación al vacío y el sólido obtenido se disolvió en solución de NaOH (0,1 M). La porfirina se precipitó con una solución de HCl 1M, se disolvió en etanol y se cristalizó por evaporación del solvente13.
La metaloporfirina se preparó colocando en contacto la TCPP (0.33mmol) con 1.82 mmol de cloruro de hierro (III) a reflujo, en N,N’-dimetilformamida (70 ml) durante 2 h. La N,N’-dimetilformamida fue removida por destilación y el sólido obtenido fue disuelto en solución de NaOH (0,1 M). La TCPPFe (III) se precipitó con una solución de HCl 1M. Finalmente se filtró la porfirina y se secó a temperatura ambiente14. El fotosensibilizador fue caracterizado por espectrofotometría UV-Vis e IR-FT.
El SiO2se preparó según el procedimiento reportado en la literatura15. Se colocó 10 mL de tetraetoxisilano (TEOS) a reflujo por 4 horas en 100 mL de una solución de agua/etanol absoluto (1/8 molar) a pH=3 (ajustado con HNO3) a 60˚C con agitación magnética. Posteriormente, se adicionó etanol absoluto (10 mL) y se aumentó la temperatura a 76˚C manteniendo reflujo durante 24 h. La muestra se rotoevaporó y el sólido calcinado se dejó en atmósfera de aire durante 4 h a 450˚C.
La adsorción de la TCPPFe en la superficie de SiO2se realizó colocando en suspensión 8.3 mmol de SiO2en 250 mL de una solución 0,4 M de TCPPFe (pH>10) durante 1h. Posteriormente, el pH se ajustó a 3,0 con una solución 0,1N de H2SO4. Después se filtró el sólido, se lavó con agua destilada y se dejó secar a temperatura ambiente11. La TCPPFe adsorbida sobre SiO2fue analizada por reflectancia difusa.
Las películas delgadas se prepararon a través de una suspensión de TCPPFe (III)/SiO2mezclando 0.30 g de la porfirina previamente macerada en un mortero durante 15 min con 0.60 g polietilenglicol-PEG, y 2.00 mL de isopropanol; la mezcla se mantuvo en agitación por 1 h. La suspensión obtenida fue colocada sobre un substrato de vidrio (sílice) utilizando la técnica Doctor Blade. La película se pre-calentó durante 30 minutos a 120°C, con el fin de evaporar el disolvente y formar la película sobre vidrio, luego se sometió a un proceso de calentamiento constante durante 1 h a 220°C para la obtención de una película más fina en nuestro substrato.
2.3 Detección del radical hidroxilo
Para la generación de radical hidroxilo, se utilizó 10 mL de una solución de 500 ppm de ácido tereftálico a pH=3 la cuál posteriormente se le fue adicionado 0.200 mL de H2O2. La solución anterior conteniendo la película delgada de TCPPFe(III)/SiO2fue irradiada con luz visible. La formación del radical hidroxilo fue detectada monitoreando el espectro de emisión de fluorescencia del ácido 2-hidroxitereftálico (excitacion a 315 nm)16.
2.4 Fotodecoloración del rojo de alizarina
En un foto-reactor tipo batch fue llevada a cabo la oxidación del colorante11. Este equipo cuenta con el espacio necesario para la instalación de las películas de TCPPFe(III)/SiO2donde se puso en contacto con la mezcla que contenía el rojo de alizarina. A esta solución se añadieron 200 μL de peróxido de hidrógeno y se irradió con luz visible; posteriormente se tomaron diferentes muestras en diversos tiempos para realizar el seguimiento de la degradación del colorante. Las reacciones fueron llevadas a cabo a una temperatura de 25°C.
3. RESULTADOS Y DISCUSIÓN
3.1 Caracterización del catalizador
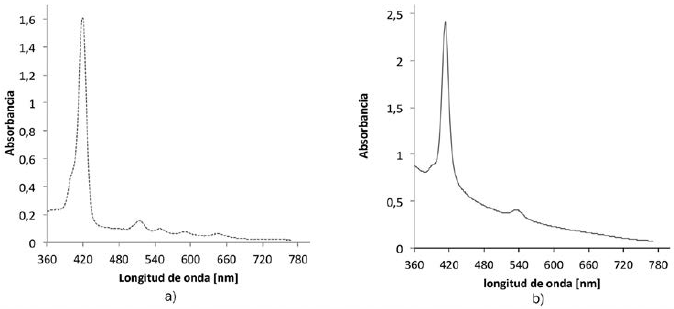
El espectro UV-vis de la TCPP obtenido en este trabajo se muestra en la (Figura 2a), en él se observa la banda de absorción Soret a 419 nm (transición a1u(π)-eg*(π)), y 4 bandas Q (514, 548, 588 y 645 nm) características de la porfirina no metálica, correspondientes a transiciones a2u(π)-eg*(π)17.
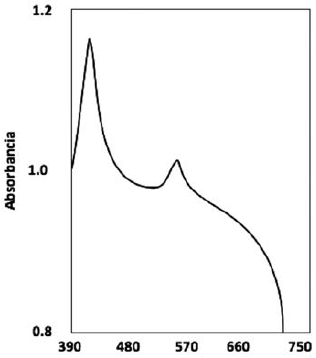
El espectro UV-vis de la TCPPFe (Figura 2b) exhibe la banda Soret a 413 nm y 1 banda Q en 534 nm. La disminución del número de bandas Q es típica de las metaloporfirinas. Cuando el ión metálico se coordina con los átomos de nitrógeno del macrociclo, la simetría de la molécula se incrementa y el número de bandas Q decrece15. La metalación de las porfirinas produce desplazamiento de las bandas Soret y Q por la interacción del metal con la nube electrónica π de los macrociclos. En el espectro de la TCPPFe se observa un desplazamiento de las bandas de absorción hacia el azul, posiblemente debido a la desestabilización de la nube electrónica π del ligando inducida por el metal e incremento de la energía de transición18. La figura 3 muestra el espectro de reflectancia difusa de la TCPPFe(III)/SiO2. Las bandas de absorción de TCPPFe adsorbida sobre SiO2son anchas y de menor intensidad con respecto al espectro de TCPPFe (III), y muestran un corrimiento hacia la región del rojo que puede atribuirse a la distorsión de los anillos de porfirina; el desplazamiento hacia el rojo generalmente se observa cuando las porfirinas son inmovilizadas sobre soportes inorgánicos19), (20. En el caso de la TCPPFe (III) adsorbida al SiO2, la banda Soret es desplazada de 419 a 427 nm mostrando un corrimiento hacia el rojo y la banda Q de igual manera es desplazada de 534 a 542 nm.
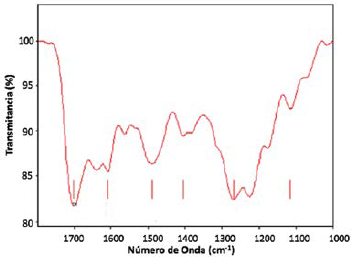
El espectro FTIR (1700-1200 cm-1) de la TCPP se muestra en la (Figura 4). La banda característica del grupo ácido carboxílico, (C=O) se observa en torno a 1701 cm-1. Los modos de tensión C-O se observan entre 1225 cm-1y 1268 cm-1, la tensión N-H en el plano se observó en la región de los 1115 cm-111. El espectro IR-FT de la TCPPFe es similar al de la TCPP.
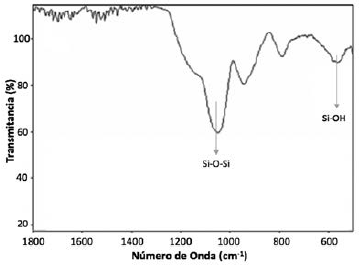
La TCPPFe puede adsorberse a la superficie del SiO2a través de los ácidos carboxílicos21. Se observó una desaparición significativa en la intensidad de las bandas correspondientes a los grupos carboxilato en el espectro IR-FT (Figura 5). No es posible distinguir el tipo de interacción existente entre la TCPPFe y el SiO2debido que en la región de 1000 y 1500 cm-1aparece una banda ancha e intensa asociada a la vibración del grupo siloxano (Si-O-Si) que solapa las bandas del carboxilato.
3.2 Detección del radical hidroxilo
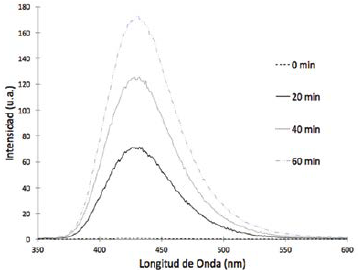
Para la detección del radical hidroxilo utilizamos la medida del espectro de fluorescencia del producto formado entre la reacción de oxidación del ácido tereftálico y el radical hidroxilo16. El espectro de emisión fluorescente de la solución se midió durante varios tiempos del proceso de iluminación con luz visible. La Figura 6 muestra el espectro de fluorescencia del compuesto generado, 2-hidroxitereftálato. Esta figura muestra un aumento de la banda de emisión máxima del ácido 2-hidroxitereftálico con el tiempo de reacción. Estos resultados corroboran que los radicales hidroxilos fueron generados por el TCPPFe/SiO2bajo irradiación con luz visible.
3.3 Fotodecoloración del rojo de alizarina
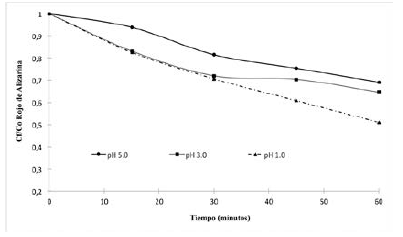
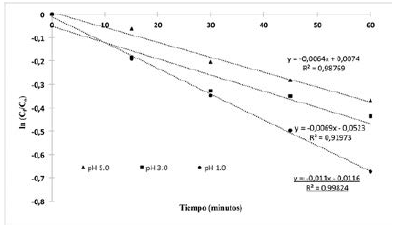
Las pruebas fotocatalíticas se llevaron a cabo variando el pH (1, 3 y 5) a temperatura ambiente (25°C). Los resultados obtenidos se muestran a continuación en la Figura 7.
Los resultados, demuestran que el pH influye en la fotodecoloración del rojo de alizarina. En la figura 7 se observa que, a valor más bajo de pH, mayor es la decoloración, esto debido a que a valores de pH bajos se beneficia la generación de radicales hidroxilo. Con base en los resultados mostrados en la figura 6 se hizo el cálculo de la velocidad de reacción a partir de los resultados experimentales obtenidos de la fotodecoloración de rojo de alizarina a un pH=1. La adsorción y la tasa de foto-mineralización de azul de metileno se siguió al modelo de cinética de Langmuir-Hinshelwood22.
Dondeves la tasa de mineralización del colorante,kes la constante de velocidad, [RA] es la concentración de rojo de alizarina, yKes el coeficiente de adsorción. La ecuación (1) se puede resolver explícitamente para (t) para usar cambios discretos en [RA] desde la concentración inicial hasta un punto de referencia cero. En nuestro caso puede suponerse un modelo aparente de primer orden:
El resultado de la integración entre las ecuaciones 1 y 2:
Donde el tiempo (t) en minutos yk’es la constante de velocidad de reacción aparente (min-1); el modelo de pseudo-primer orden se ha utilizado en varios estudios para caracterizar el efecto de diferentes condiciones experimentales sobre la tasa de degradación [23-24]. La figura 8 muestra que el proceso de oxidación se ajusta a una cinética de pseudo-primer orden, los resultados indican que el mayor valor de la constante de velocidad de fue de 1.1x10-2min-1para un pH de 1.0.
La fotodecoloración del rojo de alizarina puede deberse al proceso de degradación de este colorante mediante un proceso secuencial en el cual se ven presentes la formación de varios productos intermedios. En este proceso foto-Fenton se propone un esquema de reacción similar al reportado porZuccay colaboradores reportando anteriormente en la degradación de fenol por este mismo catalizador, pero en polvo: (1) TCPPFe (con estado de oxidación: III) absorbe la radiación en la región visible del espectro, (2) El hierro se reduce de Fe3+a Fe2+e (3) inmediatamente el Fe2+interactúa catalíticamente con H2O2que produce radicales hidroxilo. Después, (4) los radicales hidroxilo reaccionan con el rojo de alizarina generando derivados de antraquinona. La reacción en cadena prosigue hasta la formación de estructuras de cadena corta como ácido ftálico. (5) Por último, estos compuestos se descomponen en agua y dióxido de carbono25.
4. CONCLUSIONES
Nosotros hemos utilizado películas delgadas de TCPPFe (III) adsorbidas sobre SiO2como catalizador de la reacción de fotodecoloración del rojo de alizarina bajo una reacción tipo foto-Fenton inducida por luz visible. Una de las mayores ventajas de este sistema es que la reacción es eficiente bajo luz visible, además el catalizador puede reutilizarse. La prueba de atrapamiento químico del ácido tereftálico logró evidenciar la generación de radical hidroxilo. Finalmente, se encontró que el pH óptimo para la reacción es de 1.0, con una constante de velocidad de reacción de 1.1x10-2min-1.