1. INTRODUCCIÓN
La región amazónica compone el 45% del bosque tropical y en Colombia los departamentos de Amazonas, Caquetá y Putumayo constituyen el 3% de la Amazonía. Los componen tes físicos y bióticos, resultado de los procesos evolutivos, biogeográficos y ecológicos, incluyen áreas como el piedemonte andino en Putumayo y Caquetá [1]. Esta región posee la mayor tasa de deforestación en el mundo y la pérdida de la biodiversidad, es uno de los problemas más graves que presenta [2]. Los procesos de colonización, la expansión de la frontera agrí cola y ganadera, cultivos de uso ilícito, explotación de petróleo y la ocupación no planificada, han transformado los paisajes y reducido la cobertura vegetal [1].
Los cambios de cobertura vegetal alteran las propiedades de los ecosistemas y los bienes y servicios que estos ofrecen a los seres humanos; también afectan la abundancia, composi ción, la distribución de organismos y sus funciones [3]. La co bertura incide en el microclima, por ejemplo, en los bosques la humedad es mayor y la temperatura es menor, en compara ción con las zonas abiertas [4]. Además de la heterogeneidad del hábitat, las condiciones macro y microclimáticas también van a variar según los factores biofísicos, tales como: la pen diente, la elevación y el sustrato [5].
El clima ejerce efectos fisiológicos en las especies ectotérmicas, relacionados con el balance hídrico y el equilibrio tér mico; los factores abióticos, como la temperatura, inciden en la distribución y abundancia de los insectos, por tanto, aque llos que son capaces de tolerar las variaciones térmicas, logran competir exitosamente con otros organismos del ecosistema [6], mientras que los que son sensibles a las temperaturas ex tremas, esta se convierte en un factor limitante [7], debido a que bajo estas condiciones pueden perder agua, llevándolos a la desecación y restringen su capacidad para regular la temperatura corporal [6]. Teniendo en cuenta que las variaciones de la temperatura también interrumpen la supervivencia de los insectos, estos tienen algunas características, como: con tenido de agua del cuerpo, grosor de la capa lipídica, compo nentes químicos cuticulares específicos para protegerse. En el caso de las hormigas usan hidrocarburos cuticulares (CHC) en la superficie de su cuerpo para responder a estas variaciones, ya que, actúan como barrera para la desecación [8].
Algunas especies de hormigas pueden adaptarse a zo nas donde las temperaturas oscilan; se ha determinado tam bién que, la temperatura ambiental ejerce un papel impor tante en el comportamiento de búsqueda de alimento [9] y que, el calentamiento climático podría generar cambios en las interacciones competitivas entre hormigas; se estima que a futuro la competencia por alimento entre especies dismi nuya en áreas de temperatura intermedia [10]. También se ha determinado en hormigas que, dependiendo de cada es pecie, su éxito competitivo es mayor cuando la temperatura ambiental o la humedad del aire se encuentran dentro de los límites óptimos, respecto a que estas condiciones no son to talmente adecuadas [11].
Las hormigas se consideran bioindicadoras, porque su respuesta a las perturbaciones es predecible, rápida y anali zable; son abundantes, fáciles de encontrar en campo, su ta xonomía es bien conocida y la identificación es relativamen te fácil [12]; actúan como ingenieros del ecosistema, influyen en los procesos biogeoquímicos, afectando la disponibilidad de recursos, los flujos de materiales, las condiciones de hu medad y temperatura del suelo, perturbando a otros orga nismos, porque controlan la disponibilidad de recursos que ellos usan, como energía, materiales, espacio, organismos para su alimento, o la combinación de todos, sin embargo, para otros, los efectos son positivos, ya que crean nuevas oportunidades ecológicas [13].
Aunque se han realizado muchas investigaciones en hor migas, existen muchos vacíos sobre este grupo en la región amazónica [2], lo que hace complejo proponer estrategias de conservación acordes a la región del piedemonte amazónico [14] que permitan mantener la diversidad local y global [15]. Para entender las causas que realmente estructuran las co munidades de hormigas, es importante estudiar los factores abióticos en los que se incluyen: la temperatura y la humedad [2], por ello, en este trabajo se evaluó el efecto de estas varia bles ambientales en el ensamblaje de hormigas, valorando la hipótesis: el ensamblaje de hormigas de bosque y de pastizal reflejan los cambios de las variables ambientales (temperatura ambiente, temperatura del suelo y humedad relativa).
2. MÉTODOS
2.1 Área de estudio
El estudio se realizó en la vereda Altamira, municipio de Orito, departamento del Putumayo, ubicado en las coordenadas 0°37'59.9''N, 76°52'31.50'' W. Altitud media 455 m.s.n.m., con temperatura media anual de 24.7°C y la precipitación alrededor del 3348 mm. El bosque secundario ocupa tres hectáreas aproximadamente; la vegetación está representada por: Terminalia amazónica, Cecropia peltata, Oligantis discolor, Caryocar glabrum, Iriartea deltoidea, Picus crassiuscula y Ocotea javitensis. La matriz se caracteriza por contener pastos y algunos arbustos de Theobroma cacao, que ya no están siendo cultivados.
2.2 Sitios de muestreo y trabajo con hormigas
Durante un periodo de seis meses se visitó el fragmento de bosque secundario y la matriz, una vez por mes. Por sitio se trazó un transecto lineal de 100 m, separados por 250 m. En cada transecto se ubicaron 10 estaciones separadas entre sí por 10 m; para evitar el efecto de borde en el bosque, se ubicó el trasecto a una distancia de 20 metros del borde. Se implementaron seis técnicas de muestreo en cada estación: cebos alimenticios, los cuales consisten en vasos desechables pequeños provistos en su interior de atún con azúcar: 1. ubica dos en troncos de árboles a 1.50 m de altura en el fragmento de bosque y en los arbustos en la zona de pastizal; 2. trampas hipogeas enterradas aproximadamente a 10 cm de profundi dad, y 3. trampas epígeas en la superficie del suelo. Las hormi gas capturadas en los cebos se colectaron después de cuatro horas [16]. 4. colecta manual, entre trampa y trampa se realizó, en un tiempo fijo de 10 minutos/hombre en sitios como la hojarasca, troncos caídos y bajo las piedras [17] para un total aproximado de dos horas y media - hombre por transecto. 5. colecta de hormigas en hojarasca se hizo en cada estación, uti lizando una cuadrícula de 1m de lado [16], los especímenes se extrajeron mediante sacos winkler, expuestos durante 60 ho ras. 6. trampas de caída o pitfall, se instalaron vasos desecha bles de 14 onzas a ras del suelo y se llenaron con alcohol al 70% hasta un tercio de su capacidad. Las hormigas que forra jean sobre la superficie del suelo, en el día o durante la noche, caen por accidente en el vaso [18]. Las hormigas que cayeron en estas trampas fueron colectadas después de 24 horas [19].
En cada hábitat se midió, por mes y estación, la tempe ratura a nivel del suelo, usando un termómetro y, la tempe ratura ambiente y la humedad relativa utilizando un termohigrómetro. Los equipos se dejaron durante tres minutos para luego hacer la lectura respectiva. Para disminuir los sesgos debido a las fluctuaciones diarias de temperatura y humedad se hicieron dos tomas en cada estación, en la mañana, al instalar las estaciones y en horas de la tarde [20].
2.3 Trabajo de laboratorio
Los especímenes se preservaron en frascos con alcohol al 70% y se rotularon debidamente; la identificación se hizo con las claves taxonómicas del libro Hormigas de Colombia [21]. Los especímenes colectados se depositaron en la co lección de entomología de la Universidad de Nariño.
2.4 Análisis de datos
La abundancia de cada especie de hormiga se estimó como eventos de captura [22] y no con el número de indi viduos. Se determinó la diversidad verdadera de orden 1(1D), en cada hábitat con el programa EstimateS versión 9.1 [23] y se comparó que tan diferente es la diversidad entre el bosque y la matriz de pastizal, con la ecuación (1) da = D A /D B , donde, D. diver sidad de la comunidad del bosque y DB diversidad de la matriz; entonces, la comunidad A tendrá DA/DB veces más diversidad que la comunidad B [24]. Se realizó la prueba T-Student con los datos de riqueza por estación, usando el programa Excel.
La diversidad verdadera de orden 1(1D) y riqueza de cada estación calculadas en cada mes de muestreo, se usaron posteriormente para analizarlas con los promedios de las variables ambientales (temperatura ambiente, temperatura del suelo y humedad relativa), tomadas en cada estación, mediante el análisis de regresión, debido a que los datos se justaron a una distribución normal; dicho análisis se hizo por medio del programa Excel.
Con el análisis de componentes principales se calcularon los propios vectores y propios valores, usando los datos de las morfoespecies encontradas y los promedios de las varia bles ambientales a través del programa R commander [25].
3 RESULTADOS
3.1 Composición general de la mimercofauna
Se colectó en total de 118 morfoespecies, representadas en 8 subfamilias y 41 géneros. En la actualidad se presenta el reporte de 1166 especies, 11 subfamilias y 105 géneros para Colombia, representando el 81% de géneros y el 34% de espe cies en el Neotrópico [21]. Si estos datos permanecen cercanos a esta cifra, las 118 morfoespecies encontradas en este estu dio, representarían 3.47% en especies, el 72.72% en familias y el 31.78% de los géneros para el Neotrópico.
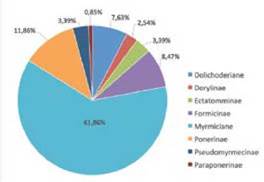
En orden de riqueza las subfamilias encontradas fueron: Myrmicinae, Ponerinae, Formicinae, Dolichoderinae; Ectatomminae y Pseudomyrmecinae y obtuvieron el mismo porcentaje de riqueza, consecutivamente siguió Dorylinae y por último Paraponerinae, con su única especie Parapo nera clavata,Fig. 1.
Fuente: Los autores.
Fig. 1 DISTRIBUCIÓN TAXONÓMICA POR SUBFAMILIA DEL TOTAL DE LAS ESPECIES DE HORMIGAS ENCONTRADAS DURANTE EL ESTUDIO
La subfamilia Myrmicinae fue la de mayor representa ción con 18 géneros y 73 especies, la dominancia de esta sobre las demás se debe a su diversidad de hábitos [26] y diversidad taxonómica [21], seguida por las subfamilias Ponerinae con 9 géneros y 14 especies, formicidae con 4 géneros y 10 especies, Dolichoderiane con 4 géneros y 9 especies, Ectatomminae y Pseudomyrmicinae con 1 género y 4 especies, Dorylinae con 3 géneros y 3 especies, y Para-Ponerinae con su único género y especie. Las subfamilias Ponerinae y Formicinae, resultaron ser las más dominantes en especies, después de Myrmicinae, porque son cosmopo litas [21]. Las subfamilias se distribuyeron tanto en el frag mento de bosque como en la matriz.
3.2 Especies compartidas y exclusivas entre los sitios de estudio
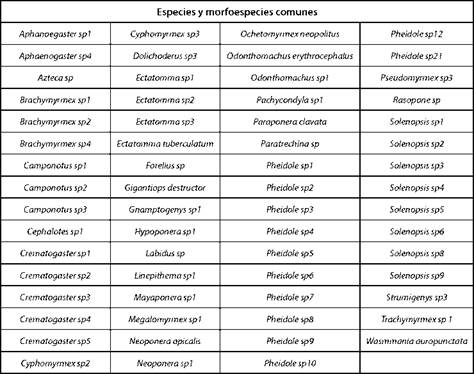
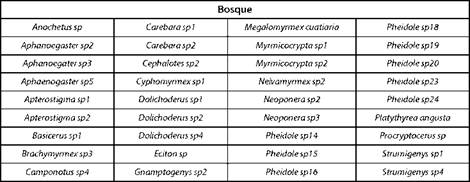
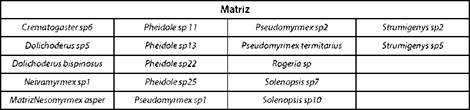
El bosque y la matriz compartieron 63 taxas (Tabla I); el bosque tuvo 38 especies exclusivas (Tabla II) mientras que, el potrero 17 (Tabla III).
Con respecto a los géneros encontrados, Aphaenogaster y Nesomyrmex no se registran para el departamento del Putumayo [27] y se ha estudiado poco sobre la biología de estos [21]. Teniendo en cuenta la distribución de los gé neros en el fragmento de bosque y la matriz, se encuen tran algunos que, por haber sido capturadas las especies de estos grupos con frecuencias bajas (1-3) es difícil decir que, están restringidas a un hábitat en particular, como son: Anochetus, Basicerus, Carebara, Eciton, Myrmicocrypta, Platythyrea y Procryptocerus ubicadas en el bosque, y Nesomyrmex y Rogeria encontradas en la matriz. No hay pu blicaciones sobre la biología de Rogeria, sin embargo se sabe que prefieren los bosques y que se distribuyen des de los 100 hasta los 1200 metros de altitud [21]. El género Apterostigma se encontró únicamente en el bosque y con mayor frecuencia, respecto a las demás. Aphaenogaster, Azteca, Brachymyrmex, Camponotus, Cephalotes, Ochetomyrmex, Crematogaster, Cyphomyrmex, Dolichoderus, Ectatomma, Forelius, Gigantiops, Gnamptogenys, Hypoponera, Labidus, Linepithema, Mayaponera, Megalomyrmex, Neivamyrmex, Neoponera, Odonthomachus, Pachycondyla, Paraponera, Paratrechina, Pheidole, Pseudomyrmex, Rasopone, Solenopsis, Strumigenys, Trachymyrmex y Wasmmania, aparecieron en los dos sitios estudiados.
Según la distribución de las hormigas que fueron iden tificadas hasta especie, se encontró que: Megalomyrmex cuatiaria y Platythyrea angusta se colectaron únicamente en bosque, pero no se puede afirmar que están restringi das a ese hábitat, porque su frecuencia de captura fue de 1. La misma situación sobre frecuencias bajas ocurrió con las especies encontradas en la matriz: Nesomyrmex asper con frecuencia de 1, y Dolichoderus bispinosus y Pseudomyrmex termitarius, con frecuencias de 5 y 4, respectivamen te; Ochetomyrmex neopolitus, Ectatomma tuberculatum, Gigantiops destructor, Neoponera apicalis, Odonthomachus erythrocephalus, Paraponera clavata y Wasmmania auropunctata, se distribuyeron en los dos hábitats estudiados.
3.3 Índices de diversidad y riqueza de hormigas en el fragmento de bosque de piedemonte amazónico y en la matriz de pastizal
El bosque presentó una riqueza de 101 especies y di versidad verdadera de orden 1 1D = 45.8 especies efectivas, mientras que, la matriz mostró una riqueza de 80 especies y diversidad verdadera de orden 1 1D = 33.3 especies efecti vas; a partir de los datos de diversidad verdadera, se concluye que, el bosque es 1.37 veces más diverso en especies efectivas de hormigas que la matriz de pastizal. La prueba de T-Student mostró que, existen diferencias significativas entre las riquezas por estación entre el bosque y la matriz (t (10) = 2,26; p=0.025).
3.4 Relación de las variables ambientales (temperatura del suelo, temperatura ambiente y humedad relativa) con el ensamblaje de hormigas en el fragmento de bosque y en la matriz
En el bosque el modelo de regresión probado con las va riables ambientales estudiadas solo explica el 13.57% de la varianza de la riqueza por estación (R2 ajustado: 0,1357) y se encontró que no hubo relación entre las variables medidas, temperatura ambiente (P 0,919572664 > P 0.05), humedad relativa (P 0.270781949 > P 0.05) y temperatura del suelo (P 0.201622127 > P 0.05); la diversidad por estación estuvo explicada por el 12.75% de la varianza (R2 ajustado: 0,1275) y no se relacionó con las variables, temperatura ambiente (P 0,950528545 > P 0.05), humedad relativa (P 0,302532975 > P 0.05) y temperatura del suelo (P 0,162983196> P 0.05).
En la matriz la varianza de la riqueza por estación, se expresó en un 8.19% ((R2 ajustado: 0,0819 y no se relacionó con las variables temperatura ambiente (P 0,141890427 > P 0.05), humedad relativa (P 0.99119509 > P 0.05) y tempe ratura del suelo (P 0.097336702 > P 0.05); la varianza de la diversidad se reflejó por el 7.97% (R2 ajustado: 0,0797) y no hubo asociación con las variables, temperatura ambiente (P 0,136654968 > P 0.05), humedad relativa (P 0,991785671 > P 0.05) y temperatura del suelo (P 0,115528654 > P 0.05).
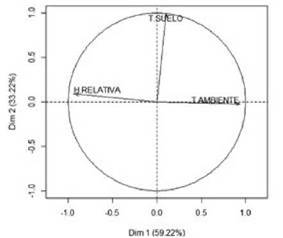
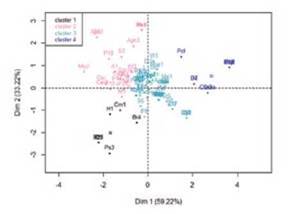
En el bosque, el análisis de componentes principales para las especies de este hábitat mostró que, los valores propios del primer componente explican el 59.22% de las variables, el se gundo componente el 33.22%, para un valor acumulado entre los dos, del 94.28% y el tercer componente explicó el 7.56%. Los tres componentes explicaron el 100% de las variables.
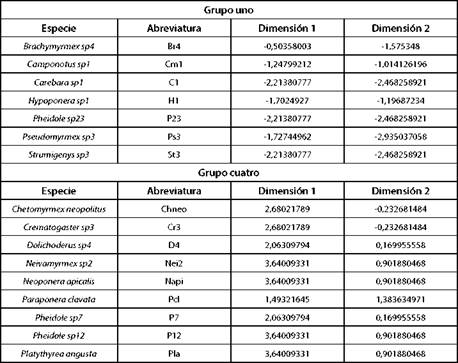
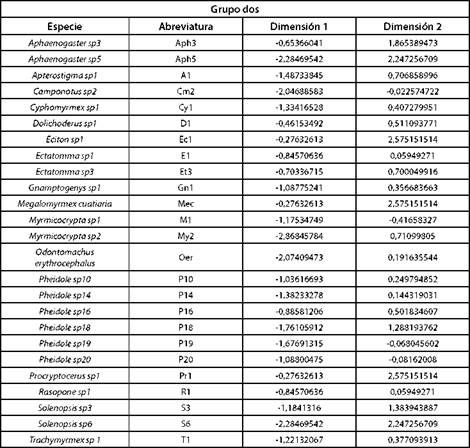
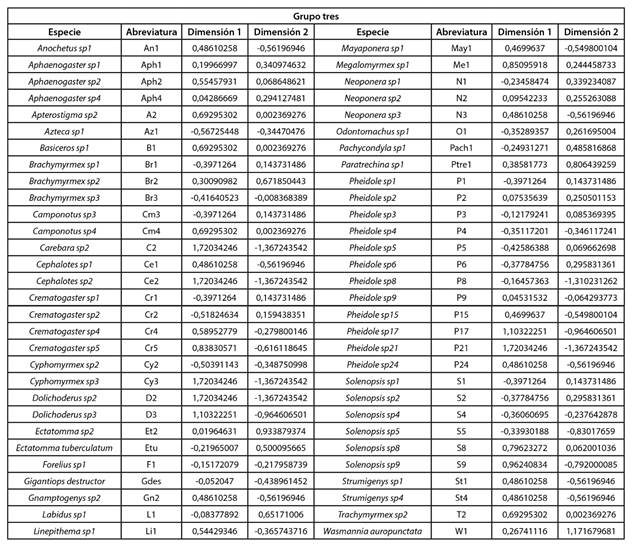
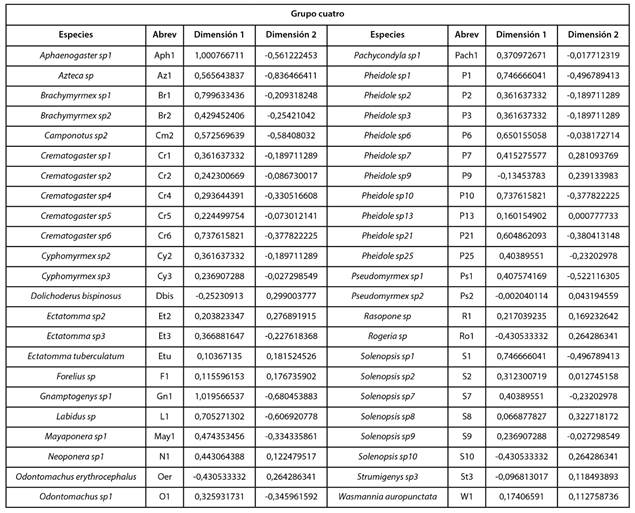
El análisis aisló los datos en cuatro componentes (clúster): 1, 2, 3 y 4. Al superponer el círculo de correlaciones, Fig. 2 y el plano principal, Fig. 3 indicaron que, las especies del grupo uno, como se muestra en la Tabla IV, se diferen cian al resto de especies, respecto a las características am bientales porque están asociadas a valores de humedad relativa más alta y temperatura del suelo más bajas, mien tras que, las hormigas del grupo dos, como se muestra en la Tabla V, se asociaron a valores de humedad relativa y temperatura ambiente parecidos. Las hormigas del grupo 3, como se muestra en la Tabla VI, estuvieron vinculadas con va lores de temperatura ambiente, humedad relativa y tempera tura de suelo semejantes y las especies del grupo cuatro, como se muestra en la Tabla VII, se asociaron con valores de tempera tura ambiente más altas con respecto a las demás especies del bosque; Paraponera clavata se diferencia del grupo porque se asociaron a valores de humedad relativa y temperatura del suelo más altas, 70% y 21.98 °C respectivamente.
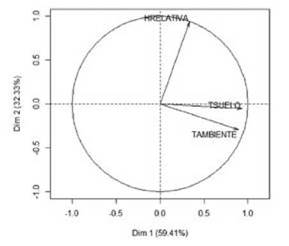
En la matriz el análisis de componentes principales para las especies de este hábitat indicó que, los valores propios del primer componente explican el 59.41% de las variables, el se gundo componente el 32.33%, para un valor acumulado entre los dos del 91.74%, y el tercer componente explica el 8.26%. Los tres componentes explicaron el 100% de las variables.
TABLA IV GRUPO UNO (HORMIGAS ASOCIADAS A VALORES DE HUMEDAD RELATIVA ALTAS Y TEMPERATURA DEL SUELO BAJAS ) Y GRUPO CUATRO (HORMIGAS ASOCIADAS A VALORES DE TEMPERATURA AMBIENTE ALTAS)
Fuente: Los autores.
TABLA V GRUPO DOS: HORMIGAS ASOCIADAS A VALORES DE HUMEDAD RELATIVA Y TEMPERATURA AMBIENTE PARECIDOS
Fuente: Los autores.
TABLA VI GRUPO TRES: HORMIGAS ASOCIADAS CON VALORES DE HUMEDAD RELATIVA Y TEMPERATURA DEL SUELO SEMEJANTES
Fuente: Los autores.
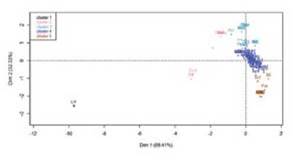
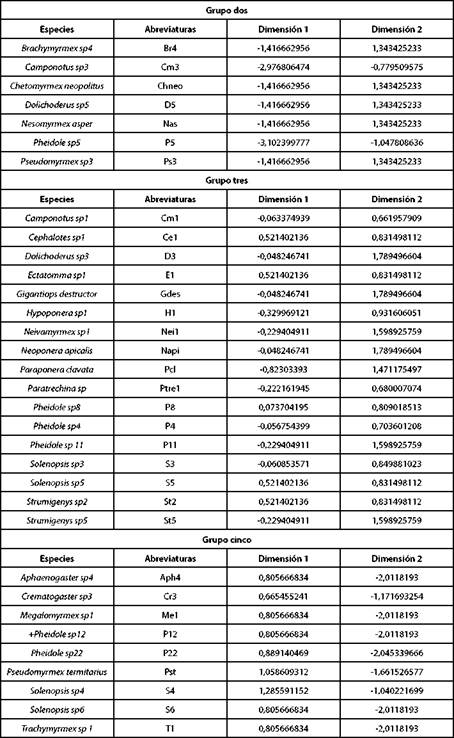
El análisis separó los datos en cinco grupos: 1, 2, 3, 4 y 5; el primer grupo representado por Linepithema sp1 (Li1). Al superponer el círculo de correlaciones, Fig, 4 y el plano principal Fig. 5, indicaron que, Linepithema sp1 es totalmen te distinta del resto, porque acepta valores de 20,12 °C de temperatura ambiente, 47% de humedad relativa y 16 °C de temperatura de suelo, siendo estos inferiores a los ad mitidos por las demás especies encontradas en la matriz; el grupo dos (Tabla VII), estuvo asociado a valores promedio de 20 °C en temperatura de suelo, mientras que, las demás especies mayores a 22 °C. Las hormigas del grupo tres (Ta bla VII), estuvieron asociadas a valores de humedad relativa afines; las del grupo cuatro (Tabla VIII) estuvieron vincula das con valores de temperatura ambiente, humedad rela tiva y temperatura de suelo semejantes, marcadas por pro medios similares en humedad relativa y las hormigas del grupo cinco (Tabla VII), se asociaron a valores parecidos de temperatura ambiente, con relaciones cercanas en valores de humedad relativa y temperatura del suelo.
4. DISCUSIÓN
Respecto a la riqueza de especies y diversidad se en contró relación entre el estado de conservación, guardan do similaridad con los trabajos de Abadía et al. [28] y el de Sanabria y Chacón [29]; en el primero encuentran mayor riqueza en los bosques, respecto a los pastizales, debido a que, las hormigas dependen de la cobertura boscosa, por que les ofrece más sitios de nidificación, y en el segundo, la mayor diversidad se encuentra en el sistema agroforestal, explicado por la preferencia de las hormigas a los hábitats de cobertura boscosa, variedad de sustratos para anidar (suelo, hojarasca y troncos caídos), microclima constante y mayor oferta de recursos alimenticios, y difiere con el estu dio de Tiede et al. [30], los cuales identifican que la riqueza de especies no cambia con la degradación del bosque.
TABLA VII GRUPO DOS (HORMIGAS ASOCIADAS A VALORES DE TEMPERATURA DE SUELO SIMILARES), GRUPO TRES (HORMIGAS ASOCIADAS A VALORES DE HUMEDAD RELATIVA AFINES) Y GRUPO CINCO (HORMIGAS ASOCIADAS A VALORES DE TEMPERATURA AMBIENTE PARECIDOS)
Fuente: Los autores.
TABLA VIII GRUPO CUATRO: HORMIGAS ASOCIADAS A VALORES DE HUMEDAD RELATIVA, TEMPERATURA AMBIENTE Y TEMPERATURA DEL SUELO SEMEJANTES
Fuente: Los autores.
Las diferencias de riqueza por estación entre el bosque y la matriz, probablemente son causadas por la cobertura y diversidad vegetal, por el tipo de suelo y la presencia de es pecies no nativas [31], por la disponibilidad de recursos [32] o por la competencia entre especies [33]. Para establecer si las variables mencionadas determinan estas discrepancias, es necesario el trabajo en campo con cada una de ellas, en los mismos sitios analizados en esta investigación.
El fragmento de bosque y la matriz son sitios parecidos en cuanto a su composición de hormigas, posiblemente por la dominancia de especies generalistas, que ingresan desde el pastizal a usos de suelo con presencia de árboles [34], los cuales les proveen diferentes sitios de nidificación [28], así mismo las especies generalistas tienen una mayor tasa de colonización de fragmentos pequeños [35]. La similaridad en la composición probablemente también se pre sentó, porque la matriz puede influir lo que sucede en los fragmentos y a su vez estos repercuten en lo que acontece en la matriz, por ello, para algunas especies este tipo de uso de suelo puede proveer recursos alimenticios que en los fragmentos de bosque son limitados, y para las especies que habitan los fragmentos hay otra fuente de recursos en la matriz [36]. La exclusividad de especies de hormigas, tan to en bosque como en el pastizal, coincide con las de Galle go y Salguero [37], quienes encuentran un mayor número de especies exclusivas en bosque con respecto a la matriz, resaltando la importancia de conservar los fragmentos de bosque para proteger la fauna asociada.
En el bosque y la matriz, la riqueza y la diversidad no es tuvieron relacionadas con las variables ambientales; estos resultados difieren a los encontrados por Dunn et al. [38], Longino y Colwell [39], Osorio et al. [32] y Kwon [40], quie nes observaron una correlación positiva entre la riqueza y la temperatura, así mismo, Gallego y Salguero [37] en potrero hallaron que al aumentar la temperatura incrementó la riqueza de hormigas, sin embargo, en el fragmento de bosque evidenciaron que la riqueza disminuyó a medida que la temperatura aumentó; según los autores, esto se explica porque las hormigas bajo estas condiciones forra jean más y obtienen mayor energía [39] y en los meses más cálidos la disponibilidad de alimentos es mayor [32], en cambio, Moreno et al. [37] mencionan que las especies son típicas a las condiciones ambientales del sitio.
En cuanto a la humedad relativa, los resultados de este estudio son similares a los de Longino y Colwell [39], en el que no se encuentra relación entre la riqueza y esta variable, no obstante, difiere con los resultados de Galle go y Salguero [17], quienes observaron en el bosque una correlación positiva, es decir, a mayor humedad aumenta la riqueza y hallaron una dependencia negativa en el po trero, o sea, a menor humedad relativa la riqueza decreció, sugiriendo que, esta variable ambiental es desfavorable para el forrajeo. Los hallazgos de este estudio sobre la co rrelación de la temperatura del suelo son diferentes a los encontrados por Walters y Mackay [41], quienes mencio nan que, la temperatura del suelo influye en la humedad del interior de los nidos.
El análisis de componentes principales en el bosque y en la matriz indicaron que, los ensamblajes no reflejan los cambios de las variables ambientales. Las especies en contradas se asocian a las variables ambientales climáti cas, pero lo hacen de diferente forma, según la respuesta fisiológica que las especies pueden tener a los cambios microclimáticos [42]. En otros estudios, se han encontra do diferentes asociaciones de la temperatura y la hume dad con respecto a la alimentación en hormigas. Chong y Lee [43] encontraron que, la actividad de alimentación de las hormigas analizadas se correlacionó positivamente con la temperatura y estuvo limitada por humedad baja. Medeiros et al. [44], en su estudio de patrones de forrajeo en hormigas hallaron que la actividad de alimentación no se correlacionó con la humedad relativa y con la tempe ratura, la correlación fue negativa, explicando que esta actividad la realizan en periodos apropiados para evitar el estrés térmico e incrementar la eficiencia, mientras que Medeiros et al. [45] observaron que la temperatura ambiente ejerce un efecto positivo en la actividad de ali mentación, en tanto que la humedad lo hace de forma negativa, y Caldato et al. [46] observaron que el patrón de actividad de alimentación de las especies dependió de la temperatura y de la humedad, explicada por la mayor dis ponibilidad de recursos a humedades más altas. En otro aspecto, Wiescher et al. [47] hallaron correlación entre la temperatura ambiente y la composición de hormigas; esta variable interactuó con la morfología y fisiología de las hormigas y afectó su distribución espacial, y Kwon [40] encontró que la competencia interespecífica es mayor a temperaturas intermedias.
En otras investigaciones que se han realizado con es pecies particulares, como en Novoa et al. [48], no eviden cian relación de la actividad diaria de las especies con la temperatura ambiente y la humedad relativa, vinculando el comportamiento con el fotoperiodo y la oferta de recur sos, aunque observaron mayor frecuencias de visitas para el aprovechamiento de recursos a temperaturas más mo deradas y humedades relativas altas, mientras que Solida et al. [33] identificaron que la coexistencia y la utilización de recursos en especies de hormigas específicas no están afectadas por la temperatura ambiente y la humedad re lativa, puesto que la competencia es la que determinó la utilización de los recursos.
Las especies que se asociaron a la temperatura del suelo en esta investigación, posiblemente actúan, según como lo explican Pol y López [49], argumentando que esta variable produce cambios en el comportamiento en las actividades diarias y estacionales, debido a que afec ta el consumo de oxígeno, la pérdida de agua y el costo de transporte, además mencionan que algunas hormigas optan por la actividad nocturna como estrategia para evi tar las altas temperaturas o poseen proteínas de choque térmico que les permiten adaptarse a estas condiciones. Por otra parte, Bozalli et al. [50] encontraron que la tempe ratura determina el crecimiento, la producción de cría y la supervivencia de colonias de hormigas y Soare et al. [51] identificaron que las colonias maduras buscan sitios con temperaturas y humedades específicas para la creación de sus nidos. También, se ha determinado que la tempera tura interviene en la distribución y el número de especies de insectos de hojarasca [52].
Particularmente, Wasmmania auropunctata, especie exotica invasora, puede resistir condiciones ambientales alteradas debido al comportamiento fisiológico y a las adaptaciones que les permiten sobrevivir en lugares de mayor estrés [53], por lo que consiguen adecuarse fácil mente a las condiciones climáticas que se presentan en el bosque y en la matriz y así vivir en ellos. Las especies del género Ectatomma anidan en zonas de climas cálidos, debido a su comportamiento de forrajeo cooperativo y capacidad de adaptación en ambientes alterados [54], explicándose de esta manera su distribución en los sitios analizados en esta investigación; sin embargo, es necesa rio estudiar la biología de cada especie para determinar patrones específicos de distribución de hormigas respec to a las variables ambientales.
En otros estudios se ha planteado la hipótesis de que las especies de hormigas pueden responder de forma continua e independiente a la temperatura, debido a que las comunidades evolucionan en hábitats diferenciados [55]. El comportamiento de los ensamblajes de hormi gas referente a las condiciones ambientales estudiadas depende de cada especie [46], por ello es importante ini ciar el estudio de la biología de cada una de las especies encontradas, para entender mejor su asociación con es tas variables y la dinámica del funcionamiento en estos ecosistemas, además es necesario que se realicen más es tudios que cuantifiquen cómo las variables ambientales a nivel de especie impactan a las comunidades de hormigas de un hábitat.
5. CONCLUSIONES
El bosque presentó mayor índice de diversidad, rique za y equitabilidad, debido a que les ofrecen a las hormigas variedad de sitios de nidificación, un microclima constante y mayor oferta de recursos alimenticios. Los sitios investiga dos deben conservarse porque contienen diversidad y es pecies exclusivas que aportan a la diversidad de hormigas del piedemonte amazónico.
Las diferencias significativas entre las riquezas por esta ción entre el bosque y la matriz, se presentaron probable mente porque los hábitats estudiados muestran diferencias en: cobertura y diversidad vegetal, tipo de suelo, presencia de especies no nativas, disponibilidad de recursos y com petencia entre especies. Para establecer si las variables mencionadas determinan estas discrepancias es necesario trabajar en campo con cada una de ellas, en los mismos si tios analizados en esta investigación.
En el bosque y en la matriz la riqueza no estuvo rela cionada con las variables ambientales, debido a que, posi blemente, otras variables determinan las diferencias y para establecerlo deben ser estudiadas. El análisis de compo nentes principales en el bosque y en la matriz indicaron que los ensamblajes no reflejan los cambios de las variables ambientales. Las especies encontradas se asocian a las va riables ambientales climáticas, pero lo hacen de diferente forma, según la respuesta fisiológica que las especies pue den tener a los cambios microclimáticos; sin embargo, los resultados muestran la importancia de estudiar la biología de cada una de las especies encontradas para entender la dinámica del funcionamiento en los ecosistemas de piedemonte amazónico.
En futuros trabajos es importante identificar a nivel de especie los taxones y evaluar las variables ambientales me didas en este estudio en las colonias, para definir si estas están relacionadas directamente con la biología de las es pecies que se encuentran en los hábitats de piedemonte amazónico. Es necesario que se evalúen otras variables que en este estudio no fueron abordadas y pueden influir en los ensamblajes, como son las variables bióticas: heterogenei dad del hábitat, densidad de herbáceas y arbustos, dispo nibilidad de sitios para anidar, relaciones intraespecíficas e interespecíficas, entre otras.