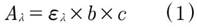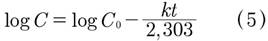1. INTRODUCCIÓN
La gran necesidad de aumentar la disponibilidad de un fármaco se encuentra muy relacionada con la disminución de los efectos secundarios que se pueden generar en el paciente, por consiguiente, actualmente, un gran número de investigaciones científicas se centran en el desarrollo de sistemas que brinden una solución estos inconvenientes. Es así como los sistemas de liberación controlada surgen como una alternativa de solución a la problemática planteada. Estos tienen como beneficio lograr minimizar la cantidad de fármaco que se necesita, ya que la liberación del principio activo es controlada y su concentración en la sangre es óptima, obteniendo así una mayor absorción.
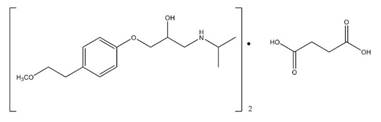
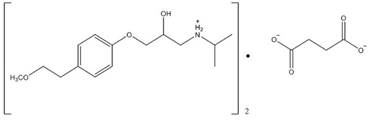
El Metoprolol pertenece a la familia β bloqueadores 1 selectivos o cardio selectivos, este tipo de medicamento se caracteriza por ser de rápida absorción, pero no completa, siendo esencialmente completa en el tracto gastrointestinal [1]. Una de las formas de encontrar este medicamento en el mercado es como Metoprolol Succinato, el cual es un antagonista de los receptores β-adrenérgicos utilizados en el tratamiento de la hipertensión, Fig. 1.
El Metoprolol Succinato es un medicamento BCS (por sus siglas en inglés Biopharmaceutics Classification System) clase I, con una vida media biológica corta y sufre metabolismo de primer paso con una biodisponibilidad del 50%. Como consecuencia, requiere una mayor frecuencia de administración para lograr el efecto terapéutico deseado [2]. Por lo tanto, la rápida absorción de las presentaciones del MPS hace que en el proceso ADME (por sus siglas Administración, Distribución, Metabolismo y Excreción) la cantidad del fármaco expulsada por la orina sea considerable. Como tal el principio activo puede liberarse al medio ambiente a través de las descargas en las WWTPs (por sus siglas en inglés Wastewater treatment plants), donde los niveles detectados fueron similares en las WWTP de España, Alemania, Italia y Estados Unidos. En los efluentes brutos de una WWTP española, las concentraciones del medicamento fueron 0,026-0,063 µg/L, lo que resultaría en una producción de masa diaria de 0,2-1,7g/día [3].
La característica de este tipo de contaminantes emergentes es que no necesitan persistir en el ambiente para causar efectos negativos, puesto que sus altas tasas de transformación/remoción se pueden compensar por su introducción continua en el ambiente, generando un efecto adverso en el medio ambiente acuático, llegándose a encontrar en algunos casos en el agua potable, lo cual genera efectos tóxicos crónicos tales como: estrogénicos, genotóxicos, cancerígenos y teratogénicos [4].
Por otro lado, la montmorillonita es un material inorgánico aprobado por la FDA (por sus siglas en inglés Food and Drug Administration) de EE.UU. como excipiente GRAS (por sus siglas en inglés Generally Recognized as Safe), a su vez es un material de gran elección por las siguientes razones: presenta excelente disponibilidad a bajo costo, tiene buena capacidad de intercalación, propiedad de hidratación e hinchazón, es físicamente estable y químicamente inerte, es fácilmente modificable por la interacción de intercambio iónico, es estable en condiciones ácidas y se espera que aumente la biodisponibilidad del fármaco que transporta [5]. También se puede destacar que la MMT (por sus siglas en inglés Montmorillonite) mejora la solubilidad, la velocidad de disolución, la absorción y la biodisponibilidad de los fármacos [6].
Por lo expuesto anteriormente, el objetivo de esta investigación fue evaluar la síntesis a pH 8 del complejo órgano-mineral (Metoprolol Succinato-montmorillonita) y su uso como posible candidato en la liberación controlada del fármaco. En este estudio se seleccionó la montmorillonita como agente transportador y recubridor del principio activo, debido a que esta clase de arcillas ayudan a que la concentración del medicamento sea óptima en la sangre. Además, la MMT aparte de cumplir con la función de transportar el principio activo, también trae un beneficio para la salud humana, ya que se ha demostrado que este tipo de arcillas tienen un poder terapéutico y también es amigable con el medio ambiente.
2. METODOLOGÍA
2.1 Materiales
Agua desionizada, arena bentónica (Colombia), Metoprolol Succinato, ácido clorhídrico (37%) J.T. Baker (U.S), hidróxido de sodio (Merck, Alemania), cloruro de potasio (Merck, Alemania), fosfato monopotásico (Merck, Alemania), fosfato disódico dihidratado (Merck, Alemania). Los espectros de Uv- Vis fueron obtenidos con un espectrofotómetro Agilent 8453 UV-Visible. Los espectros de infrarrojo de transformada de Fourier fueron tomados en el espectrofotómetro Shimadzu. Los análisis mediante espectroscopia electrónica de barrido se realizaron con un Microscopio Electrónico de Barrido FEG (Field Emission Gun) QUANTA FEG 650 y para el análisis químico con un Detector EDAX APOLO X resolución de 126,1 eV (en. Mn Kα). La identificación de las fases cristalinas presentes en los materiales en estudio se realizó por DRX de muestras policristalinas, empleando un difractómetro marca BRUKER modelo D8 Advance.
2.2 Experimentación
2.2.1 Purificación de la montmorillonita a partir de arena bentonítica de uso comercial
Se pesaron 25 g de la arena bentónica, se molieron en un mortero de porcelana y se adicionaron en un vaso precipitado con 700 mL de agua desionizada. La mezcla se agitó por tres días a 800 rpm y por decantación se separó la arcilla suspendida de los sólidos insolubles (se dejó reposar por un periodo de 3 días). La suspensión resultante se centrifugó por un tiempo de 20 minutos a 500 rpm, se eliminó el líquido sobrenadante. La arcilla húmeda se secó en la estufa a 80°C, hasta obtener un sólido que se pulverizo posteriormente con un mortero de ágata y se obtuvo el material de interés (montmorillonita) [7].
2.2.2 Determinación de la distancia interlaminar en ausencia de humedad
Se adicionó 1,22 g de montmorillonita en un crisol, el cual se llevó a calcinación a una temperatura de 500 °C durante 2 horas para eliminar el contenido de agua presente en el aluminosilicato. La montmorillonita calcinada se almacenó en un desecador hasta alcanzar la temperatura ambiente. Posteriormente, se adquirieron los respectivos datos de difracción a partir de los cuales se le realizó la determinación del valor en Å de la distancia d001 [8].
2.2.3 Síntesis del complejo Metoprolol Succinato-montmorillonita a pH 8
Se prepararon 50 mL de una suspensión de concentración 4% p/v de montmorillonita con agitación constante de 500 rpm durante un lapso de 20 minutos. Posteriormente, se adicionaron 50 mL de una solución saturada de Metoprolol Succinato de concentración 1,35% p/v, manteniendo una velocidad constante con agitación de 300 rpm durante 24 horas a 37°C y un valor de pH 8, el cual se ajustó con NaOH 0,1N. Posteriormente el complejo formado se filtró y se lavó con 3 porciones de 20 mL de agua desionizada y se secó a 50 °C por 8 horas [8].
2.2.4 Determinación de la cantidad de Metoprolol Succinato en el complejo órgano-mineral
Se tomó una alícuota de 250 µL del filtrado obtenido a partir de la síntesis del complejo órgano-mineral de pH 8, el cual se adicionó en un balón aforado de 50 mL para su posterior dilución y medición mediante la técnica UV-Visible.
Teniendo en cuenta la ley de Beer y el valor de la absortividad del Metoprolol Succinato calculado, se determinó la concentración de la disolución para poder calcular de esta forma, la cantidad del fármaco presente en el espaciado interlaminar de la montmorillonita mediante la diferencia de las concentraciones iniciales y finales de las soluciones del Metoprolol Succinato.
2.2.5 Absorción y liberación del Metoprolol Succinato in vitro
Para el procedimiento de liberación del MPS in vitro se utilizó el Metoprolol Succinato del complejo MPS-MMT sintetizado a pH 8, para esto se preparó una solución tampón de pH 1,2 el cual corresponde a un SGF (por sus siglas en inglés simulated gastric fluid), esto se logró mezclando 165,2 mL de HCl 0,1 M y 467,8 mL de 0,2 M KCl. Posteriormente se tomó del complejo de pH 8 una cantidad equivalente a 32 mg de Metoprolol Succinato, y se adiciono en 500 mL del medio de solución tampón a una temperatura de 37 °C con una agitación de 105 rpm, donde se mantuvo constantes estas condiciones del medio.
Después se tomaron alícuotas de 5 mL cada 2, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 y 60 minutos, posteriormente se tomaron volúmenes de muestras iguales cada hora hasta 8 horas y después a las 24 horas. Se procedió a la medición de su absorbancia mediante la técnica UV-Visible, para así determinar la cantidad de Metoprolol Succinato que fue liberado del complejo sintetizado (pH 8) a diferentes tiempos.
Para la liberación in vitro del Metoprolol Succinato en un SIF (por sus siglas en inglés simulated intestinal fluid) se preparó una solución tampón de pH 7,4. Una vez preparada la solución se empleó el mismo procedimiento de liberación in vitro del Metoprolol Succinato descrito para el fluido gástrico simulado [9].
3. RESULTADOS Y DISCUSIÓN
3.1 Determinación de la distancia interlaminar en ausencia de humedad
Algunos de los minerales laminares que pertenecen a la familia de los aluminosilicatos, poseen una capacidad baja de absorción de especies químicas en su interlámina, dando origen a procesos de adsorción principalmente en su superficie. En el caso mencionado anteriormente no se genera una variación del espaciado d001, lo cual es común en minerales como las micas y cloritos, en los cuales la carga de la capa es demasiada alta y también en el caso de que la carga sea cero como se presenta en la pirofilita y talco [10].
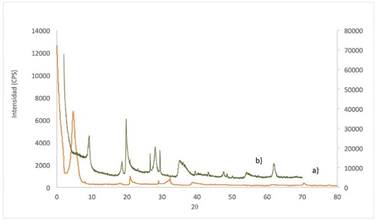
En el caso de la montmorillonita para verificar su capacidad de absorción, se realizó la caracterización del material por difracción de rayos X. Los perfiles de difracción de la montmorillonita antes y después del tratamiento térmico realizado se pueden observar en la Fig. 2.
Fuente:Los autores
Fig. 2 PERFILES DE DIFRACCIÓN DE LA MONTMORILLONITA. a) SIN TRATAMIENTO TÉRMICO (VERDE) Y b) EN AUSENCIA DE HUMEDAD (GRIS)
De acuerdo con los perfiles de difracción que se muestran en la Fig. 2, se puede apreciar que en el proceso de calcinación de la montmorillonita el espaciado basal d001 disminuyó de 14,847 Å (5,948 2theta) a 9,600 Å (9,204 2theta), cuyo último valor corresponde a la distancia interlaminar en ausencia de humedad. Por lo tanto, al disminuir el valor de la distancia d001 en la montmorillonita después de realizar el tratamiento térmico, se puede afirmar que este posee la capacidad de absorber especies químicas en los espacios interlaminares. Esta capacidad de absorción se da porque la montmorillonita posee en su interlámina cationes mono- o divalentes y moléculas de agua, las cuales interactúan en esta zona estructural. De este modo, la absorción de moléculas polares (agua o moléculas orgánicas) altera la dimensión c de forma progresiva y regular o en etapas [10].
3.2 Determinación de la cantidad de Metoprolol Succinato incorporado en el complejo órgano-mineral
La concentración del filtrado obtenido luego de la síntesis del complejo a pH 8, fue determinada mediante la técnica espectrofotométrica de Uv-Vis, donde a partir de la Ecuación de la ley de Beer ecuación (1), se calculó la concentración del Metoprolol Succinato incorporado en la montmorillonita en el complejo, empleando la diferencia de concentraciones.
Para calcular el porcentaje de eficiencia de encapsulación se utilizó la ecuación (2)
La concentración de Metoprolol Succinato incorporado en la montmorillonita obtenida fue de 360 ppm, con un porcentaje de eficiencia de encapsulación del 60%. Por lo que se puede concluir que el fármaco se logró intercalar en el aluminosilicato a causa de dos grupos que se encuentran protonados en la molécula como consecuencia del pH de síntesis estudiado.
Una de las posibles razones de la incorporación del fármaco en el aluminosilicato es debido a que el grupo carboxilato del Metoprolol Succinato (forma aniónica), interactúa con los bordes de la capa cargada positivamente de la montmorillonita, lo cual resulta en una contribución menor en la absorción en la montmorillonita debido a que la fracción del borde hasta la superficie es comúnmente bastante baja en minerales arcillosos [11], de igual manera a este valor de pH el grupo funcional cargado positivamente del MPS zwitteriónico, Fig. 3; interactúa con la superficie de la MMT cargada negativamente a través de la interacción electrostática a su vez, el grupo funcional con cargas negativas interactúa con los cationes metálicos desorbidos mediante la interacción ion-dipolo, dando como resultado una mayor influencia en la absorción el grupo amina protonado que interacciona con la carga residual negativa de la montmorillonita por medio de enlaces ion-dipolo.
3.3 Caracterización molecular y cristalográfica de los sustratos y complejos sintetizados
3.3.1 Espectroscopía Ultravioleta-visible (Uv-Vis)
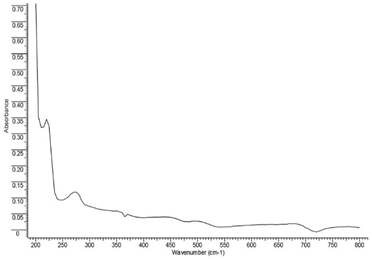
El Metoprolol Succinato tiene grupos cromóforos en la molécula (grupos funcionales no saturados que aporta los orbitales π), donde se dan las transiciones n→π* y π → π* [12]. De este modo, la energía requerida para estas transiciones es lo que lleva a las bandas de absorción del Metoprolol Succinato dentro de la región del ultravioleta visible, permitiendo ser identificadas.
En la figura 4, se presenta el resultado obtenido de la caracterización del Metoprolol Succinato por espectroscopía de UV-Vis. En el espectro del fármaco se logró identificar un máximo de absorción a 220 nm, siendo similar al valor reportado en la literatura que es a 221nm [13].
3.3.2 Espectroscopía de infrarrojo
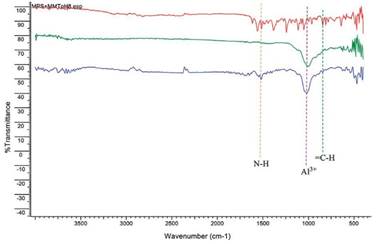
Esta técnica de caracterización, permitió la identificación de los grupos funcionales característicos del Metoprolol Succinato y la montmorillonita en el complejo obtenido. Los espectros IR se pueden apreciar en la Fig. 5, estos fueron realizados para los sustratos y el complejo de pH 8.
Fuente: Los autores
Fig. 5 COMPARACIÓN DE ESPECTROS INFRARROJO. a) METOPROLOL SUCCINATO (ROJO), b) MONTMORILLONITA (VERDE) Y, c) MPS-MMT A PH 8 (AZUL)
En los espectros se observa la presencia de grupos característicos del Metoprolol Succinato en el complejo sintetizado, como es el N-H, lo cual indica la participación del N en la absorción del MPS en la MMT. Por otra parte, la banda a 1242 cm-1 aparece para el complejo de MPS-MMT, lo cual indica la formación de enlaces de hidrógeno en la incorporación del fármaco en el aluminosilicato [3].
Se observó además, un desplazamiento de la señal del enlace Si-O en la montmorillonita (460 cm-1) en comparación con la señal que muestra el especto del complejo de MPS- MMT sintetizados (476 cm-1) hacia números de onda más altos. Estos cambios hacia números de onda más altos, así como la variación en sus intensidades surgen debido a las atracciones entre los grupos Si-O y los iones carboxilatos presentes en el medio [14]. Es importante indicar que a diferencia del Metoprolol Succinato, el complejo de pH 8 (Fig. 5c.) presenta dos picos adicionales a 1396 cm-1 y 1541 cm-1 que corresponden al estiramiento simétrico y asimétrico del grupo carboxilato, lo que indica que el fármaco se encuentra presente en el aluminosilicato en la forma zwitteriónica. También se pudo apreciar que la intensidad de las señales correspondientes al grupo carboxilato en el complejo son bastante débiles, probablemente porque la fracción de la forma zwitteriónica se encuentra en menor proporción [11].
De acuerdo con estas observaciones, se puede inferir que probablemente la intercalación del MPS en la MMT, se produce a través del grupo amina y a los enlaces de hidrógeno, debido a una posible conformación de estos enlaces entre los grupos de ácido carboxílico del Metoprolol Succinato y los átomos de oxígeno basal de la montmorillonita [11]. Además, la interacción ion-dipolo fue confirmada por la participación del grupo amina del MPS. Estas interacciones e intercambio catiónico surgen debido a que la montmorillonita posee carga residual negativa en la zona interlaminar y esta se encuentra estabilizada por cationes que pueden ser monovalentes o divalentes, a su vez estos cationes en medio acuoso pueden ser reemplazados por moléculas orgánicas, dando lugar a la interacción con los cationes presentes en las interlaminas.
3.3.3 Microscopía electrónica de barrido (MEB)
La caracterización realizada por esta técnica suministró información de interés sobre la morfología de la montmorillonita antes y después de la intercalación del Metoprolol Succinato, las micrografías se pueden observar en la Fig. 6.

Fuente: Los autores
Fig. 6 CARACTERIZACIÓN DE MUESTRAS POR LA MEB. A) METOPROLOL SUCCINATO, B) MONTMORILLONITA, C) COMPLEJO A pH 8
La micrografía que se observa en la Fig. 6 a), muestra la morfología correspondiente al principio activo que se está evaluando en este estudio, en el caso de la micrografía de la Figura 6. b), se observan distintos granos en forma de esfera con superficies onduladas y con franjas de manera de enrejado, lo cual sugiere una estructura en capas típica de la montmorillonita [14]. En la Fig. 6 c) se aprecia la micrografía del material, después de la intercalación del Metoprolol Succinato en la montmorillonita a pH 8; en esta se observa un cambio en la morfología con respecto a la de la montmorillonita (Fig. 6 b.), por lo cual esto se puede deber a la formación del complejo, lo cual indica la destrucción de la estructura en capas [15].
Cuando las partículas en forma de esfera de la montmorillonita son reemplazadas por escamas de alto y bajo radio, este cambio indica que la intercalación fue acompañada por adsorción [14], sin embargo, en el caso del complejo de Metoprolol Succinato-montmorillonita no se observó este hecho, solamente se observo una mayor aglomeración de las partículas por lo que se puede inferir que solo se da la intercalación de las partículas del principio activo en el espaciado interlaminar de la montmorillonita, lo cual se observará en los resultados obtenidos por DRX.
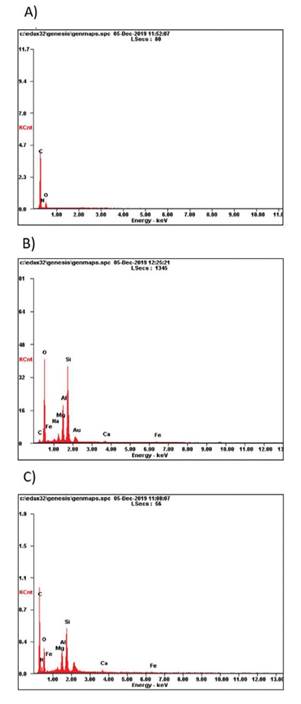
En el caso de los análisis elementales realizados en las muestras, los espectros obtenidos se pueden observar en la Fig. 7.
Fuente: Los autores
Fig. 7 IMÁGENES MEDIANTE LA TÉCNICA DE ESPECTROSCOPIA DE RAYOS X DE ENERGÍA DISPERSIVA DE LAS MUESTRAS. A) METOPROLOL SUCCINATO, B) MONTMORILLONITA Y, C) COMPLEJO A pH 8
La presencia de la señal de nitrógeno que se observa en la Figura 7 c) podría indicar la formación del complejo MPS-MMT junto con oxígeno, silicio, aluminio, hierro, magnesio y calcio presentes en la montmorillonita, lo que probablemente se puede deber a la presencia del fármaco en el complejo de MPS-MMT, tal como lo reportan los autores [15]. Por otra parte, al comparar la Figura 7 b) con la 7.c), se aprecia la disminución de iones Mg2+ en el complejo obtenido en comparación a la montmorillonita, esto es debido a que el Mg2+ es un ion intercambiable.
3.3.4 Difracción de rayos X de muestras policristalinas
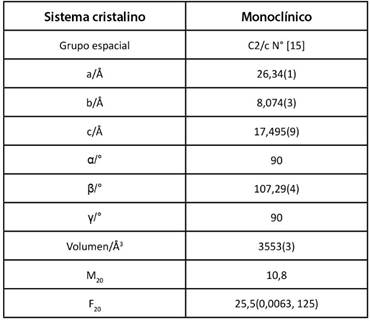
A continuación, se muestra en la Tabla I los resultados correspondientes a la caracterización cristalográfica del Metoprolol Succinato.
En la presente Tabla I, se observa que el grupo espacial del Metoprolol Succinato es C2/c, esto se significa que pertenece a un grupo de sistema monocíclico que cuenta con planos de deslizamiento o centrado en la red, este tipo de grupo es también conocido como no simorfos, el cual cuenta con translaciones múltiples [16]. En la figura , se presentan los perfiles de difracción obtenidos de los sustratos y del complejo de pH 8.
Como se aprecia en la Fig. 8 c) el complejo presenta un desplazamiento de los picos de difracción hacia ángulos más bajos con respecto a la montmorillonita en ausencia de humedad (Fig. 8 b), lo cual significa un aumento del espacio interlaminar de 9,600 Å (9,204 2 theta) a 15,187 Å (5,815 2 theta), correspondiendo esto a la ley de Bragg. El resultado indica que se intercambiaron los cationes de la capa interlaminar de la montmorillonita por moléculas de Metoprolol Succinato cargadas positivamente.
Al observar la Fig. 8 a, el perfil de difracción del Metoprolol Succinato desaparece totalmente en el complejo órgano-mineral de pH 8 (Fig. 8 c), indicando que el Metoprolol Succinato no se encuentra en la muestra en forma de mezcla mecánica (mezcla heterogénea), reafirmando la presencia del Metoprolol Succinato en el espaciado interlaminar de la montmorillonita, donde el proceso de incorporación del fármaco se da mediante absorción.
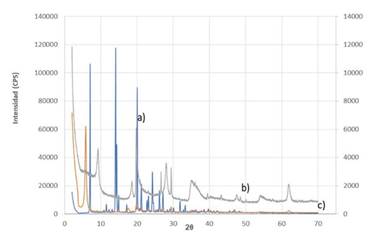
Fuente: Los autores
Fig. 8 PERFILES DE DIFRACCIÓN DE LOS SUSTRATOS Y EL COMPLEJO A pH 8. *a) METOPROLOL SUCCINATO (AZUL), b) MONTMORILLONITA (NEGRO) Y, c) COMPLEJO OBTENIDO A pH 8 (NARANJA)
3.3.5 Absorción y liberación del Metoprolol Succinato in vitro
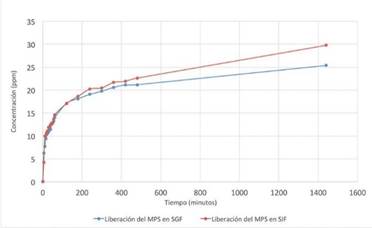
En este apartado se presenta el estudio de la cinética de liberación del Metoprolol Succinato del complejo de pH 8 en un SGF (pH 1,2) y en SIF (pH 7,4). Al comparar la concentración liberada en los primeros 5 minutos en el complejo de MPS-MMT a pH 8 en los dos tipos de fluidos (Fig. 9), se puede notar que es mayor la cantidad liberada en el fluido gástrico simulado. La diferencia entre estas dos concentraciones es de 2,11 ppm, debida posiblemente a la presencia de iones H+, los cuales por ser de menor tamaño, logran penetrar profundamente las capas de montmorillonita lo que resulta en un alto proceso de intercambio de iones en comparación con los grandes iones fosfato del fluido intestinal simulado. De igual manera el proceso de penetración e intercambio que se observa en la Fig. 9, donde el Metoprolol Succinato es liberado casi espontáneamente, es aquel que se encuentra ubicado posiblemente en zonas de menor interacción entre el principio activo y las cargas residuales negativas de las interlaminas, lo cual es generado por efectos de turbostraticidad que es un apilamiento de las láminas con rotaciones aleatorias, este fenómeno es la única forma observada para esmécticas con cargas casi exclusivamente octaédricas entre las cuales se encuentra la montmorillonita, donde un apilamiento turbostratico es más estable que un apilamiento ordenado o semiordenado [17].
Los efectos de turbostraticidad en la montmorillonita y en el complejo de MPS-MMT de pH 8 se evidencian en los perfiles de difracción, mostrados en la Fig. 6, ya que las reflexiones presentan colas o bandas asimétricas hacia ángulos altos.
En la Fig. 12, para la primera hora en el complejo de pH 8, se liberó del Metoprolol Succinato un 44% en el SGF y un 46% en el SIF, mientras que al finalizar las 24 horas se liberó en el SGF un 79% y en el SIF un 93%, donde el principio activo que es difundido y liberado lentamente a una velocidad casi constante después de la primera hora es aquel que se encuentra en el espaciado interlaminar de la montmorillonita [18]. Este fenómeno de liberación controlada observado en el complejo de MPS-MMT de pH 8 es muy favorable, debido a que se necesita que la liberación en el SGF sea más prolongada, ya que para el Metoprolol Succinato su sitio de absorción no es el estómago, por ende, con el sistema de liberación controlada se busca una mayor cantidad disponible en el líquido intestinal, después de pasar por el estómago, para la absorción en la circulación sistémica.
3.3.6 Modelos cinéticos
Los modelos con una aplicación principal y los mejores fenómenos de liberación del principio activo son, en general, el modelo de primer orden y el de Korsmeyer-Peppas [5], por lo que estos modelos han sido utilizados con el find e identificar el modelo cinético de liberación que rige en para el MPS.
Para calcular el porcentaje de liberación acumulado del MPS se utilizó la ecuación (3)
Donde p(t) = % de liberación en el tiempo t y p(t-1) = % de liberación previo a el tiempo t.
A continuación, se presenta en la Tabla II los valores de las constantes y de los r2 obtenidos en cada modelo.
Tabla II CINÉTICA DE LIBERACIÓN DEL COMPLEJO MPS-MMT A PH 8 EN FLUIDO GÁSTRICO SIMULADO (pH 1,2) Y EN FLUIDO INTESTINAL SIMULADO (pH 7,4)
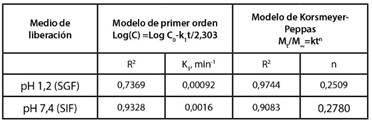
Fuente: Los autores
Como se observa en la Tabla II, en el caso de la cinética de liberación en el SGF, hay una mayor correlación lineal entre las dos variables, con el modelo de Korsmeyer-Peppas, mientras que en el medio de liberación del SIF, el modelo con el cual se tiene una mejor correlación y por ende un mayor valor de r2 es con el de primer orden.
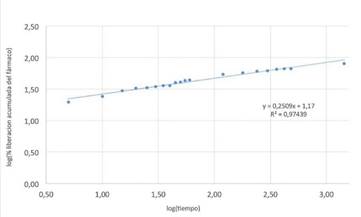
Modelo cinético de Korsmeyer-Peppas: a continuación, se presenta en la Fig. 11 el modelo cinético que se adaptó mejor a los datos de la liberación del MPS en el SGF.
La expresión que describe el modelo de Korsmeyer-Peppas es la ecuación (4):
Donde Mt/M∞ es la fracción del fármaco liberado en el tiempo t, k es la constante de velocidad de liberación y n es el exponente de liberación.
En este modelo, el valor de k es de 14,7911 min-1, que depende de las características estructurales y geométricas del sistema. El valor obtenido para n es 0,2509, característico del mecanismo de liberación del fármaco en matrices de forma esférica. Cuando n < 0,43 indica una desviación de la ley de Fick, donde la cinética de liberación obedece a la ecuación de orden cero [19], esta desviación puede ser consecuencia de la existencia de porosidad en el material, lo que lleva a una desviación de las leyes de difusión [20], teniendo en cuenta la estructura porosa de la montmorillonita, como se observa en la Fig. 6 b), este supuesto puede tenerse en cuenta.
El mecanismo que se da en el SGF, es aquel donde la liberación del principio activo en las matrices porosas está influenciado principalmente por la disolución y difusión del fármaco, y en menor proporción por la erosión [21], además se puede suponer que el fluido de hinchamiento entrante afecta el movimiento de las moléculas del medicamento al regular el coeficiente de difusión del principio activo en la matriz porosa, y al alterar el flujo de este a través del gradiente de densidad que surge en la matriz durante el hinchamiento y al hacer posible la disolución del medicamento [22]. Es importante mencionar que no se observó la erosión de la montmorillonita por completo, probablemente debido a que el Metoprolol Succinato es muy soluble en agua. Las tres fases por las cuales se ve gobernado el mecanismo de liberación descrito por el modelo de Korsmeyer-Peppas se describen en la Fig.12, zona 1 frente de hichamiento, la zona 2 frente de difusión y la zona 3 frente de erosión [23].
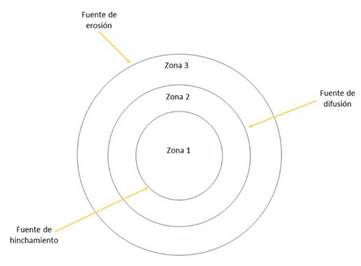
Fuente: Adaptado de [10]
Fig. 12 ORDEN Y TURBOSTRATICIDAD EN LAS LÁMINAS DE LAS ESMÉCTICAS PARTICULARMENTE EN LA MONTMORILLONITA
La montmorillonita al entrar en contacto con el medio acuoso absorbe moléculas de agua provocando que se hinche, generando así poros por donde el Metoprolol Succinato es expulsado al exterior para mantener un gradiente de concentración apropiado. A medida que el aluminosilicato se relaja y se expande esto causa que vaya erosionado. Este proceso es lento porque se requiere tiempo para que se relajen las capas interlaminares, por las cuales se difunde el Metoprolol Succinato hacia el exterior. Es importante mencionar que no se observó la erosión de la montmorillonita por completo, probablemente debido a que el Metoprolol Succinato es muy soluble en agua.
Modelo cinético de primer orden: la mayoría de los fármacos desaparecen del plasma por procesos que dependen de la concentración, lo que resulta en una cinética de primer orden [24].
La función matemática que representa el modelo de primer orden se representa mediante la ecuación (5). En esta expresión, se describe una acción superficial para la disolución de una partícula sólida en un medio líquido, donde la fuerza impulsora en tales procesos de liberación es la diferencia entre la concentración del agente activo dentro y fuera del recubrimiento del material encapsulado. La concentración del agente activo dentro de la cápsula decae sobre el proceso debido a la liberación a través del recubrimiento [19].
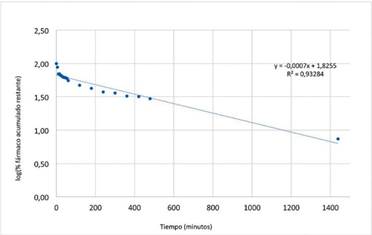
En la Figura 13, se observa el modelo cinético de primer orden, el cual se adaptó mejor a los datos de la liberación del MPS en el SIF, en donde observamos un coeficiente de correlación de 0,9328.
En el modelo de primer orden k corresponde a la constante de velocidad de eliminación, como se observa en la Tabla II el valor de k es de 0,0016 min-1. En el modelo de primer orden es muy común que se describa la cinética de liberación de principios activos solubles incorporados en una matriz porosa, además se observa que la velocidad cambia durante el tiempo con cambios de concentración del Metoprolol Succinato.
4. CONCLUSIONES
Se logró encapsular en un 60 % del fármaco en la montmorillonita, por lo cual para aumentar la eficiencia de encapsulación se debería variar las condiciones de pH en la síntesis o la concentración del Metoprolol Succinato (MPS).
A partir de los resultados obtenidos en las diferentes técnicas de caracterización utilizadas (espectroscopia de Uv-Vis, FTIR y DRX), se evidenció que el Metoprolol Succinato se incorporó en el espaciado interlaminar de la montmorillonita (MMT), donde dominaba un proceso de absorción, en el cual las interacciones que favorecían este encapsula- miento eran ion-dipolo, enlaces de hidrógeno e intercambio catiónico principalmente.
En el pH de incorporación estudiado, se observó que las interacciones del principio activo con la montmorillonita son facilitadas debido a las atracciones entre los grupos Si-O y los iones carboxilatos presentes en el medio y también por la participación del grupo amina del Metoprolol Succinato.
Los estudios realizados por difracción de rayos X de muestras policristalinas se confirmó la formación de la interacción del MPS-MMT, debido al aumento en el espacio basal d001 de la montmorillonita de 9,600 a 15,187 Å, y al desplazamiento de los picos de difracción con índices (001) hacia ángulos más bajos con respecto a la MMT, re- afirmando el intercambio de cationes dentro de las capas interlaminares.
Los resultados in vitro de la liberación del principio activo en el complejo en la disolución del fluido gástrico simulado (SGF) se ajustaron al modelo de Korsmeyer-Peppas, el cuál es característico en materiales porosos y en difusión no lineal. En la disolución del fluido intestinal simulado (SIF), los datos se ajustaron al modelo de cinética de primer orden, donde la velocidad de liberación es dependiente de la concentración del Metoprolol Succinato.