Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Ingenierías Universidad de Medellín
versão impressa ISSN 1692-3324versão On-line ISSN 2248-4094
Rev. ing. univ. Medellín v.10 n.18 Medellín jan./jun. 2011
Efecto del enriquecimiento con nutrientes en la degradación de clorpirifos, malatión y metil paratión
Inorganic nutrients effect addition over the chlorpyrifos, malathion and methyl parathion degradation
S. A. Upegui*; G. A. Peñuela**; L. R. Botero***
* Ingeniero ambiental M. Sc. Docente investigador. Grupo de Investigaciones y Mediciones Ambientales (GEMA). Universidad de Medellín. Carrera 87 No. 30 - 65, Centro de laboratorios Laboratorio de Biotecnología, Bloque 3-202, Medellín - Colombia. Tel: 057- 3405675, correo electrónico supegui@udem.edu.co
** Químico M. Sc., Ph. D., Docente investigador. Coordinador del Grupo de Diagnóstico y Control de la Contaminación (GDCON). Sede de Investigaciones Universitarias, Universidad de Antioquia, Calle 62 No. 52 - 59, Laboratorio 232, Medellín - Colombia, Tel: 057- 2196570. Correo electrónico gpenuela@udea.edu.co
*** Bióloga. M. Sc. Docente investigadora, coordinadora de la línea de Biotecnología del Grupo de Investigaciones y Mediciones Ambientales (GEMA). Universidad de Medellín, Carrera 87 No. 30 - 65, Centro de laboratorios Laboratorio de Biotecnología, Bloque 3-202, Medellín - Colombia. Tel: 057- 3405675, correo electrónico lbotero@udem.edu.co
Resumen
Con el fin de evaluar el efecto del enriquecimiento con nutrientes (una sal de fósforo o un fertilizante comercial con N, P y K) como alternativa para mejorar la capacidad de degradación de los microorganismos en una matriz sólida, contaminada con los pesticidas organofosforados: clorpirifos, malatión y metil paratión, se realizaron experimentos de cultivo bajo condiciones controladas de oscuridad, temperatura y humedad por 30 días. En todos los tratamientos hubo degradación de los pesticidas; sin embargo, en el tratamiento con fósforo los tiempos para degradar el clorpirifos y el metil paratión fueron mayores. La presencia de los pesticidas no generó efectos tóxicos detectables sobre la microflora en ninguno de los tratamientos evaluados. La actividad biológica de las matrices no presentó una relación directa con la capacidad de degradación.
Palabras clave: biorremediación, fósforo, fertilizante, clorpirifos, malatión, metil paratión.Abstract
In order to evaluate the effect of inorganic nutrient addition (phosphorus or commercial fertilizer) over the microbial degradation capacity present in a solid matrix contaminated with chlorpyrifos, malathion and methyl parathion, microcosms assays were held under controlled conditions of light, moisture and temperature for 30 days. Results showed that even though three treatments microorganisms were able to degrade the three organophosphorus pesticides, microorganisms of phosphorus-enrichment treatment were less efficient to degrade Chlorpyrifos and Methyl Parathion than microorganisms of Fertilizer-enrichment treatment. It was not observed a direct relation between mineralization and microbial pesticides degradation capacity. The microbial activity was not affected by the presence of organophosphorus pesticides.
Key words: biodegradation, phosphorus, fertilizer, chlorpyrifos, malathion, methyl parathion.
INTRODUCCIÓN
La mayoría de los pesticidas tienen un efecto adverso sobre la diversidad funcional de la microflora del suelo y en última instancia sobre su fertilidad, y por esto, la preocupación sobre el uso adecuado de estos compuestos [1].
La comunidad microbiana y sus funciones pueden ser afectadas por varios factores como son: tipo de la materia orgánica, presencia de nutrientes, propiedades fisicoquímicas de los suelos, vegetación, prácticas de manejo y presencia de contaminantes [2].
La adición de nutrientes, como compuestos inorgánicos, ha sido vista como una estrategia para la estimulación de microorganismos degradadores naturales de contaminantes, lo cual incrementa la eficiencia del proceso de biorremediación [3]; el tipo de nutrientes adicionados y la naturaleza de los compuestos xenobióticos son de gran importancia en la efectividad de los tratamientos [4].
La evaluación del efecto del fósforo en la capacidad microbiana para degradar los pesticidas es importante. Este es un nutriente fundamental para el desarrollo de los procesos biológicos (formación de compuestos energéticos dentro de la célula, como ácidos nucleicos, ATP y fosfolípidos de la membrana celular) [5].
1 MATERIALES Y MÉTODOS
Productos químicos: Para el tratamiento de las muestras se utilizó NaCl (Merck), K2HPO4 (Merck), K2Cr2O7 (Merck), CH3COONH4 (Merck), BaCl2 (Merck), NaF (Merck) y NaOH (Merck). Los cultivos fueron contaminados con los productos comerciales de metil paratión (Methión 48 EC, Agroser), clorpirifos (Lorsban 4 EC, DowAgrosciences), y malatión (Malathion 57% EC, Proficol). Para la extracción de los pesticidas se utilizó acetato de etilo grado cromatográfico marca MALLENCKRODT. La estandarización de la técnica de cuantificación de los pesticidas fue realizada con metil paratión, clorpirifos (O,O-Dietil-O[3,5,6-Tricloro-2-piridinol) y malatión marca Chem Service, con una pureza del 99,5% cada uno.
Preparación de la matriz. Se utilizó una matriz preparada a partir de una mezcla, en proporción 25:75, de compost inmaduro (50:50 residuos orgánicos: aserrín, con 5 días de activación) y suelo de un antiguo botadero de residuos a cielo abierto ubicado a los 6°16´38.85N y 75°34´06.87°, en la ciudad de Medellín, Colombia (suelo Moravia), recolectado del primer horizonte (primeros 10 cm) y almacenado a 5°C durante 8 horas hasta el momento del ensayo para conservar su actividad biológica.
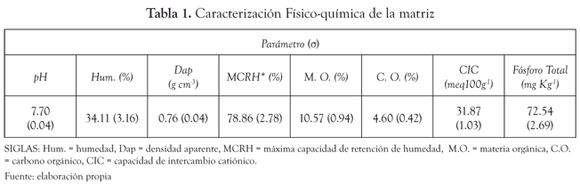
En la matriz resultante se evaluó el pH [6], % humedad [6], máxima capacidad de retención de humedad (MCRH)[7], densidad aparente (Dap) [6], porcentaje de carbono orgánico (%C.O.) [8], porcentaje de materia orgánica (%M.O.)[8], capacidad de intercambio catiónico (CIC) [6] y fósforo total disponible [9] con el fin de conocer algunas de las principales propiedades fisicoquímicas que pudieran influir en la degradación de los pesticidas.
Ensayos de degradación. Para hacer los cultivos se contaminaron 10 g de matriz con una solución mezcla de los pesticidas, y se enriqueció con fósforo (K2HPO4) para lograr una relación 100:1 (C:P), o con fertilizante comercial (20-10-15 de N-P-K) y se alcanzaron concentraciones en la matriz, de 400 mg Kg-1 P o 100 mg Kg-1 de fertilizante, y 20, 30 y 130 mg Kg-1 de malatión, metil paratión y clorpirifos, respectivamente. Como controles de experimentación se usó la matriz 25:75 sin adición de nutrientes, y con adición de nutrientes sin pesticidas. El seguimiento de los ensayos se llevó a cabo durante 30 días a condiciones de oscuridad y temperatura ambiente (25 °C). Se evaluó la concentración de los pesticidas a los 0, 1, 3, 5, 7, 15 y 30 días de incubación [10].
Para la extracción de los pesticidas desde las matrices se utilizaron 20 mL de acetato de etilo por recipiente de cultivo; los recipientes permanecieron cerrados herméticamente y sometidos a ultrasonido por 60 minutos y posteriormente a agitación horizontal por 48 horas.
El análisis de los pesticidas se llevó a cabo con un cromatógrafo de gases Agilent Technologies 6850, acoplado a un detector de microcaptura de electrones (µ-ECD), con temperatura máxima del horno de 300 °C. Se usó una columna de methylsiloxano(HP-1, 30m x 320µm x 0.25µm nominal). Para el análisis se inyectaron 2 µL de muestra en modo splitless, con un flujo de 2 mL min-1, y se usó helio como gas de arrastre. La programación del horno fue: temperatura inicial de 100°C, incrementada a40°C min-1 hasta 180°C (mantenida por 2 minutos), luego se incrementó a 10°C min-1 hasta 230°C (mantenida por 3 minutos) y por último se incrementó a 40°C min-1 hasta 290°C (mantenida durante 1 minuto). Los tiempos de retención fueron: 7.40 minutos para el clorpirifos, 7.14 minutos para el malatión y 6.41 minutos para el metil paratión.
Estudio de la actividad microbiana. Para determinar la actividad biológica de los microorganismos en cada uno de los tratamientos, y evaluar el efecto tóxico de los pesticidas sobre éstos, se efectuó el seguimiento de la mineralización mediante pruebas respirométricas durante los 30 días de ensayo, las cuales fueron monitoreadas de acuerdo con el método empleado por [11] modificado, para lo cual se capturó el CO2 producido en cada cultivo con 10 mL de una solución 0.8 N de NaOH, renovada cada 24 horas y titulada con 0.4 N de HCl (previa adición de BaCl2).
Análisis estadístico de los resultados. Los resultados de las cinéticas de degradación fueron evaluados mediante análisis de regresión simple. Se reportó el grado de significancia estadística (p-valor) y el coeficiente de correlación (r2) de los modelos ajustados a leyes de velocidad de primer orden.
Los resultados obtenidos de la actividad microbiana durante el período de estudio fueron evaluados mediante análisis de regresión simple, y se reportaron los modelos de calibración que presentaron el mejor ajuste estadístico, según el grado de significancia estadística entre las variables (p-valor) y el coeficiente de correlación (r2).
2 RESULTADOS
Caracterización de las matrices. En la matriz evaluada (25:75 compost inmaduro: suelo de Moravia) se determinó un valor de pH ligeramente básico (7.7). La humedad de la matriz fue de 34.1%, lo que correspondió a un 43.2% de la máxima capacidad de retención de humedad. La capacidad de intercambio catiónico (CIC) de la matriz (31.9 meq/100g) se encontró dentro del rango típico presentado en suelos [12]. Los valores para todos los parámetros evaluados se presentan en la tabla 1.
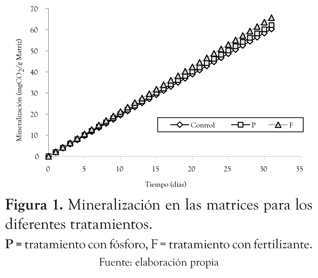
Efecto de la adición de nutrientes en la actividad microbiana. La mineralización en las matrices alcanzó, para el día 30, valores de 60.4, 62.2 y 65.7 mgCO2 g-1 matriz para los tratamientos: sin enriquecimiento (P < 0.005), con adición de fósforo (P < 0.005) y con adición de fertilizante (P < 0.005), respectivamente, y presentaron velocidades de mineralización de 1.95, 2.01 y 2.12 mgCO2 g-1 d-1 en el mismo orden (figura 1).
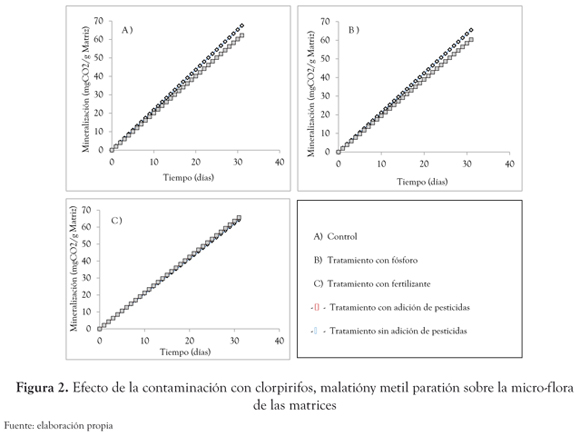
Tolerancia de la microflora a los pesticidas evaluados. ¡Error! No se encuentra el origen de la referencia. Los valores de mineralización hallados para los tratamientos con y sin pesticidas (entre 60 y 65 mgCO2 g-1 matriz) para todos los casos presentaron cinéticas de mineralización superiores en los ensayos contaminados en comparación con los ensayos sin contaminar (figura 2).
3 EFECTO DE LA ADICIÓN DE NUTRIENTES EN LA DEGRADACIÓN DE LOS PESTICIDAS
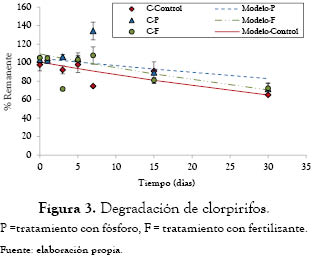
Clorpirifos. Luego de 30 días de cultivo, el clorpirifos presentó valores de degradación de 19.5% en el tratamiento con fósforo (P < 0.05), 29.5% en el tratamiento con fertilizante (P < 0.005) y 35.1% en el tratamiento sin adición de nutrientes (P < 0.05) (figura 3).
Las velocidades de degradación alcanzadas fueron de 0.014 d-1, 0.0078 d-1 y 0.014 d-1 para el tratamiento sin adición de nutrientes, con adición de fósforo y con fertilizante, respectivamente (tabla 2).
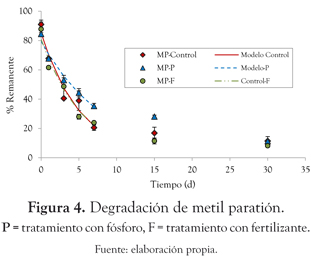
Metil paratión. El tratamiento sin adición de nutrientes fue el que presentó mayor velocidad de degradación del metil paratión (0.194 d-1), al alcanzar porcentajes de degradación del 83% luego de 30 días de cultivo (P < 0.005). Para el tratamiento con adición de fertilizante la velocidad de degradación presentó valores de 0.185 d-1 (P < 0.005) y un porcentaje de degradación final de 89%. En el tratamiento con fósforo, el metil paratión presentó un porcentaje de degradación de 82.1% con una velocidad de 0.118 d-1 (P < 0.005) (figura 4).
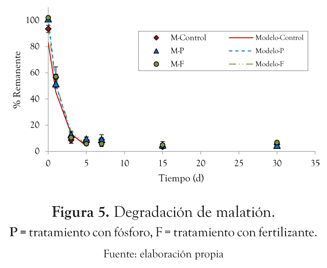
Malatión. El malatión fue degradado 85% en los primeros 5 días de cultivo para los tres tratamientos evaluados. Este compuesto presentó velocidades de degradación de 0.814 d -1, 0.691 d -1 y 0.603 d -1 en los tratamientos: sin adición de nutrientes (P < 0.005), con adición de fósforo (P < 0.005) y con adición de fertilizante (P < 0.005), respectivamente (figura 5).
4 DISCUSIÓN
El pH de la matriz (7.7) no perjudica el crecimiento de microorganismos [13], y la humedad (34.7%) garantiza condiciones aeróbicas del cultivo [12]. Con respecto a los porcentajes de materia orgánica (10.6%) y carbono orgánico (4.6%), según Fassbender y Bornemisza [14], éstos pueden considerarse altos. Por lo anterior, y teniendo en cuenta las afirmaciones de Hang [15] y Donézar [13], esta matriz presenta condiciones adecuadas para el desarrollo microbiano.
La mayor velocidad de la degradación de los plaguicidas malatión y metil paratión indica que los consorcios microbianos presentes en las matrices usadas tienen el sistema enzimático que degrada estos compuestos. Sin embargo, el clorpirifos también puede ser degradado en suelos [16]. La degradación del malatión y metil paratión fue mucho más rápida al comienzo, como ocurre normalmente en los procesos biológicos [17, 18], ya que en este momento se presentan mayores concentraciones de sustrato.
La ausencia de efectos por el enriquecimiento con nutrientes inorgánicos sobre la actividad microbiana se ajustó a lo reportado por Kong et al. [19] quienes afirman que la aplicación a largo plazo de fertilizantes químicos sobre un suelo Udoll no induce cambios significativos sobre la biomasa y la diversidad microbiana.
La disminución de la capacidad microbiana para degradar clorpirifos y metil paratión, como consecuencia de la adición de P (en relación 100:1 C:P), puede justificarse con los reportes de Tabatabai [20] y de Wilson y Jones [21], quienes comprobaron que una alta concentración de fósforo puede suprimir la actividad fosfatasa de las comunidades microbianas. La enzima fosfatasa cumple una función importante en la eliminación de grupos fosfato, presentes en las estructuras químicas de diversos compuestos [22].
La semejanza observada en la degradación de los plaguicidas con el tratamiento a base de fertilizante y el control concuerda con los reportes de Akhtar et al. [23], quienes afirman que la adición de fertilizantes sintéticos en un suelo agrícola durante dos meses no tiene efecto alguno sobre la persistencia de los pesticidas organofosforados clorpirifos y fenpropatrin. Igualmente, Siddaramappa et al. [24] observaron que la aplicación de sulfato de amonio y urea sobre un suelo utilizado para el cultivo de arroz tuvo poca influencia en la degradación de carbofuran.
5 AGRADECIMIENTOS
Agradecemos a COLCIENCIAS por su soporte económico, a los grupos de investigación GEMA, GDCON y biotecnología por su apoyo logístico, a Aleida Ochoa Higuita por su apoyo técnico, y a la Universidad de Antioquia y a la Universidad de Medellín por el apoyo general que ha hecho posible el desarrollo de este estudio.
REFERENCIAS
[1] H. Fang et al., "Degradation of chlorpyrifos in laboratory soil and its impact on soil microbial functional diversity," Journal of Environmental Sciences, vol. 21, no. 3, pp. 380-386, 2009. [ Links ]
[2] G. Renella et al., "Hydrolase activity, microbial biomass and community structure in long-term Cd-contaminated soils," Soil Biol. Biochem., vol. 36, no. 3, pp. 443-451, 2004. [ Links ]
[3] J. Z. He et al., "Molecular bacterial diversity of a forest soil under residue management regimes in subtropical Australia," FEMS Microbiol. Ecol, vol. 55, no. 1, pp. 38-47, 2006. [ Links ]
[4] J. R. De Lipthay et al., "Effect of herbicide concentration and organic and inorganic nutrient amendment on the mineralization of mecoprop, 2,4-D and 2,4,5-T in soil and aquifer samples," Environmental Pollution, vol. 148, pp. 83-93, 2007. [ Links ]
[5] M. Vidali, "Bioremediation. An Overview," Pure Appl. Chem., vol. 73, no. 7, pp. 1163-1172, 2001. [ Links ]
[6] ICONTEC, Norma Técnica Colombiana 5167: Productos para la industria agrícola. Materiales orgánicos usados como fertilizantes y acondicionadores del suelo, Reporte, Bogotá D.C., 2003. [ Links ]
[7] S. Arias et al., "Lixiviación de nitratos en dos suelos al alterar sus propiedades físicas," Revista EIA, no. 2, pp. 35-40, 2004. [ Links ]
[8] A. Walkley, y A. Black, "An examination of the degtjareff method for determining soil organic matter, and a proposed modification of chromic acid titration method," Soil Science, vol. 37, no. 1, pp. 29-38, 1934. [ Links ]
[9] B. Motta, Métodos analíticos del laboratorio de suelos, 5 ed., Bogotá: Instituto Geográfico Agustín Codazzi, 1990, 502 p. [ Links ]
[10] P. S. C. Rao, y A. G. Hornsby, Behavior of Pesticides in Soils and Water, Reporte, Institute of Food and Agricultural Sciences. , 2001. [ Links ]
[11] M. C. Leconte et al., "Co-composting rice hulls and/or sawdust with poultry manure in NE Argentina," Waste Management, vol. 29, no. 9, pp. 2446-2453, 2009. [ Links ]
[12] L. Alcalá del Olmo, "Ensayos para la caracterización físico-química de las muestras en contraminación de suelos," en Contaminación y depuración de suelos, F. López Santiago y F. J. Ayala Carcedo, eds., pp. 119-134, Madrid, 1995. [ Links ]
[13] M. Donézar, "Estudios de suelos y evaluación de tierras," en Contaminación y depuración de suelos, F. López Santiago y F. J. Ayala Carcedo, eds., pp. 11-34, Madrid, 1995. [ Links ]
[14] H. W. Fassbender, y E. Bornemisza, Química de suelos con énfasis en suelos de América Latina, San Jose, Costa Rica: Instituto Interamericano de Cooperación para la Agricultura, 1994, 423 p. [ Links ]
[15] S. Hang, Destino de los Plaguicidas en el Ambiente Suelo, Reporte, Universidad Nacional de Córdoba. Depto de Recursos Naturales. Facultad de Ciencias Agropecuarias., Córdoba, Argentina, 2003. [ Links ]
[16] M. Lopera et al., "Evaluación de la degradación del plaguicida clorpirifos en muestras de suelo utilizando el hongo Phanerochaete chrysosporium," Revista Facultad De Ingenieria Universidad De Antioquia, no. 33, pp. 58-69, 2005. [ Links ]
[17] R. Mosquera, y G. Peñuela, "Biodegradación del malatión usando microorganismos nativos de suelos agrícolas," Revista Colombiana De Ciencias Pecuarias, vol. 22, pp. 189-198, 2009. [ Links ]
[18] R. López, "Adsorción, disipación y movimiento de simazina en el suelo arenoso de un viñedo del valle de Casablanca," Tesis de Maestría, Pontificia Universidad Católica de Chile, Santiago de Chile, 2004. [ Links ]
[19] W.-D. Kong et al., "Effect of Long-Term Application of Chemical Fertilizers on Microbial Biomass and Functional Diversity of a Black Soil," Pedosphere, vol. 18, no. 6, pp. 801-808, 2008. [ Links ]
[20] A. Tabatabai, "Soil Enzymes," en Methods of soil analysis, Part. 2. Microbiological and Biochemical Properties., S. H. Mickelson y J. M. Bigham, eds., pp. 775-833, Madison, U.S.A.: Soil Science Society, 1994. [ Links ]
[21] S. C. Wilson, y K. C. Jones, "Bioremediation of soil contaminates with polynuclear aromatic hydrocarbon (PAHs): a review," Environmental Polluted, vol. 81, no. 3, pp. 1103-1106, 1993. [ Links ]
[22] L. M. Castañeda, "Estudio de la biodegradación del Clorpirifos y su principal producto de degradación, el TCP, en muestras de suelo contaminado con clorpirifos," Tesis de Maestría, Universidad de Antioquia, Medellín, 2005. [ Links ]
[23] S. Akhtar et al., "Persistence of chlorpyrifos and fenpropathrin alone and in combination with fertilizers in soil and their effect on soil microbes," Pakistan Journal of Botanic, vol. 36, no. 4, pp. 863-870, 2004. [ Links ]
[24] R. Siddaramappa, y J. N. Seiber, "Persistence of Carbofuran in flooded rice soils and water," Progressive water technology, vol. 11, pp. 103-111, 1979. [ Links ]
Recibido: 25/08/2010
Aceptado: 11/05/2011