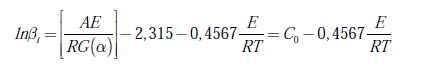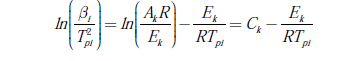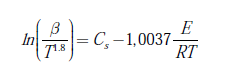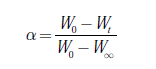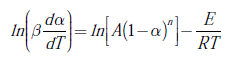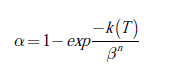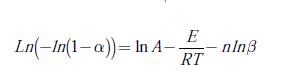INTRODUCCIÓN
Los análisis termogravimétricos son realizados principalmente con dos objetivos: I) Para obtener información sobre el mecanismo de reacción, con el cual es posible modificar el curso de la reacción o predecir el comportamiento de reacciones similares, y/o II) para determinar los valores de los parámetros cinéticos de la reacción, con la finalidad de calcular velocidades de reacción por interpolación o extrapolación bajo condiciones de reacción diferentes a aquellas en las cuales se hacen los análisis [1].
Los experimentos de análisis térmico regularmente involucran reacciones heterogéneas, al menos un reactivo sólido, y aumento o disminución continuos de la temperatura (generalmente lineal). Por esto, el análisis cinético debe enfocarse en las ecuaciones de velocidad de reacciones heterogéneas bajo condiciones no isotérmicas [1]. Existen numerosas contribuciones sobre análisis cinético no isotérmico [2-3], donde la mayoría de estos métodos parten de enfoques comunes. Algunas observaciones que se deben tener presentes son: 1) problemas de medición de la temperatura de la muestra (ocasionadas por la transferencia de calor desde el horno a las regiones exteriores de la muestra y posteriormente al interior de la misma), 2) el auto-calentamiento o auto-enfriamiento de la muestra durante la reacción, y 3) la influencia de los gases producidos en la velocidad de reacción, cuando esta es altamente reversible [1].
Comúnmente se encuentra información sobre análisis termogravimétricos en procesos de pirólisis [4-8], mientras que las publicaciones sobre termogravimetría en condiciones de combustión son más limitadas [3y9]. Valente et al. (2015)[3] estudian la termogravimetría de residuos del proceso de elaboración de vino, en un proceso de combustión. Encontraron que la descomposición térmica de estos residuos se lleva a cabo en diferentes etapas sin formación de intermediarios estables. La variación de cada etapa está relacionada principalmente con la concentración de humedad (HM), materia volátil (MV) y carbono fijo (CF) de cada una de las muestras. Las curvas obtenidas por medio de la termogravimetría derivativa (DTG) presentan tres picos principales que corresponden al secado (evaporación del agua), a la liberación de la MV y a la degradación del CF de las muestras. En estas curvas se encontró que los escobajos presentan una velocidad de degradación térmica mayor, con un perfil de combustión más cercano al eje de las ordenadas, comparados con las curvas DTG de los hollejos y semillas. Este comportamiento indica que en procesos de combustión, este residuo presentará un tiempo de residencia en caldera menor a los hollejos y semillas [3].
El objetivo de este trabajo es establecer los parámetros cinéticos de combustión (energía de activación y orden de reacción) de combustibles densificados obtenidos de residuos del cultivo (sarmientos) y procesamiento de la uva Isabela (hollejos, escobajos y semillas) y de dos mezclas de ellos. La energía de activación se determinó empleando los métodos iso-conversiones de Starink y Friedman, mientras que el orden de reacción se calculó por medio del método de Avrami.
1. MATERIALES Y MÉTODOS
1.1. Caracterización de las briquetas
Los residuos de uva, escobajos (Es), hollejos (Ho), sarmientos (Sr) y semillas (Sm) se obtuvieron en una finca del Valle de Cauca (Colombia) y de una planta de producción de jugos. Estos residuos se secaron, se molieron y se compactaron en una prensa hidráulica. Los residuos compactados comúnmente se conocen como combustibles densificados o briquetas. Se prepararon cinco tipos de residuos compactos: 1) briquetas de sarmientos (BSr), 2) briquetas de hollejos (BHo), 3) briquetas de escobajos (BEs), 4) briquetas de la mezcla de residuos teniendo en cuenta la proporción en masa que se produce de Sr (32,7%) en una hectárea de cultivo y la proporción de Es (18,7%), Ho (21,5%) y Sm (27,1%) que se generan en la producción de jugo de uva (BM1), y 5) briquetas de la mezcla en iguales proporciones en masa de los cuatro residuos (BM2). No se prepararon briquetas de semillas, porque estas al salir del molde de la prensa se desintegraban y no conservaban la forma de la briqueta, debido a la presencia de aceite que actúa como lubricante y evita la compactación del material. Las briquetas se caracterizaron por medio del análisis próximo (HM, MV, CF y ceniza - CZ), poder calorífico (HHV), análisis elemental (Carbono, C, Hidrógeno, H, Nitrógeno, N, Azufre, S y Oxígeno, O) y análisis termogravimétrico. Con el análisis próximo se determinó el índice de reactividad MV/CF, el cual establece que al comparar dos muestras, la más reactiva en el proceso de combustión es aquella que presente el mayor valor de este índice.
1.2. Análisis termogravimétrico
Esta prueba se realiza en un analizador termogravimétrico marca TA, SDT Q600, en el que se evalúa la pérdida de peso de los residuos de uva en un proceso de combustión, a tres velocidades de calentamiento. De tal manera que se registra el cambio del peso de la muestra respecto al tiempo o la temperatura. El análisis se realiza con un tamaño de muestra entre 8 y 10 mg, en atmósfera oxidante de aire a una velocidad de flujo de 100 ml/min y a velocidades de calentamiento de 10, 20 y 40 °C/min.
1.3. Parámetros cinéticos de la combustión
La energía de activación y el orden de reacción, como parámetros cinéticos de combustión en estado sólido, de las briquetas se obtienen empleando los resultados del análisis termogravimétrico. La energía de activación se calcula por medio de dos métodos cinéticos iso-conversionales: el método Starink y el método Friedman, mientras que el orden de reacción se evalúa utilizando la metodología de Avrami. El método Starink es una aproximación obtenida por la combinación de los métodos de Flynn-Wall-Ozawa (FWO) [10] y Kissinger-Akahira-Sunose (KAS) [11], cuyas expresiones matemáticas se muestran en las ecuaciones (1) y (2), respectivamente.
El método de Starink argumenta que las expresiones de aproximación del método FWO y del método KAS pueden ser transformadas en la misma fórmula general, la cual es descrita como se muestra en la ecuación (3), donde β es la velocidad de calentamiento (β = dα / dT); T es la temperatura en K; E es la energía de activación, y R es la constantes de los gases (8,315 J/mol K) [12]. Este método se diferencia de los métodos FWO y KAS por calcular, con mayor precisión, los valores de la energía de activación [4].
El método Starink se trabaja con la conversión de la biomasa, α, calculada mediante la ecuación (4), donde W 0 , W t y W ∞ son las masas de la muestra al inicio, al tiempo t y al final de la reacción, respectivamente, de tal manera que se fijan diferentes valores de conversión (entre 0 y 1) en los datos de TGA de las tres velocidades de calentamiento. Para cada valor fijo de conversión se lee la temperatura en cada una de las tres velocidades de calentamiento. Con estos datos se prepara un gráfico de ln(β / T 1,8 ) versus 1/ T, obteniéndose una línea recta, donde la pendiente corresponde al término -1,0037E/RT de la ecuación (3), del cual se calcula la energía de activación.
El método Friedman se evalúa empleando la ecuación (5)[13], donde A y n representan el factor de frecuencia y el orden de reacción, respectivamente. Al igual que en el método de Starink, aquí se fijan diferentes valores de conversión y al graficar ln(β(dα / dT)) versus 1 / T se obtiene la pendiente, que corresponde a la energía de activación.
El orden de reacción se calcula por medio del método de Avrami dado por la ecuación (6). En la ecuación, k es la constante de velocidad y está representada por la ecuación de Arrhenius: k (T)= Aexp(−E / RT). Esta ecuación se manipula aplicando doble logaritmo y se obtiene la ecuación (7). Este método consiste en fijar una temperatura, y leer la conversión a dicha temperatura en los datos de TGA para cada velocidad de calentamiento. Posteriormente, se hace una gráfica de Ln(−ln(1−α)) versus Lnβ- para cada temperatura fija, y se obtiene una línea recta, de cuya pendiente se calcula el orden de reacción, n.
2. RESULTADOS Y DISCUSIÓN
2.1. Caracterización de las briquetas
Las briquetas se caracterizaron a través del análisis próximo, último y poder calorífico, como se presenta en la tabla 1. El análisis próximo de las briquetas muestra que las BEs tienen la mayor concentración de CF (22,15%), seguidas por las BM1 (17,22%) y BM2 (17,52%). El mayor porcentaje de MV se presenta en las BHo (84,98%) y BSr (81,82%), mientras que la mayor cantidad de cenizas se encuentran en las BEs (6,21%). El porcentaje de humedad es similar en todas las briquetas, donde el rango varía entre 5,72 y 6,86%, valores que corresponden a las BHo y BM2, respectivamente. Respecto a índice de reactividad, las BHo son las más reactivas (MV/CF = 6,90), lo cual es coherente con la mayor relación atómica H/C de este briqueta, que indica un mayor contenido de estructuras moleculares con alto contenido del hidrógeno, mientras que las briquetas menos reactivas son las BEs (MV/CF = 3,23). Estos tipos de cuantificaciones de la reactividad son estimaciones iniciales que deben ser corroboradas con valores de la energía de activación como medida cinética de la reactividad.
Tabla 1 Análisis próximo, último y poder calorífico de las briquetas.
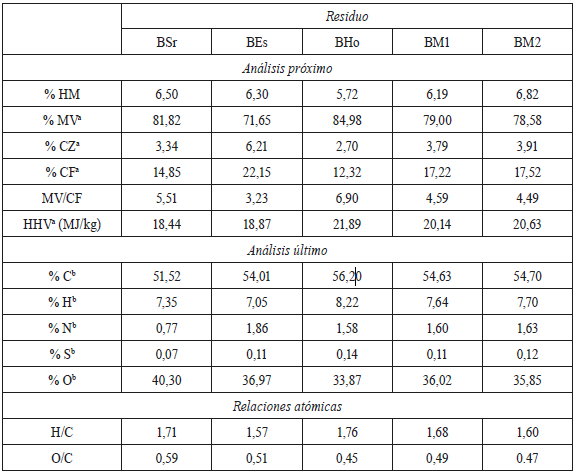
a Base seca; b base seca libre de cenizas
Fuente: elaboración propia
En los resultados del HHV, mostrados en la tabla 1, las BHo (21,89 MJ/kg) reportan el mayor contenido energético, seguidas por la BM1 (20,15 MJ/kg) y BM2 (20,63 MJ/ kg). El mayor HHV en las BHo es congruente con los datos del análisis último, debido a que estas briquetas tienen el mayor porcentaje de C y H, y menor contenido de O, respecto a las otras muestras. Lo anterior significa que en su estructura se encuentra un mayor número de enlaces C-H, los cuales liberan más energía que los C-O, cuando son sometidos a combustión. La relación entre el HHV y el análisis último también se observa en las BSr y BEs, las cuales tienen menor concentración de C y mayor contenido de O, respecto a las demás briquetas, indicando que el HHV es menor.
2.2. Termogravimetría de los combustibles densificados
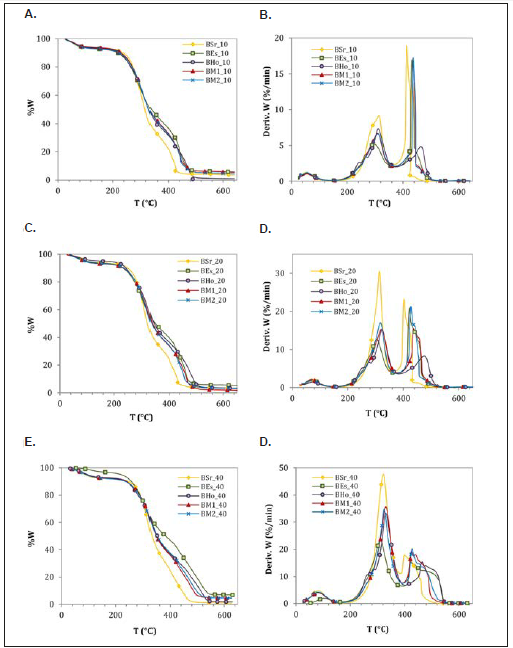
Los análisis termogravimétricos de las briquetas se realizan en atmósfera oxidante a 10, 20, y 40 °C/min, como se presenta en los perfiles TG-DTG de la figura 1. Esta figura muestra que las curvas TG tienen un comportamiento similar en todas las briquetas evaluadas, donde la biomasa se descompone en varias etapas sin formación de compuestos intermedios estables. De la misma manera, las curvas DTG de las briquetas presentan la misma tendencia, la cual consta de tres picos principales que corresponden a secado, desvolatilización y combustión carbonizado [1,9y14].
Fuente: elaboración propia
Figura 1 Curvas TG (A., C., E.) y DTG (B., D., F.) de las briquetas, realizadas a velocidades de calentamiento de 10, 20 y 40 °C/min.
Con la finalidad de entender mejor el comportamiento en la degradación térmica a la combustión de las briquetas se construye la tabla 2 que reúne los parámetros: temperatura de la región de reacción (Trr), temperatura pico donde se tiene la máxima velocidad de pérdida de peso (Tp), velocidad máxima de pérdida de peso (DTGmax) y pérdida de masa total (PM). En esta tabla se observa que Trr aumentan al incrementar la velocidad de calentamiento. En la primera y segunda zonas, los parámetros Tp y DTGmax, incrementan su valor al aumentar la velocidad de calentamiento. Sin embargo, la tercera zona no presenta una tendencia clara en estos parámetros.
Tabla 2 Parámetros de degradación térmica de las briquetas.
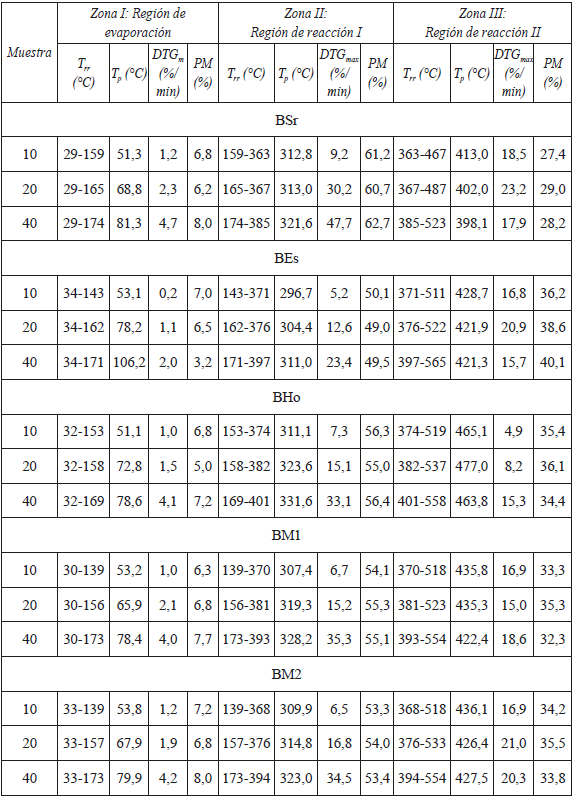
Trr: Temperatura inicial y final de la región, Tp: Temperatura de la máxima pérdida de peso, DTGmax: Máxima velocidad de pérdida de peso, ML: Pérdida de peso total.
Fuente: elaboración propia
Por otra parte, el parámetro PM muestra pequeñas fluctuaciones en las diferentes velocidades de calentamiento evaluadas. Este comportamiento también es reportado por Jeguirim y Trouvé (2009)[15] quienes explican que la pérdida de masa en cualquier zona está determinada principalmente por los componentes mayoritarios de la muestra evaluada, lo cual no se ve afectado por la velocidad de calentamiento.
Si se compara los perfiles DTG a 20 °C/min de las briquetas, se puede observar que la temperatura a la que inicia la desvolatilización es similar en todas las muestras (156 - 165 °C). Sin embargo, la temperatura final de la combustión del carbonizado (región de reacción II) varía de 487 a 537 °C, valores que corresponden a las BSr y BHo, respectivamente. Estos resultados indican que el tiempo de residencia de las BHo es mayor que el resto de briquetas en el proceso de combustión; por tanto, este tipo de briqueta requiere más tiempo para entregar la energía que contiene.
2.3. Parámetros cinéticos
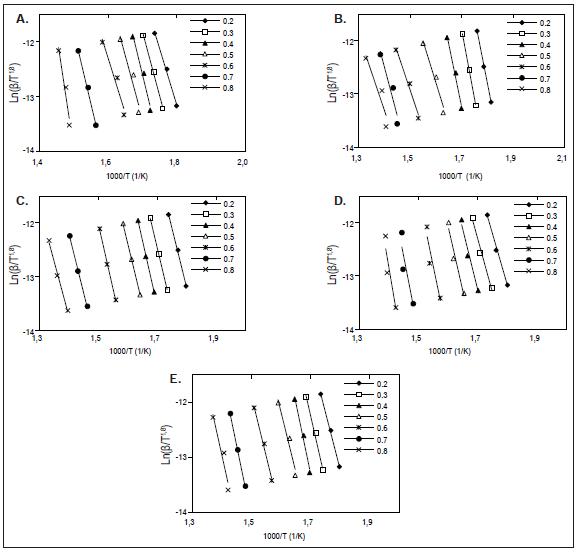
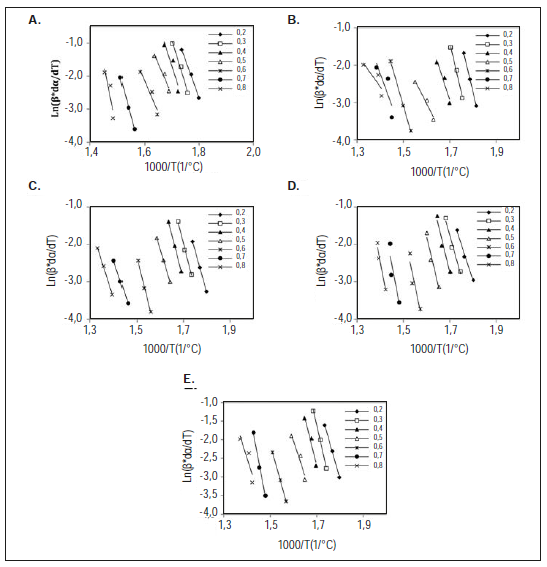
Con los resultados del análisis termogravimétrico de las briquetas se determina la energía de activación siguiendo los métodos Starink y Friedman, y el orden de reacción, por medio de la metodología de Avrami. En las figuras 2 y 3 se presentan las líneas de regresión (con coeficientes de regresión lineal cercanos a la unidad) calculadas a cada una de las briquetas, empleando los métodos Starink y Friedman, respectivamente, para valores de conversión fijos entre 0,2 y 0,8.
Fuente: elaboración propia
Figura 2 Regresión lineal de la energía de activación propuesta por el método Starink. A. BSr, B. BEs, C. Bho, D. BM1, E. BM2.
Fuente: elaboración propia
Figura 3 Regresión lineal de la energía de activación propuesta por el método Friedman. A. BSr, B. BEs, C. BHo, D. BM1, E. BM2.
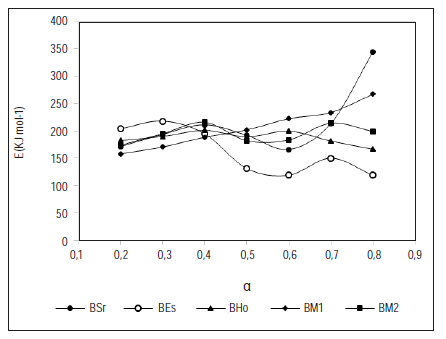
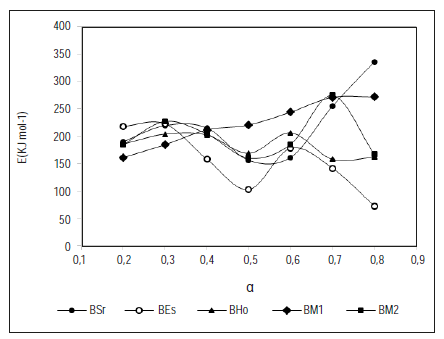
A partir de las figuras 2 y 3, y las ecuaciones (3) y (5), se determina la energía de activación para cada método, y se evalúa la variación de la energía de activación con la conversión, como se muestra en las figuras 4 y 5.
En las dos figuras se observa que la energía de activación de las cinco briquetas evaluadas varía entre las diferentes conversiones, en los dos métodos. Este comportamiento se debe a que la biomasa presenta diferentes componentes que generan numerosas reacciones en paralelo y consecutivas [2y9]. Gai et al. (2013)[4] reportan valores de energía de activación similares a los encontrados en el presente trabajo, los cuales fueron calculados a residuos agrícolas empleando el método Starink. También se aprecia que las energías de activación de cada uno de los residuos, obtenidas por el método Starink y el método Friedman a la misma conversión, presentan pequeñas diferencias.
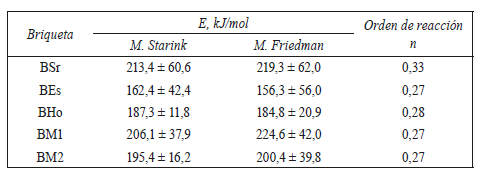
En la tabla 3 se presenta la energía de activación promedio determinada por los métodos Starink y Friedman, y el orden de reacción para cada una de las briquetas. En esta tabla se observa que los valores de energía de activación por los dos métodos son ligeramente cercanos, pero al comparar las desviaciones estándar de cada residuo, se encentra que son menores en el método de Starink. Esto confirma el hecho que el método Starink presenta mayor precisión en los valores de energía de activación comparado con otros métodos [4].
Teniendo en cuenta este valor promedio, la tabla muestra que las BSr y BM1 son las briquetas con la energía de activación mayor, mientras que BEs presenta la energía de activación más baja. Esto indica que la reactividad en la combustión de las Bes es mayor que en el resto de las briquetas, por requerir menor energía para iniciar su incineración. Esto es coherente con los valores de la temperatura pico (Tp) en la zona II, zona que controla la cinética del proceso dado que allí se lleva a cabo la mayor parte de la reacción química, que para la BEs reporta los menores valores de Tp, confirmando la menor energía de activación y la mayor reactividad entre las briquetas en estudio. Respecto al orden de reacción, todas las briquetas, excepto la BSr (orden de reacción 0,33), presentan aproximadamente el mismo orden de reacción (0,27).
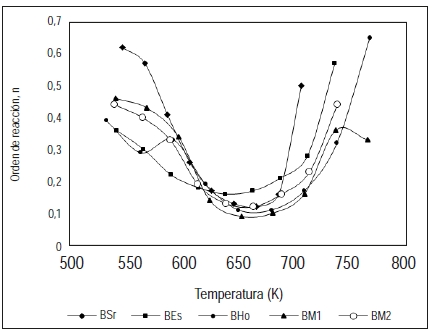
Los resultados de la regresión lineal de la metodología de Avrami se muestran en la figura 6, donde se evalúa la dependencia del orden de reacción con la temperatura, empleando siete niveles de temperatura a tres velocidades de calentamiento. En la figura se observa que en cada una de las briquetas, el orden de reacción presenta diferentes valores respecto a los niveles de temperatura evaluados. Estos valores, siguen una tendencia similar a medida que aumenta la temperatura de reacción. Dicho comportamiento también es reportados por Gai et al. (2013)[4] y muestra que, aunque los mecanismos de reacción de la combustión no son iguales en las diferentes briquetas, sí tienen un comportamiento similar, sobre todo en un rango de temperatura de 600 a 700 °C.
CONCLUSIONES
El método Starink reporta mayor precisión en los valores calculados de energía de activación respecto a los obtenidos por el método Friedman. Esto se sustenta por los menores valores de la desviación estándar registrados por el método Starink.
Aunque la energía de activación es el parámetro ampliamente reportado en la literatura para determinar la reactividad, esta puede ser complementada con el análisis de las temperaturas de pico como medida de la reactividad.
Se aprecia claramente cómo el índice de combustibilidad (MV/CF) no es suficiente para cuantificar la reactividad porque se debe determinar la energía de activación como parámetro cinético que cuantifica la reactividad.
Se encontró que de las briquetas preparadas, la BEs es más reactiva a la combustión, debido al menor valor de energía de activación reportado por esta, lo que indica que requiere menor energía para iniciar su incineración. Esto también se comprueba por las menores Tp encontradas en la zona II para esta briqueta.