Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.7 no.1 Popayán Jan./June 2009
EL USO DE HONGOS MICORRÍZICOS ARBUSCULARES COMO UNA ALTERNATIVA PARA LA AGRICULTURA
ARBUSCULAR MYCORRHIZAL FUNGI AS ALTERNATIVE TO SUSTENTABLE AGRICULTURE
SILVIA E. BARRERA B.1
1Bióloga, Escuela de Biología, Facultad de Ciencias, Universidad Industrial de Santander, Calle 9, Carrera 27, Ciudad Universitaria, Bucaramanga, Colombia.
Correspondencia: Silvia Eugenia Barrera Berdugo: e-mail: silviaebarrera@tux.uis.edu.co.
Recibido para evaluación: Febrero 6 de 2009. Aprobado para publicación: Mayo 5 de 2009
RESUMEN
Los hongos micorrízicos arbusculares (HMA) son organismos del suelo que viven simbióticamente con la mayoría de plantas. Ellos les aportan beneficios, dándoles ventajas con respecto a las plantas no micorrizadas, como por ejemplo facilitándole a la planta la toma de nutrientes de baja disponibilidad o de poca movilidad en el suelo, evitando la acción de microorganismo patógenos en la raíz, aumentando la tolerancia de la planta a condiciones de stress abiótico en el suelo, entre otros beneficios. El establecimiento de la simbiosis entre el hongo y la planta lleva a una secuencia de etapas de reconocimiento causando cambios tanto morfológicos como fisiológicos en los dos organismos que interactúan. Como herramienta biotecnológica el uso de estos microorganismos es de gran importancia, por lo que se requiere conocer acerca del efecto que las condiciones físico-químicas del suelo causan en ellos, para lograr un mejor beneficio en la agricultura. Se puede hablar de especificidad entre HMA y hospederos debido a la respuesta de los HMA a las condiciones edáficas del suelo y a otras características, como el metabolismo de las plantas, la arquitectura de la raíz y las estrategias ecológicas de los hongos. El uso de HMA en la agricultura contribuye a mejorar el nivel nutricional de la planta, sin embargo, la condición de monocultivo en los agroecosistemas, puede estar causando una disminución en la diversidad de HMA y como consecuencia, estos microorganismos podrían estar brindando un efecto aunque benéfico, limitado a los hospederos.
PALABRAS CLAVES:
Hongos micorrizicos arbusculares, agricultura, simbiosis, especificidad, condiciones edáficas del suelo.
ABSTRACT
The arbuscular mycorrrhizal fungi (AMF) are soil fungi which form mutualistic symbiosis with the roots of plants. The AMF give to the host a variety of benefits with respect to the non-host plants, for example, increased uptake of immobile or low availability nutrients from the soil, enhanced resistance to soil-bome pest and diseases, improved resistance to abiotic stress. The establishment of the symbiosis between AMF and host plants involves a sequence of recognition events leading to the morphological and physiological integrations of the two symbionts. The use of the AMF as biotechnology tool is important, hence the need to know about the effect that soil physical-chemical conditions causing them, to achieve a better profit in agriculture. We can talk about specificity between AMF and host due the responses of AMF to the soil edaphic conditions, plant's metabolisms, root architecture and ecological strategies of the AMF. The use of AMF in agriculture contribute to improve the nutritional level of the plant, however, monocultures in the agroecosystem, may be causing a decline in the AMF diversity and as a result these microorganism could be offering beneficial effects, but restricted to the host.
KEYWORDS:
Arbuscular mycorrhizal fungi, agriculture, symbiosis, specificity and soil edaphic conditions.
INTRODUCCIÓN
Los hongos micorrízicos arbusculares (HMA) son microorganismos del suelo que forman simbiosis con el 80% de las plantas terrestres [1, 2], formando arbúsculos, vesículas (en algunas especies) e hifas, dentro de las células corticales de las plantas que colonizan [3]. Su distribución además de amplia, ya que se encuentran en todos los ecosistemas y suelos, puede ser muy heterogénea en un mismo sitio en cuanto a variedad y cantidad, lo que es un requisito importante para que la planta obtenga el máximo beneficio de la asociación [4]. Esta asociación simbiótica entre el hongo y la planta, actúa como un complemento de la raíz de la planta en la toma de nutrientes [5], especialmente en la absorción de P [6], aumento de la tolerancia a condiciones de stress abiótico, mejoramiento de la calidad del suelo, fijación de N2 [7] y aumento en la diversidad y productividad de las plantas en un ecosistema determinado [8, 9].
Desde el punto de vista nutricional, el crecimiento de la planta debido al aumento en la absorción de P es el principal beneficio que obtiene del HMA, por la baja disponibilidad de este elemento, característico en los suelos tropicales [10]. Sin embargo, si el P no es un elemento limitante en el suelo, la simbiosis puede llegar a ser reducida o hasta inhibida si se encuentran altos niveles en el suelo [10].
También es importante notar que el HMA permite a la planta usar de manera mas eficiente los nutrientes del suelo, razón por la cual se pueden reducir los problemas de contaminación de éste por el exceso de fertilizantes químicos, si hay una reducción en la aplicación de los mismos [11].
A pesar del vasto conocimiento adquirido sobre esta simbiosis en distintos cultivos de interés agronómico y económico, como cacao [12], palma de aceite [13, 14, 15], maíz [16] papa [17, 18] y café [19], aún hay procesos en las etapas de reconocimiento planta-hongo y en la colonización de la raíz que son desconocidas.
Existe controversia en torno a cómo la diversidad de las comunidades de HMA tiende a disminuir en ecosistemas naturales transformados a agroecosistemas [20]. Los monocultivos por ejemplo después de años de manejo agrícola pueden reducir la abundancia de las especies fúngicas [20, 21].
Aparentemente, las especies de HMA no tienen especificidad en la elección de sus hospederos [22]. Sin embargo, diferencias en los efectos que las especies de HMA causan sobre el crecimiento de los individuos de especies vegetales, indican que éstas responden a especies específicas de HMA [9, 23] y consecuentemente, hay un aumento en la diversidad y productividad de las plantas en un ecosistema determinado [23].
La implementación de la fertilización ecológica como una forma de agricultura ecológica sostenible, donde se utilizan abonos verdes, humus, compost, o microorganismos beneficiosos, en este caso los HMA, para movilizar y reciclar nutrientes y aprovechar la fertilidad del suelo, es importante y de gran interés como una alternativa ecológica de la cual se van a generar mejores resultados que los obtenidos por el uso de fertilizantes convencionales. El objetivo de esta revisión es por lo tanto, mostrar el conocimiento actual del uso de HMA en plantas de interés agrícola, no solo desde el punto de vista nutricional, sino también si se comportan como organismos generalistas o específicos y como influyen las características edáficas del suelo en este comportamiento.
LA SIMBIOSIS PLANTA-HONGO
Los hongos micorrízicos arbusculares (HMA) se caracterizan por presentar un crecimiento intra e intercelular en la corteza de la raíz y por formar dos tipos de estructuras, arbúsculos (Figura. 1a) y vesículas (Figura. 1b) [24]. Los arbúsculos son hifas que se dividen dicotómicamente, son invaginados por la membrana plasmática de las células corticales y presentan periodos de vida cortos, mientras que las vesículas son estructuras de almacenamiento que se forman en la parte terminal de las hifas [25]. Los géneros Gigaspora y Scutellospora no producen vesículas, en lugar de ellas forman células auxiliares [26].
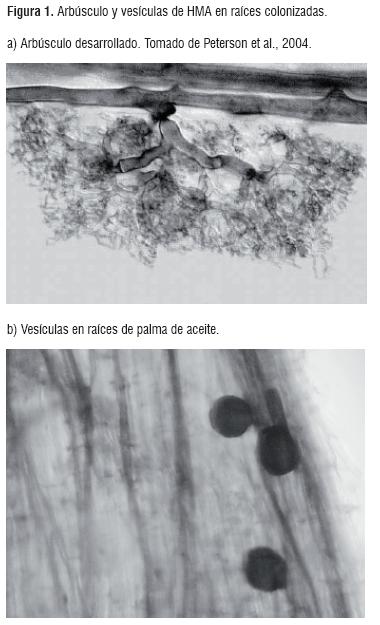
Las hifas externas pueden ser de tres tipos según su morfología y las funciones que llevan a cabo: las hifas infectivas, son las que inician los puntos de colonización en una o varias raíces; las hifas absorbentes son las que se encargan de explorar el suelo para la extracción de nutrientes y las hifas fértiles son las que llevan las esporas [27].
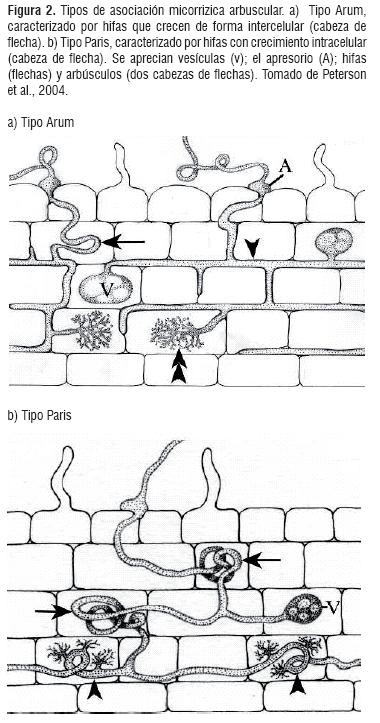
Pueden observarse dos tipos morfológicos de colonización, el tipo "Arum" (Figura. 2a), donde las hifas presentan crecimiento intercelular y los arbúsculos se encuentran dentro de las células corticales de la raíz; y el tipo "Paris" (Figura. 2b) en el cual las hifas presentan crecimiento intracelular al igual que los arbúsculos, pero forman enrollamientos cuando están dentro de la célula [25, 26, 28].
El crecimiento del hongo de manera asimbiótica se da entre una o dos semanas hasta que hace contacto con la raíz del hospedero, formando una estructura llamada Apresorio por donde penetrarán las hifas a las células corticales de la raíz, para formar los arbúsculos e incrementar el área de contacto entre la planta y el hongo [29].
Cuando las plantas son invadidas por microorganismos del suelo, se inician una serie de cambios fisiológicos y bioquímicos que no ocurren cuando un HMA coloniza la planta, esto soporta la hipótesis de que el hongo emite señales que reconoce la planta para que esta no inicie una reacción de defensa [30].
Adicionalmente, la planta también libera compuestos de naturaleza volátil o difusible (exudados) que estimulan el crecimiento de la hifa en diferentes puntos de control mientras se da la colonización fúngica [30].
Según Elias y Safir [31], la estimulación de los exudados sobre la elongación hifal es mayor en plantas deficientes en fósforo (P). En resultados obtenidos por ellos, se presentaron grandes diferencias en cuanto al crecimiento hifal en plantas con ausencia de este elemento a las dos semanas de iniciado el experimento, lo que sugiere que la acción estimulante sobre el crecimiento hifal se debe a la calidad de los exudados de las plantas desprovistas de P más que a la cantidad liberada, debido a que en este tiempo la longitud del sistema radical y la cantidad de exudados tanto de plantas deficientes y no deficientes en P fue similar.
EL USO DE LOS HMA EN LOS AGROECOSISTEMAS
En la agricultura, el uso de HMA tiene un gran potencial biotecnológico debido a que facilitan la disponibilidad de nutrientes para las plantas. Por lo tanto, plantas micorrizadas poseen una ventaja importante con respecto a las plantas no micorrizadas [32]. sin embargo, el conocimiento sobre las interacciones entre las condiciones edáficas y la ecología de los HMA nativos y la efectiva asociación simbiótica entre las plantas y estos microorganismos es limitado [16]. Por esta razón, el análisis de poblaciones de HMA nativos y su ambiente edáfico, pueden conducir a su uso eficiente en la agricultura [16], especialmente, de países en vías de desarrollo.
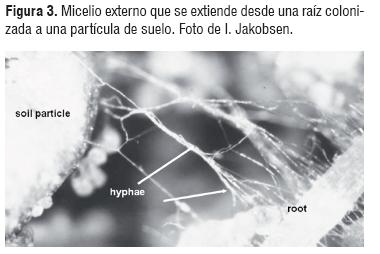
La importancia de los HMA en la agricultura radica en que por su extenso micelio extra radical (Figura 3), se forma un vínculo entre la planta y el suelo debido a que al darse la asociación planta-hongo, las plantas micorrizadas presentan ventajas en cuanto a la absorción de nutrientes de poca movilidad (como el P) con respecto a las plantas no micorrizadas, ya que en las primeras el micelio externo se extiende a una mayor distancia en el suelo que los pelos radicales de las plantas no micorrizadas [10]. Como se mencionó antes, el crecimiento de la planta se da debido al aumento de la absorción de P por la baja disponibilidad de este elemento característico en los suelos tropicales; sin embargo, la simbiosis se puede reducir o inhibir si el nivel de P en el suelo es alto y la raíz de la planta puede absolverlo por sí misma [10].
Se utilizan dos métodos importantes para manejar los HMA en la agricultura, uno de ellos es trabajar con hongos nativos con el fin de obtener el mejor beneficio de ellos, estimulando uno o varios de los géneros después de que han sido determinados, y el otro es introducir o inocular los HMA seleccionados que puedan ser manejados con prácticas agronómicas que ya hayan sido utilizadas con estos hongos [4, 33]. El problema de este método está en que la inoculación puede alterar la acción de HMA nativos eficientes, al tener que competir con los hongos seleccionados [4]. Sin embargo, es una opción importante ya que sistemas de monocultivos reducen la abundancia de las especies fúngicas [20, 21, 34], debido a que limitan los beneficios que le proporcionan los HMA a la planta, al seleccionarlos [20]. En chile, en estudios en invernadero donde se han empleado HMA nativos y comerciales para inocular suelo nativo de cultivos de pimentón, las plantas sometidas al tratamiento con HMA nativos presentaron mejores resultados que las plantas inoculadas con HMA comerciales [35]. Lo mismo sucedió en la aclimatación de plantas micropropagadas de banano (Musa AAA cv, Gran Enano), al ser inoculadas con HMA provenientes de suelos bananeros de Colombia [36].
Algunas plantas como por ejemplo la guayaba [37] o la palma de aceite [14, 38], por citar solo algunas, son dependientes de HMA, lo que indica que en suelo estéril el crecimiento de las plántulas es deficiente. Plantas con sistemas radicales abundantes como la yuca (Manihot esculenta), cítricos (citrus) y cebolla (Allium spp.) pueden ser muy dependientes de la micorriza arbuscular [39], mientras que plantas caracterizadas por raíces abundantes pero finas y con pelos radicales largos, son poco dependientes a la micorrización [20]. Se ha mencionado que una concentración alta de P en el suelo causa disminución o inhibición de la colonización micorrizica, pero cuando el nivel de este elemento es muy alto y hay colonización micorrizica también se dice que la planta es dependiente de los HMA [40]. Cuando sucede lo mencionado anteriormente también se habla de una interacción mutualismo/parasitismo [33], debido a que el hongo puede estar absorbiendo el P del suelo y no hay un incremento de este elemento en la planta, ocasionando una disminución en el crecimiento de ésta con respecto a plantas no micorrizadas [41]. Hay especies de plantas que no son dependientes de los HMA en las primeras etapas de crecimiento debido a que tienen semillas con grandes reservas alimenticias, suficientes para las primeras fases de desarrollo, no obstante, en etapas posteriores, cuando las reservas se han acabado, ellas pueden convertirse en plantas micotróficas dependientes [42].
Los resultados positivos observados en estudios llevados a cabo en invernaderos y viveros contrastan con los resultados decepcionantes obtenidos en campo, debido a las condiciones en que se mantienen los cultivos en los agroecosistemas [43]. Estos resultados han relegado el uso de las micorrizas en campo. Por esta razón es importante conocer la diversidad y la distribución de HMA en una zona agroecológica determinada, porque de esta forma es posible evaluar el status de los HMA encontrados en la región [44].
El uso común de pesticidas también tiene efectos, aunque contradictorios, en la acción de los HMA, porque dependiendo del suelo y del cultivo, puede haber un efecto estimulatorio, depresivo o no significante sobre el hongo [45]. No ha sido bien documentado el efecto que los herbicidas puedan tener sobre la actividad de los HMA en el suelo, sin embargo dada la naturaleza biológica de los productos basados en estos hongos no se recomienda hacer aplicaciones de herbicidas sobre la aplicación de HMA nativos o comerciales. Insecticidas o fungicidas biológicos basados en especies de Bacillus y Trichoderma respectivamente, son recomendados como controladores de plagas en cultivos donde se ha hecho aplicación de HMA.
SON SIEMPRE GENERALISTAS LOS HMA?
La relación HMA-planta no es considerada específica, debido a que cualquier especie de HMA puede colonizar o formar simbiosis con cualquier planta [46, 47], ya que se encuentran en todo tipo de suelos prácticamente [48]. No obstante, bajo ciertas condiciones edafoclimáticas, algunos hongos pueden beneficiar mejor o en mayor grado un determinado hospedero [46].
El pH, la humedad del suelo y la disponibilidad de nutrientes están influyendo tanto en la colonización micorrízica como en el número de esporas [44]. En diferentes cultivos y variedades de una misma especie vegetal se han obtenido diferentes respuestas de crecimiento de la planta, de acuerdo a la especie de HMA utilizado para inocular. En plántulas de palma de aceite, según Chu [14], independientemente de los diferentes niveles de fertilización usados, Gigaspora sp fue la especie que promovió mayor absorción de nutrientes y mayor crecimiento de la planta. En plántulas de tomate var Amalia de acuerdo a las condiciones evaluadas, Glomus fasciculatum fue la especie más efectiva de las seis especies utilizadas para inocular [46]. Glomus occultum fue colonizador dominante en las primeras etapas de crecimiento de plántulas de Sorghum, mientras que Glomus manihotis fue dominante en la misma etapa pero de plántulas de Cassava [49]. Acaulospora morrowiae y Acaulospora scrobiculata han sido reportadas en un rango de pH entre 3.8 y 8.0 y se adaptan a diversos niveles de fertilidad, mientras que especies de Glomus se adaptan a casi cualquier tipo de suelo y condiciones edafoclimáticas [20]. El nivel de pH afecta el número de esporas en el suelo debido a que un ligero aumento de éste cambia el nivel de saturación de Aluminio, causando una disminución en este parámetro, por lo que en arcillas por ejemplo, mejora la capacidad de intercambio catiónico del suelo favoreciendo la densidad poblacional de microorganismos, en nuestro caso la esporulación de HMA [50]. Los géneros Scutellospora y Entrophospora, son altamente diversos en los trópicos [20], sin embargo, si los agroecosistemas son alterados constantemente, géneros como Scutellospora y Gigaspora son menos frecuentes que en suelos no alterados [51]. Glomus intraradices es una especie considerada nitrofílica y es encontrada con mayor frecuencia en plantas leguminosas con alto contenido de Nitrógeno [52]. Los fosfatos de hierro y aluminio que tienden a formarse con mayor frecuencia en suelos extremadamente ácidos, también están afectando la esporulación de los HMA [50].
Todas estas respuestas específicas podrían estar reflejando diferencias en las estrategias ecológicas de las HMA, en el metabolismo de las plantas, la arquitectura de la raíz [49], la tasa de esporulación estacional que puede estar relacionada con el status fisiológico del hongo [52] y en los patrones de colonización [22]. Por lo tanto debe ser evaluada la interacción de estos componentes, pues parece indicar que durante las primeras etapas de crecimiento, las plantas hospederas tienen cierto grado de selectividad [49]. O como considera Bolaños [53] no solo las condiciones físicoquímicas del suelo están influyendo en la distribución de las especies de HMA, también existe un planteamiento biogeográfico donde dadas las características propias de las especies de HMA, ellas se adaptan a un determinado lugar. En ecosistemas naturales por ejemplo, la temporada estacional cálida o fría influye en la esporulación de las especies de HMA causando que determinada especie sea fisiológicamente activa en una temporada estacional y no en la otra, donde otra especie va a ser fisiológicamente activa [54].
Metabolitos secundarios producidos por las plantas y que regulan tanto en la fase de reconocimiento como en la fase de colonización [55, 56], pueden incrementar la colonización micorrízica [57,58] y la esporulación [18] de los HMA, de acuerdo a las condiciones físicoquímicas del suelo y la especie de hongo que está colonizando [59]. En papa, la Formononetina, un metabolito secundario, ha estimulado la esporulación de Gigaspora pero no de Glomus, la esporulación de este género fue mayor en el tratamiento sin Formononetina [18].
Actualmente, técnicas de biología molecular están siendo empleadas para demostrar que las especies de HMA pueden encontrarse en diferentes ecosistemas, tener una distribución muy amplia y colonizar diferentes hospederos, es decir ser generalistas, o tener una distribución limitada, es decir ser especialistas [60, 61].
CONCLUSIONES
- El uso de HMA en la agricultura contribuye a mejorar el nivel nutricional de la planta lo que se ve reflejado en mayor masa seca, crecimiento y área foliar de la planta.
- Los HMA son encontrados en todo tipo de suelos y pueden colonizar cualquier planta que establezca simbiosis con ellos, sin embargo, las condiciones físicoquímicas del suelo podrían estar generando cierto tipo de especificidad con respecto a las plantas hospederas, según las respuestas que muestran las plantas a determinadas especies de HMA.
- Es altamente probable que la característica de monocultivo en algunos agroecosistemas, esté contribuyendo a reducir la diversidad de HMA en el suelo, lo que estaría causando una selección de HMA que estarían aportando beneficios a las plantas de forma limitada.
- El uso de pesticidas y los suelos mas alterados por el hombre para la agricultura, estarían generando diferentes tipos de respuestas de los HMA, desde estimulantes hasta poco significantes.
BIBLIOGRAFÍA
[1] GIOVANETTI, Manuela y SBRANA, Cristiana. Meeting a non-host: the behavior of AM fungi. Mycorrhiza, 8: 123-130. 1998. [ Links ]
[2] VIERHEILIG, Horst. Regulatory mechanisms during the plant - arbuscular mycorrhizal fungus interaction. Canadian Journal of Botany, 82: 1166-1176. 2004. [ Links ]
[3] DOUDS, David y MILLNER, Patricia. Biodiversity of arbuscular mycorrhizal fungi in agroecosystems. Agriculture, ecosystems & environment, 74: 77-93. 1999. [ Links ]
[4] SIEVERDING, Ewald. El papel de las micorrizas en la agricultura. Suelos ecuatoriales, 16(1) 52-59. 1986. [ Links ]
[5] COLOZZI FILHO, Arnaldo y CARDOSO, Elke. Detecção de fungos micorrizicos arbusculares em raízes de cafeeiro e de crotolária cultivada na entrelinha. Pesquisa Agropecuária Brasileira, 35(10): 2033-2042. 2000. [ Links ]
[6] REQUENA, Natalia et al. Plant signals and fungal perceptions during arbuscular mycorrhizal establishment. Phytochemistry, 68: 33-40. 2007. [ Links ]
[7] BAREA, José et al. Microbial cooperation in the rhizosphere. Journal of Experimental Botany, 56(417):1761-1778. 2005. [ Links ]
[8] AZCÓN-AGUILAR, Concepción y BAREA, José. Applying mycorrhiza biotechnology to horticulture: Significance and potentials. Scientia Horticulturae, 68:1-24. 1997. [ Links ]
[9]VAN DER HEIJDEN, Marcel et al. Mycorrhizal fungal diversity determines plants biodiversity, ecosystem variability and productivity. Nature, 396: 69-72. 1998. [ Links ]
[10] BLANCOF, Fabio y SALAS, Eduardo. Micorrizas en la agricultura: contexto mundial e investigación realizada en Costa Rica. Agronomía Costarricense, 21(1): 55-67. 1997. [ Links ]
[11] CUENCA, Gisela et al. Las micorrizas arbusculares como una alternativa para una agricultura sustentable en áreas tropicales. Interciencia, Vol.32, No.1, p.23-29. 2007. [ Links ]
[12] CUENCA, Gisela y MENESES, Erasmo. Diversity patterns of arbuscular mycorrhizal fungi associated with cacao in Venezuela. Plant and Soil, 182: 315-322. 1996. [ Links ]
[13] BLAL, Bachar et al. Influence of vesicular-arbuscular mycorrhizae on phosphate fertilizar efficiency in two tropical acid soils planted with micropropagated oil palm (elaeis guineensis jacq.). Biology and Fertility of Soils, 9: 43-48. 1990. [ Links ]
[14] CHU, Elizabeth Y. Influência dos fungos micorrízicos arbusculares e níveis de adubação do no crescimento inicial de mudas de dendê. Embrapa. Boletim de Pesquisa, 176: 1-20. 1997. [ Links ]
[15] MOTTA, Dumar y MUNÉVAR, Fernando. Respuesta de plántulas de palma de aceite a la micorrización. Palmas, 26(3): 11-20. 2005. [ Links ]
[16] SERRALDE, Ana y RAMÍREZ, María. Análisis de poblaciones de micorrizas en maíz (Zea mays) cultivado en suelos ácidos bajo diferentes tratamientos agronómicos. Revista Corpoica, 5(1) 31-40. 2004. [ Links ]
[17] DAVIES, Fred; CALDERÓN, Constantino y HUAMAN, Zosimo. Influence of arbuscular mycorrhiza indigenous to Peru and a flavonoid on growth, yield and leaf elemental concentración of 'Yungay' potatoes (Solanum tubersoum L.). Hortscience, 40(2): 381-385. 2005. [ Links ]
[18] DAVIES, Fred et al. Influence of flavonoid (Formononetin) on mycorrhizal activity and potato crop productivity in the highlands of Peru. Scientia Horticulturae, 106(3): 318-329. 2005. [ Links ]
[19] BOLAÑOS, Martha; RIVILLAS, Carlos y SUÁREZ, Senén. Identificación de micorrizas arbusculares en suelos de la zona cafetera colombiana. CENICAFÉ, 51(4): 245-262. 2000. [ Links ]
[20] SIEVERDING, Ewald. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Eschborn, Germany: GTZ, 371. 1991. [ Links ]
[21] OEHL, Fritz et al. Impact of land use intensity on the species diversity of arbuscular mycorrhizal fungi in agroecosystems of central europe. Applied and environmental Microbiology, 69(5): 2816-2824. 2003. [ Links ]
[22] SMITH, Sally y READ, David. Mycorrhizal symbiosis. 2da ed. Londres: Academic Press Limited, 605. 1997. [ Links ]
[23] VAN DER HEIJDEN, Marcel. Different arbuscular mycorrhizal fungal species are potential determinants of plant community structure. Ecology, 79(6): 2082-2091. 1998. [ Links ]
[24] QUILAMBO, Orlando. The vesicular-arbuscular mycorrhizal simbiosis. African Journal Biotechnology, 2(12): 539-546. 2003. [ Links ]
[25] BARKER, Susan; TAGU, Denis y DELP, Gabriel. Regulation of root and fungal morphogenesis in mycorrhizal symbiosis. Plant physiology, 116: 1201-1207. 1998. [ Links ]
[26] PETERSON, Larry; MASSICOTE, Hugues y MELVILLE, Lewis. Mycorrhizas: Anatomy and cell biology. Ottawa: NRC Research Press, 173. 2004. [ Links ]
[27] International Culture Collection of (Cesicular) Arbuscular Mycorrhizal Fungi. General life cycle, and the structures formed. URL http://invam.caf.wvu.edu/. [ Links ]
[28] CAVAGNARO, Timothy et al. Morphology of arbuscular mycorrhizas is influenced by fungal identity. New Phytologist, 151: 469-475. 2001. [ Links ]
[29] BAGO, Berta; PFEFFER, Philip y SHACHAR-HILL, Yair. Carbon metabolism and transport in arbuscular mycorrhizas. Journal of Plant Physiology, 124:949-957. 2000. [ Links ]
[30] GADKAR, Vijay et al. Arbuscular mycorrhizal fungal colonization. Factors involved in host recognition. Plant physiology, 27: 1493-1499. 2001. [ Links ]
[31] ELIAS, Karol y SAFIR, Gene. Hyphal elongation of glomus fasciculatus in response to root exudates. Applied Environmental Microbiology, 53(8): 1928-1933. 1987. [ Links ]
[32] DA SILVA, Jose y CARDOSO, Elke. Micorriza arbuscular em cupuaçu e pupunha cultivados em sistema agroforestal e em monocultivo na amazônia central. Pesquisa Agropecuaria Brasileira, 41(5): 819-825. 2007. [ Links ]
[33] KLIRONOMOS, John. Variation in plant response to native and exotic arbucular mycorrhizal fungi. Ecology, 84(9): 2292-2301. 2003. [ Links ]
[34] ALLEN, Michael y BOOSALIS, Michael. Effects of two species of va mycorrhizal fungi on drought tolerance of winter wheat. New Phytology, 93: 67-76. 1983. [ Links ]
[35] CASTILLO, Claudia et al. Effect of arbuscular mycorrhizal fungi on an ecological crop of Chili peppers (Capsicum annuum L.). Chileanjar, 69(1): 79-87. 2009. [ Links ]
[36] USUAGA, Carmen; CASTAÑEDA, Darío y FRANCO, Ana. Multiplicación de hongos micorriza arbuscular (H.M.A) y efecto de la micorrización en plantas micropropagadas de banano (Musa AAA cv. Gran Enano) (Musaceae). Rev. Fac. Nal. Agr. Medellín, 61: 4279-4290. 2008. [ Links ]
[37] CHACÓN, A y CUENCA, Gisela. Efecto de las micorrizas arbusculares y de la fertilización con fosforo, sobre el crecimiento de la guayaba en condiciones de vivero. Agronomía Tropical, 48(4): 425-440. 1998. [ Links ]
[38] CORLEY, RHV y TINKER, Peter. The oil palm. Chapter 11: Mineral nutrition of oil palm. 4ta ed. Iowa USA: Blackwell Science, 327-360. 2003. [ Links ]
[39] SÁNCHEZ, Marina. Endomicorrizas en agroecosistemas colombianos. 1ra Ed. Palmira Colombia: Universidad Nacional de Colombia, 1-227. 1999. [ Links ]
[40] KAHILUOTO, Helena et al. Promotion of AM utilization through reduced P fertilization. 2. Field Studies. Plant Soil, 231: 65-79. 2001. [ Links ]
[41] JONES, Melanie y SMITH, Sally. Exploring functional definitions mycorrhizas: Are mycorrhizas always mutualism? Canandian Journal of Botany, 82:1089-1109. 2004. [ Links ]
[42] SAGGIN-JÚNIOR, Orivaldo y LOVATO, Paulo. Aplicação de micorrizas arbusculares na propagação de mudas e plantas micropropagadas. en: SIQUEIRA, J.O et al. (Eds.) Interrelação fertilidade, biologia do solo e nutrição de plantas. Lavras: SBCS/UFLA, p. 725-774. 1999. [ Links ]
[43] SYLVIA, David. Fundamentals and applications of arbuscular mycorrhizae: a "Biofertilizer" perspective. en: SIQUEIRA, J.O et al. (Eds.) Interrelação fertilidade, biologia do solo e nutrição de plantas. Lavras: SBCS/UFLA, 1999. [ Links ]
[44] KHANAM, Delowara et al. Effect of edaphic factor son root colonization and spore population of arbuscular mycorrhizal fungi. Bulletin Institute Tropical Agriculture, 29: 97-104. 2006. [ Links ]
[45] KOIDE, Roger y MOSSE, Barbara. A history of research on arbuscular mycorrhiza. Mycorrhiza, 14: 145-163. 2004. [ Links ]
[46] RODRÍGUEZ, Yakelin et al. Estudio comparativo de seis cepas de hongos micorrízicos arbusculares en su interacción con el tomate (Lycopersicum esculentum M.) var "Amalia". Ecología Aplicada, I 3(1y2): 162-171. 2004. [ Links ]
[47] POSADA, Raúl. Presencia de propágalos de hongos de micorríza arbuscular en muestras de hojarasca alrededor de dos especies arbóreas en un bosque húmedo tropical. Acta Biológica Colombiana, 6(1): 47-55. 2001. [ Links ]
[48] MOLINA, Mauricio; MAECHA, Liliana y MEDINA, Marisol. Importancia del manejo de hongos micorrizógenos en el establecimiento de árboles en sistemas silvopastoriles. Revista Colombiana de Ciencias Pecuarias, 18(2): 162-175. 2005. [ Links ]
[49] DODD, Jhon. Micorrizas. Recent advances in understanding the role of arbuscular mycorrhizas in plant production. En: SIQUEIRA, J.O et al. (Eds.) Interrelação fertilidade, biologia do solo e nutrição de plantas. Lavras: SBCS/UFLA. p. 687-703.1999. [ Links ]
[50] PEÑA, Clara et al. Micorrizas arbusculares del sur de la amazonia colombiana y su relación con algunos factores fisicoquímicos y biológicos del suelo. Acta Amazónica, 37(3): 327-336. 2007. [ Links ]
[51] SIQUEIRA, Jose; COLOZZI-FILHO, Arnaldo y OLIVEIRA, Elizabeth. Ocurrencia de micorrizas vesículo arbusculares em agro e ecossitemas naturais do estado de Minas Gerais. Pesquisa Agropecuaria Brasileira, 24: 1499-1506. 1989. [ Links ]
[52] SANTOS, Juan; FINLAY, Roger y TEHLER, Anders. Seasonal dynamics of arbuscular Mycorrhizal Fungal communities in Roots in a seminatural grassland. Applied and Environmental Microbiology, 73(17): 5613-5623. 2007. [ Links ]
[53] BOLAÑOS, Martha. Condiciones ecológicas que influyen sobre la población de endomicorrizas en la zona cafetera. p.120-121. En: Memorias IX Congreso Colombiano de la Ciencia del Suelo. Octubre 21-24, 1998. Paipa, Colombia. [ Links ]
[54] PRINGLE, Anne y BEVER, James. Divergent phenologies may facilitate the coexistence of arbuscular mycorrhizal fungi in a North Carolina Grassland. American Journal of Botany, 89(9): 1439-1446. 2002. [ Links ]
[55] AKIYAMA, Kohki., MATSUOKA, Hiroyuki. y HAYASHI, Hideo. Isolation and identification of a phosphate deficiency induced C-glycosylflavonoid that stimulates arbuscular mycorrhiza formation in melon roots. Molecular plant-Microbe interactions, 15(4):334-340. 2002. [ Links ]
[56] LAROSE, Geneviève et al. Flavonoid levels in roots of Medicago sativa are modulated by developmental stage of the symbiosis the root colonizing arbuscular mycorrhizal fungus. Journal of Plant Physiology, 159:1329-1339. 2002. [ Links ]
[57] NAIR. Muraleedharan; SAFIR, Gene. y SIQUEIRA, Jose. Isolation and identification of vesicular-arbuscular mycorrhiza stimulatory compounds from clover (Trifolium repens) roots. Applied environmental Microbiology, 27 (2): 434-439. 1991. [ Links ]
[58] SILVA-JÚNIOR, Jose y SIQUEIRA, Jose. Aplicação de formononetina sintética ao solo como estimulante da formação de micorriza no milho e na soja. Revista Brasileira de Fisiología vegetal, 9(1): 33-39. 1997. [ Links ]
[59] SCERVINO, Jose et al. Flavonoids exhibit fungal species and fungal specific effects on the presymbiotic growth of Gigaspora e Glomus. Mycology Research, 109(7):7 89-794. 2005. [ Links ]
[60] ÖPIK, Maarja et al. Composition of root-colonizing arbuscular mycorrhizal fungal communities in different ecosystems around the globe. Journal of Ecology, 94: 778-790. 2006. [ Links ]
[61] APPOLONI, Susann et al. Molecular community analysis of arbuscular Mycorrhizal Fungi in Roots of geothermal soils in Yellowstone National Park (USA). Microbiological Ecology, 56: 649-659. 2006. [ Links ]














