Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.7 no.2 Popayán Jul./Dec. 2009
ACTIVIDAD ANTIOXIDANTE Y ESTUDIO QUÍMICO DEL HONGO Pleurotus djamor RECOLECTADO EN CÓRDOBA
ANTIOXIDANT ACTIVITY AND CHEMICAL STUDY OF THE FUNGUS Pleurotus djamor COLLECTED IN CORDOBA
MIGUEL GUZMÁN1, NEVER ZÚÑIGA1, GILMAR GABRIEL SANTAFÉ2, OMAR TORRES3 Y ALBERTO ANGULO4
1 Químico, Departamento de Química. Universidad de Córdoba
2 Ph.D. Departamento de Química. Universidad de Córdoba.
3 M.Sc. Departamento de Química. Universidad de Córdoba
4 M.Sc. Departamento de Regencia de Farmacia. Universidad de Córdoba
Correspondencia: gsantafe@sinu.unicordoba.edu.co
Recibido para evaluación: 2 agosto 2009. Aprobado para publicación: 11 de agosto 2009
RESUMEN
Del extracto etanólico obtenido del hongo comestible Pleurotus djamor fue aislada mediante columnas abiertas desarrolladas sobre sílica gel la fracción esterólica. El análisis químico realizado mediante cromatografía de gases de alta resolución acoplada a espectrometría de masas permitió identificar 13 compuestos esteroidales, los cuales son reportados por primera vez en esta especie. Al extracto etanólico le fue evaluada la actividad antioxidante mediante los métodos DPPH y ABTS encontrando valores IC50 de 115.5 µg/mL y 29,37 µg/mL, respectivamente. Los datos obtenidos sugieren que Pleurotus djamor puede ser usado como una sustancia antioxidante natural.
PALABRAS CLAVE:
Hongos, Pleurotus djamor, actividad antioxidante, Córdoba.
ABSTRACT
The sterolic fraction was isolated from the ethanolic extract obtained from mushroom Pleurotus djamor by chromotaghaphy columns on silica gel. Its chemical analysis was done through high resolution gas chromotaghrophy coupled to mass expectrometry identifying 13 sterolic compounds which are found for the first time in this specie. The evaluation of the antioxidant activity for the ethanolic extract was carried out by DPPH and ABTS methods, finding values IC50 of 115.5 µg/mL and 29,37 µg/mL respectively. The data obtained suggest that Pleurotus djamor can be used as a natural antioxidant substance.
KEY WORDS:
Fungus, mushroom, Pleurotus djamor, antioxidant activity, Córdoba.
INTRODUCCIÓN
Los hongos han estado en la cumbre de la medicina oriental desde hace 2000 años, los productos derivados de estos organismos actualmente presentan los más altos volúmenes de venta en el mercado de alimentos saludables en países como Taiwán y China. Recientemente, el cuerpo fructífero y las esporas están recibiendo mucha atención, no solo como medicina homeopática sino como una nueva fuente promisoria de medicamentos. Numerosos compuestos con actividad cardiovascular, citotóxica, inmunomodulatoria, analgésica, antidiabética, antioxidante, insecticida y nematicida se han aislado en las dos últimas décadas [1].
Esta amplia gama de metabolitos secundarios es debida principalmente a que los hongos son incapaces de sintetizar macromoléculas a partir del dióxido de carbono y la energía procedente de la luz por el hecho de no poseer clorofila, por lo tanto, su biogénesis está condicionada principalmente por el tipo de nutrientes que conforman el sustrato donde se desarrollan, además de las condiciones climáticas que los rodean, haciendo que hongos presentes en regiones diferentes o que crezcan en sustratos que varíen en composición, puedan alterar y cambiar su metabolismo generando una amplia variedad de compuestos químicos [2] [3].
Los hongos constituyen un grupo muy numeroso de organismos (se han descrito aproximadamente 500.000, pero se estima que pueden existir entre 1 y 1,5 millones de especies) que presentan una amplia distribución en la naturaleza, contribuyendo a la descomposición de la materia orgánica y participando en los ciclos biológicos, solo un pequeño número son patógenos a animales y plantas. [4] Actualmente están siendo utilizados cultivos de algunas especies comestibles a gran escala como una alternativa de alimentación de bajo costo rica en vitaminas, minerales, aminoácidos, fibra y baja en grasa [5].
Colombia por su ubicación geográfica, su historia geológica, sus tipos de vegetación y clima tiene una gran biodiversidad en micoflora ya que ofrece las condiciones necesarias para que los hongos puedan producir una variedad importante de compuestos químicos. En nuestro país son relativamente pocos los estudios adelantados con relación a la constitución química de los hongos y estas investigaciones principalmente enfatizan en el contenido de ergosterol (Provitamina D2) [6].
En lo referente a la región del departamento de Córdoba, nuestro grupo de investigación ha informado sobre la identificación de cinco nuevos productos naturales aislados del hongo Ganoderma lucidum, a los cuales les fue avaluada su capacidad antioxidante obteniendo promisorios resultados [7]. También, se realizó un trabajo sobre el hongo Ganoderma concinna, en el cual se informó acerca de la identificación de tres nuevos metabolitos secundarios [8]. Por esta razón, es fundamental el seguir estudiando desde el punto de vista químico y de su bioprospección este tipo de organismos adicionando otras especies de diferentes géneros de las que se sabe habitan en la región, explorando de esta forma el potencial de bioactividad que poseen estos productos naturales.
Pleurotus spp. es un género de hongos superiores ampliamente distribuido a nivel mundial e incluye especies comestibles de alto valor económico en muchos países, resulta particularmente interesante desde el punto de vista nutricional en función de su contenido de proteínas, lípidos, niveles tolerables de ácidos nucleícos y por la presencia, además de vitaminas, minerales, fibra dietética, beta glucanos, de compuestos con actividad antioxidante e hipocolesterolémico [9][10][11]. Por lo tanto, los hongos pertenecientes a este género pueden ser utilizados para la producción de nuevos antibióticos, moléculas y compuestos útiles para mejorar la salud humana. Por su parte Pleurotus djamor es un hongo con distribución pantropical que crece de manera natural sobre troncos en descomposición de varios árboles. Esta especie se encuentra con frecuencia en zonas cálidas de África, América, Asia y Australia. P. djamor es una especie consumida principalmente a partir de ejemplares silvestres ya que su cultivo comercial es aún incipiente, aunque se han observado avances en el consumo de dicha especie [12].
Así, dentro de este contexto general, y aprovechando la buena distribucion de esta especie en nuestro medio, el presente trabajo describe el estudio químico de la fracción esterólica y actividad antioxidante del extracto etanólico del hongo Pleurotus djamor recolectado en el departamento de Córdoba.
MATERIALES Y MÉTODOS
Los especímenes del hongo Pleurotus djamor fueron recolectados en el corregimiento de Berástegui, municipio de Ciénaga de Oro en el departamento de Córdoba, esta es una zona tropical, se caracteriza por una temperatura de 27°C, humedad relativa del 80%, precipitación promedia anual de 1200 mm, 160 m.s.n.m. el hongo fue clasificado taxonómicamente en la Fundación Flora y Fauna del departamento de Córdoba. Luego de la recolección, el material fúngico fue dividido en pedazos y sometido a percolación en EtOH por 8 días, posteriormente se filtró y se destiló a presión reducida obteniéndose de esta manera el extracto etanólico crudo.
Cromatografía en columna y cromatografía en capa fina: Una vez obtenido el extracto crudo, se sometió a un proceso de separación y purificación mediante cromatografía en columna desarrollada sobre silica gel (0.063-0.2 mm, Merck®) utilizando como mezcla isocrática eluente hexano:acetato de etilo en relación 1:5 hasta obtener la fracción esterólica. Los procesos de fraccionamiento y purificación de la fracción esterólica también se llevaron a cabo mediante CC empleando una relación fase estacionaria: muestra (50:1) y como fase móvil se utilizaron mezclas de solventes con gradiente de polaridad de diclorometano, acetato de etilo y Metanol. El monitoreo fue realizado por Cromatografía en Capa Delgada (CCD) con cromatoplacas de aluminio de silica gel 60F 254 y un espesor de 0.2 mm utilizando como fase móvil mezclas de los solventes antes mencionados y colesterol como sustancia de referencia. La detección se llevó a cabo por medio de una lámpara ultravioleta marca CAMAG (con longitudes de onda de 254 y 366 nm), y solución de ácido fosfomolíbdico al 5% en etanol con posterior calentamiento, como revelador.
Cromatografía de gases de alta resolución acoplada a espectrometría de masas: El análisis por cromatografía de gases de alta resolución acoplada a espectrometría de masas (CGAR-EM) para la fracción esterólica se realizó en un equipo Hewlett Packard 6890, utilizando como columna capilar Modelo Agilent 19091J-433, HP-5, 025 mm de diámetro, 30m de largo y 0.25µm de espesor de la película, temperatura máxima 350°C y Helio como gas de arrastre. El detector utilizado fue un espectrómetro de masas Hewlett Packard 5973, equipado con una fuente de ionización de 70 eV.
Actividad Antioxidante
Método DPPH
Muestra: Se evaluó el extracto etanólico, para esto se prepararon por triplicado soluciones con concentraciones de 80, 100, 120, 140, 160 y 180 µg/mL del extracto etanólico, en DMSO y psoteriormente diluidas con solución de DPPH medidas a una absorbancia ajustada a 0.311 hasta completar 2 mL en el tubo de reacción. Blanco de la muestra: A 20 µL de cada concentración del extracto etanólico se le adicionaron 1980 µL de Metanol. Referencia: A 20 µL de DMSO se le adicionaron 1980 µL de solución madre de DPPH y se introdujeron en tubo de reacción. Después de incubar a temperatura ambiente por 30 min en la oscuridad se procedió a leer la absorbancia a 517 nm. Posteriormente, se graficó el porcentaje de inhibición Vs la concentración de la muestra para obtener la concentración eficiente en el 50% (CE50); es decir la concentración de extracto necesario para captar el 5% de los radicales libres de DPPH [13].
Método ABTS
Muestra: Se prepararon por triplicado soluciones de 5, 10, 20, 40, 60, 80 y 100 ppm del extracto etanólico en DMSO y posteriormente diluidas con solución de ABTS (2,2'-azino-bis(3-etilbenzotiazolina-6-sulfonato de amonio) con una absorbancia ajustada a 0.702 hasta completar 2 mL en el tubo de reacción. Blanco de la muestra: A 20 µL de cada concentración del extracto ertanólico se le adicionaron 1980 µL de buffer fosfato pH: 7.33. Referencia: A 20 µL de buffer fosfato se le adicionaron 1980 µL de solución de ABTS. Se determinó la variación de la absorbancia a 732 nm, se graficó el porcentaje de captación Vs la concentración de la muestra para obtener la concentración eficiente en el 50% (CE50).
RESULTADOS
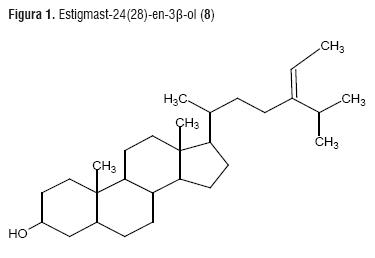
El extracto etanólico (2g) fue sometido a fraccionamiento en CC repetitiva sobre sílica gel, con sistemas eluentes de CH2Cl2, CH2Cl2:AcOEt 5:3, CH2Cl2:AcOEt 1:1 y AcOEt, hasta obtener una fracción esterólica de Rf en CCD similar al colesterol. Luego esta fracción esterólica fue analizada por CGAR-EM. El análisis cromatográfico y de los espectros de masas permitió la elucidación estructural de 13 compuestos, los cuales fueron identificados como; 24-nor-5α-colest-22-en-3β-ol (1), colest-22-en-3β-ol (2), colest-3β-ol (3), ergost-22-en-3β-ol (4), ergosta-5-24(28)-dien-3β-ol (5), ergost-3β-ol (6), estigmasta-5-24(28)-dien-3β-ol (7), estigmast-24(28)-en-3β-ol (8), ergost-24(28)-en-3β-ol (9), estigmast-28-en-3β-ol (10), 24ξ-estigmast-3β-ol (11), 24ξestigmast-3β-ol (12), 24ξestigmast-7-en-3β-ol (13). Los compuestos (11) y (12) tienen estructuras similares, pero posiblemente tienen estereoquímica diferente, puesto que poseen el mismo patrón de fragmentación en el espectro de masas y tiempos de retención muy parecidos, los cuales son 37.705 y 37.765 min respectivamente. Por su parte del compuesto (8) no se encontró información en la bibliografía consultada (figura 1), por lo que se propone como novedoso. de otro lado es importante destacar que es la primera vez que se reporta la extracción e identificación de compuestos esteroidales en el hongo Pleurotus djamor.
A continuación se presentan algunos datos espectroscópicos de los esteroles mayoritarios en la fracción esterólica, la cadena lateral se abrevia como (CL).
Colest-3-β-OL (3). EMIE, m/z [388]+(66.6%), 373 [M-CH3]+(43.1%), 355 [M-CH3-H2O]+(17.6%), 331 [M-C4H9 (CL)]+(7.8%), 233 [Fisión anillo D ]+(84.3%), 215 [Fisión anillo D-H2O]+(100%), 147 [Fisión anillo C-H2O-CH3]+(21.5%). Fórmula molecular: C27H48O
Ergostan-3-β-ol (6). EMIE, m/z [402]+(50%), 387 [M-CH3]+(30.7%), 369 [M-CH3-H2O]+(13.4%), 233 [Fisión anillo D ]+(80.7%), 215 [Fisión anillo D-H2O]+(100%), 147 [Fisión anillo C-H2O-CH3]+(21.1%). Fórmula molecular: C28H50O
Estigmast-24(28)-en-3-β-ol (8). EMIE, m/z [414]+(39.2%), 399 [M-CH3]+(5.8%), 353 [M-isopropilo-H2O]+(11.7%), 316 [M-C7H14 (CL)]+(15.6%), 302 [M-C8H16 (CL)]+(50.9%), 275 [M-CL]+(13.7%), 273 [M-CL-2H]+(90.2%), 257 [M-CL-H2O]+(76.4%), 233 [Fisión anillo D]+(23.5%). 215 [Fisión anillo D-H2O]+(43.1%) Fórmula molecular: C29H50O
Estigmast-28-en-3-β-ol (10). EMIE, m/z [414]+(75.5%), 399 [M-CH3]+(34.6%), 381 [M-H2O-CH3]+(30.6%), 353 [M-Isopropilo-H2O]+(10.2%), 330 [M-C6H12 (CL)]+(51%), 303 [M-C8H17 (CL)]+(53%), 275 [M-CL]+(34%), 255 [M-CL-2H-H2O]+(34.6%), 233 [Fisión anillo D]+(75.5%). 215 [Fisión anillo D-H2O]+(100%) Fórmula molecular: C29H50O.
24ξ-estigmast-3β-ol (11). EMIE, m/z [416]+(63%), 401(32.6%), 383(14.2%), 316(6%), 290(12%), 233(81.6%), 215(100%), 165(42.8%), 107(44%), 43(44%). Fórmula molecular: C29H52O
24ξ-estigmast-3β-ol (12). EMIE, m/z [416]+(28%),401(18%), 383(14.2%), 316(20%), 290(10%), 233(69%), 215(97%), 165(16%), 107(59%), 43(100%). Fórmula molecular: C29H52O
En la Tabla 1 se muestran los compuestos identificados en la fracción esterólica de Pleurotus djamor, y su movilidad cromatográfica (tiempos de retencion), se identificaron 13 compuestos, 10 de ellos con núcleo Δ0, otros dos con núcleo Δ5 y sólo uno con núcleo Δ7.
La evaluación de la actividad antioxidante para el extracto etanólico se llevó a cabo mediante los métodos DPPH y ABTS, encontrándose valores de CE50 de 115.5 µg/mL y 29.37 µg/mL respectivamente. Estos resultados encontrados permiten considerar como promisoria las sustancias de la especie del hongo Pleurotus djamor.
CONCLUSIONES
De la fracción esterólica del extracto etanólico del hongo Pleurotus djamor, se identificaron 13 compuestos, 10 de ellos con núcleo Δ0, otros dos con núcleo Δ5 y solo uno con núcleo Δ7. El compuesto estigmast-24-en-3β-ol (8) se propone como estructura novedosa.
El extracto etanólico del hongo Pleurotus djamor presentó actividad antioxidante promisoria según los resultados obtenidos por los métodos DPPH y ABTS, encontrándose valores de IC50 de 115.5 µg/mL y 29,37 µg/mL, respectivamente.
AGRADECIMIENTOS
Los autores desean expresar agradecimientos a la Universidad de Córdoba por la financiación del trabajo y a la Fundación Flora y Fauna de Córdoba por la clasificación del hongo.
BIBLIOGRAFÍA
[1] JONG, S.C y BIRMINGHAM, J.M. Medicinal Benefits of the mushroom Ganoderma. Adv. Appl. Microbiol. 1992. 37. pág 101-134. [ Links ]
[2] TEE, Ausanna. Aetas, identificación y recolección. ISBN 1405478063. 2006. Editorial Parragón. [ Links ]
[3] GARCÍA-PAJÓN C.M y COLLADO I.G.. Nat. Prod. Rep. 2003, 20,426. [ Links ]
[4] RAVEN P. y JHONSON. G. Biology, 2002 (Vol. VI). pág. 720. [ Links ]
[5] DABA, Ayman et al. Production of Mushroom (Pleurotus ostreatus) in Egypt as a source of nutritional and Medicinal Food. World Journal of Agricultural Sciences. 2008. Vol 4. ISSN 1817-3047. 630-634. [ Links ]
[6] NIETO, Ivonne et al. Dehidroergosterol: Un artefacto generado durante el proceso de extracción de esteroles en el hongo Pleurotus sajor-caju. Rev. Colomb. Quim. 2005. Vol.34 No.2. [ Links ]
[7] SANTAFÉ, Gilmar et al. Química y actividades antioxidante y bactericida del extracto etanólico del Hongo Ganoderma Lucidum. Publicado en la revista Scientia et Technica. 2007. XIII, Vol 33, ISSN 0122-1701. pag 329-332. [ Links ]
[8] ZULUAGA, Juan. New Lanostanoids from the Fungus Ganoderma concinna, Journal of Natural Products. ISSN 01633864. Volumen 65. págs. 417 - 421. [ Links ]
[9] BOVEK P, OZDI L y GALVABY S. Dose Time-Dependent Hypocholesterolemic Effect of Oyster Mushroom (Pleurotus ostreatus) in Rats, Nutrition. 1998. Vol. 14. págs. 282-286. [ Links ]
[10] GUO L; LIN J y LIN J. Non-volatile components of several novel species of edible fungi in China, Food Chemistry. 2007. Vol. 100. págs. 643-649. [ Links ]
[11] TSAI S, et al. Flavour components and antioxidant properties of several cultivated mushrooms, Food Chemistry. 2009. Vol. 113. - págs. 578-584. [ Links ]
[12] VEGA A, et al. Cultivo de cepas nativas de Pleurotus djamor en Panamá, en paja de arroz y pulpa de café. Revista Mexicana de Micología. 2006. Vol. 23. págs. 93-97. [ Links ]
[13] MOLYNEUX P. Activity, The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant , Songklanakarin J. Sci. Technol. 2004. No. 2. Vol. 26. [ Links ]














