Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.8 no.1 Popayán Jan./June 2010
DETERMINACIÓN DE PARÁMETROS FERMENTATIVOS PARA LA FORMULACIÓN Y OBTENCIÓN DE VINO DE NARANJA (Citrus sinensis)
DETERMINARON OF FERMENTATIVES PARAMETERS TO FORMULATION AND PROCUREMENT OF WINE ORANGE (Citrus sinensis)
DETERMINAÇÃO DE PARÃMETROS FERMENTATIVES PARA FORMULAÇÃO E OBTENÇÃO DE VINHO DE LARANJA [Citrus sinensis)
JOSÉ LUIS HOYOS1, FABIO ERNESTO URBANO2, HÉCTOR SAMUEL VILLADA CASTILLO3, SILVIO ANDRÉS MOSQUERA4, DIANA PAOLA NAVIA5
1Ingeniero Agroindustrial. Candidato a M.Sc. Ingeniería de alimentos. Especialista en Biotecnología. Docente Facultad Ciencias Agropecuarias. Universidad del Cauca, Popayán. e mail: jlhoyos@unicauca.edu.co
2Tecnólogo Agroindustrial. Universidad del Cauca, Popayán. email: calvarber@hotmail.com
3Ingeniero Agroindustrial Titular. Ph.D. Ingeniería de Alimentos. Docente Facultad Ciencias Agropecuarias. Universidad del Cauca, Popayán.
4Ingeniero Industrial de Alimentos. Mg. Ingeniería. Docente Facultad Ciencias Agropecuarias. Universidad del Cauca, Popayán.
5Ingeniero Agroindustrial. Candidato a Ph.D. Ingeniería de Alimentos. Docente Facultad Ciencias Agropecuarias. Universidad del Cauca, Popayán.
Correspondencia: email: VILLADA@unicauca.edu.co
Recibido para evaluación:12 de agosto de 2009. Aprobado para publicación:10 de enero de 2010.
RESUMEN
El objetivo fue obtener una bebida alcohólica a partir de naranja valencia. Fueron dos etapas. En la primera se realizó una caracterización fisicoquímica del fruto. En la segunda, se determinó el efecto del grado de maduración, la adición de nutrientes y anhidro sulfuroso, por un periodo de 21 días de fermentación. La caracterización fisicoquímica mostró dos estados de maduración (cinco y seis) aptos para el proceso de fermentación. La segunda etapa, los parámetros de inicio de fermentación fueron: 9g/Kg de ácido cítrico, 20°Brix, 63g de (NH4)2PO4/Kg de levadura, 160,37g de (NH4)2S04/Kg de levadura y 0.8mg de S02molecular/L El análisis estadístico arrojó para 73, un valor de azúcar residual de 60.1 g/dm3, grado alcohólico de 8.25°GL, viabilidad celular del 70%, acidez total de 0.9689%, acidez volátil de 0.090% y pH de 3.6, valores ajustados a la NTC 708, ideales para la fermentación de vinos dulces.
PALABRAS CLAVE:
Vino de frutas, estado de madurez, nutrientes, fermentación alcohólica.
ABSTRACT
The objective was to obtain an alcoholic beverage from orange valence. There were two stages. In the first, a physicochemical fruit. In the second, it was determinedthe effectofthe degree of maturation, the addition ofnutrients and anhydrous sulphur, foraperiod of 21 days of fermentation. Physicochemical showed two states ofmaturity (five and six) fit for the fermentation process. The second phase, starting fermentation parameters were: 9g/Kg citric acid, 20°Brix, 63g (NH4)2PO4/Kg yeast, 160.37 g (NH4)2S04/Kg yeast and 0.8mg of S02 molecular/L. Statistical analysis showed T3 for a valué of 60.1 g/dm3 of residualsugar, alcoholic strength of 8.25°GL, cell viability of 70%, 0.9689% of totalacidity, volatile acidity of 0,090% andpH of 3.6, valúes adjusted to the NTC 708, idealparameters for the fermentation of sweet wines.
KEYWORDS:
Wine fruit maturitystage, nutriente, alcoholic fermentation.
RESUMO
O objetivo foiobter urna bebida alcoólica a partir de laranja "Valencia". Foram duas etapas. Naprimeira, realizou-se urna caracterização físico-química do fruto. Na segunda, determinou-se o efeito do grau de maduração, a acrésci-mo de nutrientes e anidros sulfuroso, porum período de 21 dias de fermentação. A caracterizagao físico-química apresentou dois estados de maduração (cinco e seis) aptos para o processo de fermentação. Na segunda etapa, os parâmetros de inicio de fermentação foram: 9g\Kg de ácido cítrico, 20° Brix, 63g de (NH4)2PO4/Kg de levedura, 160,37g de (NH4)2S04/Kg de levedura e 0.8 mg de S02 molecular\L. A análise estatística deupara T3, um valor de açúcar residual de 60.1 g\dm3, grau alcoólico de 8.25° GL, viabilidade celular do 70%, acidez total de 0.9689%, acidez volátil de 0.090% e pH de 3.6, valores ajustados à NTC 708, ideáis para a fermentação de vinhos doces.
PALAVRAS-CHAVE:
Vinho, maturidade, nutrientes, fermentação alcoólica.
INTRODUCCIÓN
La naranja que se produce en Colombia, variedades común y Valencia, se destina hoy exclusivamente al mercado en fresco. Aunque la vocación de la naranja Valencia es servir como materia prima para la industria, la que se produce en el país no cumple con los requisitos exigidos para el procesamiento industrial ni en calidad ni en precio. La naranja que compran los consumidores colombianos se utiliza para exprimir y obtener jugo. No existe evidencia clara en el país sobre un consumo directo de la fruta fresca a escala masiva [1].
La citricultura presenta un potencial inexplotado en Colombia. El área sembrada total es de 5914 ha con una producción de 69163 Tn. El Cauca presenta un área sembrada de 92 ha, con un porcentaje de participación a nivel nacional de 1.55%, y una producción de 1159 Tn, con un rendimiento de 12600Kg/Ha [1].
No obstante, su baja participación en la producción nacional, los agricultores de diversas localidades productoras de naranja han enfrentado problemas en la maduración de las frutas. Una sobreproducción de naranja puede ser aprovechada ofreciendo productos estables a través del tiempo, tales como bebidas alcohólicas. En Colombia, el vino ocupa una mínima parte de su producción, debido a que la falta de estacionalidad climatológica no permite el cultivo de cepas típicas para vinificar, y por tanto vinos de calidad [2]. Es así, que frutas como la naranja, presentan potencial para obtener bebidas alcohólicas, siendo una alternativa viable para la producción de vinos de calidad, debido a su contenido de azúcar y aromas característicos.
El decreto 3192 de 1983 expedido por el Ministerio de la Protección Social de la República de Colombia, define el vino de frutas como el producto resultante de la fermentación alcohólica normal de mostos de frutas frescas y sanas distintas a la uva, mostos, concentrados de frutas sanas, que han sido sometidos a las mismas prácticas que los vinos de uva y cuya graduación alcohólica mínima es de seis grados alcoholímetros [3].
El Instituto Colombiano de Normas Técnica (ICONTEC), define a través de la NTC 708, los requisitos específicos de los vinos de frutas, fijando parámetros que permiten enmarcar las características de vinos provenientes de frutos diferentes a la uva, teniendo en cuenta la hetereogeneidad físico-química y biodiversidad de los frutos producidos en Colombia [4].
El objetivo del presente trabajo, fue la determinación de los parámetros fermentativos para la formulación y obtención de vino de naranja (Citrus sinensis).
METODOLOGÍA
Se efectuó un muestreo, tomando en consideración la uniformidad de la naranja valencia. Se obtuvieron 100 Kg de naranja valencia, proveniente del municipio de Rosas (Cauca). El peso del fruto entero se determinó en una balanza de piso Javar (Jav 700; Mod. B560-700; Max. 300Kg, Mín. 2000g).
La transformación de la materia prima se llevó a cabo en la planta piloto de alimentos de la Universidad del Cauca, siguiendo parámetros de limpieza y desinfección, contemplados en el Decreto 3075, que corresponde a la aplicación de Buenas Prácticas de Manufactura (BPM).
Caracterización fisicoquímica
Se realizó una selección manual de las naranjas, descartando la materia prima que presentó problemas fitosanitarios, golpes o magulladuras y materia prima senescente.
Se clasificó la materia prima por su diámetro ecuatorial, tomando la naranja de calibre C, por ser un fruto de tamaño medio según Normas Técnicas Colombianas (NTC 4086), la cual fija un diámetro entre 83-72 mm, con un peso promedio de 226 g. De igual forma se realizó una clasificación mediante el color externo de las frutas con los parámetros establecidos en la tabla colorimétrica de la norma NTC 4086 [5]. Se tomó un registro fotográfico a cada una de las muestras. La clasificación se realizó determinando sólidos solubles totales, acidez titulable e índice de madurez.
Fermentación
Para el inicio de la fermentación, se ajustó el jugo de naranja a los valores reportados para la fermentación de uva, que corresponde a 9 g/Kg de ácido predominante y 20 °Brix [6]. Se realizó el balance de masa de acuerdo a los sólidos solubles totales y acidez total para el ajuste del mosto de fermentación. Se realizaron los cálculos correspondientes para determinar la cantidad de nutrientes y anhidro sulfuroso que son indispensables para el desarrollo del ciclo fermentativo de la levadura en el medio líquido. Se cuantificó acidez titulable y pH según NTC 5114 [7], y sólidos solubles totales según NTC 5146. [8].
El mosto a fermentar se depositó en reactores de vidrio (tipo "Glass Carboy") con capacidad de 4 litros. La fermentación se extendió por un periodo de 21 días, realizando seguimiento de parámetros: recuento y viabilidad celular, azúcares totales reductores (ATR), acidez y pH.
Determinación de levadura, nutrientes y anhidro sulfuroso
Levadura. Se adicionó Saccharomyces cerevisiae, (obtenida de la empresa Levapan S.A., en su presentación de levadura seca activa), al 0.5% con respeto al total de mosto a fermentar. Esta cantidad aseguró un valor aproximado de 10 millones de células/mL cuantificado en cámara de Neubauer, siendo el óptimo según lo reportado [10].
La cantidad de levadura a generarse en el proceso fermentativo, se determinó mediante el rendimiento de biomasa con respecto a sustrato (Yx/s), que en una fermentación alcohólica es de 0.0225 g biomasa/g sustrato [18]. Con el valor de biomasa a obtenerse, se determinó la cantidad de fósforo y de nitrógeno.
Fósforo. Como fuente de fósforo se utilizó fosfato de amonio dibásico (NH4)2HP04, nutriente permitido por norma. Para determinar la cantidad de nutriente, se tomó el porcentaje de fósforo presente en levadura, que corresponde a 14 g/kg de levadura en base seca según lo reportado [10].
Nitrógeno. La fuente de nitrógeno se suplió con sulfato de amonio (NH4)2S04, nutriente permitido por norma. Para determinar la cantidad a adicionar en la fermentación, se tomó la fórmula de la levadura que es CN1.5400.52N0.16, en donde la fracción de nitrógeno corresponde a 8.73% en base seca, de acuerdo a lo reportado por Ingledew, 1999 [19].
Anhidro sulfuroso. Se adicionó en forma alterna, como metabisulfito de potasio (KHSO3), aplicado al mosto recién introducido en los recipientes de fermentación [14].
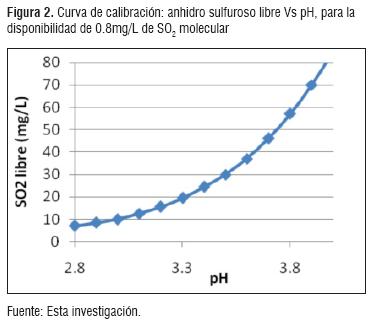
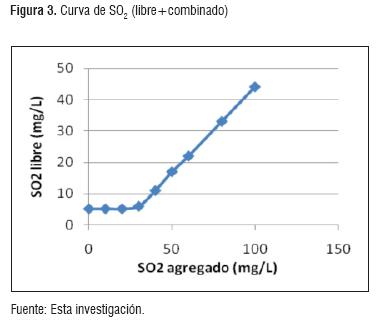
Se realizaron los cálculos correspondientes para el ajuste del S02. En la figura 2, se muestra la cantidad de S02 libre para asegurar contenidos de 0.8mg/L de S02 molecular dentro del vino, de acuerdo al pH de la solución [14]. El S02 se determinó mediante la norma GTC 4 [9]. Se determinó la cantidad de S02 necesario en la solución (libre + combinado), tal como se observa en la figura 3.
Caracterización fisicoquímica del vino
Se valoró la acidez total, acidez volátil y pH por norma NTC 5114. Se determinó ATR por NTC 5146, grado alcoholimétrico y anhidro sulfuroso por GTC 4 [7] [8] [9].
Trasegado y clarificación. Terminada la fermentación se retiraron los sedimentos del producto, obteniendo un líquido claro apto para clarificación. Se utilizó bentonita comercial (KWK BENTONITE, food grade, Cleveland, USA), para la clarificación. Se hidrató la misma en un beacker (al 0.1 % en 50mL del vino de naranja) siguiendo las recomendaciones del fabricante. Se filtró el vino, en embudo de cerámica Buchner 137 Ø y se utilizó bomba de vacío, Modelo BOA - P704-AA, 15 Amps. 4.2HZ.60.
Prueba de estabilidad. Finalmente, el producto se embotelló y siguiendo parámetros de NTC 708, se realizó la incubación a 37°C por 48 horas y se determinó su estabilidad.
Diseño experimental
El diseño aplicado fue completamente al azar (DCA), con arreglo factorial, con tres repeticiones, asignados aleatoriamente a las unidades experimentales (reactores de fermentación) sin ningún tipo de restricción.
El nivel de significación estadística fue del 5% para el análisis de varianza (ANAVA) y para la prueba de Tukey
Diseño de tratamientos:
- Tratamiento 1: jugo en estado de madurez # 5, sin adición de nutrientes ni anhidro sulfuroso.
- Tratamiento 2: jugo en estado de madurez # 6, sin adición de nutrientes ni anhidro sulfuroso.
- Tratamiento 3: jugo en estado de madurez # 5, con adición de nutrientes y anhidro sulfuroso.
- Tratamiento 4: jugo en estado de madurez # 6, con adición de nutrientes y anhidro sulfuroso.
RESULTADOS
Caracterización de la materia prima
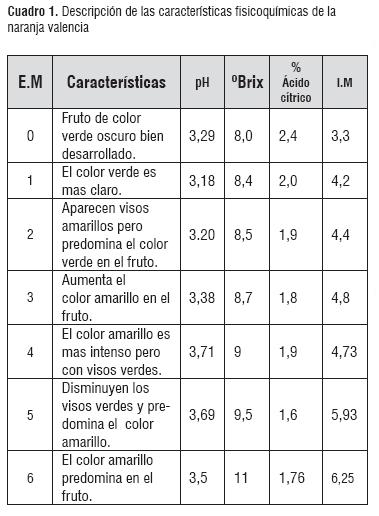
Se seleccionó y se rechazó el 3% de la materia prima por daño microbiológico. Se obtuvo una tabla de color como lo muestra la figura 3. Igualmente, el cuadro 1 muestra el reporte de los °Brix, acidez, pH e índice de madurez. Se seleccionaron dos estados de madurez número cinco (E.M.5) y número seis (E.M.6), de acuerdo a los resultados obtenidos en el cuadro 1, estos reportan valores de 9.5 y 11 °Brix respectivamente debido a un alto contenido de sólidos solubles totales, alto índice de madurez y características sensoriales propias de una madurez organoléptica, lo cual concuerda con la tabla propuesta por la Norma Técnica Colombiana (NTC4086)[5].
Resultados de la formulación
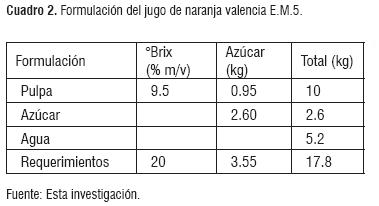
Se realizó un balance de masa, tomado como base de cálculo 10 Kg de jugo de naranja con las características del estado de madurez #5 y #6. Los cuadros 2 y 3, presentan el resumen de la formulación del fruto E.M.5 y E.M.6.
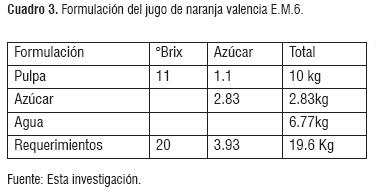
Determinación de nutrientes (nitrógeno-fósforo) y anhidro sulfuroso
Mediante el valor expresado de Yx/s, se obtienen 22.5g biomasa por cada kilogramo de azúcar presente en el mosto. Con este factor se establecieron las cantidades de nitrógeno y fósforo a adicionar.
Fósforo. El cálculo obtenido de 63g de (NH4)2HP04/Kg de levadura o su equivalente de 0.28g de (NH4)2HP04/L (asumiendo que se generan 4.5g de levadura por litro el cual presenta 20°Brix). Según la metodología propuesta, concuerda con los valores reportados para vinos de uva, que reportan la adición de 0.10 a 0.20g de (NH4)2HP04/L [6]. El valor se encuentra por encima del rango, lo cual es acorde, debido a que la adición de agua al jugo de naranja disminuye la disponibilidad de nutrientes.
Nitrógeno. De acuerdo a lo reportado [17], el jugo de la naranja valencia presenta 23mg/1OOmL de nitrógeno amoniacal, el cual no satisface los requerimientos del microorganismo. Teniendo en cuenta que el nitrógeno aportado por el fosfato de amonio, no compensa la necesidad de este nutriente, el nitrógeno restante se debe ajustar con sulfato de amonio (NH4)2S04.
Se encontró que se debe adicionar 169.81g de (NH4)2S04/Kg de levadura, equivalente a 0.764g/L. En fermentación alcohólica los iones amonio se expresan como nitrógeno amino libre (NAL). Los valores reportados para NAL se encuentran en rangos de 100 a 250 mg/L, y en jugos de frutas estos niveles deben estar por encima de 150mg/L [10]. Realizando la conversión a NH3 del valor de sulfato de amonio encontrado, este corresponde a un valor de NAL de 196mg/L que se encontraría de acuerdo a lo reportado.
Anhidro sulfuroso. El pH para E.M.5 fue 3.7 lo cual requirió una adición de 103 mg/L de S02 y el pH para E.M.6 fue de 3.6, con una adición de 85 mg/L de SO2 por lo tanto, se necesitaron 159.42 mg KHSOA. Estos valores concuerdan con los valores reportados en trabajo de vino de uva con valores que oscilan entre 100-200 mg KHS03/L [14].
Resultados fermentación
Los datos fueron tomados diariamente durante 21 días calendario.
pH. Durante el seguimiento del periodo fermentativo, los tratamientos T1 y T2 presentaron valores promedio de 3,6; T3 y T4 de 3.7, arrojando diferencias significativas para un α < 0.05. Estos valores de pH, son importantes por su efecto sobre los microorganismos, el color, sabor, la acción del SO2 y el potencial redox. El pH también esta relacionado con la resistencia a enfermedades, con el color y el enturbamiento presente en el vino [6]. El pH de los mostos del vino de mesa debe estar entre un rango de 3,1 a 3,6, mientras que para vinos de postre se puede estar entre 3.4 y 3.8 [6]. Según NTC 708, el vino de frutas debe presentar un valor entre 2.8 y 4.0 [4]. Los valores obtenidos para todos los tratamientos se encuentran bajo los parámetros establecidos.
Azúcares reductores. Se presentó una fermentación tumultuosa, en el cual se produce la ebullición del mosto tornándose turbio y espumoso por el CO2 que se desprende, resultado similar a lo presentado en otras investigaciones [6]. En este proceso cerca del 50% del azúcar contenido se convirtieron en alcohol etílico y anhídrido carbónico, igualmente este proceso fue intenso durante las primeras 36 horas y duró entre 3 y 7 días. Finalmente el líquido disminuyó en su concentración de azúcar y se transformó en vino.
La figura 4, muestra el resultado del consumo de azúcar observado durante el periodo de fermentación del vino de naranja valencia.
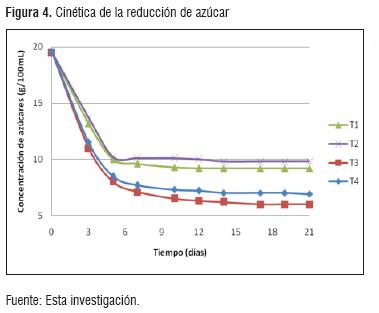
Durante este periodo fue necesario adecuar un ambiente que no se encuentre totalmente anaerobio, debido a que la ausencia total de oxígeno no permitiría la multiplicación de la levadura [14].
El análisis realizado bajo la prueba de Tukey, arrojó que se presentaron diferencias entre los tratamientos, siendo mayor la diferencia presentada entre T1 - T2 frente a T3 - T4. En la fermentación correspondiente a T1 y T2, se presentó azúcar residual por encima de 90 g/L, que es el resultado de la deficiencia en la fuente de nitrógeno, en donde bajos niveles de nitrógeno asimilable provocan menor crecimiento celular e incrementan la mayor producción de alcoholes fussel [13].
El nitrógeno debe ser adicionado como derivados proteicos solubles de tipo peptonas, péptidos y aminoácidos o urea porque la levadura no contiene enzimas proteolíticas especializadas. La adición de fósforo en forma de fosfato, es un factor indispensable para aumentar el porcentaje y velocidad de fermentación [12]. La concentración de fosfato controla la síntesis de lípidos y carbohidratos, y mantiene la integridad de la pared celular [15]. Los tratamientos T3 y T4 arrojan valores de 60.1 y 69.2 g/dm3 corespondientemente, ratificando la importancia de la suplementación de nutrientes.
Evaluando los resultados con respecto a la norma NTC 708, los vinos obtenidos se encuentran bajo la denominación de vino dulce por tener más de 50.1 g/ dm3 de azúcares totales residuales, previa inversión expresados como glucosa.
Recuento celular. La generación de biomasa por la reproducción celular, aumenta con respecto al tiempo. Al final del periodo fermentativo se observa un sedimento, y tiene lugar un fenómeno de aglutinamiento de células de levadura en el fondo del reactor [6]. Esta circunstancia facilita la elaboración del vino, porque permite separar la mayor parte de la levadura después de que se ha efectuado la fermentación.
En condiciones de trabajo se requiere de una viabilidad del 75% como mínimo, este factor controlable dentro de la fermentación, va a depender de una buena inoculación y de la adecuada adición de nutrientes. En la etapa de fermentación la viabilidad celular va disminuyendo con el transcurso del proceso, puesto que se afecta por factores como: cambio de pH, producción de ácidos y metabolitos, disminución de la tolerancia a la concentración de etanol, ausencia de oxígeno y falta de azúcar, por consumo de la misma [16].
La figura 5, muestra el comportamiento de la biomasa en el proceso, manteniéndose la tendencia de aumentar para todos los tratamientos. Los tratamientos T3 y T4 presentan un mejor comportamiento, reportando porcentajes de viabilidad superiores al 70%, lo cual no fue posible en los tratamientos T1 y T2 obteniendo valores de viabilidad del 55%, confirmando diferencias significativas con la prueba de Tukey. Como se mencionó anteriormente, los nutrientes influyen directamente en la viabilidad y por tanto mayor adaptabilidad del microorganismo a las condiciones de estrés que se presentan al final del proceso fermentativo [16].
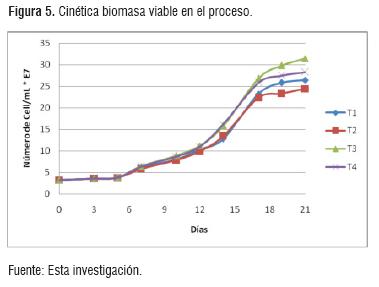
De igual forma, la decisión de evitar el uso de reguladores de acidez como carbonato de calcio y tartrato de potasio, por la adición de agua (permitida por norma NTC 7089), generó diferencias significativas entre los tratamientos. El jugo E.M.6 que presentó mayor acidez expresada en ácido cítrico, fue necesario adicionar mayor cantidad de agua. Esta actividad generó una mayor dilución de los nutrientes como elementos menores y vitaminas del complejo B, necesarios para optimizar la absorción de azúcares de acuerdo a lo reportado [20], y por tanto menor disponibilidad de estos por la levadura, lo cual se refleja en la obtención de menor cantidad de biomasa y en la mayor cantidad de azúcares residuales tanto en T2 como en T4.
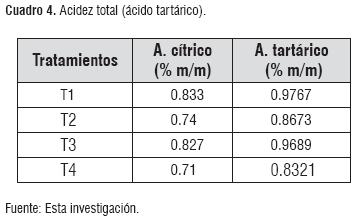
Acidez titulable. Los valores obtenidos se encuentran bajo los parámetros establecidos por norma entre 0.35 a 1% m/m de ácido tartárico, sin embargo están muy cercanos a los límites máximos. Esto se debió a que se tomó un valor de acidez total inicial de 0.9% de Á. cítrico, equivalente a 1.055% expresado como Á. tartárico (valor que se encuentra bajo el rango recomendado para iniciar el proceso fermentativo).
Durante el periodo fermentativo, la acidez disminuyó ocasionado por reacciones químicas redox de degradación de ácidos orgánicos predominantes [6]. El cuadro 4, presenta los resultados obtenidos.
Acidez volátil. La prueba de Tukey, determinó que se presentaron diferencias significativas entre todos los tratamientos, mostrando mayor diferencia los tratamientos de T1 y T2 con valores de 0.073 y 0.090% con respecto a T3 y T4, con valores de 0.033 y 0.026%. La acidez volátil o acética conviene que sea baja, pues es la causa para que los vinos se transformen en vinagres. Por el contrario, conviene que los vinos tengan una acidez fija alta, que favorece su conservación al reducirse las fermentaciones indeseables.
De acuerdo a los valores obtenidos en cada uno de los estados, el contenido final de acidez volátil se encuentra dentro de los límites para ser comercializado, lo que indica que no se presentaron problemas de acetificación durante el periodo fermentativo. El vino acetificado, es el vino enfermo que contiene más de 1,5 gramos de acidez volátil por litro expresada en ácido acético según normalidad chilena Ley 18.455.
Siguiendo los parámetros de la NTC 708, la acidez volátil expresada como ácido acético, debe tener un límite máximo de 0.12%. Comparado el valor establecido por norma con los valores obtenidos para las medias de los tratamientos, se observó que la fermentación no presentó problemas de contaminación acética.
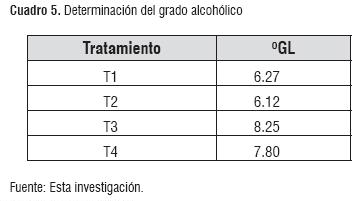
Determinación del grado alcohólico. Se observó un incremento en los grados alcohólicos finales para T3 y T4, corroborando las mejores condiciones proporcionadas a la levadura en este proceso fermentativo. Comparando °GL obtenidos, con respecto a la norma, estos se ajustan, encontrándose por encima de 6°GL, para todos los tratamientos (cuadro 5).
Prueba de estabilidad. El producto incubado a 37°C por 48 horas, no presentó alteraciones. Mostró ausencia en el recuento de mohos y levaduras, y negativo en el presuntivo para enterobacteras.
CONCLUSIONES
Los valores establecidos como parámetros de inicio de fermentación (9 g/kg de ácido predominante y 20 °Brix), permitieron obtener un vino dulce y una acidez total final, bajo norma NTC 708. El efecto de la adición de nutrientes es observable en el comportamiento de azúcares residuales, biomasa y grado alcohólico, presentando el microorganismo mayor adaptación a las condiciones de estrés generados con el avance del proceso, la adición de agua en los tratamientos con valores altos de acidez generó mayor dilución de nutrientes y por tanto menor disponibilidad de estos por la levadura, por tanto la mejor respuesta de las variables evaluadas para los diferentes tratamientos lo entrega la fermentación realizada con jugo en estado de madurez # 5, con adición de nutrientes y anhidro sulfuroso. La estabilidad se ajustó a la NTC 708, corroborando condiciones adecuadas de proceso.
REFERENCIAS
[I] Ministerio de Agricultura y Desarrollo Rural - Anuario Estadístico. Observatorio Agrocadenas Colombia. Procesamiento industrial de frutas y hortalizas. [En línea] Febrero de 2004. [Citado Mayo de 2006] Disponible en Internet, http://www.agrocadenas.gov.co/frutales/Documentos/caracterlzacion_frutales.pdf [ Links ]
[2] Sociedad Colombiana de Químicos Farmacéuticos y Aquifar. Min. Salud, SSSA. Curso: Producción y control de vinos y licores. Agosto 27-31 de 1990. [ Links ]
[3] Ministerio de Salud. Decreto 3192, Reglamentación de bebidas alcohólicas en Colombia, Noviembre 21 de 1983. [ Links ]
[4] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIÓN ICONTEC. Bebidas alcohólicas. Vinos de frutas. Quinta actualización. Santafé de Bogotá: ICONTEC. (NTC 708), 2005. [ Links ]
[5] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIÓN ICONTEC. Poscosecha de la naranja. Edición actualizada. Santafé de Bogotá: ICONTEC. (NTC 4086), 2003. [ Links ]
[6] Amerine M, C.S. Ough. Análisis de vinos y mostos. Zaragoza. España: Editorial Acribla. p. 29-33, 1976 [ Links ]
[7] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIÓN ICONTEC. Bebidas alcohólicas. Métodos para determinar la acidez y pH. 2 ed. Santafé de Bogotá: ICONTEC. (NTC 5114), 2003. [ Links ]
[8] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIÓN ICONTEC. Bebidas alcohólicas. Método para determinar el contenido de azúcar. 2 ed. Santafé de Bogotá: ICONTEC. (NTC 5146), 2003. [ Links ]
[9] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS Y CERTIFICACIÓN ICONTEC. Manual de métodos analíticos para el control de calidad de bebidas alcohólicas. Santafé de Bogotá: ICONTEC. (GTC 4), 1994. [ Links ]
[10] Jaques, K. The alcohol textbook. A reference for the beverage, fuel and industrial alcohol Industries. Nottingham. Inglaterra. 1999. [ Links ]
[II] Hoyos, J. Desarrollo de un complejo enzimátlco por fermentación de sustrato sólido Rhlzopus niveus para la obtención de alcohol etílico a partir de la melaza. Popayán. Cauca, Tesis de grado (Ingeniero Agroindustrial). Universidad del Cauca. Facultad de Ciencias Agropecuarias. Área de biotecnología. 2004. [ Links ]
[12] Casey, G. High gravity brewing: effects of nutrltion on yeast composltion, fermentable ability, and alcohol production. Applied and envlromental microbiology. Nottingham. Inglaterra. 48, 639-646,1994. [ Links ]
[13] Cooper, T. Nitrogen metabolism in Saccharomyces cerevisiae. En: The molecular biology of the yeast Saccharomyces. Metabolism and expression. Cold Spring Harbor, Nueva York. Editado por: STRATHERN, J. Cold Spring Harbor Laboratory. 250-256,1982. [ Links ]
[14] Escuela de vinicultura el Colorado. [En línea] Junio de 2006 [Citado Marzo de ]. Disponible en Internet http://www.utu.edu.uy/webnew/modulos/utu/Escuelas/Departamentos/Canelones/vitinicultura/vitivinicultura%20el%20colorado%20agrarla.htm [ Links ]
[15] Fraenkel, D. Carbohydrate metabolism. En: The molecular biology of the yeast Saccharomyces. Metabolism and expression. Cold Spring Harbor, Nueva York. Editado por: STRATHERN, J. Cold Spring Harbor Laboratory. p. 234 - 248,1982. [ Links ]
[16] Casey, G. R, y W. M. Ingledew. Ethanol tolerance in yeasts. Critical Reviews in Microbiology. 13, 219-290,1986. [ Links ]
[17] Hours, R; M. Ferreyra. Caracterización fisicoquímica y microbiológlca de jugos de naranja destinados a vinificación. Ciencia, docencia y tecnología. XVI, número 031. Universidad Nacional de Entre Rios. Argentina. 219-239,2005. [ Links ]
[18] Ingledew, W. M. alcohol production by Saca-haromyces cerevisiae: a yeast primer. Applied microbiology and food science Departament, Universty of Saskatchewan, Saskatoon. Canadá. 50-85,2000. [ Links ]
[19] Ingledew, W.M., y C.A.Patterson. Effect of nitrogen source and concentration on the uptake of peptides by a larger yeast in continuous culture. Journal of the American Society of Brewing Chemists. 57: 9-17,1999. [ Links ]
[20] Berry, D.R., y C. Brown. Physiology of yeast growth. En. Yeast Biotecnology. (Ed. D.R. Berry).1987. [ Links ]














