Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.8 no.2 Popayán Jul./Dec. 2010
AISLAMIENTO Y CONTROL MICROBIOLÓGICO DE Leuconostoc mesenteroides, EN UN INGENIO PARA OPTIMIZAR EL RENDIMIENTO DE AZÚCAR Y ETANOL
ISOLATION AND MICROBIOLOGICAL CONTROL OF Leuconostoc mesenteroides, IN TO SUGAR REFINERY TO OPTIMIZE THE PERFORMANCE OF SUGAR AND ETHANOL
ISOLAMENTO E Leuconostoc Mesenteroides CONTROLE MICROBIOLÓGICO EM UM TALENTO PARA OTIMIZAR O DESEMPENHO DE AÇÚCAR E ETANOL
RAÚL A. CUERVO MULET1, JOHANNY ÁNGEL LEDESMA2, JORGE ANTONIO DURÁN VANEGAS3, FRANCISCO E. ARGOTE VEGA4
1 Biólogo. Énfasis en Genética. Magíster en Ciencias Biológicas. Doctorando en Ciencias Biológicas. Docente Universidad de San Buenaventura.
2 Biólogo. Estudiante de Biología. Énfasis Genética. Universidad del Valle.
3 Químico. Magíster en docencia Universitaria. Docente Universidad de San Buenaventura.
4 Ingeniero Agroindustrial, Especialista en Gerencia de Mercadeo y Docencia Universitaria, Candidato a Magíster en Mercadeo Agroindustrial. Docente Universidad de San Buenaventura.
Correspondencia: racuervo@usbcali.edu.co
Recibido para evaluación: 07/04/2010. Aprobado para publicación: 05/11/2010
RESUMEN
La caña de azúcar (Saccharum officinarum L) es exprimida para obtener su jugo que después de ser purificado y neutralizado, deja cristalizar el azúcar. Considerando la importancia que representa la caña de azúcar para la industria azucarera, se hace necesario incrementar el contenido de sacarosa libre de dextrana (destrucción de sacarosa causada por la acción de microorganismos acompañantes de la caña, siendo uno de los más importantes Leuconostoc mesenteroides). En este trabajo de investigación se determinó la inhibición de la bacteria ácido-láctica L mesenteroides aislada en un ingenio azucarero del Valle del Cauca mediante la utilización de microorganismos antagonistas. Para esto, se realizaron aislamientos y cultivos de L. mesenteroides provenientes del jugo de la caña y se realizaron las diferentes pruebas bioquímicas y microbiológicas en el laboratorio para el aislamiento y la identificación de las cepas tanto de Leuconostoc mesenteroides, como las cepas bacterianas antagonistas a ella. Se comprobó que las cepas de los hongos Metharhizium anisopliae y Trichoderma sp, fueron las más eficientes en el control de crecimiento de L mesenteroides, mostrando significativamente un mayor porcentaje de inhibición en comparación de los hongos filamentosos Colletotrichum sp, Thichoderma viridae, Rhizoctonia sp y las bacterias Bacillus subtilis y Serratia marcenses y las levaduras Rhodothorula Rubra y Kloeckera japónica, no presentaron inhibición del crecimiento de Lmesenteroides. Además, se identificó a los hongos Aspergillus sp, Botrytis sp y Streptomyces sp como antagonistas naturales y habituales presentes en el jugo de caña de los Ingenios.
PALABRAS CLAVES:
Aislamiento, inhibición, antagonismo, Leuconostoc mesenteroides
ABSTRACT
Sugarcane (Saccharum officinarum L) is squeezed to obtain juice after being purified and neutralized, allowed to crystallize the sugar. Considering the importance of sugar cane accounts for the sugar industry, it is necessary to increase the content of dextran-free sucrose (sucrose destruction caused by the action of microorganisms accompanying the cañe, one of the most important Leuconostoc mesenteroides). In this research we determined the inhibition of lactic acid bacteria L mesenteroides isolated from a sugar mill in Valle del Cauca using antagonist microorganisms. For this, isolates, and cultures of L. mesenteroides from cane juice and performed various bio-chemical and microbiological tests in the laboratory for isolation and identification of both strains of Leuconostoc mesenteroides as the bacterial strains antagonistic to it. It was found that strains of the fungus Trichoderma sp, Metharhizium anisopliae, were the most efficient in controlling growth of L. mesenteroides, showing a significantly higher percentage of inhibition compared to the filamentous fungi Colletotrichum sp, Thichoderma viridae, Rhizoctonia sp, and Bacillus subtilis and Serratia bacteria and yeasts marcenses Rhodothorula Rubra and Kloeckera japonica, showed no growth inhibition L. mesenteroides. In addition, we identified the fungus Aspergillus sp, Botrytis sp and Streptomyces sp as natural enemies and common in the juice of the Sugar Cane.
KEYWORDS:
Isolation, inhibition, antagonism, Leuconostoc mesenteroides.
RESUMO
Cana (Saccharum officinarum L) é comprimida para que seu suco depois de ser purificada e neutralizado, permitiu a cristalizar o açúcar. Considerando a importancia de representar a cana para a indústria de açúcar é necessária para melhorar o conteúdo de sacarose, dextrana livre (sacarose destruição causada pela ação de microorganismos companheiros da cana, urna das mais importantes Leuconostoc mesenteroides). Neste trabalho, determinou a inibição das bacterias do ácido lático L. mesenteroides isolada de uma usina de açúcar em Valle del Cauca utilização de microrganismos antagonistas. Para isso, isolados, e as culturas de L. mesenteroides de caldo de cana e bioquímicos realizados vários exames microbiológicos no laboratório para isolamento e identificação de cepas de Leuconostoc mesenteroides como as estirpes de bactérias antagônicas a ele. Apurou-se que as cepas do fungo Metharhizium sp, Trichoderma sp, foram mais eficientes no controle do crescimento de L. mesenteroides, mostrando porcentagem significativamente maior de inibição em relação ao fungos filamentosos Colletotrichum sp, Thichoderma viridae, Rhizoctonia sp; bacterias Bacillus subtilis y Serratia marcenses e leveduras Rhodothorula Rubra e Kloeckera japonic, não apresentou inibição do crescimento L. mesenteroides. Além disso, eles identificaram os fungos Aspergillus sp, Botrytis sp e Streptomyces sp usual antagonistas naturais presentes no caldo de cana de usina.
PALAVRAS CHAVE:
Isolamento, inibição, antagonismo, Leuconostoc mesenteroides.
INTRODUCCIÓN
La pérdida de sacarosa y la formación de dextrana están asociadas con el deterioro de la caña de azúcar. El azúcar producido con caña deteriorada contiene un alto contenido de dextranas y no reúne las condiciones de aceptabilidad para su empleo como materia prima en la elaboración de algunos alimentos. Durante años este ha sido un problema que la industria azucarera ha enfrentado, convirtiéndose en un reto para el mejoramiento de la calidad y producción del azúcar. Las características físicas y químicas del jugo de caña de azúcar hacen de éste un excelente sustrato para el desarrollo de microorganismos. Uno de estos microorganismos es Leuconostoc mesenteroides el cual degrada la sacarosa presente en el jugo y forma de incorporar al mismo tiempo, metabolitos como el ácido láctico, acético, etanol, manitol y polisacáridos como dextranas y lévanos.
Ciertas especies del género Leuconostoc pueden ser particularmente perjudiciales en un Ingenio azucarero, desarrollándose en ciertas etapas del proceso tecnológico propio de este tipo de empresa, provocando grandes pérdidas de sacarosa y por lo tanto reduciendo la productividad con el perjuicio económico que esto conlleva [1].
En la caña de azúcar es posible encontrar una amplia diversidad microbiana, siendo comunes las bacterias productoras de acido láctico a partir de la fermentación de la sacarosa, también llamadas bacterias acido-lácticas.
Dentro de este grupo, los géneros mas comúnmente encontrados son: Leuconostoc, Lactobacillus y Peiococcus, los cuales pueden encontrarse en la superficie de las tinas (clarificador) donde cae la melaza o costra de sacarosa o por el contrario venir inmersas en el jugo de caña después de la molienda, suministrando un medio de crecimiento ideal para algunas de estas bacterias presentes en el material. Leuconostoc sp, es responsable de una disminución significativa en la producción de azúcar y etanol debido a los procesos de fermentación de la sacarosa, presentándose perdidas cercanas al 20% del total producido (Incauca S.A., com.pers.).
El método de control empleado habitualmente en la industria contra los microorganismos, y en especial de bacterias ácido-lácticas como Leuconostoc sp es el uso de químicos, sin embargo, la industria alimenticia o aquella industria que elabora productos de consumo humano se ve en dificultad para el control de microorganismos por químicos, dado que estos generalmente pueden ser tóxicos al humano o acarrear graves consecuencias al medio ambiente, trayendo consigo sanciones punitivas a la empresa por parte de la entidad ambiental encargada [2]. Por lo anterior, los ingenios azucareros abocados a la pérdida constante de divisas debido al crecimiento indeseable de Leuconostoc sp en el proceso de producción, y teniendo en cuenta que los químicos no representan una estrategia eficiente y rentable para el control de este microorganismo, hacen con mayor frecuencia uso del control biológico utilizando microorganismos antagonistas, inocuos para la salud humana que no tengan repercusión en el proceso de producción y que a la vez sea de fácil recuperación si ese fuera el caso [3].
Durante la ejecución de este proyecto, se pretendió inhibir el crecimiento de L. mesenteroides a partir de métodos de antagonismo microbiológicos, lo cual permitirá aumentar el rendimiento en la producción de azúcar y etanol.
MÉTODO
Microorganismo: Las cepas de los antagonistas microbiológicos utilizadas fueron obtenidas del Laboratorio de Microbiología de la Universidad del Valle. Las bacterias utilizadas como antagonistas fueron Bacillus subtilis y Serratia marcenses y los hongos antagonistas comprendieron tanto hongos filamentosos como levaduras. Dentro de los hongos filamentosos se utilizaron cepas pertenecientes al banco microbiológico de la Universidad de San Buenaventura de Colletotrichum sp, Thichoderma viridae, Rhizoctonia sp, Metharhizium anisopliae, Thichoderma sp. y dentro de las levaduras a Rhodothorula Rubra, Kloeckera japonica. Además, se logró el aislamiento de 2 bacterias ácido lácticas (Leuconostoc mesenteroides) procedentes del Molino Fulton Masa 1 y 3, respectivamente, de un Ingenio del Valle del Cauca.
Medios de cultivo
Medio Agar Nutritivo: Se agregaron 23 g de agar nutritivo comercial en un litro de agua destilada, posteriormente se somete a calentamiento dejándolo hervir aproximadamente durante un minuto y se procede a esterilizar por calor húmedo en un autoclave a 120°C durante 30 minutos a una presión de 15 psi. Posteriormente, el agar nutritivo es servido en cajas de petri y solidificado a temperatura ambiente.
Medios nutritivos PDA: El medio PDA (Papa-Dextrosa-Agar) se preparó agregando 15 g del preparado comercial en un litro de agua destilada. Este se esterilizó por calor húmedo en un autoclave en las condiciones mencionadas anteriormente. Posteriormente, fue servido en cajas de petri y solidificado a temperatura ambiente, quedando listo para la inoculación del microorganismo.
Medio YPDA: 10 g de extracto de levadura, 20 g de peptona, 20 g de glucosa y 20 g de agar se agregaron en un litro de agua destilada. Este medio fue esterilizado a 15 psi de presión y 121°C.
Medio Mayeux: Peptona 10 g, extracto de levadura 5 g, sacarosa 100g, citrato de sodio 1 g, glucosa 5 g, gelatina 2.5 g, agar 15 g en un litro de agua destilada. Posteriormente, se sometió a calentamiento hasta hervir durante aproximadamente 2 minutos y se procedió a esterilizar por autoclave (Condiciones mencionadas anteriormente). Posteriormente, se sirvió en cajas de petri y se solidificó a temperatura ambiente.
AISLAMIENTO
En el jugo de caña no se encuentra solamente la bacteria láctica L mesenteroides, por lo tanto, se hizo necesario realizar el aislamiento de esta cepa y posterior identificación. El aislamiento se realizó utilizando el método de siembras en superficie por estrías a partir de un cultivo mixto obtenido del jugo de la caña proveniente del molino Fulton del Ingenio del Cauca.
Las colonias aisladas fueron seleccionadas por sus diferencias morfológicas y se purificaron por repliques sucesivos antes de realizar las diferentes pruebas de identificación, las cuales consistieron en caracterización macroscópica (producción de goma, color, tamaño, superficie, consistencia, entre otros), microscópica tales como coloraciones diferenciales (coloración de Gram, coloración de cápsula, coloración de esporas) las cuales sirvieron para descartar algunas colonias diferentes a Leuconostoc mesenteroides y caracterización por medio de pruebas bioquímicas especificas.
El mantenimiento de la cepa pura aislada se realizó en glicerol a -20°C y se almacenó en los congeladores del laboratorio de microbiología de la Universidad de San Buenaventura-sede Cali.
IDENTIFICACIÓN DE LA CEPA BACTERIANA Leuconostoc mesenteroides
Para la identificación del aislamiento bacteriano se utilizaron diferentes parámetros, incluidas las combinaciones de características y criterios en la evaluación de similitudes, como las pruebas bioquímicas propuestas por el sistema de clasificación de bacterias del Bergey's Manual of Systematic Bacteriology, vol 2 [4].
Además, a estas cepas aisladas de Leuconostoc sp provenientes del molino fulton del Ingenio, se les realizó una caracterización macroscópica y una caracterización microscópica que incluía la coloración de gram, coloración de cápsula, coloración de esporas y posteriormente las pruebas bioquímicas específicas.
PRUEBAS DE ANTAGONISMO MICROBIOLÓGICO EN CAJAS DE PETRI
En las pruebas de antagonismo bacteriano se tomaron dos cajas con agar nutritivo y dos cajas de medio Mayeux. En el caso de las levaduras y los hongos dos cajas de YPDA y dos de medio Mayeux. Con el asa se tomaron las cepas microbianas y se procedió a realizar las siembras necesarias para determinar el antagonismo existente (Ver Figura 1); para las pruebas de antagonismo de las bacterias y las levaduras se sembraron por mitad de placas y en líneas perpendiculares los antagonistas en sus respectivos medios; las bacterias se incubaron a 37°C, las levaduras y los hongos en temperatura ambiente durante 96 horas. Posteriormente, se procedió a determinar el diámetro de crecimiento de los antagonistas cada 24 horas, observando si hubo o no antagonismo.
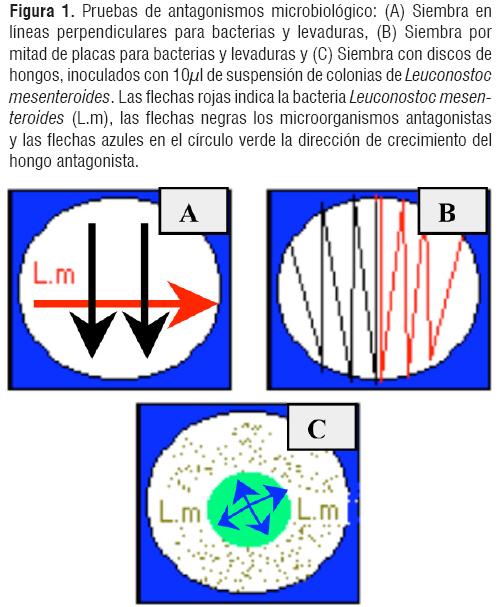 Figura 1
Figura 1DISEÑO EXPERIMENTAL DE LABORATORIO
Se seleccionaron los microorganismos que presentaban inhibición de Leuconostoc mesenteroides para la realización de la prueba estadística.
Para realizar las mediciones del efecto causado por los hongos antagonistas a Leuconostoc mesenteroides se utilizó como variable independiente al hongo y como variable dependiente a la bacteria Leuconosto sp. El diseño planteado fué un diseño completamente al azar y el estadístico utilizado fue Fisher, el cual es uno de los métodos estadísticos más usados cuando se tienen tratamientos con una sola variable de respuesta (Diámetro de inhibición) y que se encuentran en las mismas condiciones experimentales.
Las hipótesis fueron:
Hipótesis Nula (Ho): No hay diferencias significativas entre los porcentajes de inhibición de los hongos con respecto a Leuconostoc mesenteroides en diferentes tratamientos.
Hipótesis Alterna (Ha): Al menos uno de los tratamientos posee diferencias significativas.
Los tratamientos consistían en la siembra de los antagonistas con la bacteria Leuconostoc mesenteroides, además, del control en el cual L mesenteroides, se sembró sin la presencia de antagonistas, creciendo en las mismas condiciones de los otros tratamientos experimentales:
- Tratamiento 1: L mesenteroides vs Coiietotrichum sp
- Tratamiento 2: L mesenteroides vs Trichoderma viridae
- Tratamiento 3: L mesenteroides vs Rhizoctonia sp
- Tratamiento 4: L mesenteroides vs Methahrizium anisopliae
- Tratamiento 5: L mesenteroides vs Trichoderma sp
- Tratamiento 6: L mesenteroides (Control)
El modelo matemático utilizado es de tipo aditivo sin interacción donde se mide el efecto del tratamiento. El modelo estadístico por probarlo es el análisis de varianza de una vía tipo I. Se compararon los promedios de los diámetros de inhibición de los antagonistas de cada tratamiento. Además, los datos obtenidos de cada periodo en cada tratamiento serán sometidos a la prueba de Duncan(α=0.05).
OBTENCIÓN DE ESPORAS DE HONGOS ANTAGONISTAS PARA ENSAYO EXPERIMENTAL DE CAMPO
Se obtuvieron las esporas de los hongos filamentosos antagonistas y se cultivaron en PDA durante el tiempo suficiente para que la superficie del micelio esté cubierta de esporas (7-10 días). Mediante un raspado de la superficie fúngica se obtienen las nuevas esporas, las cuales se agregan a un tubo eppendorf con 1 ml de agua destilada estéril y se hacen diluciones hasta llegar a una concentración final aproximada de 2,3 x 108 esporas/ml, la cual fue obtenida a partir del conteo en cámara de Newbauer. Las esporas fueron almacenadas a 4°C hasta su uso.
ENSAYO EXPERIMENTAL DE CAMPO
Estos ensayos se realizaron con la colaboración del personal del laboratorio de microbiología de la Universidad de San Buenaventura. Se realizó un diseño piloto en el que se simularon las tinas o clarificadores del Ingenio del Cauca, en la cual se encontraba el jugo de caña, transportada en refrigeración y en envases estériles y la cual había sido previamente filtrada procedente del molino Fulton. Se utilizaron 9 clarificadores que contenían Leuconostoc mesenteroides y los microorganismos que presentaron mayor porcentaje de inhibición en las pruebas de antagonismo microbiológico en las cajas de petri (laboratorio). Posteriormente, se procedió a un seguimiento del comportamiento de los microorganismos antagonistas vs Leuconostoc mesenteroides. Para esto se realizaron conteos de colonias en diferentes tiempos y posteriormente, se realizaron los análisis de los datos obtenidos experimentalmente.
Se agregó 100 ml de guarapo de caña previamente filtrado el cual contenía una concentración indeterminada de L mesenteroides, posteriormente, se inoculó con una solución que contenía 2,3 x 108 esporas/ml de los microorganismos antagonistas y todo fue agitado y tapado. Cada 24 horas se sacaron muestras de los clasificadores y se sembraron en cajas de petri con medio Mayeux y YPDA para la determinación de la concentración de colonias de Leuconostoc sp y de los microorganismos antagonistas. Este procedimiento se hizo con 2 réplicas.
DISEÑO EXPERIENTAL DE CAMPO
El diseño estadístico implementado fue el mismo realizado en el laboratorio, con las comparaciones de medias de los tratamientos utlilzados en la prueba de Rangos múltiples de Duncan. Se realizaron tres tratamientos con tres repeticiones cada uno. Los tratamientos fueron:
Tratamiento 1: Clarificador con 100 ml de jugo, L mesenteroides y Thicoderma sp.
Tratamiento 2: Clarificador con 100 ml de jugo, L mesenteroides y Metharrizium anisopliae
Tratamiento 3: Clarificador con 100 ml de jugo y L mesenteroides
El tratamiento 3 era el tratamiento control. Los datos recogidos fueron evaluados.
RESULTADOS
AISLAMIENTO DE Leuconostoc mesenteroides
Se evaluaron y se caracterizaron dos aislados de la bacteria L mesenteroides, dependiendo de la cantidad de goma producida en medio Mayeux; las cuales fueron denominadas MFM 1 y MFM 3 (Molino Fulton Masa 1 y 3, respectivamente).
La presencia de esta goma es característica del género Leuconostoc sp, cuando crece en un medio selectivo como Mayeux, puesto que este género bacteriano toma la sacarosa presente en el medio selectivo produciendo una dextrana, la cual forma una goma translúcida por medio de una enzima dextransacarasa [12]. (Fig 2)
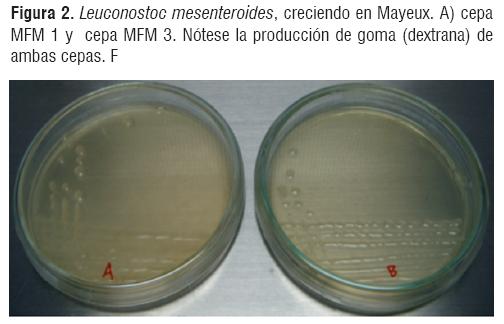
En la figura 2 se pueden observar las dos cepas aisladas de L mesenteroides y la goma formada por ella. Se puede notar que la cepa MFM 1 presenta una colonia mucosa con gran cantidad de dextrana en su alrededor, mientras que la cepa MFM 3, si bien presenta producción de dextrana, esta no es tan evidente.
Cuando ambas cepas crecen en un medio diferente a Mayeux, tal como medio nutritivo, no presentan la goma (dextrana) característica del género Leuconostoc sp, esto debido a que el agar nutritivo carece de sacarosa, el cual es el disacárido indispensable para la producción de colonias mucosas (con presencia de goma) y las colonias resultantes son de pequeño tamaño [5].
Pruebas Macroscópicas y Microscópicas de las cepas de Leuconostoc mesenteroides aisladas.
Las bacterias aisladas del jugo de caña provenientes del molino Fulton, presentaban colonias de forma circular, superficie lisa, traslúcida, color crema, consistencia viscosa, de gran tamaño, elevación convexa, borde entero con formación de dextrana, lo cual concuerda con las características macroscópicas reportadas por la literatura para el genero Leuconostoc sp. Se pudo observar además que la bacteria es un cocobacilo gram (+), agrupadas en pares o cadenas cortas, con ausencia de esporas y con presencia de cápsula.[4,6].
Pruebas bioquímicas de identificación bacteriana
Las pruebas bioquímicas realizadas permitieron la identificación de las colonias aisladas MFM 1 y MFM 3. Estas pruebas corroboraron que ambas cepas pertenecen a la especie Leuconostoc mesenteroides spp. Mesenteroides.
Las características metabólicas se muestran en la Tabla 1, donde se pone de manifiesto el comportamiento de las cepas bacterianas aisladas en las diferentes pruebas bioquímicas que permitieron su identificación. Las bacterias aisladas no pertenecen a las subespecies dextranicus ni cremoris, debido a estas dos subespecies no fermentan la arabinosa. Por el contrario, las cepas aisladas MFM 1 y MFM 3, fermentaron este azúcar, lo cual es característico de Leuconostoc mesenteroides spp. Mesenteroides.
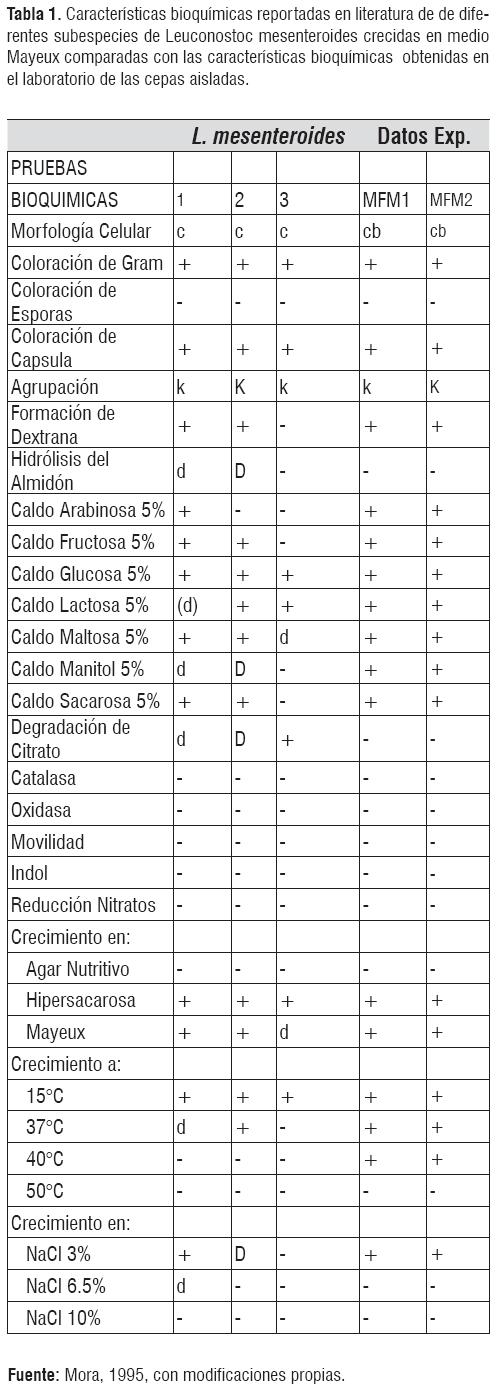
Símbolos: 1 ,L. mesenteroides, Subsp mesenteroides; 2, L. mesenteroides, Subsp dextranicum; 3, L mesenteroides, Subsp cremoris, MFMI, cepa experimental aislada 1; MFM2, cepa experimental aislada 2; c, cocos; cb, coco-bacilos; b, bacilos; k, cadenas; +, 90% ó mas de cepas son positivas; -, 90% ó mas de cepas son negativas; d, 11 -89% de cepas son positivas; (d) retardado.
Según las pruebas bioquímicas las cepas aisladas MFM 1 y MFM 2, eran las mismas y pertenecían a Leuconostoc mesenteroides spp. Mesenteroides, la cual no utilizan citrato como única fuente de carbono y energía, no presentan movilidad, no producen indol y no convierten el nitrito en nitrato, catalasa y oxidasa negativas, crecimiento positivo en NaCl 3% y negativo en NaCl al 6.5% y 10%, fermentación de arabinosa, fructosa, glucosa, lactosa, maltosa, manitol, sacarosa al 5%, positivo para la hidrólisis de almidón. Las dos cepas aisladas de Leuconostoc sp presentaron un crecimiento deficiente en agar nutritivo, pero crecieron bien en medio Mayeux, el cual era rico en sacarosa permitiéndole a la bacteria producir dextrana.
En cuanto al crecimiento de las cepas aisladas de Leuconostoc sp y que fueron crecidas a diferentes temperaturas, se puede asegurar que éste se ve retardado después de los 40°C, y no crece a los 50°C. Este dato puede discrepar ligeramente con la literatura, según el manual de Bergey's of systematic bacteriology [4, 7], se esperaba que esta bacteria no creciera por arriba de los 40°C, esta discrepancia puede ser el resultado de posibles errores en el control de la temperatura de la incubadora. Se puede observar que las pruebas bioquímicas son iguales para los aislados (MFM 1, MFM 3), por lo tanto, no hay diferencias en el metabolismo entre estas dos cepas, y se puede decir que son la misma especie, identificándose como Leuconostoc mesenteroides spp. mesenteroides.
ANTAGONISMO MICROBIOLÓGICO
Pruebas de inhibición del aislado de Leuconostoc mesenteroides spp mesenteroides por levaduras
A partir de las pruebas de antagonismo realizadas con las levaduras Rhodotorula Rubra y Kloeckera japonica en el laboratorio, se puede determinar que después de 96 horas se podía observar el crecimiento de la bacteria Leuconostoc mesenteroides spp mesenteroides aislada de los molinos fulton del Ingenio. Por lo anterior se puede determinar que estas levaduras no son antagonistas de la bacteria.
Pruebas de inhibición del aislado de Leuconostoc mesenteroides spp mesenteroides (MFM 1 y MFM 2) por bacterias
En estas pruebas se utilizaron las bacterias Bacillus subtilis y Serratia marceases, las cuales se sembraron por el método de mitad de placas. Después de 48 horas se observó un buen crecimiento de Leuconostoc mesenteroides spp mesesnteroides, por lo cual se puede decir que estas bacterias no son antagonistas de L mesenteroides, en un medio rico en sacarosa como el Mayeux.
Pruebas de inhibición del aislado de Leuconostoc mesenteroides spp mesenteroides (MFM 1 y MFM 2) por los hongos
Se realizaron pruebas de antagonismo con los hongos filamentosos Metharrizium anisopliae y Thichoderma sp, los cuales presentaron un rápido crecimiento fúngico en los medios Mayeux y YPDA e inhibieron el crecimiento de Leuconostoc mesenteroides spp mesenteroides. (Figura 3 y 4).

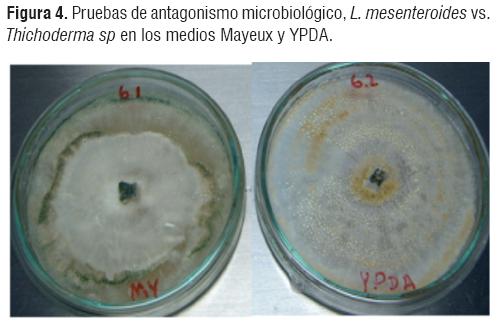
Análisis de los porcentaje de inhibición de Leuconostoc mesenteroides por los hongos antagonistas
A partir del porcentaje de inhibición, se puede observar que el crecimiento de Leuconostoc mesenteroides disminuye a medida que aumenta el crecimiento de los hongos Thichoderma sp y Metharhizium anisopliae, los cuales fueron los más efectivos al momento de inhibir el crecimiento de la bacteria.
Otras pruebas realizadas con los hongos filamentosos tales como Colletotrichum sp, Thichoderma viridae y Rhizoctonia sp, no alcanzaron el 100% de inhibición, siendo cepas fúngicas que realizan inhibición relativa a la bacteria, dependiendo del medio en el cual se está llevando a cabo el crecimiento.
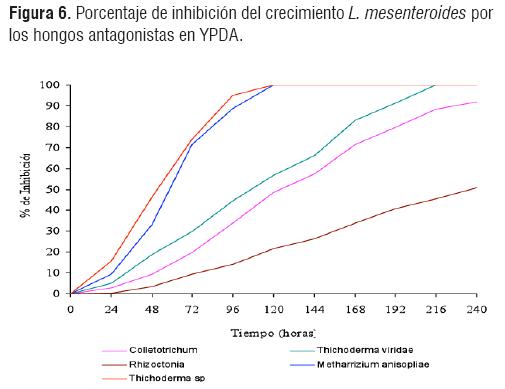
En las figuras 5 y 6 se muestra el antagonismo de los hongos seleccionados Colletotrichum sp, Thichoderma viridae, Rhizoctonia sp, Metharhizium anisopliae y Thichoderma sp. Se observó una curva uniforme de crecimiento fúngica, con mayor porcentaje de inhibición de los hongos Thichoderma sp y Metharhizium anisopliae, y un crecimiento rápido, que ocurre desde el primer día presentándose en los dos medios de cultivo.
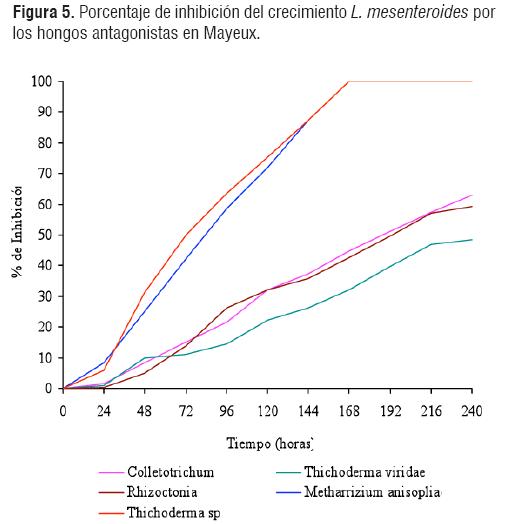
Esta rapidez en el crecimiento puede ser ocasionada por el hecho de que las enzimas que presentan los hongos tales como las proteasas extracelulares PII y PR1 producidas por Metharhizium anisopliae, aumentan con rapidez en respuesta a limitación de nutrientes [5, 8] teniendo una alta inhibición de Leuconostoc mesenteroides.
Sin embargo, el hongo mas eficiente en la inhibición de la bacteria es Thichoderma sp, el cual al igual que M. anisopliae, también posee enzimas que degradan paredes celulares, lo cual influye en la inhibición bacteriana [8, 9].
La inhibición de crecimiento de L. mesenteroides spp mesenteroides en el medio de cultivo YPDA se ve claramente realizado por los mismos hongos que realizaron la inhibición en medio Mayeux, lo cual indica que independientemente sea el medio (Mayeux o YPDA) los hongos que realizan la inhibición bacteriana son los mismos (Fig 6).
ANÁLISIS ESTADÍSTICO DE LAS PRUEBAS DE ANTAGONISMO EXPERIMENTAL DEL LABORATORIO
A partir de la anova se rechazó la Ho, la cual postulaba que no habían diferencias significativas entre los porcentajes de inhibición de los hongos con respecto a Leuconostoc mesenteroides en diferentes tratamientos.
La prueba de postanova de Duncan arrojó que no hay diferencias significativas entre los datos de inhibición obtenidos para el hongo Rhizoctonia sp vs L mesenteroides mientras que los demás hongos filamentosos si tuvieron diferencias significativas con respecto al control. Lo anterior indica que Rhizoctonnia sp no es un inhibidor eficiente de Leuconostoc mesenteroides, al contrarlo de los demás hongos filamentosos empleados en este estudio. El hongo Thichoderma sp tiene un porcentaje promedio de inhibición de 75,6%, siendo el microorganismo mas eficiente en el control de Leuconostoc mesenteroides spp mesenteroides utilizado en este estudio.
Según los datos obtenidos los hongos con menor porcentaje de inhibición fueron Colletotrichum sp, Thichoderma viridae y Rhizoctonia sp, los cuales no mostraron diferencias significativas en el porcentaje de inhibición entre ellos, mientras que Metharhizium anisopliae y Thichoderma sp, presentaron los porcentajes de inhibición bacteriana más altos. (63,1% y 75,6% respectivamente), aunque poseen diferentes porcentajes de inhibición, la prueba estadística no presentó diferencias significativas entre ellos.
PRUEBAS EXPERIMENTALES DE CAMPO
Para esta prueba se tuvo en cuenta el mayor porcentaje de inhibición del crecimiento de L mesenteroides spp mesenteroides en presencia de los microorganismos antagonistas obtenidos en las pruebas de laboratorio. Se seleccionaron los hongos Trichoderma sp y Metharrizium anisopliae su alto porcentaje de inhibición a las 96 horas el cual era de de 94,89% y de 88,77%; respectivamente. Estos hongos inhibieron la bacteria Leuconostoc mesenteroides spp mesenteroides en campo (ingenio azucarero) corroborando los datos experimentales obtenidos en el laboratorio [10], sugiere utilizar en las pruebas de campo los microorganismos Streptomyces culture y Botryodiplodia theobromae, por el efecto que pueden tener sus metabolitos microbianos sobre el crecimiento de la bacteria L mesenteroides.
CONCLUSIONES
Se recomienda el empleo del hongo Thichoderma viridae para el control de crecimiento de Leuconostoc mesenteroides spp mesenteroides, sin embargo otro hongo filamentoso eficiente en el control de esta bacteria fue Metharrizium anisopliae, siendo una alternativa para el control biológico de esta bacteria. Sin embargo, se necesitan estudios complementarlos que permitan corroborar esta afirmación.
Los hongos con menor porcentaje de inhibición fueron Colletotrichum sp, Thichoderma viridae y Rhizoctonia sp.
A partir de este trabajo de experimentación se puede determinar que los hongos Metharrizium anisopliae y Thichoderma sp poseen metabolitos que inhiben el crecimiento de la bacteria acido láctica Leuconostoc mesenteroides.
Se recomienda seguir realizando estudios donde se agreguen los dos hongos (Af. anisopliae y Trichoderma sp) para determinar si la eficiencia en el control de Leuconostoc mesenteroides spp mesenteroides realizados por estas dos cepas fúngicas es la misma cuando se realiza por separado o cuando se unen.
REFERENCIAS
[1] COGAN, T. M. & JORDÁN, K. N. 1994. Metabolism of Leuconostoc Bacteria. Journal of Dairy Science. 77 (9): 2704-2717. [ Links ]
[2] COOK, R. J. & BAKER, K. F. 1989. The nature and practice of biological control of plant pathogens. Minnesota :ST. Paul. [ Links ]
[3] HJELJORD, L & TRONSMO, A. 1998. Trichoderma and gliocladium in biological control: an overview. En Thichoderma & Gliocladium. Vol 2. Harman, G. E. y Kubicek, C. R (eds). London. 131 - 152 p. [ Links ]
[4] MORA, Z. 1995. Estudio de las microfloras contaminantes durante la etapa de molienda de caña en relación con el proceso de elaboración de azúcar. Págs. 114. Tesis, Universidad del Valle, Facultad de Ciencias, Programa Académico de Biología. [ Links ]
[5] MADIGAN, M. T, MARTINKO, J. M. & PARKER, J. 2005. Brock. Biología de los microorganismos. 10 edición. Editorial Pearson Educación, S.A., Madrid. 1096 p. [ Links ]
[6] SAIS, H. & SOTOLONGO, R. 1976. Aislamiento de cepas cubanas de L mesenteroides y su comportamiento en la producción de dextrana técnica. [ Links ]
[7] PÉREZ, J. L. 1985. La lucha química contra la podredumbre gris en la hoja. E y E. 15-81 p. [ Links ]
[8] BENÍTEZ, T, LIMÓN, M. C, DELGADO-JARANA, J. y REY M. (1998). Glucanolyitc and other enzymes and their genes, en: Thichoderma & Gliocladium. Vol. 2. Harman, G.E. y Kubicek, C.R (eds). London. 101-127 p. [ Links ]
[9] LORITO, M. (1998). Chitinolytic enzymes an their genes, en: Thichoderma & Gliocladium. Vol. 2. Harman, G. E. y Kubicek, C. R (eds). London. 73-99 p. [ Links ]
[10] CERUTTI, G., MICHELENA, G., MARTÍNEZ, A., DIEZ, K., CARRERA, E., LEGRA, S. 2003. Inhibition by biological methods of Leuconostoc mesenteroides in the sugar industry. Revista ICIDCA Sobre los Derivados de la Caña de Azúcar. 37 (1): 34-38. [ Links ]














