Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.8 no.2 Popayán Jul./Dec. 2010
LAS BIOPELÍCULAS EN LA INDUSTRIA DE ALIMENTOS
BIOFILMS IN THE FOOD INDUSTRY
BIOFILMES NA INDÚSTRIA DE ALIMENTOS
DIANA PAOLA NAVIA1, HÉCTOR SAMUEL VILLADA2, SILVIO ANDRÉS MOSQUERA3
1 Ingeniera Agroindustrial, Universidad del Cauca, Facultad Ciencias Agropecuarias, Grupo CYTBIA. Popayán-Colombia
2 Ph.D Ingeniería de Alimentos. Docente Titular. Universidad del Cauca, Facultad Ciencias Agropecuarias, Departamento de Agroindustria. Popayán-Colombia
3 Ingeniero Industrial de Alimentos. Especialista en Gerencia de Producción. Magíster en Ingeniería. Docente Titular Departamento de Agroindustria, Facultad de Ciencias Agropecuarias, Universidad del Cauca. Popayán-Colombia
Correspondencia: dnavia@unicauca.edu.co
Recibido para evaluación: 6/08/2010 Aprobado para publicación: 2/11/2010
RESUMEN
Algunos microorganismos útiles y bacterias patógenas como por ejemplo Pseudomonas, Vibrio, Escherichia, Salmonella, Listeria, Streptococcus, Staphylococcus, Mycobacteria, tienen la capacidad de adherirse y crecer en los alimentos y/o en las superficies que están en contacto con ellos formando biopelículas. Estas son significativamente importantes en el campo alimentario porgue causan serios problemas que dificultan y perjudican las operaciones y los procesos al generar pérdidas de energía, reducción del flujo (en tuberías) y transferencia de calor, y taponamiento de poros de membranas, entre otros. Este documento considera los aspectos biológicos y fisicoquímicos relacionados con la formación y desarrollo de las biopelículas, lo cual, unido al desarrollo de metodologías de diagnóstico e identificación, permitirán desarrollar estrategias gue faciliten la prevención y control de la contaminación en la industria de alimentos para mantener los sistemas libres de biopelículas y favorecer la calidad y seguridad de los alimentos.
PALABRAS CLAVE:
Biopelícula, Adhesión bacteriana, Procesamiento de alimentos, Saneantes.
ABSTRACT
Some useful microorganisms and pathogenic bacteria such as Pseudomonas, Vibrio, Escherichia, Salmonella, Listeria, Streptococcus, Staphylococcus, Mycobacterium, have the ability to adhere and grow in food and/or surfaces in contact with them. In this context, the biofilms are significantly important in the food industry because they cause serious problems that impede and impair the operations and processes to generate energy losses, reduced flow (in pipes) and heat transfer, and plugging of membrane pores, among others. This document considers the biological and physicochemical aspects related to training and development of biofilms, which, together with the development of methods for diagnosis and identification, will help develop strategies for prevention and control of pollution in the food industry to maintain biofilm-free systems and promote the quality and food safety
KEYWORDS:
Biofilm, Bacterial adhesión, Food processing, Sanitizers.
RESUMO
Alguns microorganismos úteis e bactérias patogênicas, como Pseudomonas, Vibrio, Escherichia, Salmonella, Listeria, Streptococcus, Staphylococcus, Micobactéria, têm a capacidade de aderir e crescer em alimentos e/ou as superfícies em contato com eles. Neste contexto, os biofilmes são significativamente importantes na alimentação, porque podem causar problemas graves que impedem e dificultam as operações e processos para gerar perdas de energia, fluxo reduzido (tubos) e transferência de calor, e entupimento de poros da membrana, entre outros. Este documento considera a aspectos biológicos e físico-químicas relacionadas à formação e desenvolvimento de biofilmes, que, juntamente com o desenvolvimento de métodos para o diagnóstico e identificação, ajudará a desenvolver estratégias de prevenção e controle da poluição na indústria de alimentos para manter os sistemas de biofilme livre e promover a qualidade e segurança alimentar.
PALAVRAS-CHAVE:
Biofilme, Adesão bacteriana, Processamento de alimentos, Sanitizantes.
INTRODUCCIÓN
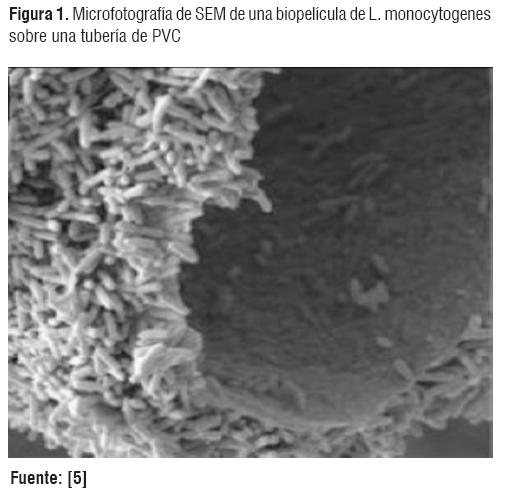
La mayoría de las células se pueden adaptar porque se adhieren a superficies con presencia de sustratos, que generalmente están contenidos dentro de una matriz orgánica polimérica de origen microbiano. Una biopelícula se considera como una matriz biológicamente activa formada por células de una o varias especies y sustancias extracelulares en asociación con una superficie sólida (Ver Figura 1), incluyendo superficies minerales, tejidos vivos o muertos de animales o plantas, polímeros sintéticos, cerámicas y aleaciones de metales [1].
A lo largo de la historia de la microbiología, investigadores han encontrado que las bacterias crecen en forma diferente después de su adhesión en superficies y posterior formación de biopelículas. En 1964, Mitchell y Kevin Marshall examinaron los primeros estados de formación de biopelículas por bacterias y diferenciaron la adsorción reversible e irreversible, esta última constituyendo el primer estado de formación de las biopelículas [1]. Aunque las descripciones de las biopelículas han variado a través de los años, las características fundamentales se han mantenido.
Las biopelículas que se encuentran en la naturaleza consisten en comunidades de microorganismos primarios viables y no viables protegidos por sustancias polímeros extracelulares (EPS) polianiónicas fijadas a la superficie [2]. Las EPS pueden contener polisacáridos, proteínas, fosfolípidos, ácidos nucleicos, ácidos teicoicos y otras sustancias polímeros hidratadas con un porcentaje de agua entre 85 y 95% [2]. Las EPS protegen a los microorganismos que hacen parte de la biopelícula contra agentes antimicrobianos, previenen al acceso de biocidas, secuestrantes metálicos, toxinas, evitan la deshidratación, refuerzan la resistencia de la biopelícula al estrés ambiental y permiten a los microorganismos capturar los nutrientes [3]. Dependiendo del tipo de células involucradas en la biopelícula, las microcolonias pueden estar compuestas por 10-25% de células y 75-90% de matriz EPS [4]. Los requisitos para el crecimiento de la biopelícula son la presencia de microorganismos y el sustrato; si alguno de estos no se encuentra disponible, la biopelícula no se formará [4]. La sinergia existente dentro de la comunidad de la biopelícula, es el factor que permite que ésta soporte condiciones adversas y pueda sobrevivir.
Es importante considerar la formación de biopelículas, ya que durante las últimas décadas se han presentado tanto a nivel industrial, en sectores como marítimo, alimentos, aceites, papel, odontológico, medicina, tratamiento de aguas [4], como doméstico, y desafortunadamente en la mayoría de los casos su crecimiento y formación es perjudicial, causando problemas como corrosión, olores desagradables, taponamiento de tuberías, fallas en equipos y deficiencia en la transmisión de calor (ej. Intercambiadores de calor) [6], lo que resulta en elevados costos de limpieza y mantenimiento. Las esponjas húmedas utilizadas en la preparación de alimentos, en las cuales se depositan comúnmente los microorganismos, son un ejemplo de estas fuentes de contaminación. Esponjas contaminadas con Staphylococus aureus, Salmonella enteritidis y Campylobacter jejuni fueron capaces de transferir patógenos a las superficies de acero inoxidable, en donde el S. aureus sobrevivió por más de 4 días [7]. En tanto que otras bacterias como el Bacillus cereus pueden sobrevivir en condiciones extremas y multiplicarse en forma de esporas, las cuales pueden germinar y crecer sobre superficies y alimentos procesados [8].
De otro lado, las biopelículas pueden ser benéficas, como por ejemplo el Bacillus subtilis y sus especies afines que son utilizados como agentes de biocontrol antifúngico en cultivos, como inhibidores de la corrosión causada por bacterias en materiales como el acero y como agentes de limpieza de un lugar contaminado, ya sea in situ o ex situ, este último conocido como biorremediación [9].
Así, una mayor comprensión de los mecanismos utilizados por los microorganismos en sus procesos de adhesión a las diferentes superficies, proporcionará una base para el desarrollo de mejores materiales, métodos y estrategias que permitan remover, prevenir o potenciar activamente la formación de biopelículas, según sea la necesidad.
BASES QUÍMICAS Y FISICOQUÍMICAS
El proceso de formación de las biopelículas inicia con la adherencia de células a la superficie, formando microcolonias por la activación de sus genes, con la producción de EPS y una subsecuente maduración de la biopelícula, como se muestra en la figura 2.
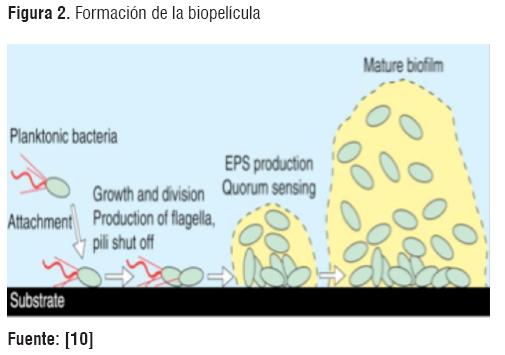
El mecanismo de adhesión al sustrato puede ser activo o pasivo dependiendo de la motilidad de las células. Una adhesión pasiva se da por la gravedad, difusión y dinámica del fluido. En una adhesión activa la superficie de la célula bacteriana facilita el proceso. Los flagelos, permiten la movilidad de las células hasta el sitio específico de adhesión y los pili, proteínas de adhesión, cápsulas y carga de las superficies, facilitan el proceso de agregación y adhesión [2].
Por medio de observaciones de microscopía en fase de contraste, se ha encontrado que antes de la adhesión, las células bacteriales exploran el área donde se van a fijar [1], y generalmente se localizan donde se encuentran células de las mismas especies, si las hay, formando monocapas de células sobre la superficie colonizada.
Estas observaciones directas de las células demuestran que las mismas pueden percibir su proximidad a la superficie. A continuación, las células inician su estado de adhesión y formación de biopelícula, y deben producir nuevo material exopolisacárido para consolidar su adhesión a la superficie y a otras células bacteriales. En el proceso de adhesión inicial de las células, existe un estado reversible, seguido de uno irreversible. La fase reversible involucra fuerzas físicas como las electrostáticas y estéricas, Van der Waals e interacciones hidrofóbicas, conocidas en conjunto como la DVLO (Derjaguin, Verwey, Landau y Overbeek) [4]. Ésta ha sido usada para describir la interacción neta entre la célula y la superficie plana como un balance entre dos factores aditivos. Las interacciones de Van der Waals son de atracción y las interacciones de repulsión se dan por la superposición entre el sustrato y la célula (doble capa eléctrica). Este amplio rango de fuerzas es conocido como fisisorclón [4]. En este estado, la bacteria muestra un movimiento browniano y puede ser fácilmente removida. Las células microbianas planctónicas suspendidas en el flujo, son trasportadas hasta la superficie por dichas fuerzas físicas o por apéndices bacterianos como los flagelos. Factores como la energía disponible, la funcionalidad de la superficie, orientación bacterial, condiciones de temperatura y presión, son variables locales del ambiente que contribuyen a la adhesión bacterial. Si las fuerzas de repulsión son mayores que las de atracción, la bacteria se separa de la superficie, lo que podría ocurrir probablemente antes del acondicionamiento del sustrato [4].
En la segunda fase, un número de células adsorbidas, reversiblemente, permanecen inmovilizadas y se adsorben irreversiblemente por los apéndices físicos de la bacteria (flagelos, pili y fimbrias) que superan las fuerzas físicas repulsivas de la doble capa eléctrica. Además, el contacto de los apéndices estimula las reacciones químicas de oxidación e hidratación, permitiendo la formación de enlaces con la superficie [11]. Por lo anterior, se requiere un mayor esfuerzo para remover la bacteria por la formación de fibrillas poliméricas, las cuales forman un puente entre la célula bacterial y el sustrato [11], y habilitan la asociación irreversible con la superficie. Este tipo de uniones toman entre 20 minutos hasta cuatro horas para formarse, a una temperatura de 20°C [2], pero son tan fuertes que impiden la remoción de estas colonias ya formadas. Por ello los medios para removerlas requieren tratamientos químicos fuertes, aplicación de enzimas, detergentes, sanitizantes, surfactantes y/o condiciones de calor extremas.
CINÉTICA Y ESTABILIDAD
En fase estacionaria, las células se dividen (división binaria), y las células hijas cubren el exterior e interior del punto de adhesión hasta formar un grupo [12]. Tales interacciones y crecimiento dentro de la biopelícula, forman una estructura similar a la de un hongo. Esta estructura, permite el paso de nutrientes a la bacteria hasta el interior de la biopelícula. Después de iniciar la fase de adaptación, se presenta un rápido incremento de la población, correspondiente al crecimiento en fase exponencial [4]. El rápido crecimiento ocurre por el aprovechamiento de los nutrientes del fluido o del sustrato. En este estado, la contribución física y química de la adhesión final y los procesos biológicos prevalecen. La liberación de polisacáridos de adhesión intercelular (PIA) y la presencia de cationes divalentes, permiten la interacción fuerte entre las células[4].
La fase de crecimiento estacionarla describe la fase donde la velocidad de división es igual a la velocidad de muerte celular. A una alta concentración de células, una serie de mecanismos de señalización celular son empleados por las blopelículas, donde un número de sistemas de autoinducción son usados para estimular la expresión genética de procesos mecánicos y enzimáticos de producción de alginatos, los cuales forman parte fundamental de la matriz extracelular [1,4].
La fase de muerte se relaciona con el desprendimiento de la biopelícula. Las enzimas son producidas por los mismos microorganismos, para el rompimiento de los polisacáridos de la biopelícula, activando el desprendimiento de la superficie de la bacteria para la colonización de sustrato fresco. La alginato liasa producida por Pseudomonas fluorecens y Pseudomonas aeruginosa, N-acetyl-heparosan liasa por Escherlchia coli y hialurodinasa por Streptococcus equi son ejemplos de enzimas encargadas del rompimiento de la matriz de la biopelícula [4].
Con respecto a las técnicas que permiten el seguimiento del crecimiento microbiano (que es uno de los aspectos más importantes en la determinación de la cinética de formación de los microorganismos), y para evaluar la adhesión de bacterias, se puede usar un método colorimétrico, en el cual por medio de la tinción de las células fijas con cristal violeta o safranina y su posterior lavado, se analizan varias cepas, en un tiempo de al menos 24 a 48 horas para estimar la adherencia de las células teñidas después de la etapa de lavado. El uso de pruebas rápidas ha sido reportado para evaluar la formación de la biopelícula. Estas pruebas han sido validadas en cepas de Listeria monocytogenes, E. coli, Staphylococcus xylosus, y Staphylococcus carnosus, las cuales tienen habilidad para formar biopelículas en acero inoxidable, poliestireno y vidrio [13].
Los métodos que se podrían emplear para evaluar la adhesión bacterial son: análisis de microscopía, técnicas en placa, fracción aérea de superficie de cobertura, entre otros. La ventaja de estas técnicas es que son estandarizadas internacionalmente y permiten la comparación directa. Las técnicas estáticas permiten el crecimiento del medio con pocas fluctuaciones mecánicas y térmicas. Los métodos dinámicos, incluyen el crecimiento de biopelículas usando flujo de líquidos, donde la atracción del microorganismo con la superficie es forzada. De esta forma el nutriente y otros constituyentes químicos del medio, pueden ser constantemente monitoreados y mantenidos con el tiempo [13].
Una de las técnicas usadas para observar y medir la adhesión de la biopelícula es el background. En el background, la medida de la adhesión de la bacteria se realiza por el establecimiento sobre una superficie de vidrio en una cámara sellada, el recuento se lleva a cabo con un microscopio [14]. Después de un periodo de tiempo la cámara es girada al revés, las células no adheridas se desprenden de la superficie por la aplicación de esfuerzos de corte y finalmente las células que permanecen adheridas son recontadas [14]. Recientemente, la medida de adhesión de las bacterias ha sido mejorada por tecnologías sofisticadas de micromanipulación, microscopía de fuerza atómica y pinzas ópticas [15,16]. En estas técnicas se usan equipos como el microscopio de barrido electrónico (SEM), microscopio óptico y microscopio de láser confocal [13,17,18,], los cuales permiten la adquisición de imágenes con gran resolución, para su posterior análisis. La microscopía óptica y electrónica de barrido son netamente de observación y no miden directamente la adhesión de la población bacterial. Las técnicas para determinar la fuerza crítica, como la microscopía de fuerza atómica y micromanipulación determinan directamente la fuerza requerida para que la bacteria pueda ser removida, esta última desarrollada por el Grupo de Micromanipulaclón de la Universidad Birmingham, Inglaterra, y permite medir las propiedades mecánicas de la célula [19].
De otro lado, algunos autores presentan la incidencia de métodos de control como aplicación de ozono, agua electrolizada oxidizada, ácido láctico y emulsiones entre otras, en la disminución y eliminación de las biopelículas [20, 21, 22, 23, 24, 25].
MODELOS DE PREDICCIÓN
Varios modelos han sido propuestos para explicar el desarrollo y propiedades de las biopelículas.
Teoría de monocapa de la biopelícula. La primera teoría de la estructura de biopelícula, es un modelo continuo, que describe las biopelículas como lisas, planas y homogéneas [2,26].
Teoría estructural en 3D: Teoría Multicapa. El modelo continuo fue adecuado por predicciones ingenieriles, pero las observaciones usaron microscopía de contraste diferencial de interferencia (DIC), indicando una estructura heterogénea. El modelo de Kreft o swarm describe las biopelículas como un mosaico heterogéneo con microorganismos agrupados sostenidos por EPS [26].
Teoría actual. Está basada primariamente en la evidencia entregada por el microscopio de barrido con láser confocal. Este instrumento ha permitido visualizar una estructura como un hongo en la biopelícula con estructuras aéreas denominadas torres, pedestales y canales de agua. La porción más elevada es el hongo formado por un tallo estrecho penetrado por canales. Este modelo propone que el crecimiento celular en la periferia es rápido y lento en el interior. Las torres o porciones del hongo pueden romperse y repoblar otros lugares. Se ha demostrado que el rango de la porosidad de las biopelículas maduras en la parte superior es de 89% y del 5% en la capa del fondo [27], evidencia que confirma este modelo.
Se ha descrito la estructura de la biopelícula en un rango de monocapas de células simples dispersadas en fragmentos de células, las cuales son esparcidas a lo largo de la mucosa de las capas en tres dimensiones [28], en las cuales los organismos pueden competir, operar independientemente, cooperar o ser predadores.
CONTROL Y REMOCIÓN DE LAS BIOPELÍCULAS
Los nutrientes, el agua limitante, el diseño de equipos y el control de temperatura son aspectos importantes en el control de la biopelícula. Es muy frecuente, que las variables mencionadas anteriormente, no se puedan cambiar, por tanto el control de la biopelícula queda reducido a la efectividad de la limpieza que se realice sobre las áreas y equipos de proceso. La limpieza puede estar acompañada por el uso de químicos o la combinación de efectos físicos y químicos. Los agentes químicos de limpieza suspenden y disuelven residuos de los alimentos por la disminución de la tensión superficial, emulsificación de grasas y peptización de las proteínas [29].
En la mayoría de las plantas de proceso de alimentos, las superficies de contacto con los alimentos son limpiadas y sanitizadas diariamente, sin embargo muchas otras superficies como los tanques de almacenamiento y los exteriores de las bombas, paredes y techos no presentan un plan de limpieza efectivo. Estos aspectos generan una oportunidad para la formación de biopelículas en presencia de humedad. Para el caso de la remoción de biopelículas de Bacillus, esta se encuentra influenciada por la velocidad de flujo, tiempo y temperatura de limpieza, agentes alcalinos, presencia de quelantes, especialmente EDTA. Estos han mostrado ser más efectivos en la remoción de blopelículas que la limpieza con agentes ácidos. Otros tratamientos como la esterilización con vapor, son útiles en este aspecto; se ha reportado que la exposición a vapor (125°C x 30 min) de material contaminado con biopelículas, es un método de limpieza altamente efectivo [30].
La formación de aerosoles es frecuentemente, la principal fuente de dispersión de los microorganismos. Estos son formados durante el lavado de las superficies y drenajes, o cuando las biopelículas se secan y liberan material particulado. La inundación de los desagües de los pisos, produce un aerosol que incrementa la microflora en el aire. Se ha demostrado que después de 210 minutos de la generación de un aerosol, L. monocytogenes era detectable en el aire [31]. Es así, como la implementación y cumplimiento de sistemas de calidad como las Buenas Práticas Agrícolas (BPA), Buenas Prácticas de Manufactura (BPM), Análisis de Peligros y Puntos Críticos de Control (HACCP), sistemas ISO (9000, 14000, 22000), disminuyen los eventos de corrección dados por prácticas deficientes en el proceso. Tanto el consumidor como la industria, exigen metodologías que garanticen la inocuidad de los alimentos. El número de regulaciones técnicas y estándares de calidad y competitividad se están incrementando en la mayoría de los países.
GENERALIDADES EN LA INDUSTRIA LÁCTEA
El daño de leche pasteurlzada por bacterias Gram positivas y de esporas termoresistentes es bien reconocido [32], su presencia se da por su resistencia a tratamientos térmicos así como inadecuados métodos de limpieza y desinfección de superficies. El incremento del transporte de leche cruda refrigerada desde las fincas productoras hasta las fábricas se ha incrementado en las últimas décadas, generándose problemas de contaminación con Bacillus cereus, el cual promueve alteraciones de las proteínas de la leche y lípidos por proteasas y lipasas, disminuyendo la vida útil de los productos [33]; se ha encontrando que las superficies de equipos post-pasteurización, así como otros equipos implicados en la cadena láctea son reservorios de este microorganismo [34].
Con respecto a los problemas generados en las diferentes operaciones del procesamiento lácteo, la formación de depósitos en intercambiadores de calor, es un problema que causa la reducción de la eficiencia y el aumento de la caída de presión, afectando la economía de las plantas de procesamiento. Como resultado de la formación de estos depósitos existe la posibilidad del deterioro en la calidad del producto porque el fluido no se puede calentar a la temperatura requerida y a que los depósitos desalojados por el flujo del fluido pueden causar contaminación. Al ser la leche un fluido biológico complejo, las respuestas térmicas de sus constituyentes difieren uno del otro, pudiéndose clasificar los depósitos en dos tipos. El tipo A, corresponde a proteína y se llevan a cabo a temperaturas entre 75-11O°C. Estos depósitos son blancos, suaves y esponjosos y su composición es de 50- 70% de proteínas, 30-40% de minerales y 4-8% de grasa. Los depósitos tipo B, corresponden a minerales y se presentan a temperaturas superiores a 110°C. Los depósitos son duros, de color gris, y su composición es de 70-80% de minerales, 15-20% de proteínas y 4-8% de grasa [32]. La formación de estos depósitos promueve la adhesión de microorganismos a la superficie de la transferencia de calor, formándose una bioincrustación. La presencia de microorganismos en el flujo del proceso y/o en la capa de depósitos no solo afecta la calidad del producto, sino que también tiene influencia en el proceso [35].
Entre los mecanismos de remoción de estas biopelículas se pueden usar el ozono, el agua electrolizada y el lavado hidráulico, entre otros.
Ozono. El interés en el ozono como alternativa al cloro y otros desinfectantes químicos en operaciones de limpieza y desinfección, se basa en su alto poder biocida, amplio espectro microbiano, ausencia de productos que pueden causar daño a la salud, habilidad para aplicarse in situ, y sus ventajas ambientales que permiten a las empresas el cumplimiento de obligaciones legales [36].
El ozono fue decretado por un panel de expertos del Departamento de Agricultura de Estados Unidos (USDA) en el año 1998, como una sustancia segura (GRAS) para usarse como desinfectante o sanitizante en la industria de alimentos en acuerdo con la FDA, institución que también lo aprobó [37].
El ozono puede aplicarse como gas o en agua ozonizada y en diferentes superficies y materiales entre los que se encuentra el acero inoxidable usado en la industria de alimentos.
Agua Electrolizada. El agua electrolizada oxidizada (EO), también conocida como agua electrolizada fuertemente acida (SAEW) o solución acuosa electrolizada fuertemente acida (ESAAS), es un nuevo agente antimicrobiano que ha sido usado en Japón por varios años, y que tiene aplicación sobre gran variedad de microorganismos. El EO, es producida por el paso de una solución salina diluida a través de una celda electrolítica, dentro de la cual el ánodo y el cátodo están separados por una membrana [38].
Se ha demostrado que el agua EO, es un efectivo agente antimicroblano en aplicaciones en canales de aves de corral, huevos, semillas de alfalfa, peras, manzanas, melocotón, tomates, fresas y equipos de procesamiento de alimentos [39]. Los brotes de listeriosis se han asociado con el procesamiento de alimentos y la formación de biopelículas de L. monocytogenes en el ambiente de procesamiento como una fuente de contaminación primaria [40]. Se ha reportado que con tratamientos de EO durante 30-120 seg, se logró reducir hasta 4.3-5.2 log ufc (en 2-5 cm) las poblaciones de bacterias viables de L. monocytogenes en biopelículas sobre superficies de acero inoxidable [41], y que el EO tiene un gran potencial para ser usada como agente de limpieza y sanitización para limpieza in situ en sistemas de ordeño [42].
Lavado Hidráulico. El Lavado Hidráulico (LH), o flushing, es una de las técnicas disponibles para mejorar la calidad del agua y la capacidad hidráulica del sistema de distribución de un acueducto, quitando la arena, los sedimentos, y las biopelículas de las paredes de la tubería [43].
El Lavado Hidráulico Unidireccional (LHU) es un método mejorado del LH convencional, y se lleva a cabo a velocidades de aproximadamente 1.8 m/s, las cuales pueden ser adecuadas para el retiro de la biopelícula y de los productos de la corrosión y otros desechos unidos a las paredes de la tubería [44].
Por otra parte, en lo referente a la superficie de materiales, investigaciones recientes demostraron que la supervivencia de Yersinla spp., Enterobaccteria spp., Aeromonas spp., depositadas en vidrio y acero inoxidable era dependiente de la humedad relativa [44,45]. El análisis de imagen digital y Microscopía de Epifluorescencla directa (DEM) es un método usado para cuantificar microorganismos viables y no viables, que puede llevarse a cabo en 15 minutos. Se ha estudiado el efecto de varios ambientes en la supervivencia de Enterobacter cloacae, Pseudomonas aeruginosa y S. aureus sobre superficies de acero inoxidable [45], usando DEM y el método convencional de cultivo. También se demostró que patógenos como el S. aureus siguen siendo viables en la superficie de acero, aún si está seca [45]. Esto confirma la importancia de secar rápidamente las superficies de acero inoxidable, después del proceso de limpieza y desinfección, para disminuir la proliferación de las bacterias, ya que el agua es un factor que potencia el crecimiento microbiano y la formación de la biopelícula.
ASPECTOS EN VEGETALES FRESCOS
Los vegetales frescos han sido identificados como medios de transporte de bacterias patógenas altamente importantes en salud pública, tales como Salmonella [46], Shigella [47], Listeria monocytogenes [48], Escherichia coli, entre otros. Las bacterias no patógenas pueden constituir comunidades de biopelículas en vegetales como lechuga y tomate y los microorganismos potencialmente patógenos pueden llegar a ser retenidos y protegidos dentro de estas biopelículas [49]. Por el contrario de las células planctónicas, las biopelículas bacterianas sobre las superficies de las plantas son más resistentes a los sanitizantes y detergentes, lo que se atribuye a la producción de enzimas que degradan las sustancias antimicrobianas [50]. Se demostró, que ácido láctico al 0.2%, seguido de cloro a 200ppm y cloruro de lauril dimetil bencil amonio al 0.1 mg/ml fue el tratamiento de sanitizantes más eficiente con reducciones de 5.08, 4.7 y 4.21 log ufe en tomates contaminados con Y. enterocolitica [51]. Este tratamiento puede ser efectivo en la reducción de poblaciones de E. coli y Y. enterocolitica en vegetales dependiendo del tamaño de inóculo, tipo de vegetal y el tiempo transcurrido entre la sanitización y el consumo.
La FDA (Food and Drug Administration) ha propuesto que los tratamientos con sanitizantes en vegetales frescos deben ser capaces de reducir la carga de patógenos a mínimo 5 log ufe sin afectar las características sensoriales del producto tratado.
ASPECTOS EN LA INDUSTRIA DE CÁRNICOS
La microflora de aves incluye patógenos tales como Salmonella sp., Campylobacter jejuni, L. monocytogenes y E. coli, esta última formando parte de la microflora intestinal. Con la aparición de E. coli enterohemorrágica 0157:H7 en la comida china, ésta se ha convertido en una fuente de contaminación más importante que la causada por Salmonella. Estos microorganismos pueden atacar fuertemente tanto la piel como los músculos de las aves, y las superficies de los equipos de procesamiento. En este ámbito, se han realizado investigaciones sobre métodos sinergísticos contra este tipo de biopelículas, es así como una combinación biocida de peróxido de hidrógeno, bisulfato de sodio y timol fue eficaz contra iE. coli y S. typhimurium adheridas a la piel de pollos [52].
El uso de tales combinaciones biocidas brinda un método fácil, efectivo y seguro para desinfección de aves de corral, al mismo tiempo ofrece buenas perspectivas en esterilización de materiales de empaque, sanitizantes para huevos incubados, y desinfectantes de frutas y vegetales. Con garantías económicas, esta combinación puede ser un sustituto seguro y efectivo de los antibióticos comunes usados en el procesamiento de aves de corral.
La contaminación de carne en el ambiente de proceso puede ocurrir en cualquier estado, desde el sacrificio hasta el embalaje. Se ha reportado que las células de la biopelícula, podrían interactuar con proteínas (flbronectina, laminina y colágeno) de la carne y adherirse exitosamente a su superficie [53].
Diseño Sanitario. De acuerdo con [54], los principios para el diseño de equipos e instalaciones deben permitir el control sobre los riesgos de contaminación durante el procesamiento de productos de carne y pollo listos para comer (RTE), la construcción de nuevas instalaciones y la renovación de las existentes.
TENDENCIAS
Teniendo en cuenta que un gran número de industrias se están viendo afectadas por la formación de biopelículas y considerando también que actualmente existen restricciones en algunos tipos de biocidas, es probable que las investigaciones mantengan un interés industrial que permita prever las circunstancias futuras. La adhesión de las bacterias y la formación de las biopelículas, no están completamente entendidas en términos de genética y efectos ambientales; es probable que las técnicas como la micromanipulación y la microscopía de fuerza atómica, sean mucho más exploradas, ya que actualmente no están ampliamente disponibles. Se han diseñado sistemas que se pueden montar in situ, para observar las condiciones de flujo de la biopelícula, sus propiedades elásticas, y otras características utilizando microscopía de barrido con láser confocal (CLMS)[4]. Este tipo de técnicas permite analizar el comportamiento antes, durante y después de una superficie, expuesta a diferentes compuestos químicos para evaluar la reducción de la adhesividad de las bacterias y consecuente formación de las biopelículas. Sería importante que el sector agroalimentario pueda acceder a este tipo de tecnologías, en beneficio de las empresas y los consumidores.
En Colombia, aunque los reportes de listeriosis y la presencia de Listeria monocytogenes en leche cruda no se encuentra reglamentado, hay una considerable incidencia de este patógeno en este tipo de alimentos debido a que el procesamiento de productos derivados como quesos y helados pueden ser preparados usando leche contaminada. Se ha reportado la incidencia de patógenos en el 37% de leche cruda y en el 2% de la leche pasterizada, con una incidencia del 29.2% y del 22.8% en quesos tipo suaves colombianos [55]. En hospitales de tercer nivel, en la ciudad de Cali (Colombia), se registraron 19 casos fatales relacionados con este sector, desde 1994 hasta 1999. Por otra parte, el consumo de leche cruda a nivel nacional es muy alto; en el Departamento de Boyacá, cerca del 95% de los habitantes compran este tipo de leche a personal no autorizado, aduciendo mejor contenido nutricional comparado con la leche pasterizada. Hoy día, varios grupos de investigación se encuentran desarrollando técnicas de detección y control con el fin de disminuir la incidencia de contaminación por formación de biopelículas en este sector agroindustrlal [55].
CONCLUSIONES
Las biopelículas generalmente están asociadas a procesos de contaminación en la industria de alimentos, sin embargo, el desarrollo de nuevas tecnologías permite la aplicación en procesos benéficos como fermentaciones y biorremediación.
La falta de control y prevención en la formación de biopelículas puede generar problemas de salubridad y pérdidas económicas por daños en instalaciones, equipos y aditamentos.
Los problemas ocasionados por la formación de biopelículas en la industria de alimentos pueden ser prevenidos mediante la correcta implementación y aplicación de sistemas de calidad y el uso de técnicas de remoción tales como ozono, agua electrolizada oxidizada, lavado hidráulico, entre otros.
AGRADECIMIENTOS
A la Universidad del Cauca por los recursos facilitados.
REFERENCIAS
[1] COSTERTON, J. Introduction to biofilm: Discussion. Int J Antimicrob Ag., 11, 217-221,1999. [ Links ]
[2] CHMIELEWSKI, R. and FRANK, J. Biofilm Formation and Control in food Processing Facilities, Compr Rev Food Sel Food Sal, 2, 22-32, 2003. [ Links ]
[3] CARPENTIER, B. and CERF, 0. Biofilms and their consequences, with particular reference to hygiene in the food industry: Review. J Appl Bacteriol., 75, 499-511,1993. [ Links ]
[4] GARRETT, T.; BHAKOO, M. and ZHANG, Z. Bacterial adhesión and biofilms on surfaces, Review, Prog Nat Sci., 18; 1049-1056, 2008. [ Links ]
[5] SANDASI, M.; LEONARD, C. and VILJOEN, A. The effect of five common essential of five components on Listona monocytogenes biofilms, Food Control, 19,1070-1075,2008. [ Links ]
[6] POULSEN, L Microbial Biofilm in Food Processing. Review. Lebensm Wiss Technol, 32, 321-326. 1999. [ Links ]
[7] SHARMA M.; EASTRIDGE, J. and MUDD, C. Effective household disinfection method of kitchen sponges, Food Control, 20, 310-313, 2009. [ Links ]
[8] ABEE, T. et al. Germination and outgrowth of spores of Bacillus cereus group members: Diversity and role of germinant receptors. Food Microbiol., In Press. [ Links ]
[9] MORIKAWA, M. Beneficial Biofilm Formation by Industrial Bacteria Bacillus subtills and Related Species: Review. J Biosci Bioeng., 101,1-8,2006. [ Links ]
[10] STEPHENS, C. Microbiology: Breaking Down Biofilms, Curr Biol., 12, R132-R134, 2002. [ Links ]
[11 ] KUMAR, G. and ANAND, S. Significance of microbial biofilms in food industry: A review,. Int J Food Microbiol, 42, 9-27,1998. [ Links ]
[12] HALL-STOODLEY, L. and STOODLEY, R. Developmental regulation of microbial biofilms, Curr Opin Biotech.,13, 228-233, 2002. [ Links ]
[13] CHAVANT, P. et al. A new device for rapid evaluation of biofilm formation potential by bacteria, J Microbiol Meth., 68, 605-612, 2007. [ Links ]
[14] SHAHEEN, R. et al. Persistence strategies of Bacillus cereus spores isolated from dairy silo tanks, Food Microbiol., 27, 347-355, 2010. [ Links ]
[15] FANG, H.; CHAN, K. and XU, L. Quantification of bacterial adhesión forces using atomic force microscopy (AFM), J Microbiol Meth., 40, 89-97, 2000. [ Links ]
[16] BOYD, R. et al. Use of the atomic force microscope to determine the effect of substratum surface topography on bacterial adhesion, Langmuir., 18, 2343-2346, 2002. [ Links ]
[17] PERNI, S. et al. Biofilm development by Listeria innocua in turbulent flow regimes, Food Control., 17,875-883,2006. [ Links ]
[18] GARCÍA-ALMENDÁREZ, B. et al. Effect of Lactococcus lactis UQ2 and its bacteriocin on Listeria monocytogenes biofilms, Food Control., 19, 670-680, 2008. [ Links ]
[19] LIU, W. et al. Development and use of a micromanipulation technique for measuring the force required to disrupt and remove fouling deposits, Food Bioprod Process, 80; 286-291, 2002. [ Links ]
[20] AL-ADHAM, I.S.I. et al. Microemulsions are highly effective anti-biofilm agents, Appl Microbiol., 36, 97-100,2003. [ Links ]
[21] BIRKS, S. Ozone technology gets a clean break, Food Manuf., 78, 63-64, 2003. [ Links ]
[22] SIMÕES, M., SIMÕES, L. and VIEIRAB, M. A review of current and emergent biofilm control strategies, Food Sel Technol., 43, 573-583, 2010. [ Links ]
[23] OKULL, D. and LABORDE, L. Activity of electrolyzed oxidizing water against Penicilium expansum on suspensión and on wounded apples, J Food Sci, 69, 23-27, 2004. [ Links ]
[24] OZER, N. and DEMIRCI, A. Electrolyzed oxldizing water treatment for decontamination of raw salmon inoculated with Escherichia coli 0157:H7 and Listeria monocytogenes Scott A and response surface modeling. J Food Eng., 72, 234-241, 2006. [ Links ]
[25] RUSSELL, S. The effect of electrolyzed oxidative water applied using electrostatic spraying on pathogenic and indicator bacteria on the surface of eggs. Poultry Sci, 82,158-162, 2003. [ Links ]
[26] BISHOP, P. Biofilm structure and kinetics, Water Sci Technol., 36, 287-294,1997. [ Links ]
[27] ZHANG, T. and BISHOP, P. Structure, activity and composition of biofilm, Water Sci Technol., 29, 335-344,1994. [ Links ]
[28] DAVEY M. and O'TOOLE, G. Microbial biofilms: from ecology to molecular genetics, Microbiol Mol Biol R., 64, 847-867, 2000. [ Links ]
[29] SERRA, G. P. Estudio del Biofilm: Formación y Consecuencias. Escola de Prevenció I Seguretat Integral, 2003. Available: http://www.adiveter.com/ftp/articles/A1070308.pdf [citado 1 de Noviembre de 2010] [ Links ]
[30] WIRTANEN, G.; HUSMARK, U. and MATILLA-SANDHOLM, T. Microbial evaluation of the biotransfer potential from surfaces with Bacillus biofilms after rinsing and cleaning procedures in closed food processing systems. J Food Protect., 59,727-733,1996. [ Links ]
[31] ZHANG, G. Aerosol Studies with Listeria innocua and Listeria monocytogenes. J Food Protect., 70; 1857-1865,2007. [ Links ]
[32] BANSAL, B. and CHEN, X. A critical review of milk fouling in heat exchangers, Compr Rev Food Sci Food Saf., 5, 27-47, 2006. [ Links ]
[33] FROMM, H. and BOOR, K. Characterization of pasteurized fluid milk shelf-life attributes, J Food Sci., 69, 207-214, 2004. [ Links ]
[34] SALUSTIANO, V. Contamination of milk with Bacillus cereus by post-pasteurization surface exposure as evaluated by automated ribotyping, Food Control., 20, 439-442, 2009. [ Links ]
[35] YOO, J.-A., HARDIN, M. and CHEN, X. The influence of milk composition on the growth of Bacillus sterothermophilus. J Food Eng., 77, 96-102,2006. [ Links ]
[36] PASCUAL, A. et al. Use of ozone in food industries for reducing the environmental impact of cleaning and disinfection activities. Trends Food Sel Tech., 18, S29-S35, 2007. [ Links ]
[37] GUZEL-SEYDIM, Z., GREENE, A. and SEYDIM, A. Use of ozone in the food industry, Lebensm Wiss Technol., 37, 453-460, 2004. [ Links ]
[38] HSU, S. Effects of flow rate, temperature and salt concentration on chemical and physical properties of electrolyzed oxidizing water. J Food Eng., 66,171-176,2005. [ Links ]
[39] HUANG, Yu. et al. Application of elecrolyzed water in the food industry. Food Control 19(4); 329-345. 2008. [ Links ]
[40] CARPENTIER, B. and CHASSAING, D. Interactions in biofilms between Listeria monocytogenes and resident microorganisms from food industry premises. Int J Food Microbiol., 97,111-122,2004. [ Links ]
[41] AYEBAH, B. and HUNG, Y.C. Electrolyzed water and its corrosiveness on various surface materials commonly found in food processing facilities. J. Food Process Eng., 28, 247-264, 2005. [ Links ]
[42] WALKER, S. CIP cleaning of a pipeline milking system using electrolyzed oxidizlng water. Int J Dairy Technol., 58, 65-73, 2005. [ Links ]
[43] CARVAJAL, L; GÓMEZ, A. y OCHOA S. Hydraulic flushing modeling in pipes to control of biofilm growth. Dyna, 74, 63-72, 2007. [ Links ]
[44] MORETRO, T. et al. Biofilm formation and the presence of the intercellular adhesion locus ica among Staphylococci from food and food processing environments. Appl Environ Microb., 69, 5648-5655, 2003. [ Links ]
[45] FUSTER-VALLS, N. et al. Effect of different environmental conditions on the bacteria survival on stainless steel surfaces, Food Control., 19, 308-314,2008. [ Links ]
[46] GUPTA, S. et al. Outbreak of Salmonella Braenderup infections associated with Roma tomatoes, north eastern United States: A useful method for subtyping exposures in field investigations, Epidemiol Infect, 135,1165-1173, 2007. [ Links ]
[47] RELLER, M. et al. A large multiple-restaurant outbreak of infection with Shigella flexneri serotype 2a traced to tomatoes. Clin Infect Dis., 42, 163-169,2006. [ Links ]
[48] JOHNSTON, L. et al. A field study of the microbiological quality of fresh produce of domestic and Mexican origin. Int J Food Microbiol., 112, 83-95, 2006. [ Links ]
[49] RAYNER, J., VEEH, R. and FLOOD, J. Prevalence of microbial biofilms on selected fresh produce and household surfaces. Int J Food Microbiol., 95, 29-39, 2004. [ Links ]
[50] ROMANOVA, N. et al. Rapid methods to assess sanitizing efficacy of benzalkonium chloride to Listeria monocytogenes biofilms. J Microbiol Meth., 71, 231-237, 2007. [ Links ]
[51] VELÁZQUEZ, L. et al. Evaluation of chlorine, benzalkonium chloride and lactic acid as sanitizers for reducing Escherichia coli Ol 57:H7 and Yersinia enterocolitica on fresh vegetables. Food Control., 20,262-268, 2009. [ Links ]
[52] KIM, D. and DAY, D. A biocidal combination capable of sanitizing raw chicken skin. Food Control., 18, 1272-1276,2007. [ Links ]
[53] CHEN, J., ROSSMAN, M. and PAWARD, D. Attachment of enterohemorrhagic Escherichia coli to the surface of beef and a culture medium. Food Sel Technol., 40, 249-254, 2007. [ Links ]
[54] SEWARD, S. Sanitary design of ready to eat meat and poultry processing equipment and facilities. Trends Food Sel Tech., 18, S108-S111,2007. [ Links ]
[55] VANEGAS, M. et al. Detection of Listeria Monocytogenes in raw whole milk for human consumption in Colombia by real-time PCR. Food Control., 20, 430-432, 2009. [ Links ]














