Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.9 no.2 Popayán Jul.y/Dec. 2011
1 Ingeniero Químico. Ph.D. Ingeniería de Alimentos. Docente Facultad de Ciencias Agropecuarias, Departamento de Ingeniería Agrícola y Alimentos, Universidad Nacional de Colombia, Sede Medellín.
2 Ingeniera de Alimentos. M.Sc. Ciencia y Tecnología de Alimentos, Universidad Nacional de Colombia, Sede Medellín.
3 Licenciatura en Educación, Área Mayor Química. Ph.D. Ciencia y Tecnología de Alimentos, Facultad de Ciencias Agroindustriales, Universidad del Quindío.
Correspondencia: mcortes@unal.edu.co
Recibido para evaluación: 20/04/2011. Aprobado para publicación: 27/05/2011
RESUMEN
La impregnación al vacío es la técnica aplicada por la ingeniería de matrices, como mecanismo de incorporación de soluciones al interior de las matrices alimentarias. Se evaluó la evolución del color en la pulpa de banano verde (PBV) (Musa cavendish) a diferentes condiciones de almacenamiento: tiempo (0, 3, 6, 9, 12 y 15 días), temperatura (4, 20 y 30°C) y empaque, con vacío (CV) y sin vacío (SV)); bajo tratamientos con sulfitos (500, 1000, 1500 mg/kg PBV) y de la interacción antioxidante (60, 90, 120 mg/100 g PBV) acidulantes (50, 150, 250 mg/100 g PBV). Los parámetros de color se evaluaron en el espacio CIEL*a*b*, en términos de luminosidad (L*) y cromaticidad a* y b*. El ANOVA presentó diferencias estadísticas significativas (p <0,05) en todos los parámetros con respecto a tiempo de almacenamiento, temperatura, condiciones de empacado, zonas y concentraciones. Siempre la zona radial fue más oscura que la zona superficial. El almacenamiento de pulpa de banano a 4°C, CV, permitió obtener características de color aceptables comercialmente durante los 15 días de almacenamiento. Los tratamientos con metabisulfito a 500 mg/kg PBV y la combinación de ácido ascórbico (90 mg/100 g PBV) y ácido cítrico (50 mg/100 g PBV), presentaron las mejores características de color en el tiempo a las diferentes temperaturas y concentraciones.
PALABRAS CLAVE:
Musa cavendish, pardeamiento enzimàtico, polifenil oxidasa, antioxidantes, acidulantes.
ABSTRACT
Vacuum impregnation is a technique applied by matrix engineering as the mechanism to incorporate the solutions to the interior of an alimentary matrix. The development of the color of the pulp of unripe Banana (PUB) (Musa cavendish) was evaluated in different storage conditions: Time 0, 3, 6, 9, 12, and 15 days, Temperature 4, 20, and 30°C, packed with vacuum (WV) and without vacuum (NV) under sulfite treatment (500, 1000, 1500 mg/kg PUB) and the antioxidant interaction (60, 90, 120 mg/100 g PUB), acidulant (50, 150, 250 mg/100 g PUB) using the vacuum impregnation (VI) technique. The parameters of color were evaluated using CIEL *a *b *, in terms of lighting (L*) and chromaticity a* and b*. The ANOVA test showed significant statistical differences (P <0,05) in all the parameters related to the times of storage, temperature, packing conditions, areas of the pulp, and concentration of the solutions. In all of the cases the core part of the pulp was darker than the external part. The storage of the Banana pulp at 4°C, packed under vacuum, allowed to get acceptable commercial characteristics of color during the 15 days of storage. The treatment with metabisulfites at 500 mg/kg PUB and the combination of Ascorbic (90 mg/100 g PUB) and Citric (50 mg/100 g PUB) acids, gave the best characteristics of color in time at the different temperatures and concentrations.
KEY WORDS:
Musa cavendish, enzymatic browning, Polyphenyl oxidase, antioxidants, acidulants.
RESUMO
A impregnaçáo a vacuo é é uma técnica usada pela engenharia de matrizes como um meio de incorporar soluçóes na matriz dos alimentos. Neste trabalho foram avaliados a evoluçáo da cor da polpa da banana verde (PBV) (Musa cavendish) para diferentes condiçóes de armazenamento: tempo (0, 3, 6, 9, 12 e 15 dias), temperatura (4, 20 e 30 °C) e condiçóes de embalagem (com vácuo (CV) e sem vacuo (SV)), sob tratamento com sulfitos (500, 1000, 1500 mg/kg de PBV) e interaçáo antioxidante (60, 90, 120 mg/100 g PBV) e acidulantes (50, 150, 250 mg/100 g PBV). Os parâmetros de cor foram avaliados no sistema CIÉL*a*b*, em termos de luminosidade (L*) e cromaticidade (a*,b*). A análise de variância (ANOVA) apresentou diferenças significativas (p <0,05) em todos os parâmetros em relaçáo ao tempo de armazenamento, temperatura, condiçóes da embalagem, áreas da fruta e concentraçóes. A área radial foi sempre mais escura do que a regiáo da superfície. 0 armazenamento de polpa da banana a 4°C e embalada a vácuo (CV), permitiu a obtençáo de características de cor comercialmente aceitáveis durante os 15 dias de armazenamento. Os tratamentos com metabisulfito a 500 mg/kg PBV e urna mistura de ácido ascòrbico (90 mg/100 g PBV) e ácido cítrico (50 mg/100 g PBV), teve as melhores características de cor ao longo do tempo em diferentes temperaturas e concentraçóes.
PALAVRAS CHAVE:
Musa cavendish, escurecimento oxidativo, antioxidante, acidulante.
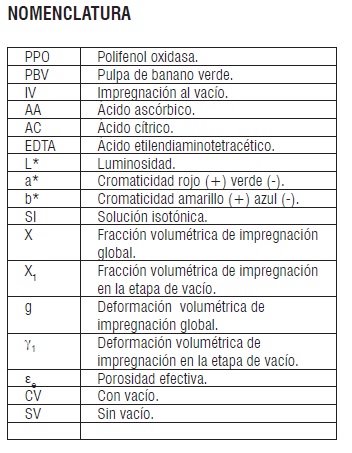
INTRODUCCIÓN
El banano en sus múltiples variedades, es una fruta tropical de reconocida importancia comercial, con un agradable sabor y un contenido importante de carbohidratos, fibras, vitaminas y minerales, tales como las vitaminas A, B6, B9, C, E, magnesio, calcio, silicio, fósforo, azufre, hierro, sodio y potasio [1,2]. Colombia es uno de los principales exportadores de banano, participando, en el año 2008, con el 15,33% (1.798.300 ton.) para los mercados de Bélgica, Estados Unidos, Alemania e Italia [3].
Durante la manipulación, almacenamiento y procesamiento del banano, se generan múltiples reacciones, entre ellas el pardeamiento enzimático, que afecta notablemente el color y en general la vida útil del producto [4]. Esta reacción es atribuida a la acción de la polifenoloxidasa (PPO), una cobreproteína que actúa sobre los compuestos fenólicos, causando oxidación y polimerización con el consecuente desarrollo de un color pardo [5], que reduce la aceptabilidad por parte del consumidor [6]. La PPO cataliza dos reacciones diferentes en presencia de 02: la o-hidroxilación de sustratos fenólicos (actividad cresolasa) a o-difenoles, y la oxidación de o-difenoles a quinonas (actividad catecolasa); estas quinonas se pueden polimerizar a través de rutas no enzimáticas generando pigmentos pardos conocidos como melaninas [7]. El pardeamiento enzimático se puede controlar a través de métodos físicos y químicos, siendo, en la mayoría de los casos, la combinación de los dos. Los métodos físicos incluyen la reducción de temperatura y/o oxígeno [8], el uso de empaque en atmósferas modificadas o recubrimientos comestibles, tratamiento con irradiación gama o altas presiones [9]. Los métodos químicos aplicables pueden dividirse en tres clases, dependiendo del factor que ataque, el cual puede ser la enzima, los sustratos o los productos [10,11]. Tratamientos químicos han sido aplicados con agentes reductores como el ácido ascórbico, pirosulfito de sodio y agentes que contiene grupos tiol como la L- cisteína [12,13,14], acidulantes como los ácidos cítrico, málico y fosfórico [15], agentes quelantes, como el dietil ditiocarbamatol de sodio [14], agentes acomplejantes como la ciclodextrina [14,16]; haluros, como el fluoruro de sodio y cloruro de sodio [14,17]; inhibidores de enzimas [18,19]; y tratamientos enzimáticos en frutos [20,21].
Durante la última década, se ha utilizado la ingeniería de matrices a través de la aplicación de la técnica de impregnación al vacío (IV) [22,23], como una metodología que permite controlar propiedades funcionales y/o sensoriales en sistemas porosos, a partir de la incorporación al interior de la matriz alimentaria de componentes fisiológicamente activos, además de componentes que favorecen el sabor, la textura y el color [24,25,26,27,28]. El objetivo de la presente investigación fue evaluar los cambios de color, durante el almacenamiento de la pulpa de banano verde (PBV) (Musa cavendish), impregnada al vacío con soluciones antipardeantes.
MÉTODO
Materias primas
Se utilizaron bananos de la variedad Musa cavendish, de la región del Urabá (Antioquia, Colombia), en un estado de madurez verde según la norma técnica Colombiana NTC 1190, tipo exportación. Las muestras de PBV fueron de forma cilíndrica (peso ~ 27g, diámetro ~ 30 - 40 mm., longitud ~ 50 mm.). Los componentes antipardeantes de estudio fueron, metabisulfito de sodio (Na2S205) (99% pureza), ácido ascórbico (AA) (99% pureza) y ácido cítrico (AC) (99% pureza); además se utilizó sal común, benzoato de sodio (conservante) y etilendiaminotetracético (EDTA) (secuestrante de 02).
Color
Se utilizó un espectrofotómetro X-RITE modelo SP-64, con el iluminante D65, observador de 10°, sin especular incluido y una ventana de observación de 4 mm. A partir del espectro de reflexión de las muestras, se obtuvieron las coordenadas de color CIE-L*a*b*, realizando las lecturas en la zona radial y superficial de la PBV. Las lecturas de color se realizaron superficial y radialmente en 3 lotes o r&ecute;plicas, a razón de 5 muestras/lote y 6 lecturas /muestra, para un total de 90 lecturas para cada condición de almacenamiento. Los patrones de comparación fueron muestras de PBV fresco a las mismas condiciones de almacenamiento. Un estudio preliminar en PBV fresco, fijó el criterio de aceptación comercial en función de la luminosidad (L*), definiendo un L*crítico = 70 [29].
Impregnación al vacío
La respuesta a la IV se determinó con una solución isotónica (SI) de NaCl (1,6%p/p) de igual aw que la PBV fresco (0,990± 0,003), en términos de fracción volumétrica de impregnación (m3 Sl/m3 PBV) al final de la etapa de vacío (X1) y al final del proceso (X), la deformación volumétrica al final de la etapa de vacío (g1) y al final del proceso (g) y la porosidad efectiva (ee), de acuerdo a la metodología descrita por [30]. El proceso IV se realizó durante 5 minutos a una presión de vacío de 31,4 mm Hg y mantenidas por otros 5 minutos a la presión barométrica local de 640 mm Hg. La composición de las soluciones de impregnación se determinaron según la metodología descrita por Cortés [31]: conservante (1000 mg/kg PBV), EDTA (75 mg/kg PBV), S205= (500,1000 y 1500 mg/ kg PBV), AA (60, 90 y 120 mg/100 g PBV) y AC (50, 150 y 250 mg/100 g PBV).
Almacenamiento
Las condiciones de almacenamiento fueron: temperatura (4, 20 y 30°C), tiempo (0, 3, 6, 9, 12 y 15 días) y empacado (con vacío (CV) y sin vacío (SV)); se utilizaron bolsas plásticas multicapa de poliamida-polietileno marca ALICO S.A., con barrera al vapor de agua (< 15 g/m2/24h/atm, T = 38°C), 02 (60 ce/ m2/24h/atm, 23°C), N2 y C02.
Diseño experimental y análisis de datos
El diseño experimental utilizado para los tratamientos con sulfitos fue un diseño factorial aleatorizado con 3 factores: temperatura de almacenamiento (3 niveles: 4, 20 y 30°C), tiempo de almacenamiento (6 niveles: 0, 3, 6, 9,12 y 15 días) y tratamiento (8 niveles: patrón CV y SV, Sulfitos a 500, 1000 y 1500 mg/kg PBV en condiciones CV y SV). El diseño experimental utilizado para la mezcla de AA y AC fue similar al de los sulfitos donde las concentraciones utilizadas fueron 60, 90 y 120 mg de AA /100 g PBV y 50,150 y 250 mg de AC /100 g PBV. Se trabajaron para los ensayos lotes de 750 g de solución. La concentración más favorable a los parámetros de color en la PBV de la solución de AA empleada, se mezcló con las diferentes concentraciones de AC para evaluar su sinergia en el control del pardeamiento. Los resultados se analizaron a partir de ANOVAS, utilizando el método LSD (mínimas diferencias significativas) como método de comparaciones múltiples, con un nivel de confianza del 95% y un nivel de potencia del 80%. Se utilizó el paquete estadístico Statgraphics Centurium (XV).
RESULTADOS
Los valores medios más la desviación estándar obtenidos de los parámetros IV con la SI fueron: X = 13,30 ± 1,74%, X1 = -1,78 ± 2,36%, g1 = -0,12 ± 0,32%, g = -0,06 ± 3,99 % y ee = 12,27 ± 4,57%. Estos resultados identifican la estructura de la PBV adecuada para el proceso IV, lo cual es correspondiente con los valores de εe, que representa la disponibilidad del volumen interno para la incorporación de la solución ¡sotónica. Los valores negativos de X1 y g1 en la etapa de vacío indican la salida del líquido nativo del interior de la estructura y una contracción volumétrica en la PBV. Los valores negativos de g representan una contracción global de la estructura, la cual no es capaz de recuperar su condición inicial, como resultado del acoplamiento del mecanismo hidrodinámico y del fenómeno de deformación relajación. Algunos investigadores reportan valores de X menores a los obtenidos, como en uchuvas (6,60±1,16) [32,33] y fresas (1,5±0,3) [34], y mayores en hongos (Pleurotus ostreatus) 31,2±10,7 [28].
PBV impregnada con Na2S205
Las figuras 1 y 2 presentan los valores medios con intervalos LSD (95%) de L*, a*, b* a 4, 20 y 30°C, para las muestras patrones OSV y OCV (zona radial y superficial) y para las muestras tratadas con Na2S205 y empacadas CV y SV. Para la zona radial y superficial y en los niveles de las temperaturas utilizadas, el ANOVA presentó diferencias significativas (p<0,05) en L*, a*, b* con respecto a los factores tratamiento y tiempo de almacenamiento.
Se observa que en las muestras OSV y OCV en los valores de L* siempre fueron menores en la zona radial que en la superficial, debido al efecto del corte mecánico ejercido en la zona radial, que produce un sellamiento en los poros, lo que provoca que la luz que incide sobre la muestra presente mayor absorción, reflejándose menos y produciendo muestras más oscuras. Además el corte mecánico genera ruptura de poros y liberación de sustratos y enzimas. Las muestras patrones empacadas sin vacío (OSV) en la zona radial a 4,20 y 30°C alcanzaron el valor L* crítico en el día 1 y en la zona superficial a los 3, 2 y 1.5 días respectivamente; mientras que las muestras patrones empacadas con vacío (OCV) en la zona radial lo alcanzaron a los 10,5 y 3 días y en la zona superficial a los 11,8 y 4.5 días, respectivamente. Esta situación muestra un efecto mayor en la degradación de la coordenada L* al potenciarse el pardeamiento cuando se incrementa la temperatura, coincidiendo con lo reportado por otras investigaciones [35]. Algunos autores han obtenido valores de L* en PBV menores, lo cual se podría atribuir a los cambios de variedad, cultivos, condiciones ambientales, entre otros [36]. El ANOVA presentó diferencias significativas en las coordenadas a* y b* por efecto del periodo de almacenamiento, el tipo de empaque y la zona; presentando valores promedios de 5 y 27 respectivamente, mostrando en el plano cromático a*b* desplazamiento de la zona de los grises hacia la zona límite de los grises y amarillos, tanto en la zona radial como la superficial.
El ANOVA presentó diferencias significativas en las coordenadas L*, a* y b* por efecto de los factores tratamiento y tiempo de almacenamiento. La coordenada L* presenta en los niveles de temperaturas utilizados, valores superiores en las muestras impregnadas con Na2S205 que las muestras patrones, y además mayores tiempos de aceptación, lo cual se atribuye a las propiedades blanqueantes y antioxidantes o reductoras del Na2S205 [37], el cual ejerce un efecto inhibitorio competitivo sobre la PPO, al atrapar los grupos sulfidrilos del sitio activo [38].
A 4°C, los valores de L* en todas las muestras CV (radial y superficial) presentaron una tendencia a mantenerse durante los 15 días en el rango entre 75 y 80; mientras que las muestras SV, presentaron los mejores resultados en la zona radial y superficial con el tratamiento Na2S205 a 1500 mg/kg PBV, con tiempos de aceptación comercial de 13 y 15 días respectivamente. A medida que incrementa la temperatura de almacenamiento (20 y 30°C) se potencializa el efecto del pardeamiento, siendo el tratamiento más efectivo a 1500 mg/kg PBV), con un tiempo de aceptación comercial (±12 días), tanto para la zona radial como para la zona superficial, a condiciones CV y SV.
Las coordenadas a* y b* en las muestras impregnadas con Na2S205 tienden a ser más estables que L*, desplazándose entre los valores a* (-2 - 3) y (-2 -1), b* (21 - 28) y (20 - 25,5), para las zonas radial y superficial respectivamente. En el plano cromático a*b*, las muestras tratadas inician en el área de grises y se desplazan hacia el límite de los grises con amarillos.
Las muestras almacenadas a 4°C, CV, cumplieron con el tiempo de aceptación de 15 días para 500, 1000 y 1500 mg Na2S205/kg PBV, conservando el color al retardar el pardeamiento enzimático. Se seleccionó el tratamiento 500 mg Na2S205/kg PBV, por su menor costo y efectividad, donde las muestras empacadas CV presentaron mayores tiempos de aceptación que las SV.
PBV impregnada con AA
Las figuras 3 y 4 presentan los valores medios con intervalos LSD (95%) de los parámetros de color L*, a*, b* para PBV en las zonas radial y superficial respectivamente, tratada por IV con AA a las concentraciones 60,90 y 120 mg/100g PBV y para las muestras patrones a las temperaturas de almacenamiento 4, 20 y 30°C durante los tiempos de control de 0, 3, 6, 9,12 y 15 días en condiciones de empacado CV y SV. Para todas las temperaturas, el ANOVA presentó diferencias significativas (p<0,05) en las coordenadas L*, a* y b*, con respecto a los factores tratamiento y periodo de almacenamiento. En todos los casos, la zona radial fue más oscura que la zona superficial (L*<), similar a lo observado en los tratamientos con Na2S205 ; mientras que las muestras tratadas con AA fueron más claras (> L*) que las muestras patrones, lo cual se atribuye a la incorporación de la solución antlpardeante en la PBV la cual desde un primer instante empieza a ejercer un poder inhibitorio de la PPO.
Las muestras impregnadas a concentraciones de 60, 90 y 120 mg/100g PBV, almacenadas CV a 4°C presentan valores de L* > L*crítico (70), alcanzando para el día 15 valores entre 71 y 78, tanto para la zona radial como para la zona superficial. A 20 y 30°C se observa como las muestras impregnadas a mayores concentraciones de AA CV (90 y 120 mg/100g PBV) alcanzan valores de L* > L*crítico, durante los 15 días de almacenamiento, tanto para la zona radial como para la zona superficial, siendo mayores en la zona superficial. A 20°C las muestras empacadas CV y tratadas a 60 mg/100g PBV presentaron L* > L*crítico hasta el día 12 y a 30°C hasta el día 6. Las muestras impregnadas en todas las concentraciones y almacenadas SV, no lograron mantener a ninguna temperatura el color en el tiempo de estudio de 15 días (L* < L*crítico), lo cual se atribuye al efecto fundamental del 02 en presencia del sustrato fenólico y la enzima PPO.
En el plano cromático a*b*, los valores medios para las muestras empacadas CV y SV y tratadas a las diferentes concentraciones, se ubican en el límite de los tonos grises, desplazándose hacia la zona de los tonos grises con amarillo, (a*<10y b*<32).
Se seleccionó la concentración de 90 mg/1 OOg PBV, por ser la concentración más baja que garantiza el tiempo de aceptación de 15 días a las 3 temperaturas evaluadas.
PBV impregnada con AA y AC
Las figuras 5 y 6 presentan los valores medios con intervalos LSD (95%) de L*, a*, b* para PBV en las zonas radial y superficial respectivamente, tratadas por IV con AA a 90 mg/100g PBV, y con AC a 50, 150 y 250 mg/100g PBV y para las muestras patrón a 4, 20 y 30°C durante los tiempos 0, 3, 6, 9, 12 y 15 días y en condiciones de empacado CV y SV.
Para todas las temperaturas, el ANOVA presentó diferencias significativas (p<0,05) en L*, a* y b* con respecto a los factores tratamiento y tiempo de almacenamiento. Para todos los tratamientos, la zona radial fue más oscura que la zona superficial, de igual manera como lo ocurrido en los tratamientos con sulfito y AA; además, las muestras almacenadas CV presentaron mayores tiempos de aceptación que las SV. Esta situación se atribuye a la acción acidulante y antioxidante de los componentes antipardeantes, que hace reducir el pH de la matriz e inactivar o ralentizar el mecanismo de reacción de la PPO [37], al mismo tiempo por la influencia de la disminución de la presión parcial de 02 sobre la inhibición del pardeamlento enzimátlco [21].
Se observa que las muestras tratadas a las concentraciones de 50, 150 y 250 mg/100g PBV, almacenadas CV a 4°C y 20°C, se mantuvieron por encima del L*crítico durante los 15 días de estudio, tanto en la zona radial como superficial con valores de L* entre 74 y 80,5 a 4°C y 70 y 80,5 a 20°C. En las muestras empacadas CV almacenadas a 30°C, se observó que a las concentraciones de 150 y 250 mg/100g PBV en la zona superficial, se obtuvieron valores de L* > L*crítico durante los 15 días de seguimiento, mientras que en la zona radial solamente se mantiene por encima del L*crítico la concentración de 250 mg/100g PBV. Las muestras almacenadas en condiciones de SV en la zona radial a las temperaturas de 4,20 y 30°C al igual que las muestras almacenadas a 30°C en la zona superficial en las tres concentraciones de AA y AC pasaron el L*crítico antes de cumplir el día 3; para la temperatura de 4°C, las muestras no alcanzaron a llegar al día 9 y para la temperatura de 20°C no alcanzaron el día 6 en la zona superficial; lo que confirma que, si no hay remoción de 02 la actividad de la enzima PPO no es inhibida [21].
En el plano cromático a*b* los valores medios para todos los tratamientos de AA y AC a 50, 150 y 2500 mg/100 g PBV, CV y SV se encuentran ubicados en la zona de los grises con una ligera tendencia a alcanzar la zona de amarillos (a*<10 y b*<27).
Los resultados obtenidos, definen que los procesos de IV de PBV con concentraciones de 90 mg de AA y 50, 150 y 250 mg AC/100 g PBV son efectivos en el control del pardeamiento tanto en la zona radial como superficial, cuando el producto es empacado CV y almacenado a 4 y 20°C. Por efectos de costos y efectividad, se seleccionó el tratamiento combinado a 90mg AA /100 g PBV y 50 mg AC/100g PBV.
CONCLUSIONES
La PBV se considera una matriz adecuada para el proceso IV, con una porosidad efectiva de aproximadamente 12%, que facilita la incorporación de soluciones en su interior. Esta característica permite aplicar componentes antipardeantes como el metabisulfito de sodio, ácido ascórbico y ácido cítrico en solución, que al ser incorporados controlan el pardeamlento enzimático.
La coordenada L* representa el parámetro de color que relaciona los mayores cambios debido al pardeamlento enzimático, lo cual permite revalidar el criterio de aceptación comercial en función un L*3 70.
En todos los casos, el corte mecánico en la zona radial produce un sellamiento y rompimiento de poros liberando sustratos y enzimas, que hace que los valores de L* sean menores y las muestras se vean más oscuras, debido a una mayor absorción de la luz y menor reflexión.
La temperatura de almacenamiento y el empacado representan factores determinantes en el proceso de pardeamiento de la PBV, siendo 4°C y el empacado CV las condiciones más efectivas que permiten alcanzar un tiempo de aceptación de 15 días, cuando el fruto es impregnado con concentraciones de 500,1000 y 1500 mg Na2S205/kg PBV; 60, 90 y 120 mg AA/100 g PBV; y los tratamientos combinados a 90 mg AA/100 g PBV con 50,100y150mg AC/100gPBV.
REFERENCIAS
[1] OVALLE, J. y RUEDA, S.G. Paquete de capacitación en manejo post-cosecha del banano criollo. Convenio SENA - Reino Unido, Bogotá (Colombia): 1999, 298 p. [ Links ]
[2] HOFSOMMER, H. and WALLRAUCH, S. The composition of banana puree. Fruit Processing, 11 (1), 2001, p. 6-11. [ Links ]
[3] FAO. Dirección de Comercio y Mercados. Estadísticas banano. Organización de las Naciones Unidas para la agricultura y la alimentación, Roma (Italia): 2009, p. 1-2. [ Links ]
[4] GARCÍA, C, GIRALDO, G., HURTADO, H. y MENDIVIL, C. Cinética enzimática de la polifenol oxidasa del banano Gros Michel en diferentes estados de maduración.Vitae, 13 (2), 2006, p. 13-19. [ Links ]
[5] QUINDE, Z., ULLRICH, S.E. and BAIK, B.K. Genotypic variation in color and discoloration potential of barley-based food products. Cereal Chemistry, 81 (6), 2004, p. 752-758. [ Links ]
[6] FRIEDMAN M. Food browning and its prevention: an overview. Journal of Agriculture and Food Chemistry, 44 (3), 1996, p. 631-653. [ Links ]
[7] SÁNCHEZ-FERRER, A., RODRÍGUEZ-LÓPEZ, J.N., GARCÍA-CÁNOVAS, F. and GARCÍA-CARMONA, F. Tyrosinase: a comprehensive review of its mechanism. Biochem. Biophys, Acta 1247,1995, p.1-11. [ Links ]
[8] ZAWISTOWSKI, J., BILIADERIS, C.G. and ESKIN, N. Polyphenol oxidase. En: Oxidative Enzymes In Foods. DS Robinson, Nam Eskin eds. New York (USA): Elsevier Science Publishers, 1992, p. 217-273. [ Links ]
[9] SUN, N., LEE, S. and SONG, K.B. Effect of high-pressure treatment on the molecular properties of mushroom polyphenoloxidase. Lebensmittel-Wissenschaft und-Technologie, 35 (4), 2002, p. 315-318. [ Links ]
[10] ANTOLOVICH, M., PRENZLER, R.D., PATSALIDES, E. and MCDONALD S. Methods for testing antioxidant activity. The Analyst, 127 (1), 2002, p. 183-198. [ Links ]
[11] MARSHALL, M.R., KIM, J. and WEI C.H. Enzymatic browning in fruits, vegetables and seafoods [online]. Available: htpp://www.fao.org/ag/ags/agsl/enzymefinal/copyrigh.htm [citado 5 de Noviembre de 2009]. [ Links ]
[12] DING, C.K., CHACHIN, K., UEDA, Y. and WANG, C.Y. Inhibition of loquat enzymatic browning by sulfhydryl compounds. Food Chem., 76 (2), 2002, p. 213-218. [ Links ]
[13] RICHARD-FORGET, F.C., GOUPY RM. and NICOLÁS, J.J. Cysteine as an Inhibitor of enzymatic browning 2: Kinetic studies. J Agrie Food Chem., 40 (11),1992, p. 2108-2113. [ Links ]
[14] SELLES S. Pardeamiento enzimatico del fruto de níspero (Eriobotrya japónica cv. Algerie): Enzimología y fisiología de la polifenil oxidasa. [Tesis Ph.D Química]. Universidad de Alicante, Facultad de Ciencias, Alicante (España). 2007, 223 p. [ Links ]
[15] NICOLAS, J., RICHARD-FORGET, F.C., GOUPY RM., AMIOT, M.J. and AUBERT, S.Y. Enzymatic browning reactions in apple and apple products. Crit Rev Food Sci Nutr., 34 (2), 1994, p. 109-157. [ Links ]
[16] NUÑEZ-DELICADO, E., SOJO, M., GARCIA-CARMONA, F. and SÁNCHEZ-FERRER, A. Parcial purification of latent persimmon fruit polyphenol oxidase. J Agric Food Chem., 51 (7), 2003, p. 2058-2063. [ Links ]
[17] CASADO-VELA, J., SELLES, S. and BRU, R. Purification and kinetic characterization of polyphenol oxidase (PPO) from tomato fruits (Lycopersicom esculentum cv. Muchamiel). J Food Biochem, 29 (4), 2005, p. 381 -401. [ Links ]
[18] MCEVILY, A.J., IYENGAR, R. and GROSS A. Compositions and methods for inhibiting browning in foods using resorcinol derivatives. U.S. patent 5,059,438.1991. [ Links ]
[19] LUO, Y. and BARBOSA-CÁNOVAS, G.V. Enzymatic browning and its inhibition in new apple cultivars slices using 4-hexylresorcinol in combination with ascorbic acid. Food Science and Technology International, 3 (3), 1997, p. 195-201. [ Links ]
[20] VAMOS-VIGYAZO, L. Polyphenol oxidase and peroxidase in fruits and vegetables. Crit Rev Food Sci. Nutr., 15(1),1981, p. 49-127. [ Links ]
[21] GUERRERO, J., SWASON, B. and BARBOSA-CÁNOVAS, G. Inhibition of polyphenoloxidase in mango puree with 4-Hexilresorcinol, cysteine and ascorbic acid. LWT, 38 (6), 2005, p. 625 - 630. [ Links ]
[22] FITO, P. Modelling of vacuum osmotic dehydratation of foods. Journal of Food Engineering, 22 (1-4), 1994, p. 313-328. [ Links ]
[23] FITO, P. and PASTOR, R. Non-diffusional mechanism occurring vacuum osmotic dehydration (VOD). Journal of Food Engineering, 21 (4), 1994, p. 513-519. [ Links ]
[24] FITO, P. and CHIRALT, A. Vacuum impregnation of plant tissues. En: A Design of minimal processing technologies for fruits and vegetables. Alzamora, S. M.; Tapia, M.S.; Lopez-Malo (Eds), Maryland: Aspen Publisher Inc., 2000, p.189-204. [ Links ]
[25] FITO, P., CHIRALT, A., BARAT, J.M., MARTÍNEZ-MONZO, J. and MARTÍNEZ-NAVARRETE, N. Vacuum impregnation for development of new dehydrated products. Journal of Food Engineering, 49 (4), 2001, p. 297-302. [ Links ]
[26] CORTÉS, M. y CHIRALT, A. Cinética de los cambios de color en manzanas deshidratadas por aire fortificado con vitamina E. Vitae, 15 (1), 2008, p. 8-16. [ Links ]
[27] PUENTE, I., BETORET, N. and CORTÉS, M. Evolution of probiotic content and color of apples impregnated with lactic acid bacteria. Vitae, 16 (3), 2009, p. 297-303. [ Links ]
[28] RUIZ, M., CORTÉS, M. y HENRÍQUEZ, L.E. Efecto de dos atmósferas de empaque en hongos comestibles (Pleurotus ostreatus.) tratados mediante impregnación al vacío con una solución conservante. Vitae, 17(1), 2010,11-19. [ Links ]
[29] PINTO, L. Caracterización de los atributos de calidad durante el almacenamiento del banano verde (Musa cavendish) mínimamente procesado impregnado al vacío con soluciones antipardeantes. [Msc. Ciencia y Tecnología de Alimentos]. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Medellín (Colombia): 2010,237 p. [ Links ]
[30] SALVATORI, D., ANDRES, A., CHIRALT, A. and FITO, P. Structural and compositional profiles in osmotically dehydrated apple. Journal of Science, 63 (3), 1998, p. 1-5. [ Links ]
[31] CORTÉS M. Desarrollo de productos de manzana deshidratados enriquecidos con vitamina E. [Tesis Ph.D. Ingeniería de alimentos]. Universidad Politécnica de Valencia, Valencia (España): 2004,320 p. [ Links ]
[32] MARÍN, Z. Viabilidad del desarrollo de uchuva (Physalis peruviana L.) mínimamente procesada enriquecida con micro-organismos probióticos a partir de la ingeniería de matrices. [Msc. Ciencia y Tecnología de Alimentos]. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Medellín (Colombia): 2009,157 p. [ Links ]
[33] RESTREPO, A.M., CORTÉS, M. y MARQUES, C.J. Uchuvas (Physalis peruviana L.) mínimamente procesadas fortificadas con vitamina E. Vitae, 16(1), 2009, p. 19-30. [ Links ]
[34] RESTREPO A.M. Nuevas perspectivas de consumo de frutas: Uchuva (Physalis peruviana L.) y fresa (Fragaria ananassa Duch) mínimamente procesadas fortificadas con vitamina E. [Msc. Ciencia y Tecnología de Alimentos]. Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, Medellín (Colombia): 2008,105 p. [ Links ]
[35] CHRISTOPHER, W., YEARS LEY, N.H. and BANKS, S.G. Temperature effects on the internal lower oxygen limits of apple fruit. Postharvest Biology and Technology, 11(2), 1997, p. 73-83. [ Links ]
[36] QUEVEDO, R., DÍAZ, 0., RONCEROS, B., PEDRESCHI, F. and AGUILERA, J.M. Description of the kinetic enzymatic browning in banana (Musa cavendish) slices using non-uniform color information from digital images. Food Research International. 42(9), 2009, p. 1309-1314. [ Links ]
[37] LYENGAR, R. and MCEVILY A.J. Anti-browing agents: alternatives to the use of sulfites in foods. Trends Food Sci Technol., 3(3), 1992, p. 60-64. [ Links ]
[38] DANIELE U. Estudio de la utilización de metabisulflto de sodio como inhibidor del pardeamiento en duraznos deshidratados al sol. Memorias X Congreso de Ciencia y Tecnología de alimentos. CYTAL. Mar del Plata (Argentina), 2005; p. 18-20. [ Links ]














