Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.9 no.2 Popayán Jul.y/Dec. 2011
EFECTO DEL TRATAMIENTO FERMENTATIVO CON MIELES DE CAÑA Y ABEJA EN LA CALIDAD PROTEICA DE ALIMENTOS CÁRNICOS Y LÁCTEOS
EFFECT OF A FERMENTATION TREATMENT WITH A HONEY MIXTURE ON THE PROTEIN QUALITY OF MEAT, FISH AND DAIRY FOODS
EFEITO DO TRATAMENTO DE FERMENTAÇÃO COM DUAS FONTES DE MEL NA QUALIDADE PROTEICA DE ALIMENTOS CÁRNICOS E LÁCTEOS
1 Químico. Centro Internacional de Agricultura Tropical - CIAT. Palmira. Colombia.
2 PhD. Nutrición Humana. Centro Internacional de Agricultura Tropical - CIAT. Palmira. Colombia
3 Tecnólogo químico y de alimentos. Centro Internacional de Agricultura Tropical - CIAT. Palmira. Colombia
Correspondencia: d.e.gutierrez@cgiar.org A.A CIAT. 6713, Cali, Colombia, Tel: + (572) 4450100 Ext.:3675, Fax: + (572) 4450073, Financiado por la Agencia Canadiense de Desarrollo Internacional (CIDA 7034161), Fondo Monsanto y el Centro Internacional de Agricultura Tropical (CIAT).
Recibido para evaluación: 12/05/2010. Aprobado para publicación: 03/04/2011
RESUMEN
Se evaluaron alimentos cárnicos (salmón, trucha, chorizo, salchicha) y lácteos (queso) sometidos a 3 tratamientos: 1) Térmico (77), 2) Fermentativo (TF), 3) Testigo (TE). Para evaluar algunos efectos se determinó el contenido de nitrógeno total (CNT), el contenido de proteína soluble (PS), y la digestibilidad in vitro de proteína (DP). El TF mejoró significativamente la DP en los alimentos. En el CNT se encontró que entre el TT y el TE no hubo diferencias, sin embargo sí hubo diferencia en el CNT entre el TE y el TE evidenciando menor CNT en el TF. Para la PS no hubo diferencia entre TF y el TE, sin embargo para el TT sí hubo diferencia, evidenciando mayor PS en 2 de los 4 alimentos evaluados en relación al TE. El TF no mejoró la calidad proteica de los alimentos, si bien hubo aumento en la DP, también hubo pérdidas en el CNT.
PALABRAS CLAVES:
Calidad Proteica, Fermentación, Mieles, Digestibilidad In Vitro de Proteína.
ABSTRACT
Meat (salmon, trout, chorizo, sausage) and dairy (cheese) products were treated in 3 ways: thermal cooking, fermentation, and raw. The following was evaluated: total nitrogen content (TN), soluble protein content (SP) and in vitro protein digestibility (PD). Thermal cooking significantly improved the product's PD. There was no difference in TN between thermal cooking and raw; however, TN was lower in fermentation than raw. For SP there was no difference between fermentation and raw; however in 2 of the 4 foods tested SP was higher for thermal cooking than raw. Fermentation did not improve the protein quality of foods; although there was an increase in DP, there were also losses in TN.
KEYWORDS:
Protein Quality, Fermentation, Honey, In Vitro Protein Digestibility.
RESUMO
Se avaliaram alimentos cárnicos (salmão, truta, linguiça, salchicha) e lácteos (queijo) submetidos a 3 tratamentos: 1) Térmico (77), 2) Fermentação (TF), 3) Testemunha (TE). Para avallar os efeitos dos tratamentos, se determinou o conteúdo de nitrogênio total (CNT), o conteúdo de proteína solúvel (PS), e a digestão in vitro de proteína (DP). 0 TF melhorou significativamente a DP nos alimentos. No CNT não houve diferenças significativas entre o TT e o TE mas houve entre o TF e o TE, mostrando menor CNT no TF. Para a PS não houve diferença significativa entre oTF e o TE, mas houve diferenga para o TT, mostrando maior PS nos 2 dos 4 alimentos avaliados com relaçao ao TE. 0 TF não melhorou a qualidade protéica dos alimentos, apesar do aumento na DP, houve perdas no CNT.
PALAVRAS CHAVE:
Qualidade Protéica, Fermentação, Mel, Digestão In Vitro de Proteína.
INTRODUCCIÓN
La fermentación es un proceso económico y sencillo que causa cambios químicos y modifica la funcionalidad de los alimentos [1 -5]. Es la acción de microorganismos y/o enzimas que genera cambios en dicho proceso y como consecuencia se mejora el valor nutricional, se disminuyen o eliminan factores antinutricionales, se aumenta la vida útil de los alimentos, especialmente de los productos cárnicos y lácteos que por su composición química y características biológicas son altamente perecederos [6], y se modifican las propiedades sensoriales, lo cual a veces se traduce en una mejor aceptabilidad por el público consumidor. Los cambios ocurridos en los alimentos fermentados dependerán de las condiciones de la fermentación en cada alimento.
De esta manera la fermentación produce distintos grados de desnaturalización e hidrólisis de las proteínas resultando en partículas más pequeñas que son más fácilmente atacadas por los jugos gástricos e intestinales cuando se ingieren, pudiendo ayudar en casos a personas con trastornos digestivos donde la secreción de ácido clorhídrico se ve afectada [7,8].
La miel de abeja es un alimento nutritivo que es consumido por el hombre en todo el mundo debido a sus bondades, en cuanto a su valor nutritivo y a sus efectos terapéuticos. Ha sido considerado un agente antibacteriano efectivo para el tratamiento de infecciones respiratorias, gastrointestinales y úlceras [9-12]. Su actividad antimicrobiana la han confirmado numerosos autores, en bacterias Gram positivas y Gram negativas [13-17], así como mejoras en la salud de personas que padecen de trastornos cardiacos [18].
La miel de caña es un alimento muy económico, producido en Colombia en grandes cantidades y que además es rico en contenido de minerales, especialmente en hierro, zinc y calcio [19] los cuales son fundamentales en la dieta de personas.
Teniendo en cuenta las propiedades anteriores de la miel de abeja y la miel de caña, nace la idea por parte de una empresa de alimentos en Colombia, de desarrollar un proceso fermentativo en alimentos cárnicos y lácteos, con el objetivo de combinar las propiedades nutricionales y funcionales de las mieles de caña y de abeja, junto con las propiedades fisicoquímicas y funcionales que otorgan los procesos de fermentación en los alimentos, a fin de lograr mejoras en la calidad proteica de los alimentos anteriormente mencionados.
El objetivo de este trabajo es evaluar los posibles efectos que proporcione el tratamiento fermentativo con la mezcla de miel de caña y miel de abejas, en la calidad proteica de los alimentos cárnicos y lácteos anteriormente mencionados.
MÉTODO
Tratamiento de las muestras
Las muestras fueron tratadas siguiendo el procedimiento descrito en la figura 1.
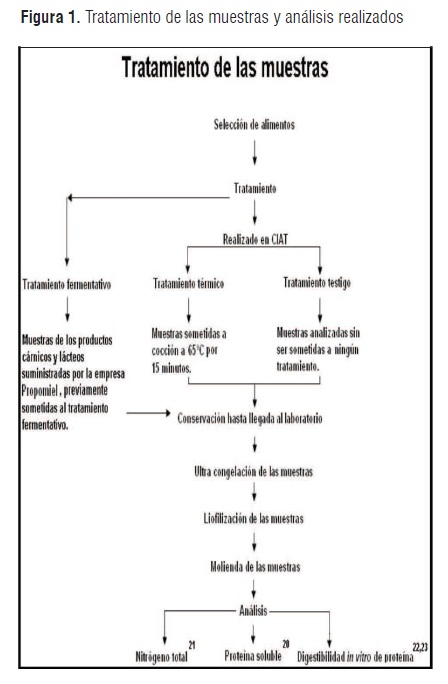
Selección de los alimentos. Para el presente estudio se trabajó con muestras de alimentos cárnicos y lácteos adquiridos comercialmente en supermercados de cadena, utilizando los siguientes productos: trucha arco iris comercial y salmón chileno comercial (marca Bahía Cúpica), chorizo comercial (ternera Zenú), salchicha comercial (Big Rica de Rica Rondo) y queso campesino comercial (marca Colanta). Se escogieron estos productos de marcas reconocidas, ya que estos poseen un control de calidad y estandarización en la composición nutricional, además como una recomendación de la empresa Propomiel, con el fin de trabajar con el mismo tipo de muestra que ellos someten al tratamiento fermentativo.
Los alimentos con el tratamiento fermentativo, fueron suministrados por la empresa de alimentos Propomiel (Calarcá, Quindío, Colombia), la cual fue la encargada de realizar el tratamiento en las muestras.
Tratamientos fisicoquímicos. Las muestras fueron sometidas a 3 tratamientos diferentes, un tratamiento fermentativo con la mezcla de mieles de caña y de abeja (realizado por la empresa Propomiel), un tratamiento térmico aplicando cocción a 65°C durante 15 min, y un tratamiento testigo con el fin de comparar el efecto de los 2 tratamientos iniciales. Es decir, con el tratamiento testigo el alimento quedó crudo.
Tratamiento fermentativo con mezcla de miel de caña - miel de abejas. El tratamiento fermentativo con las mezclas de mieles de caña y de abeja, fue realizado por la empresa Propomiel (Calarcá, Quindío, Colombia) la cual utilizó un proceso fermentativo propio y por el cual se reservó el derecho de difusión del mismo. De manera general se tomaron 80 g de cada una de las muestras y se colocaron en un bioreactor con 50 mL de un medio fermentativo conformado por una mezcla 50:50 de mieles de caña y abeja, durante 78 h a una temperatura de 25°C. Después del proceso fermentativo las muestras no fueron sometidas a procesos de cocción por recomendación de la empresa Propomiel, como un valor agregado para consumir estos alimentos directamente sin necesidad de ser cocinados. Posteriormente las muestras se extrajeron del medio fermentativo y se redujeron de tamaño con procesador de alimentos (Universal, 826, Medellín, Colombia) para ser depositadas en bolsas plásticas y congeladas inmediatamente.
Tratamiento de térmico. Para este tratamiento se tomó aproximadamente 80 g de cada una de las muestras y se colocaron en un beaker de 250 mL. Se adicionó aproximadamente 150 mL de agua ultra pura 18 MΩ.cm y se sometieron a proceso térmico a 65°C en una plancha calentadora (Corning, PC610, Corning, EEUU) por 15 min. Al cabo de este tiempo las muestras se retiraron de la plancha calentadora y se dejaron enfriar, posteriormente la muestra cocida fue reducida de tamaño con procesador de alimentos (Universal, 826, Medellín, Colombia) y fue depositada en bolsas plásticas, junto con el agua de cocción e inmediatamente sometidas a congelación.
Tratamiento testigo. Las muestras una vez adquiridas, fueron sometidas a reducción de tamaño con un procesador de alimentos (Universal, 826, Medellín, Colombia). Posteriormente se depositaron en bolsas plásticas e inmediatamente sometidas a congelación.
Congelación y liofilización. Cada una de las muestras fue congelada en un ultrafreezer (Reveo Thermo Scientific, Asheville, EEUU) a una temperatura de -80°C, y posteriormente liofilizada en un equipo liofilizador (Labconco, Kansas, EEUU) hasta que la muestra estuvo totalmente seca, lo cual tomó aproximadamente 1 sem.
Molienda. Una vez secas las muestras, se procedió a reducir de tamaño y a homogenizar las muestras, para este proceso se utilizó un mortero de cerámica. Las muestras ya homogenizadas se depositaron en recipientes plásticos y se almacenaron a -8°C en nevera, hasta su análisis.
Cuantificación de proteína soluble. La cuantificación de la proteína soluble en las muestras, se realizó usando el método de Lowry et al. [20] con algunas modificaciones. Para esto se tomó 0,1 g de muestra, se adicionó 20 mL de NaOH 1N y se homogenizó con ultra-turrax (IKA T18, Staufen, Alemania) por 3 min. Posteriormente la muestra se filtró en un papel filtro Whatman N°1 (Maidstone, Inglaterra), y se recogió el filtrado en tubos de 50 mL. Se tomaron y colocaron 0,385 mL del filtrado en viales Eppendorf de 1,5 mL, se adicionó 0,538 mL de la solución de Lowry (solución A:B:C, 100:1:1); la solución A se preparó con 0,572 g NaOH, 2,862 g Na2C03 y se llevó a 100 mL con agua 18 MΩ.cm, la solución B se preparó con 1,4232 g CuS04 y se llevó a 100 mL con agua 18 MΩ.cm, la solución C, se preparó con 2,853 g de tartrato de sodio dihidratado y se llevó a 100 mL con agua 18 MΩ.cm. La mezcla de muestra y reactivo de Lowry, se homogenizó en vortex mixer (Fisher Scientific, New York, EEUU), se llevó a la oscuridad durante 20 min. Luego se adicionó el reactivo de Folin (1 mL Folin y 1,2 mL de agua 18 MΩ.cm), se homogenizó con vortex mixer (Fisher Scientific, New York, EEUU) y se llevó a la oscuridad durante 30 min. Posteriormente, se colocaron 0,3 mL de la mezcla en platos de 96 pozos (Corning Incorporated, Corning, EEUU), se llevaron al espectrofotómetro (Biotek, MQX200, Winooski, EEUU) y se realizó lectura de la absorbancla a 750 nm.
Cuantificación del contenido proximal de nitrógeno.
El contenido de nitrógeno total, se cuantificó usando un método colorimétrico [21], en el cual la muestra se digestó con ácido sulfúrico concentrado en presencia de un catalizador (selenio); de esta manera el nitrógeno total se convirtió en amonio. Para esto se pesó 0.1 g de cada una de las muestras, se agregaron 2 mL de la mezcla ´cida (2 L de ácido sulfúrico al 96% + 3.5 g selenio), se agitaron las muestras y se dejaron en reposo por 20 h, posteriormente los tubos con las muestras se introdujeron en bloques de digestión (Skalar, 5600, Breda, Holanda) a 330°C durante el tiempo suficiente para que las muestras tomaran una coloración clara, aproximadamente 2 h. Una vez terminada la digestión, las muestras se dejaron enfriar y se llevaron con agua bidestilada hasta un volumen de 50 mL. Posteriormente las muestras fueron analizadas en un equipo autoanalizador (Skalar 4000 basado en el sistema Segmented Flow Analysis, Breda, Holanda). El ion amonio en el digestado se determinó formando un complejo de color verde esmeralda, mediante la adición de salicilato, nitroprusiato y cloro activo, este complejo se determinó colorimétrlcamente a 660 nm para determinar la concentración de nitrógeno total.
Determinación de la digestibilidad de proteína mediante método in vitro. Para analizar la digestibilidad de la proteína in vitro, se empleó el método de Hsu et al. [22], modificado por McDonough et al. [23]. Se pesaron cantidades de muestra de alimento que contenían 10 mg de nitrógeno; para esto previamente se analizó el contenido de nitrógeno total de las muestras. La cantidad de muestra fue disuelta en 2.5 mL de agua 18 MΩ.cm, luego se adicionaron 2.5 mL de NaOH 0.2N, se agitaron las muestras y posteriormente la mezcla se incubó por 30 min a 37°C en un baño MarÍa con agitación (Thermo Scientific, 2872, New York, EEUU) a 65 rpm. Después de la incubación, se adicionaron 5 mL de HCl 0.075 N y se ajustó el pH a 8. Posteriormente se adicionaron 2 mL de una solución multienzimática compuesta (4 mg de tripsina, 4,48 mg de quimotripsina y 1,02 mg de peptidasa). El pH se monitoreó por 10 min mediante un pHmetro (Thermo Scientific 8210, Beverly, EEUU) después de iniciada la reacción multienzimática. El porcentaje de digestibilidad de proteína se calculó usando la fórmula descrita en la ecuación 1:
Donde X representa el pH a los 10 min de iniciada la reacción.
Análisis estadístico de los resultados
El análisis estadístico se realizó empleando el software Stata, versión 9 (Stata Corp, College Station, Texas, EEUU). Para todos los análisis se compararon los 3 tratamientos (fermentación con miel, térmico, testigo). Los datos de digestibilidad de proteína, proteína soluble y nitrógeno total, no presentaron una distribución paramétrica, por lo tanto se aplicó el análisis no-paramétrico (Kruskal-Wallis test), para ver si este arrojaba diferencias significativas (P < 0.1) entre los tratamientos. Posteriormente se realizó la prueba post-hoc de Bonferroni, para conocer cuáles tratamientos fueron diferentes.
RESULTADOS
Digestibilidad in vitro de proteína
Para la salchicha y el chorizo, se encontró una diferencia significativa (P<0,05) entre el tratamiento fermentativo (78,06±1,11% para salchicha, 80,79±0,22% para chorizo) y el tratamiento térmico (72,90±1,50% para salchicha, 71,94 ±0,90% para chorizo), siendo mayor la digestibilidad de proteína en el tratamiento fermentativo. Para el salmón y la trucha no se encontró diferencia significativa (P>.0,05) entre el tratamiento fermentativo (83,46±0,88% para salmón, 84,25±0,77% para trucha) y el tratamiento térmico (84,95±0,43% para salmón, 84.38±0,82% para trucha). Por otra parte para todos los alimentos excepto para el salmón, se encontró diferencia significativa (P<0,05) entre el tratamiento fermentativo y el tratamiento testigo, presentando una mayor digestibilidad de proteína en los alimentos sometidos al tratamiento fermentativo (Tabla 1).
Contenido de nitrógeno total
Para todos los alimentos con la excepción de chorizo, se encontró diferencia significativa (P<0,05) entre el tratamiento fermentativo y el tratamiento de térmico, siendo menor el contenido de nitrógeno total en el tratamiento fermentativo (19,42±1,11 g/kg en salchicha, 55,55±3,52 g/kg en salmón, 39,47±0,97 g/kg en queso, 66,56±6,84 g/kg en trucha). Por otra parte no hubo diferencia significativa (P>.0,05) en el contenido de nitrógeno total entre el tratamiento térmico y el tratamiento testigo (Tabla 2).
Contenido de proteína soluble. Se encontró una diferencia significativa (P<0,05) en el contenido de proteína soluble, entre el tratamiento fermentativo y el tratamiento térmico, evidenciando un mayor contenido de proteína soluble en 3 de los 4 alimentos evaluados por el tratamiento térmico (22,75 ±3,47 g/kg en salchicha, 53,64±3,38 g/kg en salmón, 48,14±3,46 g/kg en trucha). Por otra parte se encontró que sólo el chorizo presentó un menor contenido de proteína soluble en el tratamiento térmico (19,79±0,91 g/kg) comparado con el tratamiento fermentativo (33,3±3,34 g/kg). Entre el tratamiento fermentativo y el testigo, sólo hubo diferencia estadísticamente significativa para la salchicha, siendo mayor el contenido de proteína soluble en el testigo (20,47±2,79 g/kg), los demás alimentos no evidenciaron diferencias estadísticas (P.>0,05) entre el tratamiento fermentativo y el testigo (Tabla 3).
Discusión. En la digestibilidad in vitro de proteína por el efecto de la fermentación, se pudo encontrar un aumento significativo de aproximadamente 5% respecto al tratamiento térmico, para 2 de 4 productos evaluados (salchicha, chorizo), mientras que para los otros 2 restantes (salmón y trucha) el porcentaje de digestibilidad de proteína fue similar a la encontrada en el tratamiento térmico, es decir el tratamiento fermentativo mejoró o igualó el efecto del tratamiento térmico en la digestibilidad proteica de los productos alimenticios evaluados. Otros autores han evidenciado en mayor o menor grado el aumento de la digestibllldad de proteínas por efecto de la fermentación en algunos alimentos como fríjoles [24], garbanzos [25], productos lácteos [26] y salchichas [27] entre otros.
En orden descendente se pudo encontrar que la mayor digestlbilidad de proteína en los alimentos procesados en el tratamiento fermentativo se presentó para el producto lácteo con 87,02%, seguido de los productos de carne de pescado con 84,25% para trucha y 83,46% para el salmón, posteriormente para el chorizo de cerdo se obtuvo una digestibilidad de 80,79% y para la salchicha de carne de res 78,06%. Esta tendencia en la digestibllldad de proteína también se evidenció en los otros tratamientos (térmico y testigo), y se debe a la complejidad de las proteínas y del alimento que las contienen, en el caso del producto lácteo se trata de proteínas simples, por esta razón hay una mayor dlgestibilidad proteica, en el caso de los productos de carne de pescado tanto las proteínas como el alimento en sí son más complejos, sin embargo presentan una mayor digestibilidad que los productos de carne de cerdo y de res, ya que poseen menos tejido conectivo y menos cantidad de grasas haciéndolas más digeribles [28].
El nitrógeno total evaluado en las muestras, se utilizó como un indicador de la concentración de proteína total en los alimentos. La metodología empleada para el análisis cuantifica el nitrógeno total en la muestra y se asume que esta concentración se refiere 100% al nitrógeno proteico, sin embargo cabe aclarar que en este nitrógeno total hace parte cualquier compuesto que posea nitrógeno en el alimento, y no únicamente el nitrógeno proteico. Mediante este indicador se encontró que no hubo diferencias significativas entre el tratamiento térmico y el testigo; esto indica que el tratamiento térmico aplicado no afectó el contenido de nitrógeno de los alimentos, es decir no modificó el contenido de proteína total de los alimentos. Algunos estudios realizados en carnes han demostrado que el contenido de nitrógeno sólo se ve afectado en tratamientos térmicos fuertes con temperaturas superiores a 177°C [29]. Por otra parte se pudo determinar que hubo diferencia significativa en el contenido de nitrógeno entre el tratamiento fermentativo y el tratamiento térmico, en 4 de las 5 muestras evaluadas por estos 2 tratamientos, evidenciando una gran disminución en el contenido de nitrógeno para el tratamiento fermentativo. Esta disminución en el contenido de nitrógeno total de en promedio 40%, se atribuye principalmente a pérdidas de nitrógeno en el tratamiento fermentativo por la solubilización de proteínas del alimento en el medio fermentativo, ya que se ha demostrado que la fermentación aumenta la cantidad del nitrógeno soluble en algunos alimentos [30] haciendo que mucho de este nitrógeno quedara en el medio fermentativo el cual no fue analizado por no ser empacado en los productos por la empresa que desarrolló la técnica.
La proteína soluble evaluada corresponde a la fracción proteica de los alimentos que fue soluble en un medio alcalino. Este parámetro se utilizó para evaluar cambios en esta fracción proteica por efecto de los tratamientos. Se encontró que no hubo diferencias significativas en el contenido de proteína soluble entre el tratamiento fermentativo y el tratamiento testigo para 4 de los 5 alimentos evaluados, lo que indica que el tratamiento fermentativo no modificó esta fracción proteica en los alimentos, excepto para la salchicha donde se evidenció un menor contenido por efecto de este tratamiento. Por otra parte el tratamiento térmico en comparación con el testigo, aumentó el contenido de proteína soluble en 3 de 4 alimentos evaluados, siendo mayor el aumento en los alimentos con menor complejidad estructural en las proteínas, es decir para el salmón y trucha, lo que revela que el tratamiento térmico modificó o desnaturalizó las proteínas en estos alimentos, haciendo que esta fracción proteica soluble en medio básico, aumentara con respecto al testigo. Algunos autores han demostrado el aumento en las proteínas solubles de algunos alimentos lácteos, por efecto de los tratamientos térmicos [31]. Otros autores por el contrario han evidenciado disminución en las proteínas solubles en carnes y cereales [32].
Una de las debilidades de este trabajo fue el no haber analizado el medio donde se fermentaron los alimentos, con el objetivo de evaluar la calidad y cantidad de proteína del alimento que pudo haberse solubilizado en dicho medio, y de esta manera tener una mejor evaluación del tratamiento fermentativo. Una fortaleza, fue el haber realizado por primera vez un análisis del efecto en la calidad proteica de los alimentos sometidos a este tratamiento fermentativo novedoso, el cual viene siendo mejorado con el fin de ser estandarizado industrialmente.
CONCLUSIONES
En general las muestras sometidas al tratamiento fermentativo presentaron una digestibilidad de proteína mayor o igual a las muestras sometidas al tratamiento térmico.
En cuanto al contenido de proteína soluble, el tratamiento fermentativo no modificó la fracción proteica soluble (alcalina) en las muestras en relación al tratamiento testigo, mientras que el tratamiento térmico mejoró esta fracción proteica en 2 de 4 alimentos evaluados. Hubo una alta disminución en el contenido de nitrógeno para las muestras sometidas al tratamiento fermentativo en comparación con el testigo, mientras que para el tratamiento térmico, no hubo cambios significativos en el contenido de nitrógeno comparado con el testigo, es decir el tratamiento térmico no modificó el contenido de proteína total en las muestras.
Las pérdidas tan altas en el contenido de nitrógeno para el tratamiento fermentativo, se atribuyen principalmente a pérdidas de materia en el tratamiento fermentativo por la solubilización de proteínas del alimento en el medio fermentativo, el cual no fue empacado en los productos por la empresa de alimentos y por ende no fue analizado.
El tratamiento fermentativo utilizado no mejoró la calidad proteica de los alimentos, si bien es cierto que hubo un aumento de aproximadamente 5% en la digestlbilidad de proteína de los alimentos sometidos a este proceso, también se evidenciaron pérdidas significativas de aproximadamente 40% en la concentración de nitrógeno total de las muestras.
AGRADECIMIENTOS
Este trabajo fue posible gracias al flnanciamiento por parte de Monsanto Fund, y la Agencia Canadiense de Desarrollo Internacional (CIDA7034161) a través del Proyecto AgroSalud y el Centro Internacional de Agricultura Tropical, CIAT. Se agradece a la empresa Propomiel por suministrar las muestras, la técnica de fermentación, y por permitir la total independencia en la interpretación y publicación de los resultados hallados en esta investigación. En el CIAT se agradece, al Laboratorio de Servicios Analíticos por realizar algunos análisis para este proyecto, y al Laboratorio de Calidad Nutrlcional donde se realizó este trabajo de investigación.
REFERENCIAS
[1] HASLER, CM. Functional food: their role in disease prevention and health promotion. Food Technology, (52), 1998, p. 63-70. [ Links ]
[2] INSTITUTE OF MEDICINE/ NATIONAL ACADEMY OF SCIENCES. Opportunities in the nutrition and food sciences. Ed. PR. Thomas y R. Earl, Washington D.C; National Academy Press. 1994. [ Links ]
[3] SIUTA, C. Improving probiotic survival rates. Food technology, (55), 2001, p. 36-42. [ Links ]
[4] SOTOMAYOR, C, et al. Lentil starch content and its microsomal structure as influenced by natural fermentation. Starch, (51), 1999, p. 152-6. [ Links ]
[5] YADAW, S., KHEAOPAUL, N. Indigenous legume fermentation: effect on some antinutrients and in-vitro digestibility of starch and protein. Food Chemistry, (50), 1994. p. 403-56. [ Links ]
[6] GUERRERO, L. Biotecnología Alimentaria. Productos cárnicos. 1 ed. México D.F (México): Editorial Limusa, 1993, p. 225-326. [ Links ]
[7] HULL, M., et al. Artificial gastric digestion of milk. Journal of Dairy Science, (21), 1938, p. 164-8. [ Links ]
[8] SHLYGIN, G.K. The physiology of the intestinal digestion. Progress in Food and Nutrition Science, (2), 1977, p. 249-51. [ Links ]
[9] ANDARGARCHEW, M., et al. In vitro assessment of the antimicrobial potential of honey on common human pathogens. Ethiopian Journal of Health Development, (18), 2004, p. 107-11. [ Links ]
[10] MOLAN, P., RUSSELL, K. Non-peroxide antibacterial activity in some New Zealand honeys. Journal of Agriculture, (27), 1988, p. 62-7. [ Links ]
[11] SUBRAHMANYAM, M. Topical application of honey treatment of burns. British Journal of Surgery, (78), 1991, p. 497-98. [ Links ]
[12] WESTON, R., et al. Antibacterial fenolic components of New Zealand Manuka honey. Food Chemistry, (64), 2000, p. 295-301. [ Links ]
[13] MOLAN, R. The antibacterial activity of honey. Bee World, (73), 1992, p. 5-28. [ Links ]
[14] SELCUK, H., NEVIN, K. Investigation of antimicrobial effect of honey collected from various regions of Turkey. Journal of Biology Science, (5), 2002, p. 325-28. [ Links ]
[15] TAORMINA, R., et al. Inhibitory activity of honey against food borne pathogens as influenced by the presence of hydrogen peroxide and level of antioxidant power. International Journal Food Microbiology, (69), 2001, p. 217-25. [ Links ]
[16] TORRES, A., et al. Calorimetric investigation properties of 'Angelita' honey-a product of the stingless bee Tetragonisca angustula from Colombia. Thermoch, (415), 2004. p. 107-13. [ Links ]
[17] WILLIX, D.; et al. A comparison of the sensitivity of wound-infecting species of bacteria to the antibacterial activity of Manuka honey and other honey. Journal of Applied Bacteriology, 1992. (73), 388-94. [ Links ]
[18] IOIRISH, N. Las abejas, farmacéuticas aladas. 1 ed. Moscú (Rusia): Editorial Mir, 1985. [ Links ]
[19] TÉLLEZ, D. Caracterización de las melazas empleadas en el proceso fermentativo de la destilería San Martín - Industria de Licores del Valle. Tesis pregrado Bacteriología. Santiago de Cali, Colombia. Universidad del Valle. 2004. [ Links ]
[20] LOWRY O., et al. Protein measurement with the folin phenol reagent. Journal of Biological Chemistry, (93), 1951, p. 265-75. [ Links ]
[21] HSU, H., et al. A multienzyme technique for estimating protein digestibility. Journal of Food Science, (42), 1977, p. 1269-73. [ Links ]
[22] McDONOUGH, F., et al. In vitro assay for protein digestibility: Interlaboratory study. Journal of the Association of Official Analytical Chemists, (73), 1990, p. 622-25. [ Links ]
[23] DÁVILA, M., et al. Leguminosas germinadas o fermentadas: alimentos o ingredientes de alimentos funcionales. Archivos Latinoamericanos de Nutrición, (53), 2003, p. 348 -54. [ Links ]
[24] MORENO, R.C., et al. Composición química y calidad nutritiva de garbanzo (Cicer arietinum L.) fresco y endurecido después de la fermentación en estado sólido (FES). Food Science and Technology International, (6), 2000, p. 251-58. [ Links ]
[25] LIVIA, A. Effects of fermentation on curd size and digestibility of milk proteins in vitro of Swedish fermented milk products. Journal of Dairy Science, (65), 1982, p. 509-14. [ Links ]
[26] REUTERSWÄRD. A.L., et al. Digestibility of collagenous fermented sausage in man. Meat Science, (14), 1985, p. 105-21. [ Links ]
[27] HERNÁNDEZ, R., GALLEGO, S. Tratado de nutrición. 1 ed. Madrid (España): Editorial Díaz de los Santos, 1999. [ Links ]
[28] DINA, A., et al. El tratamiento térmico sobre el valor nutricional de las proteínas de la superficie y centro de las carnes asadas. Revista científica, Facultad Ciencias Veterinarias de La Universidad de Zulia, FCV-LUZ, (9), 1999, p. 427-33. [ Links ]
[29] MORALES, CM., et al. Preliminary studies on chorote - a traditional Mexican fermented product. World Journal of Microbiology & Biotechnology, (21), 2005, p. 293-96. [ Links ]
[30] DEWIT, J., et al. Effects of Various Heat Treatments on Structure and Solubility of Whey Proteins. Journal of Dairy Science, (67), 1984, p. 2701 -10. [ Links ]
[31] SZULC, M., SZCZAWINSKI, J. The effect of storage and heat treatment on amino acids content in meat. Annals of Warsaw Agricultural University. SGGW. AR. Veterinary Medicine, (10), 1980, p. 57-63. [ Links ]














