Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.9 no.2 Popayán Jul.y/Dec. 2011
SENSIBILIDAD IN VITRO DE PHYTOPHTHORA INFESTANS AL EXTRACTO DE FIQUE (Furcraea gigantea vent.) Y FUNGICIDAS SISTEMICOS
IN VITRO SENSITIVITY OF PHYTOPHTHORA INFESTANS TO FIQUE EXTRACT (Furcraea gigantea vent.) AND SYSTEMIC FUNGICIDES
SENSIBILIDADE IN VITRO DE PHYTOPHTHORA INFESTANS AO EXTRATO DA CULTURA DO FIQUE (Furcraea Gigantea Vent.) E FUNGICIDAS SISTEMICOS
DAVID E. ALVAREZ S.1, CLAUDIA E. SALAZAR G.2, ANDRES M. HURTADO B.3, DERIAN M. DELGADO B.4, OSCAR ARANGO B.5
1 Ingeniero Agrónomo. Investigador grupo TEA. Universidad de Nariño.
2 Ingeniera Agrónoma. M. Sc. Profesora Asistente, Programa de Ingeniería Agronómica, Facultad de Ciencias Agrícolas. Universidad de Nariño.
3 Ingeniero Químico. Ph. D. Director grupo de investigación TEA, Profesor Asociado, Facultad de Ingeniería Agroindustrial. Universidad de Nariño.
4 Ingeniero Agrónomo. Universidad de Nariño.
5 Ingeniero Agroindustrial. M.Sc. Profesor Asistente, Facultad de Ingeniería Agroindustrial. Universidad de Nariño.
Correspondencia: claudiasalazarg@yahoo.com.
Recibido para evaluación: 27/09/2011. Aprobado para publicación: 07/06/2011
RESUMEN
Con el objeto de evaluar tratamientos alternativos para el manejo de tizón tardío de la papa causada por Phytophthora infestans, se estudió la respuesta de sensibilidad in vitro del patógeno al bioinsumo de fique (Furcraea gigantea Vent), comparándolo con los productos comerciales Ridomil-Gold® y Curzate®. Para esto, se utilizó un diseño irrestrictamente al azar con arreglo factorial, en donde el factor A correspondió a los tratamientos antes nombrados y el factor B a las concentraciones: 10, 100, 1.000, 10.000, 100.000 µg.mL-1 adicionadas al medio de cultivo. La sensibilidad del aislamiento se evaluó mediante la escala de Shattock y se calculó la concentración efectiva cincuenta (EC50). Los resultados mostraron diferencias significativas (P<0,05) entre los tratamientos, mostrando que en altas concentraciones del extracto de fique hay sensibilidad. Los valores de (EC50 fueron de 4,02 µg.mL-1 para Ridomil-Gold® y 3,91 µg.mL-1 para Curzate®; en tanto el bioinsumo de fique fue 8,912 µg.mL-1 y una concentración capaz de inhibir el crecimiento in vitro en 75.000 µg.mL-1, estos valores indican que el bioinsumo de fique afecta el crecimiento del patógeno y puede considerarse para estudios en condiciones de campo.
PALABRAS CLAVE:
Extracto vegetal, tizón tardío, papa (Solanum tuberosum L).
ABSTRACT
In order to evaluate alternative treatments for management of potato late blight caused by Phytophthora infestans, the response of the pathogen in vitro sensitivity to bio-products of fique (Furcraea gigantea Vent) were studied and compared with commercial products Ridomil -Gold ® and Curzate ®. For this, a randomized completely design with factorial arrangement was used, where the A factor did corresponds to the above named treatments and B factor at concentrations: 10, 100,1,000, 10,000,100,000 µg.mL-1 in addition at the growth medium. The results showed significant differences (P<0,05) between treatments, which were analyzed by Shattock sensitivity scale, showing that the isolation tested was sensitive to high concentrations of fique extract. The fiftieth effective concentration (EC50> was calculated obtaining values of 4.02 µg.mL-1 for Ridomil-Gold® and 3.91 µg.mL-1 for Curzate®; and for fique bio-input was of 8,912µg.mL-1 which was able to inhibit the in vitro growth at 75.000 µg.mL-1, these values indicate that fique bio-input affects the pathogen growth and can be considered for studies in field conditions.
KEYWORDS:
Extract plant, late blight, potato (Solanum tuberosum L).
RESUMO
Objetivou-se avallaros tratamentos alternativos para o controle da requeima da batata causada por Phytophthora infestans, estodou-se a resposta da sensibilidade in vitro do patógeno de bio-produtos de fique (Furcraea gigantea Vent) em comparação com produtos comerciais, Ridomil Gold ® e Curzate ®. Para isso, foi utilizado um desenho irrestrito ao acaso, com arranjo fatorial, onde o fator A correspondeu aos tratamentos antes apontados, e o fator B ás concentrações: 10, 100, 1.000, 10.000, 100.000 µg.mL-1 adicionadas ao meio de cultivo. A sensibilidade do isolamento foi avaliada pela escala Shattock e calculou-se a concentração efetiva (EC50). Os resultados mostraram diferenças significativas (P<0,05) nos tratamentos. Observando-se que em altas concentrações do extrato do fique há sensibilidade. Igualmente os valores (EC50) foram 4,02 e 3,91µg.mL-1 para Ridomil-Gold ® e Curzate ® respectivamente; no bio-produto do fique foi 8,912 µg.mL-1 e uma concentração capaz de inibir o crescimento in vitro em 75,000 µg.mL-1 sinalalndo que o bio-produto afeta o crescimento do patógeno e poderia se considerar para estudos em condições de campo.
PALAVRAS-CHAVE:
Extrato de planta, requeima da batata, papa (Solanum tuberosum L.).
INTRODUCCIÓN
La 'gota o tizón tardío' causado por el patógeno Phytophthora infestans (Mont.) de Bary, se constituye en el agente fitopatológico más perjudicial de la papa (Solanum tuberosum L.) en las zonas húmedas del mundo [1]. En Colombia se reporta como el limitante de mayor incidencia en el cultivo [2,3,4], debido principalmente a condiciones climáticas favorables para el desarrollo del patógeno y a la siembra de materiales altamente susceptibles como las variedades Diacol Capiro, Parda Pastusa, ICA Nevada y Tuquerreña [4]. Este patógeno es el responsable de pérdidas económicas de consideración, limitando la producción de la papa puesto que, al no realizarse una adecuada estrategia de manejo, las pérdidas pueden oscilar entre el 70 y 100% de la producción [5].
El manejo de este problema fitosanitario se fundamenta en el uso de productos sintéticos en donde los agricultores realizan aplicaciones calendario con moléculas protectantes como Mancozeb y sistémicos como Metalaxyl-M y Cymoxanil de manera intensiva [3,6]. El uso indiscriminado de estos productos actuando en el mismo sitio de acción ha provocado una alta presión de selección y sensibilidad reducida del patógeno [2,7,8, 9], sumado a esto, se destaca la contaminación por su residualidad y acumulación en suelos, plantas, animales y en el mismo hombre, lo que ocasiona alteraciones en los procesos bioquímicos normales y por tanto, graves enfermedades [10].
Como posible solución a esta problemática algunos autores han reconocido en los extractos de diferentes especies de plantas sus propiedades fungicidas, cualidades que han generado gran interés por sus resultados promisorios en laboratorio e invernadero [3]. Se debe destacar que, existe una vasta diversidad de especies vegetales con propiedades de interés para la investigación, de la cual menos del 10% de la población vegetal ha sido evaluada en la búsqueda de actividad biológica [11].
Productos conocidos como bioinsumos definidos por el Instituto Colombiano Agropecuario-ICA [12], como extractos de metabolitos secundarios de plantas cuyos principios activos se han confirmado en la práctica como plaguicidas, se consideran como alternativas ambientalmente benignas que pueden constituirse a futuro como un método sostenible, competitivo y equitativo para el manejo integrado de patógenos, entre los cuales se encuentra Phytophthora infestans[3].
En papa criolla se han utilizado extractos de ajo (Allium sativum L.) y ajenjo (Artemisa absinthium L.) que parecen tener un efecto de reducción en la severidad de la enfermedad del tizón tardío [3]. Investigadores evaluaron 88 extractos vegetales distribuidos en 44 familias botánicas valorando la capacidad de inhibir la formación de zoosporas y crecimiento in vitro del patógeno P. infestans, en este estudio, 19 extractos eran eficientes para la reducción de ambas variables[13]. Así mismo, extractos de Cereus deficiens Otto & D. [14], Cassia tora L[15], Bazzania trilohata L, Diplophyllum albicans L. [16] y Catalpa ovata G. [17] mostraron cierta inhibición del patógeno a nivel de laboratorio.
Se han realizado aproximaciones en la evaluación del potencial que tiene el jugo de fique en el control de P. infestans, encontrando que esta especie suculenta del género Furcraea spp. utilizada principalmente en la extracción de fibras, presenta cualidades fungicidas que pueden ser utilizadas en el manejo de este problema fitosanitario [18,19], ya que posee propiedades tensoactivas y plaguicidas y presenta contenidos de esferoides naturales entre los que se han encontrado saponinas y fitoesteroles [20], componentes que pueden interactuar como limitantes en el crecimiento del patógeno.
Cabe destacar que, de la planta de fique solamente se aprovecha la cabuya (fibra natural), la cual representa el 4% del peso de la hoja. Los residuos del proceso de extracción constituyen el 96%, siendo el jugo de fique el más representativo con el 70% del peso total; este residuo líquido al carecer de un manejo adecuado ocasiona problemas de contaminación hídrica afectando la ictiofauna de las quebradas y la disponibilidad del recurso hídrlco para el consumo humano y animal [21], por ende, la transformación de este sub producto en un bioinsumo que pueda integrarse en un esquema de manejo integrado de la enfermedad del tizón tardío en el cultivo de la papa, puede convertirse en una solución a la problemática ecológica y de manejo agroecológico del patógeno P. infestans.
El objetivo del presente trabajo fue evaluar la respuesta de sensibilidad del patógeno Phytophthora infestans al bioinsumo de fique (Furcraea gigantea Vent.) comparándolo con los productos comerciales Ridomil Gold® (Metalaxyl-M + Mancozeb) y Curzate® (Cymoxanil+Mancozeb) y determinar la concentración efectiva cincuenta EC50 a nivel in vitro.
MÉTODO
El presente ensayo se desarrolló en el laboratorio de fitopatología de la Universidad de Nariño, ubicado a una altura de 2.488 msnm, con una temperatura promedio de 14°C y una humedad relativa del 70%.
Aislamiento del patógeno Phytophthora infestans
Se colectaron muestras de tejido afectado con el patógeno de un lote experimental ubicado en el corregimiento de Catambuco, vereda Cubijan bajo, Municipio de Pasto (Nariño), en el cual no se realizaron aplicaciones de productos sintéticos para el control de la enfermedad; este material fue llevado al laboratorio de fitopatología de la Universidad de Nariño, el cual se cortó en pedazos pequeños (5mmx5mm), se desinfectó con hipoclorito de sodio al 3% por dos minutos y se enjuagó en agua destilada durante un minuto [22], este material se sembró en cajas de Petri con medio nutritivo agar tomate (agar 18 g, sacarosa 18 g, carbonato de calcio 0,5 g, solución madre de tomate 200 mL, solución madre de arveja 200 mL, agua destilada 600 mL) [23]. El patógeno se purificó por transferencia continua a nuevas cajas de Petri hasta obtener una colonia pura de P. infestans.
Obtención del bioinsumo de fique
Hojas de fique de la variedad "negra común" (Furcraea gigantea Vert.), recolectadas en el Municipio de El Tambo (Nariño), fueron transportadas a la planta piloto de la Universidad de Nariño, en donde se procedió a realizar la extracción del jugo mediante un molino de rodillos y posterior filtrado por medio de cedazos artesanales de lona. El jugo fue centrifugado a 5.000 rpm por un lapso de cinco minutos con el objeto de eliminar el total de sustancias sólidas presentes. La fracción final fue fermentada de manera anaeróbica a una temperatura constante de 33°C durante cuatro días.
Diseño Experimental
Se utilizó un diseño irrestrictamente al azar (D.I.A.) con arreglo factorial, donde el factor A correspondió a los tratamientos: bioinsumo de fique, Ridomil Gold® (Metalaxyl-M 4% y Mancozeb 64%), Curzate® Cymoxanil 8% y Mancozeb 64%) y un testigo absoluto. El factor B hace relación a cinco concentraciones evaluadas: 10,100,1.000,10.000 y 100.000 µ mL-1. La unidad experimental consistió en una caja de Petri, con cinco repeticiones, para un total de 95 unidades experimentales.
Sensibilidad del patógeno Phytophthora infestans
El comportamiento in vitro del patógeno se determinó por medio del crecimiento radial de las colonias de P. infestans, para esto, discos de micelio de 1,1 cm de diámetro del patógeno obtenidos con sacabocado fueron establecidos en cajas de Petri con medio agar tomate, enmendado con los diferentes tratamientos. Cada unidad experimental fue evaluada mediante el programa gráfico Tpsdig2®[24] después de un período de incubación de 8 días a temperatura promedio de 18°C.
Se determinó el porcentaje de crecimiento respecto al testigo absoluto sin enmendar (Ec.1), utilizando la siguiente relación:
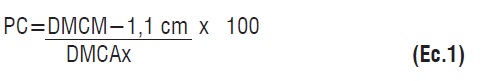
Donde: PC =porcentaje de crecimiento; DMCM = diámetro medio de la colonia creciendo en tratamiento; 1,1 cm corresponde al diámetro del cilindro con micelio y DMCA = diámetro medio de la colonia sin enmendar [25]. Con base en el porcentaje de crecimiento se determinó la sensibilidad del aislamiento evaluado mediante la escala propuesta por Shattock [26], en donde:

Los datos obtenidos se analizaron mediante un análisis de varianza y prueba de comparación de medias LSD de Fisher a un nivel de significancia del 0,05 mediante el programa estadístico Statgraphics®[27].
Determinación de la concentración efectiva cincuenta (EC50)
Este valor se calculó con base en la regresión lineal obtenida de la respuesta del crecimiento radial promedio de las cinco repeticiones en cada tratamiento, las cuales fueron graficadas contra el logaritmo de la dosis evaluada [25], determinando así la concentración efectiva capaz de inhibir el 50% del crecimiento radial tanto para el bioinsumo de fique como para los productos sistémicos.
RESULTADOS
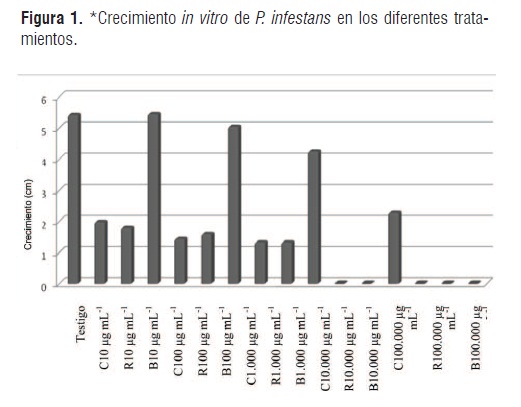
El análisis del efecto en el crecimiento del patógeno P. infestans en el medio de cultivo agar tomate enmendado con el bioinsumo de fique y los productos sintéticos, indican que existen diferencias significativas (P<0,05) entre los tratamientos y las concentraciones evaluadas respecto al testigo absoluto. La acción antifúngica fue evidente en el desarrollo del experimento, puesto que se redujeron los porcentajes en el crecimiento micelial del patógeno con el aumento de la dosis en cada uno de los tratamientos evaluados (Tabla 1), a partir de la concentración 100 µg mL-1 para el bioinsumo de fique y 10µg mL-1 para los productos sintéticos con moléculas Metalaxyl-M y Cymoxanil.
La evaluación de la sensibilidad del patógeno se realizó mediante la escala propuesta por Shattock [26], puesto que permitió determinar el comportamiento de P. infestans, basándose en el crecimiento micelial relativo en presencia de los productos restrictivos, considerando el crecimiento de un testigo absoluto (sin enmendar).
Los fungicidas utilizados como comparadores ante el bioinsumo de fique, mostraron un comportamiento similar en el total de evaluaciones realizadas, se destaca que la concentración mas baja evaluada 10 µg mL-1 causó una reducción en el crecimiento promedio del patógeno P. infestans del 87% con la utilización del producto comercial Ridomil Gold® y 83% con el producto Curzate®, indicando un comportamiento de sensibilidad intermedia bajo esta concentración. Además se observó un efecto fungistático para las concentraciones 100 y 1.000 µgmL-1 de los productos comerciales, con porcentajes de crecimiento entre el 4,2% y 9,3% y una respuesta de sensibilidad al grupo de las fenilamidas y cianoacetamida-oximas. Se destaca que, a partir de la concentración 10.000 µgmL-1 ambos productos Ridomil Gold® y Curzate® inhibieron completamente el crecimiento del patógeno, confirmando una acción fungicida a nivel in vitro.
En esta evaluación se encontró una alta eficiencia de los fungicidas comerciales para reducir el crecimiento de P. infestans, sin embargo, no fue posible comparar estos resultados con la mayoria de trabajos de sensibilidad a las moléculas Metalaxyl y Cymoxanil, puesto que no se utilizó el ingrediente activo en grado técnico en las evaluaciones realizadas; en consecuencia al evaluar moléculas principales con características slstémicas, acompañadas de un fungicida protectante, se puede conducir a un efecto de enmascaramiento que dificulte la lectura de la acción directa de los fungicidas sistémicos [9].
En la Figura 1 se presenta el crecimiento in vitro de P. infestans utilizando los productos Curzate®, Ridomil Gold® y bioinsumo de fique a diferentes concentraciones.
La Figura 2 muestra exclusivamente la sensibilidad observada del patógeno frente al bioinsumo de fique.
En cuanto a la evaluación del bioinsumo de fique (Furcraea gigantea Vent.), se determinó que el extracto fermentado de esta agavaceae tiene efecto en la inhibición del patógeno P. infestans a nivel in vitro, causando una reducción en el promedio de crecimiento del 27,1% con la dosis 100 µg mL-1 y una clasificación en la escala de sensibilidad como resistente (superior al 60% en relación al testigo absoluto); pero que se incrementa en 41,7% y 78,2% en las concentraciones 1.000 y 10.000 µg mL-1 del bioinsumo con clasificación de sensibilidad intermedia. No obstante, cuando el medio de cultivo fue enmendado con la proporción más alta del bioinsumo 100.000µmL-1 fue evidente el efecto de éste en la sensibilidad del patógeno al inhibir totalmente el crecimiento miceilal in vitro obteniendo el mismo efecto producido por los productos Ridomil Gold® y Curzate® aplicados en la misma concentración, estos resultados pueden ser explicados por la gran proporción de metabolitos secundarios presentes en el extracto de esta agavacea [18, 20]. Estos metabolitos, formados a través de las rutas de obtención de los metabolitos primarios, y por procesos bioquímicos ayudados por enzimas provenientes de cadenas de oxidaciones y reducciones, han demostrado tener una fuerte actividad antibacterial y antifúngica [28, 29].
En la Universidad de Nariño, se caracterizó fisicoquímicamente el jugo de fique (Furcraea gigantea Vent.) determinando la presencia de alcaloides y saponinas dentro de los metabolitos secundarios importantes en esta planta[19].
La acción antifúngica de los alcaloides presentes en un extracto vegetal podría deberse a la presencia de nitrógeno en su estructura como amina o amida infiriendo en el desarrollo del patógeno a evaluar [30]. Así mismo, en estudios de sensibilidad de P. Infestans utilizando saponinas, se encontró cierta inhibición del crecimiento micelial, aludiendo esta respuesta a la desactivación de la síntesis de varias enzimas a nivel de la célula y del metabolismo del oomycete[18].
Por otra parte, la actividad de los extractos no sólo se debe a la presencia de metabolitos secundarios, sino también de la concentración que se identificó en el análisis químico cualitativo y se le atribuye propiedades antimicrobianas [31], lo cual explica que el uso de las bajas concentraciones del bioinsumo (10 y 100 µug mL-1) no afectaron el crecimiento in vitro del patógeno. Finalmente, se exploró un nuevo rango de concentraciones en la evaluación del bioinsumo de fique entre 10.000 µg mL-1 y 100.000µg mL-1; la primera corresponde a la concentración que permitió una respuesta de sensibilidad intermedia del aislamiento y la última aquella en la cual se inhibió totalmente el crecimiento del patógeno, tal como se indica en la Figura 3.
Los resultados demostraron la necesidad de adicionar una dosis alta del extracto para generar un efecto fungistático o fungicida con relación a los productos sintéticos, reflejándose en los valores de EC50.
El cálculo de la concentración capaz de inhibir el cincuenta por ciento del crecimiento (EC50) a nivel in vitro para el bioinsumo de fique correspondió a 8.912 µg mL-1 (R2 =0,982) comparado con valores tan bajos como 4,02µg mL-1 para el producto Ridomil Gold® similar al reportado en literatura en este producto comercial [9] y 3,91 µg mL-1 para el producto Curzate®. Esta diferencia entre el tratamiento vegetal y los productos comerciales que presentan un carácter sistémico con acción protectante, curativa y erradicante exclusiva para el control de Oomycetes, obedece al hecho de que, el extracto de fique en su composición presenta 85% de humedad y tan solo el 8% del volumen total representa la parte orgánica y amorfa [32], en la cual se encuentra los principios activos reportados por los diferentes autores como antifúngicos, por lo anterior el tratamiento vegetal en el total de concentraciones presentó cierta desventaja al ser comparado con los productos comerciales.
El efecto del bioinsumo en el presente rango de concentración (Figura 3) permitió determinar, que al enmendar el medio de cultivo con 75.000 µg mL-1 del tratamiento, se inhibe totalmente el crecimiento micelial in vitro del patógeno, determinando así la concentración letal del bioinsumo; de esta forma se propone junto al valor de EC50 como estimativos para el cálculo de la dosis de aplicación en campo para el manejo de la enfermedad del tizón tardío de la papa, convirtiéndose en una atractiva fuente, no solo por la diversidad en la composición química que el bioinsumo posee, sino por su acción biológica y su carácter menos nocivo sobre el medio ambiente.
CONCLUSIONES
Bajo condiciones in vitro, se demostró que el extracto fermentado de la especie Furcraea gigantea Vent. presenta un efecto de inhibición ante el patógeno Phytophthora infestans a una concentración de 75.000 µg mL-1, causando una respuesta similar a la obtenida por los fungicidas sistémicos evaluados.
Se propone el cálculo de la EC50 (8.912µg mL-1) y la concentración letal (75.000 µg mL-1) como un estimativo para experiencias de aplicación del bioinsumo de fique dentro de un programa de manejo integrado de la enfermedad del tizón tardío en cultivos de papa.
AGRADECIMIENTOS
Los autores agradecen al Ministerio de Agricultura y Desarrollo Rural de Colombia, por la financiación del proyecto No 119-2008J3895-3808; a la Universidad de Nariño, Facultad de Ingeniería Agroindustrial y Facultad de Ciencias Agrícolas.
REFERENCIAS
[1] PROINPA. Papa andina: Innovación para el desarrollo en los Andes 2002 -2006 [On line] url:http://www.papandina.cip.cgiar.org (citado Agosto del 2009). [ Links ]
[2] SALAZAR, C. Dinámica temporal de las poblaciones de Phytophthora infestans a los fungicidas Metalaxyl, Cymoxanil y Propamocarb en cultivos de papa. Tesis de maestría. Bogotá: Universidad Nacional de Colombia, Facultad de Agronomía, 2000. 70 p. [ Links ]
[3] CASTAÑO, J. y CASTRO, R. Efecto de once extractos vegetales sobre el tizón tardío causado por Phytophthora infestans (Mont de Bary) en papa (Solanum phureja Juz. et Buk) Revista Agronomía, 2006, Vol. 10 No. 1-2, 148 p. Bogotá. [ Links ]
[4] JARAMILLO, S. Monografía sobre Phytophthora infestans (Mont) de Bary. Medellín: Universidad Nacional de Colombia, Facultad de Ciencias Agropecuarias, 2004, 137 p. [ Links ]
[5] CEVIPAPA. El correo de la papa: Evaluación de clones de papa con resistencia a Phytophthora infestans como estrategia para el manejo integrado de la gota. Boletín Sinalpapa, 2002, 22 p. Bogotá. [ Links ]
[6] MARTÍNEZ, E. y OSORIO, J. Estudios preliminares para la producción de un biosurfactante bacteriano activo contra Phytophthora infestans (Mont.) De Bary. Revista Corpoica - Ciencia y tecnología agropecuaria, p. 5 - 16 [Online] url:http://www.corpoica.gov.co/SitioWeb/Archivos/Revista/1.Estudiosprelimlnares.pdf (Citado Septiembre del 2009). [ Links ]
[7] CARREÑO, N., VARGAS, A., BERNAL, A. y RESTREPO, S. Problemas fitopatológicos en especies de la familia solanaceae causadas por los géneros Phytophthora, Alternaria y Ralstonia en Colombia. Agronomía Colombiana, 2006, Vol. 25. No 2. Bogotá [ Links ]
[8] PÉREZ, W. y FORBES, G. Manual técnico: El tizón tardío de la papa. Perú: Centro Internacional de la papa (CIP),2008, 41 p. [ Links ]
[9] GARCÍA, H., MARÍN, M., JARAMILLO, S. y CORTÉS, J. Sensibilidad de aislamientos colombianos de Phytophthora infestans a cuatro fungicidas sistémicos. Agronomía Colombiana. 26 (1),2008, p. 47-57. Bogotá. [ Links ]
[10] BRAVO, L., BERMÚDEZ, T. y MONTES, B. Inhibición de Fusarium moniliforme mediante polvos vegetales y algunos de sus componentes químicos. Manejo Integrado de Plagas, 57:29-34, 2000, 56 p. [ Links ]
[11] HARVEY A. Strategies for discovering drugs from previously unexplored natural products. Drug Discovery Today (On line) url:http://www.lbmb.uni.wroc.pl/prace2/praca18.pdf (Citado Septiembre, 2000). [ Links ]
[12] COLOMBIA. INSTITUTO COLOMBIANO AGROPECUARIO. Resolución N. 3079 (19 de octubre de 1995), 32p. [Online] url:http://www.ideam.gov.co/apc-aa/img_upload/a2b62d2f4edac7672b1b68bd101b3fb5/R_3079_95.pdf (Citado Mayo del 2009). [ Links ]
[13] CAO, K. and VAN BRUGGEN A. Inhibitory efficacy of several plant extracts and plant products on Phytophthora infestans. Journal of Agricultural University of Hebei 24, 2001,91 -99 p. [ Links ]
[14] ZAPATA, R., SANABRIA, M. y RODRIGUEZ, D. Reducción del desarrollo de hongos fitopatógenos con extracto de cardón lefaria (Cereus deficiens Otto & Diert). INCI, mayo, Vol.28, No.5, 2003, p.302-307. [ Links ]
[15] KIM, Y., LEE, C.H., KIM, H. and LEE, H. Anthraquinones isolated from Cassia tora (Leguminosae) seed show an antifungal property against phytopathogenic fungi. Journal of agricultural and food chemistry, 2004, 52, 54 p. [ Links ]
[16] MEKURIA, I., STEINER, U., HINDORF, H., FRAHM, J. and DEHNE, W. Bioactivlty of bryophyte extracts against Botrytis cinerea, Alternaria solani and Phytophthora infestans. Journal of applied botany and food quality. 79,2005, 89-93 p. [ Links ]
[17] CHO, J., KIM, H., CHOI, G., JANG, K., LIM, H., LIM, C., CHO, K. and KIM. J. Dehydro-alpha-Iapachone isolated from Catalpa ovata stems: activity against plant pathogenic fungi. Pest management science, 62, 2006, 414-418 p. [ Links ]
[18] PRECIADO, D. y RANGEL, E. Extracción de un biofungicida a partir del jugo de fique (Furcraea spp). Tesis Ingeniería Química. Medellín: Universidad Pontificia Bolivariana, 2006, 78 p. [ Links ]
[19] ROJAS, M. Características fisicoquímicas del jugo de fique (Furcraea spp.) elaboración y evaluación de un biofungicida útil en el control agroecológico de la gota (Phytophthora infestans) en la papa. Tesis Ingeniería agroindustrial. Pasto: Universidad de Nariño, Facultad de Ingeniería agroindustrial, 2008, 103 p. [ Links ]
[20] GÓMEZ, M. y VANEGAS, E. Evaluación de la producción de esferoides a partir del jugo de fique con Cunninghamella spp. Tesis Ingeniería Química. Medellín: Universidad Pontificia Bolivariana de Medellín. Facultad de Ingeniería Química, 2001. [ Links ]
[21] MOJICA, A. y PAREDES, J. El cultivo del fique en el departamento de Santander. Bucaramanga (Colombia): Centro Regional de Estudios Económicos, 2004, 154 p. [ Links ]
[22] AGRIOS, G. Fitopatología. 2a ed. México: Limusa, 2002, 838 p. [ Links ]
[23] CAICEDO, D. y CHALPARIZAN, M. Antagonismo in vitro de aislamientos de Trichoderma spp. sobre el patógeno Phytophthora infestans (Mont) de Bary provenientes de cultivos de tomate de árbol (Solatium betaceum) y papa (Solatium tuberosum L.) en el departamento de Nariño. Tesis Biología. Pasto: Universidad de Nariño, Facultad de Ciencias Exactas y Naturales, 2008, 89 p. [ Links ]
[24] ROHLF, F.J. TpsDig, digitize landmarks and outlines, version 2.05. Department of Ecology and Evolution, State University of New York at Stony Brook, 2005. [ Links ]
[25] RIVEROS, F., S0T0MAY0R, R., RIVERA, V., SECOR, G. y ESPINOZA, B. Resistencia de Phytophthora infestans (Montagne) de Bary a Metalaxyl en cultivo de papas en el norte de Chile. Agricultura técnica, 2003, 63 (2), 117-124 p. Chile. [ Links ]
[26] SHATTOCK, R. Studies on the inheritance o resistance to metalaxyl in Phytophthora infestans. Plant Pathology. 1988, 37:4-11 p. [ Links ]
[27] STATGRAPHICS PLUS. Statistical Graphics Corp, 2000. [ Links ]
[28] SANABRIA, A. Análisis fitoquímico preliminar: Metodología y su aplicación en la evaluación de 40 plantas de familia Compositae. Bogotá: Universidad Nacional de Colombia, 1983, p. 46-49. [ Links ]
[29] VERPOORTE, R. and MEMELINK, J. Biotechnology for the production of plant secondary metabolites. Phytochemistry Rev, 1:13-25, 2002. [ Links ]
[30] FUERTES, C., ALCARRAZ, M. y VIDALON, M. Flavonoides y alcaloides de Lupinus ballianus c.p. Smith con actividad antibacteriana y antifúngica. Ciencia e Investigación: Vol. 1 no. 2, Diciembre, 1998. Lima, Perú. [ Links ]
[31] RODRÍGUEZ, A., MORALES, D. y RAMÍREZ, M. Efecto de extractos vegetales sobre el crecimiento in vitro de hongos fitopatógenos. Cultivos tropicales 21 (2), 2000, 79-82 p. [ Links ]
[32] COLOMBIA. MINISTERIO DE AGRICULTURA Y DESARROLLO RURAL. Guía ambiental del subsector fiquero. Bogotá: 2 Ed., 2006, 27-28 p. [ Links ]














