Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.10 no.1 Popayán Jan./June 2012
EFECTO DE INOCULACIÓN DE MICROORGANISMOS EN CRECIMIENTO DE RÁBANO (Raphanus sativus)
EFFECT OF INOCULATION OF MICROORGANISMS ON RADISH GROWTH (Raphanus sativus)
EFEITO DA INOCULAÇÃO MICRORGANISMOS NO CRESCIMENTO DE RABANETE (Raphanus sativus)
LUZ INDIRA SOTELO D1, JAVIER ALEXANDER JIMÉNEZ F.2, ARTURO TARSICIO DE ZAN3, MARIA CLEMENTINA CUETO V4.
1 Ph.D. en Ciencia y Tecnología de Alimentos. Grupo de Procesos Agroindustriales, Universidad de La Sabana.
2 Ingeniero de Producción agroindustrial. Candidato a M.Sc. Diseño y gestión de procesos. Grupo de Procesos Agroindustriales, Universidad de La Sabana.
3 PhD en Estadística e Investigación operativa. Grupo de Ingeniería de Procesos e Innovación, Universidad de La Sabana.
4 M.Sc. en Microbiología. Grupo de Procesos Agroindustriales, Universidad de La Sabana.
Correspondencia: indira.sotelo@unisabana.edu.co
Recibido para evaluación: 20/01/2011 Aprobado para publicación: 21/03/2012
RESUMEN
El efecto de la inoculación de microorganismos que pueden estimular el crecimiento en plantas, ha sido de gran interés para la producción de bioinsumos en los últimos años. Se inocularon cepas de Azotobacter sp, Bacillus pumilus y Bacillus licheniformis en un cultivo de rábano (Raphanus sativus), aisladas e identificadas de un proceso de compostaje de la empresa (GEO ®). Se realizó un diseño experimental de cinco tratamientos y un control, con 15 repeticiones para cada uno. Previo a la aplicación de los tratamientos cada cepa se sometió individualmente a crecimiento en caldo de cultivo. La aplicación de cada tratamiento se efectuó dos veces por aspersión, con un intervalo de 15 días durante el tiempo de cultivo. Las variables de respuesta que se evaluaron en el cultivo de rábano fueron: longitud de las plantas, número de hojas y peso seco del sistema radicular. Los resultados mostraron menor efectividad en la producción de biomasa radicular en el tratamiento T5 (mezcla de los tres microorganismos); además se encontró un mayor rendimiento en todas las variables de respuesta, con la utilización de la fertllización química. Sin embargo los tres microorganismos aplicados individualmente presentan resultados promisorios para la aplicación en cultivos agrícolas de ciclo corto.
PALABRAS CLAVES: Biomasa, Azotobacter sp, Bacillus pumilus, Bacillus licheniformis, Cultivos Agrícolas.
ABSTRACT
The effect of microorganism's inoculation that could stimulate the growth in plants has been of great interest for bioinsumos production in last years. Strain of Azotobacter sp, Bacillus pumilus and Bacillus licheniformis were isolated and identified of GEO ® composting process and inoculated in a radish culture (Raphanus sativus). Experimental design was realized with five treatments and a control, with 15 repetitions; each microorganism strain was to put individually in growth culture. The treatments took place twice by aspersion with interval of 15 days during radish culture. The response variables evaluated in radish culture were: length of plants, number of leaves and dry weight of root radish. With treatment T5 (mix of three microorganisms), the results showed a minor effectiveness in root biomass production; in addition was a greater yield in all characteristics with the use of chemical fertilization. Nevertheless, the individually applied of each microorganism present promissory results for the application in agriculture cultures of short cycle.
KEYWORDS: Biomass, Azotobacter sp, Bacillus pumilus, Bacillus licheniformis, Agricultural Crops.
RESUMO
O efeito da inoculação de microrganismos que podem estimular o crescimento em plantas tem sido de grande interesse para a produção de bio-produtos nos últimos anos. Isolados foram inoculados Azotobacter sp, Bacillus pumilus e Bacillus licheniformis em uma cultura de rabanete (Raphanus sativus) isolados e identificados em um processo de compostagem da empresa (GEO ®). Foi realizado um delineamento experimental de cinco tratamentos e controle, com 15 repetições para cada um. Antes da aplicação dos tratamentos, cada cepa foi submetida ao crescimento individual em caldo. A aplicação de cada tratamento foi realizada por aspersão duas vezes com um intervalo de 15 dias durante o tempo da colheita. As características avaliadas no cultivo de nabo foram: altura das plantas, número de folhas e massa seca do sistema radicular. Os resultados mostraram menor eficácia na produção de biomassa radicular no tratamento T5 (mistura de todos os três organismos) também encontraram melhor desempenho em todas as variáveis de resposta, com o uso de fertllización química. No entanto, todos os três organismos têm aplicado individualmente para apliacción resultados promissores em cultivos de ciclo curto agrícolas.
PALAVRAS CHAVE: Biomassa, Azotobacter sp, Bacillus pumilus, Bacillus licheniformis, Culturas Agrícolas.
INTRODUCCIÓN
Los microorganismos pueden constituir bio-fertilizantes y bio-controladores que representan parte fundamental de los sistemas agrícolas sostenibles debido a su importancia para la circulación de nutrientes en la planta y también contribuyen a reducir en lo posible el uso de fertilizantes [1]. Los microorganismos benéficos, como los hongos micorrizos arbusculares y rizobacterias, pueden ser usados como biofertilizantes, que promueven el crecimiento vegetal a través de una asociación simbiótica y permiten aprovechar con mayor eficiencia la humedad del suelo e incrementar la absorción de elementos minerales poco móviles y solubles, tales como el P y algunos microelementos como Cu, Fe y Zn [2,3]. Existen además microorganismos biocontroladores que compiten por nutrientes y espacio entre ellos; otros son productores de enzimas degradadoras de la pared celular, de metabolitos antifúngicos y micoparasitismo [4,5].
En la actualidad se ha avanzado en el estudio de la aplicación de microorganismos seleccionados del suelo, con potencial de fijación de Nitrógeno y solubilización del Fósforo, que contribuyan a otorgar a las plantas sustancias fisiológicamente activas en el metabolismo de las mismas [6]. Muchos de estos microorganismos provienen de procesos microbianos controlados, que convierten los materiales biodegradables orgánicos en un producto estable, este proceso ha sido comúnmente denominado compostaje. Los microorganismos que hacen la mayor parte de estos procesos, son termófilos (bacterias, actinomicetos y hongos), que crecen en temperaturas relativamente altas. El rango de temperaturas aptas para el crecimiento de microorganismos termófilos es de 55°C a 71°C, en donde se inactivan la mayoría de los microorganismos patógenos.
Los principales factores que afectan la tasa de producción de microorganismos y la actividad biológica en el compostaje son: el contenido de la mezcla (40-60% material de compostaje), estructura física, consistencia, aireación, balance de nutrientes, pH y temperatura [7]. La descomposición aeróbica convierte la materia orgánica biodegradable en productos finales oxidados, principalmente dióxido de carbono (CO2) y agua. El Fósforo, Potasio y otros elementos minerales se conservan en el material compostado, una relación aproximada de C:N:P:K de 25:1:0.2:0.08 es deseable para procesos orgánicos de compostaje [7].
El uso de rizobacterias promotoras del crecimiento de las plantas o agentes de biocontrol se está volviendo más popular en los últimos años. Estos microorganismos son benéficos bien sea directamente contribuyendo al crecimiento de las plantas o indirectamente reduciendo la incidencia de la planta a enfermedades [8]. Además se presume que tienen la habilidad de producir o cambiar la concentración de hormonas en la planta, fijar asimbióticamente N2, ser antagonistas contra microorganismos fitopatógenos y solubilizar fosfatos, minerales y otros nutrientes [9]. En general estos microorganismos forman consorcios microbianos, los cuales pueden ser más robustos a las fluctuaciones ambientales y pueden desarrollar funciones que son difíciles e incluso imposibles para especies individuales de microorganismos [10].
El género Azotobacter sp se caracteriza por ser Catalasa positiva, Gram negativo, aerobio pero puede crecer bajo condiciones reducidas de oxígeno [11]; este microorganismo lleva a cabo reacciones de conversión de N2 a NH4 debido a la catálisis de sus enzimas, principalmente Molibdeno, Hierro y Vanadio Nitrogenasas [12].
Los Bacillus licheniformis y Bacillus Pumilus son microorganismos Gram positivos, catalasa positiva, que crecen preferiblemente bajo condiciones aerobias [13]; estudios sobre Bacillus licheniformis han reportado gran capacidad antagónica sobre microorganismos fitopatógenos, por lo que se le atribuye gran potencial como biocontrolador de agentes patógenos [14]; además poseen gran actividad enzimática nitrogenasa, que depende en gran medida de la fuente carbonada del medio de cultivo, se ha evidenciado mayor actividad nitrogenasa cuando la fuente de carbono se basa en fructosa [15]. Algunos autores han mostrado que ambos Bacillus presentan gran capacidad colonizadora de la rizosfera y capacidad productora de fitohormonas, como la giberelina, que estimula el crecimiento de las plantas [16].
El rábano (Raphanus sativus L.) es una planta que se cree originaria del sur de Asia, de raíz gruesa y carnosa, de tamaño y forma variable, piel de color rojo, rosado, blanco u oscuro, según la variedad; posee hojas basales, pecioladas, lámina lobulada con uno a tres pares de segmentos laterales con bordes dentados [17]. Se desarrolla bien en climas medios y húmedos del trópico con una temperatura óptima de 18 a 22°C; su ciclo productivo es corto y puede variar entre 20 y 70 días, según la variedad; se adapta a cualquier tipo de suelo pero los suelos profundos, arcillosos y neutros son los ideales [17,18].
La raíz de esta planta posee altos contenidos vitamínicos y minerales; se han reportado valores, que contienen 0,86 g de proteínas, 30 UI (unidades internacionales) de vitamina A, 30 mg de vitamina B1, 20 g de vitamina B2 y 24 mg de vitamina C en 100 g de materia fresca de rábano [19]. Presenta además un contenido promedio de 37 mg de Ca, 31 mg de P y 1 mg de Fe. En cuanto a valores de composición bromatológica se han reportado valores de 57,8 ± 14,2 (g) materia seca; 9,048 ± 2,903 (g) fibra; 7,310 ± 3,076 (g) sólidos solubles; 0,2243 ± 0,0481 (g) Vitamina C; 0,67 ± 0,15 (g) Proteína y 3,69 ± 0,15 (g) Nitratos, por cada kg de fruto fresco [20].
En cuanto a la aplicación de consorcios microbianos, se han realizado estudios sobre promotores del crecimiento de las plantas en formulación liquida constituídos por mezclas de Bacillus licheniformis, Bacillus sp., Pseudomonas aeruginosa y Streptomyces fradiae, los resultados de la aplicación han evidenciado un incremento en los parámetros productivos en el girasol (tamaño de la flor, peso de la flor, numero de semillas, peso de las semillas) [21].
Así el objetivo de esta investigación fue evaluar el efecto promotor de crecimiento en un cultivo de ciclo corto, rábano inoculado con cepas de Azotobacter sp, Bacillus Pumilus y Bacillus licheniformis aislados e identificados de un proceso de compostaje.
MÉTODO
Obtención de los microorganismos
Los microorganismos utilizados para esta investigación fueron aislados e identificados de un proceso de compostaje propio de la empresa GEO® ubicada en el municipio de Funza (Cundinamarca). El protocolo para el aislamiento e identificación y multiplicación de los microorganismos se describe a continuación:
Aislamiento e identificación de los microorganismos
A partir del proceso de compostaje se aislaron e identificaron los microorganismos siguiendo el protocolo descrito en la figura 1a.
Activación y preparación de inóculo para las pruebas de cultivo
Se realizaron curvas de crecimiento hasta alcanzar una población de 1x108UFC/mL con los microorganismos aislados e identificados Azotobacter sp, Bacillus pumilus y Bacillus licheniformis. Para el proceso de crecimiento se utilizó caldo nutritivo metabólicamente activo y libre de contaminantes. La producción de Azotobacter sp. se realizó durante 24 horas con agitación constante a 180 r.p.m. y 30°C. La producción de Bacillus licheniformis y Bacillus Pumilus se realizó durante 18 horas con agitación constante a 180 r.p.m y 30°C. Estos microorganismos obtenidos con poblaciones definidas se utilizaron para la inoculación de los tratamientos para el cultivo de rábano.
Semillas de rábano
Se utilizaron semillas de Rábano Rojo Crismon Giant (distribuido por AVAL LTDA. Registro ICA 4173) con especificaciones de 90% de germinación y 99% de pureza. Las semillas fueron desinfectadas con hipoclorito de sodio al 2% por 2 minutos y lavadas 3 veces con agua destilada estéril; fueron sumergidas durante 18 horas en 100 mL de agua destilada antes de su germinación.
Prueba de germinación
En bandejas de polietileno de 27 x 37 cm forradas en la parte superior con papel absorbente blanco humedecido, las semillas se depositaron hasta la aparición de la radícula, para luego ser depositadas sobre cajas de Petri con papel humedecido obteniendo plántulas para su posterior cultivo.
Diseño experimental en campo
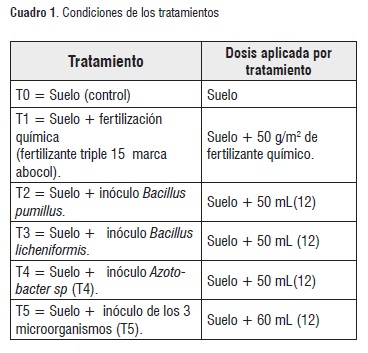
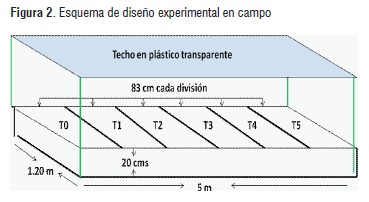
Con el fin de evaluar el efecto de la inoculación de los microorganismos sobre el cultivo de rábano, se realizó un diseño experimental con cinco (5) tratamientos y un control (Cuadro 1), distribuidos en divisiones de triplex de 1.0 x 1.20 m y 20 cm de profundidad.
La disposición de los tratamientos se muestra en la figura 2.
Condiciones de cultivo
Las condiciones experimentales del cultivo ciclos día/noche, fueron realizadas a temperatura entre 10°C a 21°C, humedad relativa 85%; se realizó seguimiento durante ocho semanas comprendidas entre el 21 de septiembre hasta el 6 de noviembre del 2009 en el vivero de la Universidad de La Sabana, situado en el municipio de Chía, Cundinamarca. El suelo fue mezclado con cascarilla de arroz, para obtener condiciones poco arcillosas en el mismo.
Métodos de inoculación
Fueron empleadas 15 plántulas de rábano (Raphanus sativus) para cada tratamiento (Cuadro 1). Se aplicaron los microorganismos en los tratamientos independientes mediante aspersión de 50 mL a cada una de las plántulas, dos veces durante el cultivo: la primera, al momento de sembrar las plántulas y la segunda aplicación 15 días después, simulando las posibles aplicaciones realizadas por el agricultor.
Seguimiento del cultivo
Las variables de respuesta analizadas durante las 7 semanas de cultivo en los tratamientos fueron:
- Longitud de las plantas: se hizo la medición por medio de un calibrador pie de rey (6''), cada lunes en horas de la mañana.
- Número de hojas: se hizo por conteo manual cada semana, cada lunes en horas de la mañana.
- Peso seco: Al finalizar las 7 semanas de cultivo se introdujeron 9 muestras de cada uno de los tratamientos en un horno marca WTB Binder ED115, a una temperatura de 85 °C por 48 h. Se determinó el peso de las muestras utilizando balanzas de precisión de rango de 0,1 mg. Posteriormente se calculó el peso seco, de la siguiente manera: Peso Seco = Peso crisol con muestra - Peso crisol.
Análisis estadístico
Los resultados obtenidos para las variables de respuesta longitud de la planta y número de hojas, se expresaron en promedio ± desviación estándar en cada semana de cultivo para cada tratamiento. Se realizaron quince mediciones para longitud de las plantas y el número de hojas en cada una para las 7 semanas de cultivo. Para el peso seco se llevaron a cabo nueve mediciones para cada uno de los tratamientos al final de la cosecha. Las diferencias significativas se analizaron utilizando el software Minitab 15 ®, aplicando el método ANOVA con un nivel de significancia a=0,05 y bajo la prueba de Tukey.
RESULTADOS
Los registros sobre las plántulas germinadas de rábano durante las siete semanas de seguimiento permitieron evaluar los siguientes parámetros:
Longitud del tallo
Los resultados obtenidos evidenciaron un incremento permanente en la longitud de las plantas en los seis tratamientos hasta el tiempo de cosecha (Figura 3).
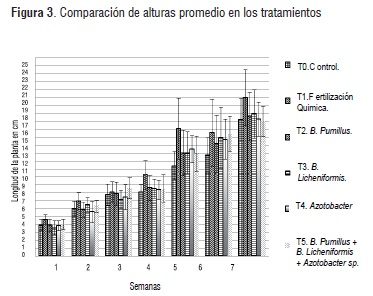
Se evaluó el diferencial promedio de crecimiento total a lo largo de las siete semanas para cada uno de los tratamientos (Figura 3). Durante las semanas 4 y 5 de cultivo, el tratamiento de fertilización química (T1) presento diferencias significativas (Tukey, p = 0,05) con respecto a los demás tratamientos. El mayor incremento promedio del crecimiento de plántulas de rábano corresponde al tratamiento de fertilización química (T1), siendo este tratamiento considerado referencia en cuanto al incremento promedio de las plántulas debido a que el tratamiento de suelos con fertilizantes químicos aumenta la disponibilidad inmediata de los macronutrientes necesarios para el crecimiento de la planta [6]. En este sentido se resalta el incremento reflejado por el tratamiento con inoculo de B. Licheniformis (T3), que alcanzó un incremento de 14.50 ± 3.05 cm. Esto tiene semejanza a estudios con formulaciones de B. Licheniformis, los cuales mostraron gran actividad promotora del crecimiento en plantas de tomate, además de control de enfermedades, debido a la fuerte actividad antagónica de este microorganismo [22]. Se evidenció además que el tratamiento (T5), mezcla de los tres microorganismos, fue el único que presentó diferencias significativas en la longitud del tallo comparado con la fertilización química (T1), lo cual muestra cómo los consorcios microbianos pueden presentar competición interna por nutrientes [22] o inhibición de otros microorganismos benéficos, que puede afectar negativamente el crecimiento de las plantas.
Los resultados mostraron que no hubo diferencias significativas de crecimiento del tallo entre los tratamientos inoculados con B. Pumillus (T2), B. Licheniformis (T3) y con Azotobacter sp (T4) y el tratamiento con fertilización química, sin embargo a excepción de las semanas 4 y 5 se observó un mayor crecimiento con la fer tilización química (T1). Esto podría sustentar la posible utilización de inoculantes microbianos en las primeras semanas de cultivo, con el fin de disminuir el uso de fertilizantes químicos. Se observó además que no hubo un rendimiento predominante entre los cultivos inoculados de forma independientemente con los diferentes microorganismos, tratamientos (T2, T3 y T4).
Investigaciones sobre crecimiento de rábano han mostrado alturas promedio desde 17 cm a 27 cm [21] y de 2,5 a 15 cm [19], a lo largo de 7 semanas de cultivo. En este estudio en particular se encontraron alturas de 11 a 25 cm al final de la semana 7.
Número de hojas
El incremento en el promedio de número de hojas para los tratamientos T0 y T1 fue mayor en el tratamiento (T0) en donde no se utilizó ningún tipo de fertilizante, alcanzando un incremento promedio de 6 hojas. Los tratamientos inoculados con los microorganismos en los tratamientos T2, T3 y T4 mostraron un incremento total promedio entre 4 y 5 hojas. Algunos autores afirman que un rápido crecimiento y una mayor expansión de hojas y raíces se presenta cuando no hay otras plantas competidoras en la cercanía [17].
A mayor densidad de cultivo, una planta que crece más rápido que su vecina proxima, utilizará una mayor cantidad de un determinado recurso disponible e incrementará su tasa de crecimiento en general, lo que puede explicar el comportamiento de los tratamientos sin fertilización y con fertilización química (T0) y (T1).
En la figura 4, se observa cómo la variabilidad de los datos en estos tratamientos es mayor en las semanas 5 y 6, en los cuales el incremento en el número de hojas está dentro de un intervalo más amplio comparado a los demás tratamientos, con valores de 6 a 13 hojas para la semana 5 y de 9 a 23 en la semana 6. Se evidenciaron además diferencias significativas en el promedio de número de hojas de T1 y T5 con respecto a los demás tratamientos, principalmente en las semanas 6 y 7 de cultivo.
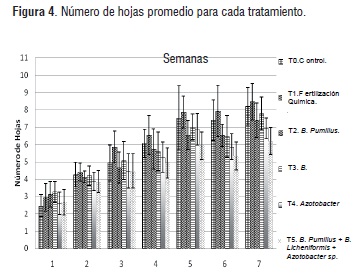 Figura 4
Figura 4El número de hojas es un parámetro importante en el crecimiento de las plantas debido a que la luz es uno de los factores determinantes en el crecimiento, en diámetro y altura de las plantas [23]. El desarrollo y llenado de los frutos depende principalmente de la actividad fotosintética de las hojas funcionales, sin embargo en este estudio se presentó mayor desarrollo de las hojas en el tratamiento sin ningún tipo de fertilización pero sin la misma eficiencia en la producción de biomasa radicular; en otro tipo de cultivos como el plátano, estudios mostraron que cuando se aumenta la densidad de plantación, incrementa el auto sombreo, lo que repercute en el comportamiento fisiológico de la planta [24].
Peso seco
Luego de siete semanas de cultivo en los diferentes tratamientos se evaluó la producción de biomasa radicular para cada uno de los mismos (Figura 5).

En este estudio el tratamiento control (T0), presentó mayor incremento de área foliar (Figura 4) y no presentó la mayor producción de biomasa en la raíz (Figura 6). Esto se debe a la falta de algunos de los nutrientes que se encuentran en mayor disponibilidad en el tratamiento con fertilización química (T1) [25]. Por lo tanto no tuvo la misma eficiencia productiva de biomasa radicular. Los tratamientos inoculados con B. Pumillus (T2), B. Licheniformis (T3) y Azotobacter sp (T4), presentaron un rendimiento promedio, sin presentar diferencias significativas entre los mismos. Sin embargo el análisis estadístico (Cuadro 2) también mostró que los resultados obtenidos para peso seco tratados con la mezcla de los tres microorganismos (T5), resultaron significativamente menores (a=0.05) con respecto a T1, T3 y T4.
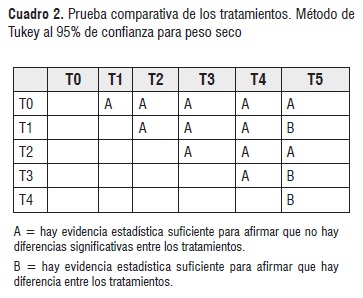
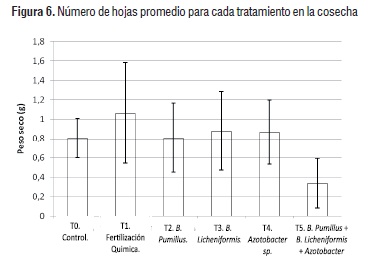
La fertilización química generó mejores resultados debido a que brinda nitrógeno inorgánico, el cual es de fácil disponibilidad para la planta, mientras que el nitrógeno orgánico fijado por los microorganismos debe ser mineralizado en un proceso de amonificación para ser asimilado por la planta [25, 26].
Las mediciones de peso seco brindan una información más precisa acerca de la eficiencia de las plantas en la acumulación de nutrientes [27] o, en otras palabras, explican la eficiencia de acumulación de materia seca como producto de sus procesos metabólicos [28]. Estudios en rábano han reportado que los incrementos en el área foliar ayudaron a incrementar el rendimiento por planta [17].
Investigaciones sobre el uso de B. licheniformis han mostrado incrementos en el área superficial y en el largo radicular en pino, esto contribuye a hacer evidente el potencial de este microorganismo como alternativa fertilizante en combinación con otro tipo de tratamientos [29].
CONCLUSIONES
La selección de inoculantes efectivos presenta un gran desafío en cuanto a la elección apropiada de microorganismos aislados. La adaptación al medio en el que son introducidos, puede ser un impedimento de su uso en la agricultura [30], lo cual explica la poca eficiencia del tratamiento inoculado con la mezcla de los tres microorganismos, sobre las variables analizadas debido posiblemente a la inhibición entre ellos o con la microflora presente en el cultivo, además de una posible competencia por los nutrientes.
Sin embargo entre los tratamientos inoculados, aquellos inoculados con B. licheniformis demostraron tener mayor eficiencia en cada una de las variables de respuesta analizadas, aunque sin diferencias mayores con respecto a los demás tratamientos inoculados, por esta razón existe la posibilidad de analizar diferentes diseños experimentales donde se hagan inoculaciones en combinación por pares entre estos microorganismos. En general el uso de estos microorganismos presentó buenas expectativas en cuanto a su posible utilización en procesos combinados de fertilización.
Cabe destacar que los inóculos microbianos deberán evaluarse antes de la incorporación a un cultivo, con el fin de encontrar un mecanismo de adaptación más adecuado a las condiciones del entorno, ya que combinaciones de biofertilizantes con diferentes microorganismos benéficos han presentado resultados promisorios para el crecimiento de cultivos [31].
AGRADECIMIENTOS
Los autores agradecen a: Colciencias código proyecto CONVOCATORIA 347 DE 2006 cod: 1222-347-19488.
Al fondo patrimonial de la Universidad de La Sabana.
A la empresa GEO®. Por la facilitación de material de compostaje y por la participación en el proyecto
Al Ingeniero de Producción Agroindustrial Alejandro Clavijo por su colaboración durante el proceso de experimentación.
REFERENCIAS
[1] RAMAZAN, C. et al. Growth promotion of plants by plant growth-promoting rhizobacteria under greenhouse and two different field soil conditions. Bioresource Technology. 2008. Vol. 99: 8507–8511. [ Links ]
[2] TERRY, E.; et al. Biofertilizantes; una alternativa promisoria para la producción hortícola en organopónicos. Cultivos Tropicales. 2002. vol. 23; no. 3: 43-46 [ Links ]
[3] GARZA, I.; et al. Sorgo cultivado con biofertilizantes; fitohormonas y fósforo inorgánico. TERRA Latinoamericana. 2005. Vol. 23; No. 4: 581-586. [ Links ]
[4] ZHANG, H.; et al. Biocontrol of gray mold decay in peach fruit by integration of antagonistic yeast with salicylic acid and their effects on postharvest quality parameters. Biological Control. 2008. Vol. 47: 60–65. [ Links ]
[5] ZHANG, H.Y.; ZHENG, X.D.; yU, T. Biological control of postharvest diseases of peach with Cryptococcus laurentii. Food Control. 2007. Vol. 18: 287–291. [ Links ]
[6] LÓPEZ, M.; et al. Efecto de biofertilizantes bacterianos sobre el crecimiento de un cultivar de maíz en dos suelos contrastantes venezolanos. Agronomía Tropical. 2008. Vol. 58(4): 391-401. [ Links ]
[7] SWEETEN, J. M. AND AUVERMANN, B. W. Composting Manure and Sludge. AgriLife Communications and Marketing; The Texas A & M University System. 2008. E-479. [ Links ]
[8] JETIYANON, K.; FOWLER, W.D.; KLOEPPER, J.W. Broad spectrum protection against several pathogens by PGPR mixtures under field conditions. Plant Disease. 2003. Vol. 87: 1390–1394. [ Links ]
[9] RAMOS, B.; et al. Alterations in the rhizobacterial community associated with European alder growth when inoculated with PGPR strain Bacillus licheniformis. Environmental and Experimental Botany. 2003. Vol 49: 61-68. [ Links ]
[10] BRENNER, K.; YOU, L. AND ARNOLD F. Engineering microbial consortia: a new frontier in synthetic biology. Trends in Biotechnology. 2008. Vol.26, No.9: 483-489. [ Links ]
[11] MADIGAN, M. T.; MARTINKO, J. M.; PARKER, J. Brock Biology of Microorganisms. 8 edition. Prentice Hall. Upper Saddle River; New Jersey. 1997: 701-703. [ Links ]
[12] FALLIK, E.; CHAN, Y.K.; AND ROBSON, R. L. Detection of Alternative Nitrogenases in Aerobic Gram-Negative Nitrogen-Fixing Bacteria. Journal of bacteriology. 1991. Vol. 173; No. 1: 365-371. [ Links ]
[13] VIVAS, M.; et al. Identificación y caracterización de una bacteria degradadora de parafinas. Investigación Universitaria Multidisciplinaria. 2008. Año 7; No. 7: 51-60. [ Links ]
[14] REINOSO, Y. et al. Aislamiento; selección e identificación de bacterias del género Bacillus antagonistas de pectobacterium carotovorum. FITOSANIDAD. 2006. Vol. 10; No. 3. 187-191. [ Links ]
[15] RODRÍGUEZ, A. et al. Caracterización fisiológica de la comunidad microbiana endófita de la caña de azúcar. Revista Colombiana de Biotecnología. 2005. Vol. 3. No 1: 66-75. [ Links ]
[16] RAMOS, B. y GUTIÉRREZ, F. Estudio de la capacidad de dos cepas bacterianas del genero Bacillus para promover el crecimiento vegetal. 2000. Tesis de Doctorado; Universidad de San Pablo CEU. Facultad de Ciencias experimentales y técnicas. Departamento de Biología. Madrid. [ Links ]
[17] CRIOLLO, H.; GARCÍA, J. Efecto de la densidad de siembra sobre el crecimiento de plantas de rábano (Raphanus sativus L.) bajo invernadero. Revista colombiana de ciencias hortícolas. 2009. Vol. 3; No.2: 210-222. [ Links ]
[18] MONTERO, S.M.; SINGH, B.K. y TAYLOR, R. Evaluación de seis estructuras de producción hidropónica diversificada en el trópico húmedo de Costa Rica. Tierra Tropical. 2006. Vol. 2; No. 1: 27-37. [ Links ]
[19] RAMÍREZ, R. y PÉREZ, M. Evaluación del potencial de los biosólidos procedentes del tratamiento de aguas residuales para uso agrícola y su efecto sobre el cultivo de rábano rojo (Raphanus sativus L.). Revista Facultad Nacional Agronomía-Medellín. Universidad Nacional de Colombia. 2006. Vol.59; No.2: 3543-3556. [ Links ]
[20] LU, ZHAO-LIANG. et al. Analysis and Evaluation of Nutritional Quality in Chinese Radish (Raphanus sativus L.). Agricultural Sciences in China. 2008. Vol.7; No. 7: 823-830. [ Links ]
[21] SRINIVASAN, K. AND MATHIVANAN, N. Biological control of sunflower necrosis virus disease with powder and liquid formulations of plant growth promoting microbial consortia under field conditions. Biological Control. 2009. Vol. 51: 395–402. [ Links ]
[22] LEE, J. P. et al. Evaluation of formulations of Bacillus licheniformis for the biological control of tomato gray mold caused by Botrytis cinerea. Biological Control. 2006. Vol. 37; 329–337. [ Links ]
[23] ROMO, M. Efecto de la luz en el crecimiento de plántulas de Dipteryx micrantha harms Shihuahuaco transplantadas a sotobosque; claros y plantaciones; Ecología aplicada. 2005. Vol. 4; No. 1 y 2: 1-8. [ Links ]
[24] BARRERA J.; CAYÓN G. y ROBLES, J. Influencia de la exposición de las hojas y el epicarpio de frutos sobre el desarrollo y la calidad del racimo de plátano Hartón' (Musa AAB Simmonds). Agronomía Colombiana. 2009. Vol. 27; No. 1: 73-79. [ Links ]
[25] ELIZONDO, J. Producción y calidad de la biomasa de morera (Morus alba) fertilizada con diferentes abonos. Agronomía Mesoamericana. 2007. Vol. 18; No. 2: 255-261. ISSN: 1021-7444. [ Links ]
[26] MAYZ-FIGUEROA, J. Biological Nitrogen Fixation. Revista Cientifica UDO Agricola. 2004. Vol. 4; No. 1: 1-20. Universidad de Oriente Press. ISSN: 1317-9152. [ Links ]
[27] BORREGO, F. et al. Análisis de crecimiento en siete variedades de papa (Solanum tuberosum L.). Agronomía Mesoamericana. 2000. Vol. 11; No. 1: 145-149. [ Links ]
[28] CASIERRA, F.; CARDOZO, M. C. y CÁRDENAS, J. F. Análisis del crecimiento en frutos de tomate (Lycopersicon esculentum Mill.) cultivados bajo invernadero. Agronomía Colombiana. 2007. Vol. 25 No. 2: 299-305. [ Links ]
[29] PROBANZA, A. et al. Pinus pinea L. seedling growth and bacterial rhizosphere structure after inoculation with PGPR Bacillus (B. Licheniformis CECT 5106 and B. pumilus CECT 5105). Applied Soil Ecology. 2002. Vol. 20: 75–84. [ Links ]
[30] SALANTUR, A. et al. Effect of inoculation with non-indigenous and indigenous rhizobacteria of Erzurum (Turkey) origin on growth and yield of spring barley. Plant Soil. 2005. Vol. 275: 147–156. [ Links ]













