Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.10 no.1 Popayán Jan./June 2012
ADSORBENTES A BASE DE CASCARILLA DE ARROZ EN LA RETENCIÓN DE CROMO DE EFLUENTES DE LA INDUSTRIA DE CURTIEMBRES
RICE HUSK-BASED ADSORBENTS IN THE REMOVAL OF CHROMIUM FROM TANNING INDUSTRY EFLUENTS
ADSORVENTES A BASE DE CASCA DE ARROZ NA RETENÇÃO DE CROMO DE EFLUENTES DA INDÚSTRIA DE CURTUMES
YANSY MILENA RODRÍGUEZ1, LIZBETH PAOLA SALINAS2, CARLOS ALBERTO RÍOS2, LUZ YOLANDA VARGAS3
1Ingeniera Química. Universidad Industrial de Santander. Bucaramanga (Colombia)
2Geólogo. Ph.D. Ciencias Aplicadas. Universidad Industrial de Santander. Escuela de Geología. Bucaramanga (Colombia)
3Química. Universidad Industrial de Santander. Escuela de Química. Bucaramanga (Colombia)
Correspondencia: carios@uis.edu.co
Recibido para evaluación: 23/02/2011. Aprobado para publicación: 16/03/2012
RESUMEN
Diferentes materiales adsorbentes fueron preparados a partir de la cascarilla de arroz (un residuo lignocelulósico agroindustrial), para la remoción de cromo presente en las aguas resultantes de la curtición, debido a su alta toxicidad para la salud humana y a nivel ambiental. La cascarilla de arroz se evaluó como ceniza y carbón activado con acido fosfórico e hidróxido de sodio como agentes activantes. La parte experimental consistió en la calcinación de la cascarilla de arroz, activación química, caracterización, pruebas de adsorción y absorción atómica; obteniendo mejores resultados el adsorbente activado con hidróxido de sodio. Para la activación de la cascarilla de arroz con NaOH se requirió una serie de experimentos para determinar las mejores condiciones de operación en el proceso de obtención del carbón activado. Se obtuvo una mayor remoción en el carbón que se activo a una temperatura de 600°C, un tiempo de activación de 30 minutos y una concentración de la solución de 1% p/p; la remoción de cromo fue del 72,8% comparado con la cascarilla de arroz activada con H3PO4 que fue del 54,5% y la ceniza de cascarilla de arroz 49,2%.
PALABRAS CLAVES: Residuo agroindustrial, Activación, Adsorción, Contaminación, Medio ambiente.
ABSTRACT
Several adsorbent materials were prepared from rice husk, a lignocellulosic waste from agro-industry, for the removal of chromium present in the effluents of the tanning, due to its high toxicity in the health and to environmental level. The rice husk was evaluated as ash and activated coal with phosphoric acid or hydroxide of sodium as activating agents. The experimental part consisted of calcination of the rice husk, chemical activation, characterization, tests of adsorption and tests of atomic absorption; obtaining better results the adsorbent activated with hydroxide of sodium. The activation of the rice husk with NaOH required a series of experiments to determine the best conditions of operation in the process of obtaining of the activated coal. A major removal was obtained in the coal that was activated at 600°C 30 minutes of activation time and 1% p/p of solution concentration; the removal was of the 72,8 % compared with the rice husk ash activated with H3PO4 that was of the 54,5% and the rice husk ash 49,2%.
KEYWORDS: Agroindustrial waste, Activation, Adsorption, Pollution, Environment.
RESUMO
Diferentes materiais adsorventes fórum preparados a partir da casca de arroz, um resíduo lignocelulósico agroindustrial, para a remoção de cromo das águas resultantes da curtição, devido a sua alta toxicidade na saúde e ao nível ambiental. A casca de arroz, a qual se avalia como cinza e carvão ativado com acido fosfórico e hidróxido de sódio como agentes ativadores. A parte experimental consta de calcinação da casca de arroz, ativação química, caracterização, testes de adsorção e absorção atômica; obtendo os melhores resultados o adsorvente ativado com hidróxido de sódio. A ativação da casca de arroz com NaOH se precisaram uma série de experimentos para determinar as melhores condições de operação no processo de obtenção do carvão ativado. Obteve-se uma maior remoção no carvão que se ativo a uma temperatura de 600°C, um tempo de ativação de 30 minutos e uma concentração da solução de 1% p/p; a remoção foi do 72,8% comparado com a casca de arroz ativada com H3PO4 que foi do 54,5% e a cinza de casca de arroz 49,2%.
PALAVRAS CHAVE: Resíduo agroindustrial, Ativação, Adsorção, Poluição, Meio ambiente.
INTRODUCCIÓN
En los procesos industriales, especialmente en operaciones mineras, plantas de galvanoplastia, centrales de energía, fábricas de electrodomésticos, y curtiembres, se generan efluentes líquidos con altas concentraciones de sustancias altamente tóxicas, no biodegradbles y cancerígenas [1]. Estos efluentes deben ser tratados adecuadamente debido a su alta toxicidad, para lo cual se han desarrollado diferentes tecnologías para el tratamiento, las cuales incluyen la precipitación química [2], electrodiálisis [3], intercambio iónico [4], separación por membrana [5] y adsorción [6. Dentro de los métodos utilizados, la adsorción ha sido aplicada con gran éxito en el tratamiento de efluentes contaminados. El proceso productivo desarrollado por la industria de curtiembres, incluye una serie de etapas durante la cual se aplican grandes cantidades de agua y químicos a las pieles; el método de curtido con sal de cromo es el más utilizado en la mayoría de curtiembres [7]. La dificultad que presenta el uso de sales de cromo en el curtido es la cantidad de curtiente que no se fija, y que permanece en los reflujos y los lodos de depuración, lo cual impide la utilización de los materiales residuales, principalmente de este metal [8]. Por lo tanto, el procesamiento de pieles no solo genera una gran cantidad de residuos tóxicos sino que presenta efectos negativos sobre el medio ambiente y la salud humana [6]. El nivel máximo de contaminación de cromo para el agua potable es de 0,05 mg/L [9]. Por lo tanto, la concentración de cromo en los efluentes de la industria de curtiembres debería ser inferior a este valor. En estos efluentes, el cromo puede encontrarse como Cr6+ o Cr3+, siendo este último más estable y mucho menos tóxico que el Cr6+. Los métodos más comunes empleados para la reducción del cromo en solución, incluyen la reducción de Cr6+ a Cr3+ y la precipitación química como Cr(OH)3, intercambio iónico sobre resina, electrodiálisis, osmosis inversa y adsorción sobre carbón activado [10-13]. La adsorción es un método eficaz para remover cromo [14], siendo el carbón activado uno de los materiales adsorbentes más utilizados para tal fin [15]. Sin embargo, debido al alto costo del carbón activado, se ha investigado la posibilidad de utilizar diferentes residuos industriales, tales como lodo rojo [16], escoria activada [17], carbón activado desarrollado a partir de residuos de fertilizantes [18], algas verdes filamentosas Spirogyra [19], arcilla blanqueadora agotada desengrasada [20], ceniza de bagazo de caña de azúcar [21] y cascarilla de arroz y sus derivados [22]. La cascarilla de arroz es un residuo agroindustrial, el cual dada su importante generación y acumulación, ha encontrado múltiples aplicaciones en diferentes campos y por intermedio de diferentes métodos, para preparar materiales adsorbentes que viabilicen su uso posterior en el tratamiento de efluentes industriales. En el presente estudio, se prepararon diferentes materiales adsorbentes, ceniza de cascarilla de arroz, cascarilla de arroz activada con acido fosfórico y ceniza de cascarilla de arroz activada con hidróxido de sodio para la eliminación de cromo, el cual es un agente altamente tóxico que es cancerígeno, mutagénico y teratogénico para los organismos vivos [23]. Una variedad de métodos han sido desarrollados para la remoción de cromo de aguas residuales, tales como la adsorción, intercambio iónico, precipitación química, electro-deposición y ósmosis inversa [24-26]. En consecuencia, el objetivo del presente estudio es evaluar la viabilidad de las aplicaciones de la cascarilla de arroz y su producto calcinado activado para la eliminación de cromo a partir de un efluente de la industria de curtiembres. Con este fin, los materiales adsorbentes preparados fueron probados en una serie de experimentos de adsorción.
MÉTODO
Para el tratamiento del efluente de la industria de curtiembres, se utilizaron varios materiales adsorbentes, los cuales incluyen la cascarilla de arroz original y productos obtenidos a partir de esta por diferentes métodos de activación: calcinación, con H3PO4 y con NaOH. La capacidad de eliminación de cromo fue evaluada a partir de ensayos de adsorción.
Solución. Se usó un efluente de la industria de curtiembres que opera en el Parque Industrial de Chimita (Santander), el cual presenta una alta concentración de cromo. La muestra inicialmente fue filtrada para eliminar la presencia de residuos sólidos.
Biomasa. La biomasa utilizada como material de partida en el presente estudio corresponde a la cascarilla de arroz adquirida en la Arrocera La Granja, Bucaramanga (Santander). Este material fue lavado con agua destilada, secado en una estufa a 120°C durante 1 h y almacenado en bolsas de polietileno a temperatura ambiente hasta su respectivo uso y/o pre-tratamiento. A partir de esta se prepararon tres clases de materiales adsorbentes: ceniza de cascarilla de arroz, cascarilla de arroz activada con H3PO4 y ceniza de cascarilla de arroz activada con NaOH. La Figura 1 ilustra aspectos generales del proceso de activación del material de partida y su producto calcinado.
Activación de la cascarilla de arroz
Ceniza de cascarilla de arroz. Inicialmente se pesaron 80 g de cascarilla de arroz, los cuales fueron transferidos a un crisol. El material de partida fue calentado en una mufla a 120°C durante 1 h con el fin de eliminar la humedad presente en la muestra, tiempo al cabo del cual la temperatura se elevo a 450°C durante 1 h para obtener ceniza de cascarilla de arroz, según el método propuesto por Fierro et al. [27].
Cascarilla de arroz activada con H3PO4. La preparación de esta muestra se llevo a cabo en dos partes: activación y calcinación. En primera instancia se determino la fracción de espacios vacios, adicionando 2400 ml de agua destilada a 100 g de cascarilla de arroz en un vaso de precipitado hasta cubrirla. El volumen de H3PO4 (85%) utilizado se calculo con base en la relación H3PO4/cascarilla de arroz de 1:5 propuesta por Fierro et al. [27]. Debido a que la pureza del H3PO4 es del 85 se requiere mayor cantidad para la activación de la cascarilla de arroz. La cantidad de H3PO4 fue de 13,76 ml. Posteriormente en tres vasos de precipitado se distribuyeron los 100 g de la cascarilla de arroz. Por otra parte, en un vaso de precipitado se pusieron 13,76 ml de H3PO4 a los cuales se adiciono agua destilada hasta alcanzar un volumen de 2400 mL. La solución resultante se distribuyo entre los tres vasos de precipitado que contenían la cascarilla de arroz. Luego, se dejó en contacto la cascarilla de arroz. Esta solución se dejo durante 1 h, se midió el pH y se realizaron varios lavados hasta obtener un pH neutro. Finalmente, la muestra se seco a 120 oC durante 1 h y se calcino a 450 oC durante 1 h para obtener carbón activado.
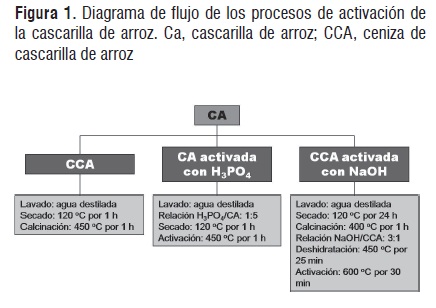
Ceniza de cascarilla de arroz activada con NaOH. La activación de la ceniza de cascarilla de arroz con NaOH se realizó para mejorar la capacidad de adsorción de la cascarilla de arroz, en dicho proceso se varió la concentración de la solución de NaOH, el tiempo de activación y la temperatura. Inicialmente se lavo la cascarilla con agua destilada, se seco a 120°C durante 24 horas, posteriormente se calcinaron las muestras a 400°C por 4 horas, se dejaron enfriar a temperatura ambiente y se pusieron en contacto con soluciones de NaOH en concentraciones de 10%, 20%, 30%, 50% y 70% p/p, debido a que en trabajos previos [28] se han utilizado relaciones de NaOH/ceniza de cascarilla de arroz de 3:1. Finalmente, se aumentó la temperatura de activación con una tasa de calentamiento de 15°C/ minuto. Se dejó enfriar la muestra, se lavó con agua destilada y se filtró para secarse a 110°C por espacio de 3 horas. Cada muestra puesta en contacto con la solución de NaOH era de 3g de ceniza de cascarilla de arroz la cual era empapada con 10 ml de solución.
Proceso de activación. Las concentraciones utilizadas (10%, 20%, 30%, 50% y 70% p/p) durante la activación alcalina no permitieron la formación del adsorbente, por lo que se evaluaron soluciones en concentraciones menores (0,5%, 1% y 5% p/p), las cuales si permitían obtener el carbón activado. Al evaluarlas a diferentes temperaturas y tiempos de activación se obtuvo que las mejores condiciones del carbón para obtener mayor remoción fueron: 1% p/p de la solución de NaOH, 600°C y 30 min de activación. El tiempo de activación fue de 30 minutos, debido a que comparado con los otros tiempos evaluados se obtuvo mayor remoción de cromo, esto se presento porque a tiempos menores el contacto entre la ceniza de cascarilla de arroz y el NaOH no era suficiente para favorecer la formación de los poros y a tiempos mayores estos se destruían. La temperatura de activación seleccionada fue de 600°C, ya que temperaturas menores no garantizaron la eliminación del material volátil afectando la posibilidad de aumentar la porosidad del adsorbente, mientras que temperaturas superiores rompen enlaces disminuyendo los poros. Por último, la concentración de la solución del agente activante fue de 1% p/p puesto que a valores mayores de 10% se obtuvo un gel que no presento las propiedades para un contacto homogéneo con el agua de curtiembre y las concentraciones de 0.5% y 5% removieron menor cantidad de cromo.
Caracterización fisicoquímica. Las muestras de cascarilla de arroz original y modificadas fueron pulverizadas utilizando un mortero de ágata y llevada a un tamaño de 38 mm (400 mesh). El espécimen seleccionado de la muestra fue colocado en un portamuestra de aluminio mediante la técnica de llenado lateral para hacerle el análisis mineralógico. La toma de datos de difracción se realizó en un difractómetro marca RIGAKU modelo D/MAX IIIB. Las condiciones experimentales fueron voltaje: 40 kV, corriente 30 mA, rendijas (slits): Ds (1.0°), RS (0,3mm) y SS (1.0°), muestreo: 1.0°, rango de medición: 2-70° (2.), radiación: CuKa1, monocromador: grafito, detector: centelleo, tipo de barrido: a pasos y tiempo de muestreo: 2 seg. El análisis cualitativo de las fases presentes en la muestra se realizó mediante comparación del perfil observado con los perfiles de difracción reportados en la base de datos PDF-2 del International Centre for Diffraction Data (ICDD). La morfología de la cascarilla de arroz fue analizada por microscopia electrónica de barrido (MEB) en un microscopio electrónico de barrido ambiental marca FEI modelo Quanta 200, el cual presenta un dispositivo de emisión de campo FEG (Field emmision Gun). Este equipo permite realizar observaciones en tres modos de operación diferentes: alto vacío, bajo vacío y condiciones ambientales, dispone de detectores para la realización de imágenes de SE (secondary electrons) y BSE (back-scattered electrón microscopy). Las imágenes al MEB fueron tomadas utilizando las siguientes condiciones experimentales: magnificación = 100-6000x, distancia de trabajo (WD) = 8.4, voltaje de aceleración (HV) = 7.0 kV, tamaño del haz (spot) = 3.0, modo SE, detector LFD. Con el fin de determinar los grupos funcionales responsables del la adsorción de metales, la cascarilla de arroz y sus productos de activación fueron analizados por espectroscopia infrarroja de transformada de Fourier (FTIR), utilizando un espectrómetro marca Bruker, modelo Tensor 27, en la región de 4000-400 cm-1.
Ensayos de adsorción. Se llevaron a caboexperimentos batch con un efluente de la industria de curtiembres usando 3 tipos de materiales adsorbentes: ceniza de cascarilla de arroz, cascarilla de arroz activada con H3PO4 y ceniza de cascarilla de arroz activada con hidróxido de sodio, evaluadas bajo los mismos parámetros. Se puso en contacto 0.25, 0.5 y 1 g de adsorbente con 50 mL de solución (efluente industrial) a temperatura ambiente. Las muestras fueron sometidas a agitación de 10 rpm hasta por 24 h en un Shaker BIOT-S-04 (GFL). Los tiempos medidos para agitación fueron: 5, 10, 15,30, 45, 60, 360, 720,1440 min. El peso del adsorbente se determino en una balanza analítica meter Toledo AB204 con capacidad mínima de 10 mg y capacidad máxima de 210 g. Posteriormente, las muestras fueron filtradas y se midió el pH resultante. La determinación del contenido de cromo tanto de la solución original como de las soluciones tratadas se realizó mediante el método de adsorción atómica de llama en un espectrofotómetro marca Thermo Electrón Corporation, mientras que la determinación del pH de la solución, así como su variación a lo largo del proceso de remoción, se llevó a cabo con un pHmetro digital marca Schott Instrument.
RESULTADOS
Caracterización de materiales adsorbentes
Los perfiles de difracción de rayos X (Figura 2) revelan que la cascarilla de arroz original (Figura 2a) es amorfa a los rayos X, presentando una banda ancha en la región de 2. entre 12 y 25°, lo cual está relacionado con el estado amorfo de la sílice de la cascarilla de arroz, tal como lo reportan en la literatura diferentes autores [29-33], la mayoría de los cuales han demostrado que este residuo agroindustrial es una excelente materia prima para la obtención de sílice amorfa. Por otra parte, la ceniza de cascarilla de arroz (Figura 2b) presenta una giba importante en la región de 2. entre 12 y 35° cuya máxima intensidad se presenta alrededor de los 18° de ángulo 2., mientras que la cascarilla de arroz activada con H3PO4 (Figura 2c) presenta una giba de menor intensidad aunque en la misma región que aquella observada con la ceniza de cascarilla de arroz. Por lo tanto, estos materiales no muestran estructura cristalina.
La Figura 3 ilustra fotografías tomadas con MEB de la muestra de cascarilla de arroz original utilizada en el presente estudio. En general, la superficie externa de la cascarilla de arroz, denominada exocarpo, se caracteriza por tener una estructura simétrica constituida por celdas convexas, las cuales están separadas por surcos y granos de compuestos de silicio dispersos sobre toda la superficie [33], tal como se observa en la Figura 4a. Es posible observar también la presencia de estructuras filiformes (Figura 4b). La superficie interna (endocarpo) de la muestra de cascarilla de arroz sin tratamiento presenta celdas cóncavas.
La Figura 4a muestra un espectro FTIR para la cascarilla de arroz, donde se observa bandas de absorción características para los grupos funcionales de compuestos orgánicos. Texeira and Zezzi [34] han mostrado que la cascarilla de arroz presenta principalmente compuestos tales como lignina y celulosa, cuyo grupo funcional hidroxilo (-OH). La banda de 3413.62 cm-1 corresponde a OH que es consecuencia de la presencia de agua, así mismo las bandas 2922.67 cm-1, 2125.34 cm-1. 1643.54 cm-1 y 1376.47 cm-1 corresponden a enlaces C=O, C=C y C-H característicos de materiales orgánicos tales como lignocelulosa. Por otra parte, en 1087.87 cm-1 aparece el grupo funcional Si-O perteneciente al contenido de sílice presente en la muestra. La Figura 4b se observa el espectro FTIR para la ceniza de cascarilla de arroz, las bandas mejor marcadas son las correspondientes al agua y a la sílice aunque con una menor intensidad, esto debido a que el agua se evaporó en el proceso de calcinación. Las Figura 4c y 4d representan los espectros infrarrojo para la cascarilla de arroz activada con H3PO4 y la ceniza de cascarilla de arroz activada con NaOH respectivamente, en ellas se observa que los picos mejor marcados son el del agua y la sílice, aunque para la ceniza de cascarilla de arroz activada con NaOH el pico correspondiente a la sílice es más notorio, lo cual le confiere mayor capacidad para adsorber metal.
Remoción de Cr. La adsorción de metales pesados está fuertemente influenciada por el pH del medio. Dicho efecto permite la disponibilidad de iones metálicos, para ser adsorbidos en solución por materiales adsorbentes cuya superficie tiene centros potenciales de adsorción. La Figura 5 muestra la cantidad de cromo removido en función del tiempo de adsorción para las tres cantidades de materiales adsorbentes evaluados. Los resultados muestran que el adsorbente con el que se obtiene una mayor remoción es la ceniza de cascarilla de arroz activada con NaOH, seguido de la cascarilla de arroz activada con H3PO4 y ceniza de cascarilla de arroz, pero para una dosis de 0.25 g se observa este comportamiento hasta 45 minutos de contacto entre el agua de curtiembre y el adsorbente. De esta figura, se puede inferir que el tiempo en el que se obtiene una mayor remoción es 60 min para todas las dosis, pero la que adsorbe más cantidad del ión es 0.5 g, esto indica que la cantidad removida no es directamente proporcional con la dosis empleada, ya que esta es una cantidad de adsorbente apropiada para tratar los 50 mL de agua usada en las pruebas de adsorción. En general, tiempos mayores a una hora no representan un aumento considerable en la remoción, por el contrario la cantidad de cromo removida disminuye tomando un comportamiento estable, debido a que la superficie del adsorbente se satura. La tendencia que presentan los adsorbentes para las dosis empleadas es estable cuando se usa 0.5 g, a diferencia de lo observado con el uso de 0.25 y 1 g, dosis que producen fluctuaciones las cuales se deben a que con la primera cantidad los puntos activos del carbon son pocos para la cantidad del ion presente en el agua y para 1 g estos puntos son obstruidos por el exceso de adsorbente afectando el contacto.
Eficiencia de los adsorbentes en la retención de Cr. Los adsorbentes ceniza de cascarilla de arroz, cascarilla de arroz activada con H3PO4 y ceniza de cascarilla de arroz activada con NaOH, presentaron las siguientes eficiencias del 49.2, 54.5 y 72.8%, respectivamente. Estos resultados muestran que el mejor adsorbente es la ceniza de cascarilla de arroz activada con NaOH el cual tiene un 23,6% más de remoción en comparación con los otros adsorbentes utilizados. Por lo tanto, la activación con NaOH proporciona mayor remoción y condiciones de activación que hacen viable el proceso.
pH. Los resultados de las mediciones de pH de los tres adsorbentes para los diferentes tiempos de adsorción se ilustran en la Figura 6. Tanto la ceniza de cascarilla de arroz como la cascarilla de arroz activada con H3PO4 presentan disminución del pH a diferencia de lo que se observa con la ceniza de cascarilla de arroz activada con NaOH, lo cual se debe a que se presento mayor interacción entre la superficie y el adsorbato en solución. El rango de pH en el que se mantiene el agua tratada está entre 0 y 5 aproximadamente, con esto se garantiza que el proceso que se está llevando a cabo es la adsorción y no precipitación del ion.
CONCLUSIONES
La cascarilla de arroz activada con H3PO4 presenta una capacidad de adsorción baja y, aunque puede remover cromo del efluente de curtiembres, esta no es muy eficiente. Por otra parte, la cascarilla de arroz activada con NaOH puede remover hasta el 72,8% de cromo del efluente de curtiembres. Las condiciones optimas de activación fueron: concentración del 1% p/p de NaOH, temperatura de activación de 600 °C y tiempo de activación de 30 min. El tiempo de adsorción en el que se presenta mayor remoción fue el mismo para cada uno de los materiales adsorbentes probados para las diferentes dosis trabajadas, siendo este de 1 h. No obstante, las siguientes recomendaciones deben considerarse para mejorar el proceso de adsorción: evaluar la variación de temperatura, evaluar el efecto del pH, llevar a cabo pruebas de adsorción en un lecho fijo. Finalmente, se recomienda plantear alternativas para tratar el problema del cromo en los efluentes de curtiembres, las cuales podrían incluir la precipitación del cromo presente en los residuos líquidos generados durante el proceso de curtido, regenerando la sal de cromo a partir del precipitado obtenido.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Laboratorio Químico de Consultas Industriales, al Laboratorio de Química Estructural y al Laboratorio de Espectroscopia Atómica y Molecular de la Escuela de Química, así como al Laboratorio del Grupo de Investigaciones en Minerales, Biohidrometalurgia y Ambiente de la Escuela de Ingeniería Metalúrgica y Ciencia de los Materiales de la Universidad Industrial de Santander, y al Instituto Zuliano de Investigaciones Tecnológicas, por las facilidades analíticas suministradas y el personal de apoyo para el desarrollo del trabajo experimental.
REFERENCIAS
[1] LEYVA-RAMOS, R., JACOBO-AZUARA, A., DIAZ-FLORES, P.E., GUERRERO-CORONADO, R.M., MENDOZA-BARRON, J. and BERBER-MENDOZA, M.S. Adsorption of chromium(VI) from an aqueous solution on a surfactant-modified zeolite. Colloids Surf. A: Physicochem. Eng. Aspects, 330 (1), 2008, p. 35-41. [ Links ]
[2] FENG, D., ALDRICH, C. and TAN, H. Treatment of acid mine water by use of heavy metal precipitation and ion exchange. Miner. Eng., 13 (6), 2000, p. 623-642. [ Links ]
[3] MOHAMMADI, T., MOHEB, A., SADRZADEH, M. and RAZMI, A. Modeling of metal ion removal from wastewater by electrodialysis. Separ. Purif. Technol., 41 (1), 2005, p. 73-82. [ Links ]
[4] DABROWSKI, A., HUBICKI, Z., PODKOSCIELNY, P. and ROBENS, E. Selective removal of the heavy metal ions from waters and industrial wastewaters by ion-exchange method. Chemosphere, 56 (2), 2004, p. 91-106. [ Links ]
[5] MOLINARI, R., ARGURIO, P. and POERIO, T. Studies of various solid membrane supports to prepare stable sandwich liquid membranes and testing copper(II) removal from aqueous media. Separ. Purif. Technol., 70 (2), 2009, p. 166-172. [ Links ]
[6] BULUT, Y. and TEZ, Z. Removal of heavy metals from aqueous solution by sawdust adsorption. J. Environ. Sci., 19 (2), 2007, p. 160-166. [ Links ]
[7] TAHIR, S.S. and NASEEM. R. Removal of Cr(III) from tannery wastewater by adsorption onto bentonite clay. Separ. Purif. Technol., 53 (3), 2007, p. 312-321. [ Links ]
[8] CHÁVEZ-PORRAS, A. Descripción de la nocividad del cromo proveniente de la industria de curtiembre y de las posibles formas de removerlo. Rev. Ing. Universidad de Medellín, 9 (17), 2010, p. 41-49. [ Links ]
[9] WHO. Guidelines for Drinking-Water Quality. Geneva: World Health Organization, 2006. [ Links ]
[10] LEYVA-RAMOS, R., JUAREZ-MARTINEZ, A., and GUERRERO-CORONADO, R.M. Adsorption of chromium (VI) from aqueous solutions on activated carbon. Water Sci. Technol., 30 (9), 1994, p. 191-197. [ Links ]
[11] LEYVA-RAMOS, R., GUERRERO-CORONADO, R.M., FUENTES-RUBIO, L. and MENDOZA-BARRON, J. Remoción de cromo hexavalente y trivalente de solución acuosa por medio de resinas de intercambio iónico. Inform. Tecnol., 11 (3), 2000, p. 93-100. [ Links ]
[12] RANGANATHAN, K. Chromium removal by activated carbons prepared from casurina equisetifolia leaves. Biores. Technol., 73 (2), 2000, p. 99-103. [ Links ]
[13] MOHAN, D., SINGH, K.P. and SINGH, V.K. Removal of hexavalent chromium from aqueous solution using low-cost activated carbons derived from agricultural waste materials and activated carbon fabric cloth. Ind. Eng. Chem. Res., 44 (4), 2005, p. 1027-1042. [ Links ]
[14] TARASEVICH, Y.I. and KLIMOVA G. M. Complexing Sorbents Based on Dispersed Minerals for Recovery of Heavy Metal Ions from Aqueous Solutions. Theor. Exp. Chem., 35 (3), 1999, p. 158-161. [ Links ]
[15] PÉREZ-CANDELA, M., MARTÍN-MARTÍNEZ, J.M. and TORREGROSA-MACIÁ. R. Chromium (VI) Removal with Activated Carbons. Water Res., 29 (9), 1995, p. 2174-2180. [ Links ]
[16] GUPTA, V.K., GUPTA, M. and SHARM. S. Process Development for the Removal of Lead and Chromium from Aqueous Solutions Using Red Mud-an Aluminum Industry Waste. Water Res., 35 (5), 2001, p. 1125-1134. [ Links ]
[17] SRIVASTAVA, S.K., GUPTA, V.K. and MOHAN., D. Removal of Lead and Chromium by Activated Slag-A Blast-Furnace Waste. J. Environ. Eng., 123 (5), 1997, p. 461-468. [ Links ]
[18] SRIVASTAVA, S.K., GUPTA, V.K. and MOHAN., D. Kinetic Parameters for the Removal of Lead and Chromium from Wastewater using Activated Carbon Developed from Fertilizer Waste Material. Environ. Model. Assess., 1 (4), 1996, p. 281-290. [ Links ]
[19] GUPTA, V.K., SRIVASTAVA, A.K. and JAIN, N. Biosorption of Chromium (VI) from Aqueous Solutions by Green Algae Spirogyra Species. Water Res., 35 (17), 2001, p. 4079-4085. [ Links ]
[20] SENG, C.E., LEE, C.G. and LIEW, K.Y. Adsorption of Chromium (VI) and Nickel (II) Ions on Acid-and Heat-activated Deoiled Spent Bleaching Clay. J. Am. Oil Chem. Soc., 78 (8), 2001, p. 831-835. [ Links ]
[21] GUPTA, V.K. and ALI., I. Removal of Lead and Chromium from Wastewater using Bagasse Fly Ash-a Sugar Industry Waste. J. Colloid Interf. Sci., 271 (2), 2004, p. 321-328. [ Links ]
[22] KIM, K.S. and CHOI, H.C. Characteristics of Adsorption of Rice-hull Activated Carbon. Water Sci. Technol., 38 (4-5), 1998, p. 95-101. [ Links ]
[23] DUPONT, L. and GUILLON, E. Removal of hexavalent chromium with a lignocellulosic substrate extracted from wheat bran. Environ. Sci. Technol., 37 (18), 2003, p. 4235-4241. [ Links ]
[24] DEAN, J.G., BOSQUI, F.L. and LANOUETTE, K.H. Removing heavy metals from waste water. Environ. Sci. Technol., 6, 1972, p. 518-522. [ Links ]
[25] GUPTA, V.K., JAIN, C.K., ALI, I., SHARMA, M. and SAINI, V.K. Removal of cadmium and nickel from wastewater using bagasse fly ash-a sugar industry waste. Water Res., 37 (16), 2003, p. 4038-4044. [ Links ]
[26] RENGARAJ, S., JOO, C.K., KIM, Y. and YI, J. Kinetics of removal of chromium from water and electronic process wastewater by ion exchange resins: 1200H, 1500H and IRN97H. J. Hazard. Mater., 102 (2-3), 2003, p. 257-275. [ Links ]
[27] FIERRO, V., MUÑIZ, G., BASTA, A. H., EL-SAIED, H. and CELZARD, A. Rice straw as precursor of activated carbons: Activation with phosphoric acid. J. Hazard. Mater., 181 (1-3), 2010, p. 27-34. [ Links ]
[28] GUO, Y., YU, K., WANG, Z. and XU, H. Effects of activation conditions on preparation of porous carbon from rice husk. Carbon, 41 (8), 2003, p. 1645-1648. [ Links ]
[29] YALÇIN, N. and SEVINÇ, V. Studies of the surface area and porosity of activated carbons prepared from rice husks. Carbon, 38 (14), 2000, p. 1943-1945. [ Links ]
[30] YALÇIN, N. and SEVINÇ, V. Studies on silica obtained from rice husk. Ceram. Int., 27 (2), 2001, p. 219-224. [ Links ]
[31] DELLA, V.P., KÜHN, I. and HOTZA, D. Rice husk ash as an alternate source for active silica production. Mater. Let., 57 (4), 2002, p. 818-821. [ Links ]
[32] LIOU, T.H. Preparation and characterization of nano-structured silica from rice husk. Mater. Sci. Eng. A, 364 (1-2), 2004, p. 313-323. [ Links ]
[33] ARCOS, C.A., PINTO, D.M. and RODRÍGUEZ, J.E. La cascarilla de arroz como fuente de SiO2. Rev. Fac. Ing. Univ. Antioquia, 41, 2007, p. 7-20. [ Links ]
[34] TEXEIRA, C.R. and ZEZZI, M.A. Biosorption of heavy metals using rice milling by-products. Characterisation and application for removal of metals from aqueous effluents. Chemosphere, 54 (7), 2004, p. 987-995.es. [ Links ]













