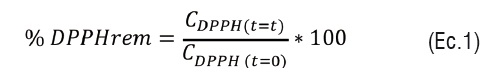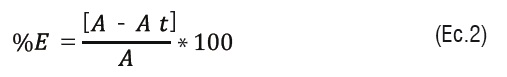Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biotecnología en el Sector Agropecuario y Agroindustrial
versão impressa ISSN 1692-3561
Rev.Bio.Agro vol.10 no.2 Popayán jul./dez. 2012
ACTIVIDAD ANTIOXIDANTE DEL ACEITE ESENCIAL DE ORÉGANO (Lippia origanoides H.B.K) DEL ALTO PATÍA
ANTIOXIDANT ACTIVITY OFESSENTIAL OILS OF OREGANO (Lippia origanoides H.B.K) GROWN IN ALTO PATIA
ATIVIDADE ANTIOXIDANTE DO ÓLEO ESSENCIAL DE ORÉGANO (Lippia origanoides H.B.K) DO ALTO PATIA
OSCAR ARANGO B.1 , DIANA PANTOJA D.2, LORENA SANTACRUZ CH.2, ANDRÉS M. HURTADO B.3
1 Ingeniero Agroindustrial. M.Sc. Universidad de Cantabria, M.Sc. Universidad Autónoma de Madrid. Profesor asociado, Universidad de Nariño.
2 Ingeniero Agroindustrial, Facultad de Ingeniería Agroindustrial, Universidad de Nariño.
3 Ingeniero Químico. Ph.D. Universidad Autónoma de Madrid. España. Profesor asociado, Universidad de Nariño. Grupo de Investigación Tecnologías Emergentes en Agroindustria, Facultad de Ingeniería Agroindustrial, Universidad de Nariño.
Correspondencia: oscar769@hotmail.com
Recibido para evaluación: 16/02/2011 Aprobado para publicación: 16/06/2012
RESUMEN
Debido a los posibles efectos carcinogénicos de algunos antioxidantes sintéticos las investigaciones sobre la obtención y evaluación de antioxidantes naturales tienen un creciente interés. En este trabajo se analizó la composición y se evaluó la capacidad antioxidante de una especie de orégano (Lippiaoriganoides H.B.K) que crece de forma silvestre en la región del Alto Patía al suroccidente de Colombia. El aceite esencial de las hojas de orégano (AEO) se extrajo por la técnica de arrastre con vapor. La composición química se analizó por cromatografía de gases acoplada a espectrometría de masas (GC-MS), identificando los constituyentes con base en sus patrones de fragmentación y sus índices de retención de Kovats. La actividad antioxidante se evaluó mediante los métodos espectrofotométricos de DPPH* y ABTS*+. Los componentes principales fueron timol (73,7%), ρ-cimeno (10,5%), mirceno (3,1%) y γ-terpineno (2,9%). Los valores de EC50 (concentración de aceite esencial que reduce el 50% de radicales DPPH*) para el AEO y para el BHT fueron 5,58 y 1,33 mg/mL, respectivamente; por su parte los valores TEAC (actividad antioxidante equivalente al Trolox) para el AEO y para el BHT fueron 0,33 y 0,68 mg/mL respectivamente, lo que indica que la capacidad antioxidante del AEO es similar a la del BHT, lo cual se puede atribuir a la acción sinérgica de sus compuestos fenólicos. El alto rendimiento de extracción y contenido de timol en el aceite esencial de orégano del Alto Patía hacen que esta especie tenga un alto potencial para la obtención de antioxidantes naturales.
PALABRAS CLAVES: Lippiaoriganoides, Actividad antioxidante, DPPH, ABTS.
ABSTRACT
Because of the potential carcinogenic effects of some synthetic antioxidants research on the collection and evaluation of natural antioxidants have a growing interest. In this work was analyzed the composition and evaluated the antioxidant activity of an oregano species (Lippiaoriganoides H.B.K) that grows wild in the region of Alto Patía, southwestern Colombia. The essential oils were obtained from oregano leaves by steam distillation technique. The chemical composition was analyzed by gas chromatography-mass spectrometry (GC-MS), identifying the constituent based on their fragmentation patterns and Kovat's indices. The antioxidant activity was evaluated by spectrophotometric methods DPPH* and ABTS*+. The main components were thymol (73.7%), ρ-cymene (10.5%), myrcene(3.1%) and γ-terpinene (2.9%). EC50 values (essential oil concentration that reduces 50% of DPPH* radicals) and TEAC (Trolox equivalent antioxidant activity) for the oregano essential oils (OEO) and BHT were 5.58 and 1.33 mg/mL and 0.33 and 0.68 mg/mL, respectively, indicating that the antioxidant capacity of the OEO is similar to that of BHT, which can be attributed to the synergistic action of its phenolic compounds.The highextraction yieldand content ofthymol inoregano essentialoilof Alto Patíamake this specieshas a highpotentialfor obtainingnatural antioxidants.
KEYWORDS: Lippiaoriganoides, Antioxidant activity ,DPPH, ABTS.
RESUMO
Devido aos possíveis efeitos carcinogênicos que têm alguns antioxidantes sintéticos, as pesquisas na obtenção e avaliação de antioxidantes naturais têm um crescente interesse. Neste trabalho foi analisada a composição e a capacidade antioxidante de uma espécie de orégano (Lippiaoriganoides H.B.K) que cresce em forma silvestre na região de Alto Patía ao sudoeste da Colômbia. O óleo essencial das folhas de orégano (OEO),foi extraído pela técnica de arraste com vapor. A composição química foi analisada por cromatografia gasosa acoplada a espectrometria de massas (GC-MS), os compostos foram identificados baseado nos patrões de fragmentação e seus índices de retenção de Kovats. A atividade antioxidante foi avaliada mediante os métodos espectrofotométricos de DPPH* y ABTS*+. Os principais componentes foram timol (73,7%), ρ-cimeno (10,5%), mirceno (3,1%) y γ-terpineno (2,9%). Os valores de EC50 (concentração do óleo essencial que reduz o 50% de radicais DPPH*) e de TEAC (atividade antioxidante equivalente ao Trolox) para o OEO e para o BHT foram 5,58y 1,33mg/mL e 0,33 e 0,68 mg/mL respectivamente, isto indica que a capacidade antioxidante do OEO é similar ao do BHT, que pode se atribuir a ação sinérgica dos compostos fenólicos. O alto rendimento de extração e conteúdo de timol no óleo essencial de orégano do Alto Patía fazem desta espécie, um potencial para a obtenção de antioxidantes naturais.
PALAVRAS-CHAVE: Lippiaoriganoides, Atividade antioxidante, DPPH, ABTS.
INTRODUCCIÓN
Al suroccidente de Colombia, entre los departamentos de Cauca y Nariño, se encuentra la región del Alto Patía,caracterizada por un clima tropical muy seco, en la que crece de forma abundante y silvestre una especie perteneciente a la familia Verbenaceae, conocida popularmente como 'orégano de monte' (Lippiaoriganoides H.B.K). Investigaciones etnobotánicas han encontrado que las hojas de esta planta se usan como condimento y en medicina popular sus infusiones se emplean como tratamiento contra dolores de estómago, indigestión, diarrea, náuseas, flatulencias, dolores menstruales, así como antiséptico oral [1, 2]. También se ha demostrado que el aceite esencial de orégano (AEO) podría ser usado para el tratamiento de infecciones causadas por bacterias multirresistentes [3].
En estudios previos sobre la composición de los aceites esenciales de ésta planta se han encontrado al menos tres quimiotipos diferentes, en dos de los cuales los componentes principales son timol y carvacrol y un tercero menos común donde estos compuestos no están presentes o lo están en muy baja cantidad [4].
Un antioxidante puede definirse como una sustancia que, cuando está presente a baja concentración comparada con la de un substrato oxidable, previene o retrasa significativamente la oxidación del sustrato[5].
El butilhidroxianisol (BHA), y el butilhidroxitolueno (BHT) son los antioxidantes sintéticos de mayor uso en la industria de alimentos y farmacéutica; sin embargo, se han encontrado efectos secundarios en humanos, como el aumento del colesterol, hepatomegalia e inducción de cáncer hepático, entre otras [6, 7, 8], por lo cual algunos países están aplicando fuertes restricciones a su uso y existe una tendencia a sustituirlos por antioxidantes naturales, lo que ha ocasionado que actualmente exista una demanda creciente por encontrar más información concerniente al potencial antioxidante de nuevas especies de plantas para su utilización en las industrias alimentaria, cosmética y farmacéutica.
Adicionalmente, muchos desordenes de la salud como cáncer, enfermedad cardiovascular, aterosclerosis, gastritis, daños en el sistema nervioso central y aceleración del envejecimiento, entre otros, son atribuidos a la acción de los radicales libres [9, 10].
Los alimentos juegan un papel importante en el control del estrés oxidativo. Una dieta rica en antioxidantes como vitaminas C, E, carotenoides, selenio, zinc y polifenoles reduce la incidencia de cáncer y enfermedades cardiovasculares y degenerativas [11].
Los polifenolesson un grupo de compuestos con propiedades reconocidas entre las que se encuentran la estabilización de radicales libres, inhibición de enzimas hidrolíticas y oxidativas y acción antiinflamatoria [12]. En varios casos se ha determinado que la actividad antioxidante del extracto o del aceite esencial de una planta está relacionada directamente con la cantidad de compuestos fenólicos presentes en ella[13], uno de tales compuestos es el timol, el cual constituye el componente mayoritario en el aceite esencial del orégano de monte.
Celis et al. [14], estudiaron la actividad biológica de tres plantas pertenecientes a la familia Verbenacea siendo Lippiaoriganoides la más promisoria por su capacidad de captura de radicales y su baja toxicidad.En otro estudio se determinó que el potencial inhibitorio de radicales ABTS fue mayor en los aceites esenciales que contienen fenoles como el timol y carvacrol.
Debido al alto porcentaje de timol (73%) encontrado en el aceite esencial del orégano del Alto Patía y a sus características comoun antioxidante promisorio para usar en diferentesmedios, en este trabajo se evaluó la capacidad de estabilización de radicales DPPH y ABTS del AEO comparada con la de los antioxidantes sintéticos BHA y BHT.
MÉTODO
Material vegetal. El material vegetal (solo hojas)fue colectado en la zona conocida como Cordón Panamericano del Alto Patía, municipio de Taminango, corregimiento de El Remolino, en límites de los departamentos de Cauca y Nariño, al suroccidente de Colombia. La región se caracteriza por tener un clima cálido y seco con altitud de 800 msnm y precipitación media de 809 mm al año, con vegetación típica de un enclave subxerofítico La colecta se realizó en la época inmediatamente posterior al periodo de lluvias, entre los meses de julio y agosto. La identificación taxonómica de las muestras se realizó en el Herbario de la Universidad de Nariño.
El material vegetal fue pesado, seleccionado y se dejó secar en sombra a temperatura ambiente (promedio de 18°C) por espacio de ocho días.
Extracción del aceite esencial. El proceso de extracción del AEO se realizó en la Planta Piloto de la Facultad de Ingeniería Agroindustrial de la Universidad de Nariño, utilizando la técnica de arrastrecon vapor.Las condiciones de operación del equipo de extracción fueron tiempo 2h, densidad de lecho 80g/L y presión de vapor 0,32 PSI. Se obtuvo un rendimiento de 3,27% p/p (g de aceite/100 g de hojas secas).
Análisis de la composición del aceite esencial. Se realizó en los Laboratorios Especializados de la Universidad de Nariño utilizando un cromatógrafo de gases Shimadzu GC 17A versión 3, equipado con un inyector split/splitless a temperatura de 250°C, relación split 1:100 y un detector de ionización en llama (FID) (280°C). Los datos cromatográficos fueron adquiridos y procesados con un programa Shimadzu Class VP 4.3. Para la separación de mezclas se utilizó una columna apolar DB-5 (J&W) de 30 m x 0,25 mm D.I. y 0,25 µm de una fase estacionaria de 5% fenil-polietilsiloxano. La temperatura del horno fue programada de 40°C (5 min) hasta 250°C a 5°C min-1. El gas de arrastre y gas auxiliar empleado fue helio (99.9995%, Aga-Fano S.A) a flujo de 1 ml min-1, las velocidades de flujo para gases de combustión en el FID fueron 300 mL min-1 para el aire y 30 mL min-1 para el hidrógeno, el volumen inyectado de los extractos fue de 1.0 µL. Los espectros de masas se obtuvieron en modo SCAN en un intervalo de masas de 38 a 450 m/z.
Para la identificación de los compuestos por medio de índices de Kovats se utilizó como referencia la mezcla de parafinas de C6 – C32. Para confirmar la identificación de los metabolitos secundarios del aceite esencial se realizó un análisis por GC-MS en el Laboratorio de Cromatografía de la Universidad Industrial de Santander, en la cual se utilizó un cromatógrafo de gases Agilent Tecnologies 6890N acoplado a un detector selectivo de masas (MSD) Agilent Tecnologies 5975 Inert, operado en el modo barrido completo (full scan) de radio frecuencia. La columna empleada en dicho análisis fue DB-WAX (J & W Scientific, Folsom, CA, USA). La identificación de los compuestos químicos se basó en sus índices de retención y por comparación de sus espectros de masas con aquellos de las librerías de Wiley y Adams.
Evaluación de la actividad antioxidante. La capacidad de captura de radicales libres del AEO se determinó mediante los métodos espectrofotométricos de DPPH [15, 16] y ABTS [6].
El aceite de orégano se evaluó en un intervalo de concentraciones de 0,1 – 8,97 mg mL-1 y las muestras de BHA y BHT en concentraciones de 0,0085 – 0,102 mM.
Las mediciones del cambio de absorbancia que se producen en la reacción, se hicieron a temperatura ambiente en un espectrofotómetro Genesys 10 UV-VIS Scaning 335907. Las longitudes de onda empleadas fueron 516 y 734nm para DPPH* y ABTS*+ respectivamente. Diariamente, antes de cada medición se equilibró el espectrofotómetro durante 10 minutos. Para el blanco se utilizó etanol grado HPLC. Todas las mediciones se realizaron por triplicado.
Ensayo de DPPH. Se preparó la solución de 2,2-difenil-1-picrilhidracilo (DPPH*) (Sigma Aldrich), pesando 0,014 g de DPPH*que se disolvieron en 100 mL de etanol. Tras una agitación de diez minutos, se tomaron 20 mL se enrasó hasta 100 mL en etanol y se agitó de nuevo.
La recta de calibración resultó del promedio de tres ensayos, utilizando concentraciones de DPPH*de 0 a 0,025 mM.Se tomaron 30 µL de cada una de las concentraciones de aceite esencial y se adicionaron a 3,0 mL de a solución de DPPH* midiéndose la absorbancia cada 5 minutos hasta la estabilización de la reacción. El valor de absorbancia que se obtuvo en cada ensayo se extrapoló en la recta de calibrado de DPPH*, para obtener el equivalente a la concentración de DPPH* a tiempo t, (CDPPH*(t=t)), con el cual se calculó el porcentaje de DPPH* remanente (% DPPH*rem)usando la ecuación que se muestra a continuación:
La gráfica del porcentaje de DPPH* remanente frente al tiempo, es la representación de la cinética de la reacción, y con lagráfica del porcentaje de DPPH* remanente frente a la concentración del aceite en el medio de reacción (mg/mL), se determinó por regresión de mínimos cuadrados la ecuación que permitió encontrar el valor EC50 (concentración eficaz al 50%) que se define como la cantidad de antioxidante (mg/mL) necesario para reducir la concentración de DPPH* a la mitad.
También se calculó el porcentaje de estabilización, según la ecuación (2), como sigue:
Donde:
A =Absorbancia en el tiempo 0
At = Absorbancia después de un periodo de tiempo en reposo.
Con la ecuación encontrada en la representación del porcentaje de estabilización frente alas concentraciones se calculó el valor EC50 que corresponde al valor de la concentración de aceite esencial que estabiliza el 50% del radical libre.
Ensayo de ABTS. En un tubo de ensayo se mezclaron la solución deABTS*+ (2,2'-azinobis-3-etil-benzotiazolina-6-sulfónico) (Sigma Aldrich) 7mM y persulfato de potasio 2,45mM en proporciones 1:1(v/v). La solución de ABTS*+ fue preparada diluyendo la mezcla con etanol grado HPLC hasta alcanzar absorbancia 0,700±0,050 en una longitud de onda de 734 nm. La solución fue almacenada en la oscuridad a temperatura ambiente durante 12-16 h antes de su uso.
La actividad antioxidante se expresócomo porcentaje de estabilización, según la ecuación (2).Otro indicador que se obtuvo es el TEAC (actividad antioxidante equivalente al Trolox, mM y mg/mL) que se calculó tomando la curva de patrón Trolox (análogo vitamina E).
RESULTADOS
Composición del aceite esencial de L. origanoides. Los componentes mayoritarios presentes en el aceite esencial de orégano utilizado en este estudio son en su orden: timol (73,7%), ρ-cimeno (10,6%), mirceno (3,1%) y γ-terpineno (2,9%). Por picnometría se determinóque la densidad del aceite es 0,9546 g/mL.
Los resultados obtenidos en cuanto a la composición del aceite esencial coinciden con el quimiotipo II citado el trabajo de Ruiz et al.[17], cuyos compuestos mayoritarios fueron timol (56,3%), ρ-cimeno (11,8%) y γ-terpineno (7,3%) y con el quimiotipo C descrito por Stashenko et al. [4], en el cual el timol es el componente mayoritario (56%), seguido de ρ-cimeno (9,0%) y γ-terpineno (5,0%).
Los constituyentes volátiles del AEO del Alto Patía fueron iguales a los encontrados por Muñoz et al. [18], aunque con diferencias en sus cantidades relativas timol 14,3% y carvacrol 44,4%, lo que sugiere que se trata de quimiotipos diferentes. Rojas et al.[19], evaluaron la composición del aceite esencial de Lippiaoriganoides colectado en dos estaciones del año (lluviosa y seca) en Venezuela, encontrando que el timol fue el componentes principal, aunque su presencia fue mayor en la estación lluviosa (61,9%) que en la seca (44,7%).
Evaluación de la actividad antioxidante
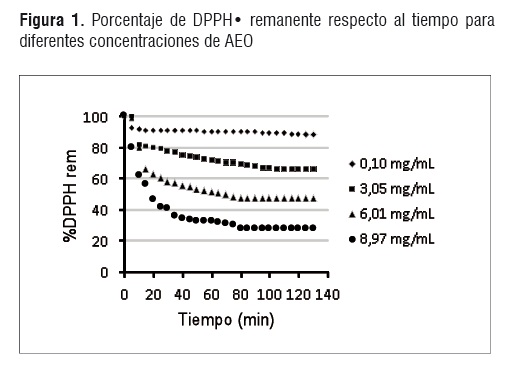
Ensayo de DPPH. La figura 1 muestra una velocidad de reacción proporcional a la concentración del aceite, de esta manera, la mayor concentración de AEO (8,97 mg/mL) deja cerca del 20% de DPPH remanente. El estado estacionario para las reacciones de DPPH* se alcanzó en el intervalo de 90-120 min.
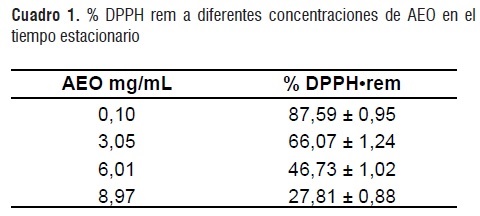
A un tiempo estacionario (te) de reacción de 105 min se determinaron los porcentajes de DPPH* remanente para cada concentración de AEO, los resultados se presentan en el cuadro 1.
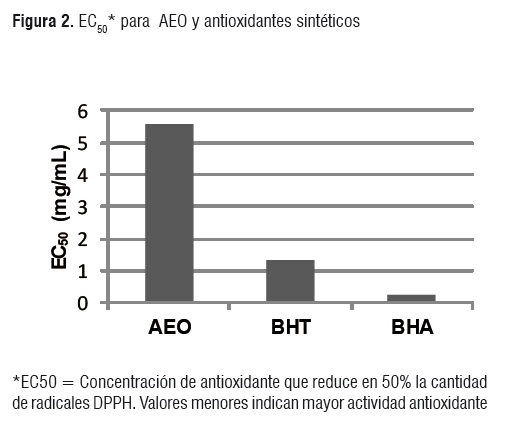
Con los datos del cuadro 1 se obtuvo una ecuación para la recta de ajuste (R2= 0,99) con la cual se determinó que la concentración de AEO necesaria para disminuir la concentración de DPPH inicial al 50% (EC50)es 5,58±0,035 mg AEO/mL DDPH.
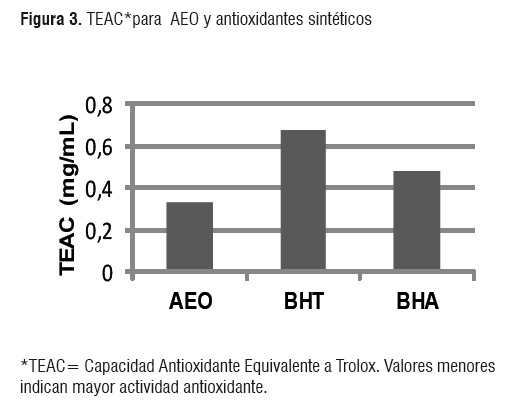
Ensayo de ABTS. Se elaboró una curva de calibrado con diluciones de concentración conocida del patrón Trolox, obteniéndose la ecuación y = -0,205x + 0,691 (R2 = 0,999) que relaciona la absorbancia con la concentración de Trolox. Con los datos obtenidos en la curva de calibrado se calcularon los porcentajes de estabilización y se determinó la concentración de antioxidante que da el mismo porcentaje de estabilización que 1 mM de Trolox. Los resultados de este ensayo se suelen expresar en unidades TEAC (actividad antioxidante equivalente a Trolox). Se determinó que 1 mM de Trolox (0,250 mg/mL), estabiliza el 30,16% de radical ABTS*+, este dato se utilizó para calcular el TEAC de los antioxidantes evaluados.
Con los datos del porcentaje de estabilización de radicales ABTS a diferentes concentraciones de AEO a 1 min de reacciónse calculó el TEAC, obteniendo como resultado 1,16±0,5 mg/mL, por lo tanto, con 1,16 mg/mL de AEO se consigue el mismo porcentaje de estabilización del radical ABTS*+ que con 1 mM de Trolox, equivalente a 30,16% de reducción del radical ABTS*+.
Al evaluar la capacidad para estabilizar los radicales DPPH* y ABTS*+ de los antioxidantes sintéticos BHA y BHT se obtuvieron resultados similares a los reportados en la literatura [6, 20, 21]. En las figuras 2 y 3 se presenta una comparación de la actividad antioxidante del AEO frente a la del BHA y BHT.
El orden de actividad antioxidante según el método DPPH fue BHA > BHT > AEO, mientras que en el método ABTS se evidenció que AEO > BHA > BHT. Se debe resaltar que en ambos métodos la capacidad de estabilización de radicales libres del AEO fue semejante en orden de magnitud a la de los antioxidantes sintéticos BHT y BHA.
Algunas veces los resultados obtenidos por diferentes métodos no son comparables, debido a varios factores como: la estructura física del sistema, la naturaleza del substrato, la presencia de compuestos que pueden interactuar, la forma de iniciar la oxidación y el método para medir la oxidación [22, 23].
Algunas investigaciones relacionan la actividad antioxidante de los aceites esenciales con su contenido de compuestos fenólicos [24], para el caso del aceite esencial de orégano del Alto Patía(L. origanoides) empleado en esta investigación esta capacidad antioxidante puede atribuirse principalmente a su alto contenido de timol (73%).
La actividad antioxidante del aceite esencial de L. origanoides (EC50= 5,58±0,035 mg/mL DDPH*) resultó ser muy superior frente a la de los aceites esenciales de otras plantas de la misma especie tales como Lippia alba (quimiotipo carvona), Lippia alba (quimiotipo citral) y Phyladulcis que mostraron valores de EC50 de 289, 305 y 8,47 mg/mg DPPH* respectivamente [20].
CONCLUSIONES
Los resultados obtenidos indican que el aceite esencial delorégano silvestre del Alto Patía (L. origanoides) presenta una capacidad de estabilización de radicales libres superior a la de los aceites esenciales de otras plantas de la misma especie y que la misma es comparable a la de los antioxidantes sintéticos BHA y BHT. Dicha actividad se atribuye principalmente a su alto contenido de timol (73%)lo que sumado al alto rendimiento de extracción (3,27%) convierten a esta planta en una especie promisoria para la obtención de antioxidantes naturales.
REFERENCIAS
[1] OLIVEIRA, D., LEITAO, G., BIZZO, H., LOPES, D., ALVIANO, D., ALVIANO C.and LEITAO, S. Chemical and antimicrobial analysis of essential oil of Lippia origanoides H.B.K. Food Chemistry, 101, 2007, p. 236-240. [ Links ]
[2] PASCUAL, M., SLOWING, K., CARRETO, E., SÁNCHEZ, D., VILLAR, A. Lippia: traditional uses, chemistry and pharmacology: a review. Journal of Ethnopharmacology, 76, 2001, p. 73-79. [ Links ]
[3] VELASCO, J., ROJAS, J., SALAZAR, P., RODRÍGUEZ, M., DÍAZ, T., MORALES, A., y RONDÓN, M. Antibacterial activity of the essential oil of Lippia oreganoides against multiresistant bacterial strains of nosocomial origin. Natural Products Communication. 2(1), 2007, p. 85-88. [ Links ]
[4] STASHENKO, E., MARTINEZ, J., RUIZ, C., ARIAS, G., DURAN, C., SALGAR, W., CALA, M. Lippia origanoides chemotype differentiation based on essential oil GC-MS and principal component analysis. J. Sep. Sci. 33, 2010, p. 93–103. [ Links ]
[5] HUANG, D., OU, B. y PRIOR, RL. The chemistry behind antioxidant capacity assays. J. Agric. Food Chem. 23; 53(6), 2005, p. 1841-56. [ Links ]
[6] RE, R., PELLEGRINI, N., PROTEGGENTE, A., PANNALA, A., YANG, M., and RICE-EVANS, C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free radicals in Biology and Medicine, 26 (9), 1999, p. 1231–1237. [ Links ]
[7] DOS SANTOS, F., LOPES, J., CITO, G., de OLIVEIRA, E., de LIMA, S., de AM REIS, F. Composition and biological activity of essential oils from Lippia origanoides H.B.K. J. Essen. Oil Res, 16, 2004, p. 504 – 506. [ Links ]
[8] VARGAS, A., BOTTIA, E. Estudio de la composición química de los aceites esenciales de seis especies vegetales cultivadas en los municipios de Bolívar y El Peñón – Santander, Colombia. Proyecto de grado, Universidad Industrial de Santander Facultad de Ciencias, Escuela de Química. 2008. 201 p. [ Links ]
[9] KUMPULAINEN, J., SALONEN, J. Natural Antioxidants and anticarcinogens in nutrition, health and disease. The Royal Society of Chemistry, 1999, p. 178 – 187. [ Links ]
[10] COOK NC, SAMMAN, S. Flavonoids- chemistry, metabolism, cardioprotective effects, and dietary sources. Nutritional Biochemistry, 7, 1996, p. 66 – 76. [ Links ]
[11] ROUSSEL, A., NEVE, J., HININGER, I. In Radicaux libres et stress oxydant. Aspects biologiques et pathologiques, J. Delattre, J.-L. Beaudeux, D. Bonnefont-Rousselot (eds). Editions TEC & DOC, Lavoisier: Paris, 2005, 261 p. [ Links ]
[12] FRANKEL, E. Nutritional benefits of flavonoids. International conference on food factors: Chemistry and Cancer Prevention. Abstracts, C6- 2. Hamamatsu, Japan, 1995. 86 p. [ Links ]
[13] MIGUEL, M.G. Antioxidant activity of medicinal and aromatic plants. A review. Flavour and Fragrance Jornal, 25, 2010, p. 291–312. [ Links ]
[14] CELIS, N., ESCOBAR, P., ISAZA, J., STASHENKO, E., MARTÍNEZ, J. Estudio comparativo de la composición y actividad biológica de los aceites esenciales extraídos de Lippia alba, Lippia origanoidesyphyla (Lippia) dulcis, especies de la familia Verbenaceae. Scientia et Technica, 13 (33), 2007, p. 103 – 105. [ Links ]
[15] BRAND-WILLIAMS, W., CUVELIER, M. and BERSET, C. Use of a free radical method to evaluate antioxidant activity. Food Science and Technology, 28 (1), 1995, p. 25 – 30. [ Links ]
[16] CAVERO, M. Obtención de extractos de plantas aromáticas mediante fluidos subcríticos y supercríticos. Caracterización Química y Funcional. Tesis doctoral, Universidad Autónoma de Madrid, Facultad de Ciencias, Departamento de Química Física Aplicada. 2003. 254 p. [ Links ]
[17] RUIZ, C., TUNAROSA, F., MARTINEZ, J., STASHENKO, E. Estudio comparativo por GC-MS de metabolitos secundários volátiles de dos quimiotipos de Lippia origanoides H.B.K., obtenidos por diferentes técnicas de extracción. Scientia et Technica. 33, 2007, p. 325 – 328. [ Links ]
[18] MUÑOZ, A., KOUZNETSOV, V., STASHENKO, E. Composición y capacidad antioxidante in-vitro de aceites esenciales ricos entimol, carvacrol, trans-anetol o estragol. Salud UIS,41(3), 2009, p. 287-294. [ Links ]
[19] ROJAS, J., MORALES, A., PASQUALE, S., MÁRQUEZ, A., RONDÓN, M., IMRÉ, M. y VERES, K. Comparative study of the chemical composition of the essential oil of Lippiaoreganoides L. collected in two different seasons. Natural Products communication. 1(3), 2006, p. 205-207. [ Links ]
[20] STASHENKO, E., JARAMILLO, B, y MARTÍNEZ, J. Comparación de la composición química y de la actividad antioxidante in vitro de los metabolitos secundarios volátiles de plantas de la familia Verbenaceae. Revista de la Academia Colombiana de Ciencias, 27, 2003, p. 579 – 597. [ Links ]
[21] SÁNCHEZ-MORENO, C. Review: methods used to evaluate the free radical scavenging activity in foods and biological systems. Food Science and Technology, 8 (3), 2002, p. 121 – 137. [ Links ]
[22] BECKER, E., NISSEN, L., SKIBSTED, H. Antioxidant evaluation protocols: Food quality or health effects.European Food Research and Technology, 219 (6), 2004, p. 561 – 571. [ Links ]
[23] FRANKEL, E., MEYER A. The problems of using one-dimensional methods to evaluate multifunctional food and biological antioxidants. J. Sci. Food Agric. 80, 2000, p. 1925 – 1941. [ Links ]
[24] SHAHIDI, F., WANASUNDARA, P.Phenolic antioxidants.Critical Reviews in Food Science and Nutrition, 32, 1992,p. 67 – 103. [ Links ]