Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.10 no.2 Popayán July/Dec. 2012
ALTERACIONES EN LA PRODUCCIÓN mRNA DE ENZIMAS INTESTINALES DE CERDOS DURANTE VARIOS PERÍODOS POSDESTETE
ALTERATIONS IN THE PRODUCTION mRNA OF INTESTINAL ENZYMES IN PIGS DURING SEVERAL POSTWEANING PERIODS
ALTERAÇÕES NA PRODUÇÃO DE mRNA DE ENZIMAS INTESTINAIS DOS SUINOS DURANTE DIVERSOS PERÍODOS APOS O DESMAME
1 MsC Ciencias Básicas Biomédicas, Estudiante Doctorado Ciencias Básicas Biomédicas. Universidad de Antioquia. Grupo BIOGEM.
2 Doctor en Ciencias Biomédicas. Profesor Asociado. Universidad Nacional de Colombia Sede Medellín. Facultad de Ciencias Agropecuarias. Grupo BIOGEM. Colombia. A.A. 1779, Medellín, Colombia.
3 Doctor en Ciencias Animales. Profesor Asistenter Universidad Nacional de Colombia Sede Medellín. Facultad de Ciencias Agropecuarias. Grupo BIOGEM. Colombia. A.A. 1779, Medellín, Colombia.
Correspondencia: jeparrasu@unalmed.edu.co
Recibido para evaluación: 19/10/2011. Aprobado para publicación: 20/06/2012
RESUMEN
El objetivo de este estudio fue determinar la expresión génica de enzimas a nivel de enterocito de cerdos durante el período posdestete. El trabajo de campo se realizó con 16 cerdos destetados a los 21 días de edad en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia. Los animales fueron alimentados durante 10 días con una dieta basal que tuvo como componentes leche y algunos de sus derivados, y que además cumplía con todos los mínimos nutricionales. Los cerdos se sacrificaron escalonadamente los días 1, 5, 7 y 10 posdestete. Se realizó extracción completa del intestino delgado, el cual fue dividido en tres secciones (duodeno, yeyuno e íleon). Se evaluó la expresión génica de las enzimas digestivas por RT-PCR. El diseño estadístico empleado fue completamente al azar. Para las enzimas intestinales se presentaron disminuciones significativas, donde el día cinco posdestete presentó los menores valores(P<0.01). Entre el día uno y 10 posdestete hubo diferencias (P<0.01). El duodeno presentó los mayores valores de expresión génica (P<0.01). El destete temprano altera la expresión molecular de enzimas a nivel de enterocito,ocasionando la disminución de la absorción intestinal de nutrientes, y probablemente la presentación del síndrome de diarrea posdestete.
PALABRAS CLAVE: Aminopeptidasas, Destete, Disacaridasas, RT-PCR, Vellosidades intestinales.
ABSTRACT
The aim of this study was to determine the gene expression of enzymes to enterocyte level of pigs during post-weaning periods.The experiment was conducted in San PabloProductionCenter of the Universidad Nacional de Colombia (Medellín) with 16 weaned pigs at 21 days of age.The animals were fed for 10 days with a basal diet with milk and some of its derivatives, and that also fulfilled all the nutritionals minimums. Pigs were sequentially slaughtered on days one, five, seven, and 10 days after weaning.Complete extraction of small intestine was realized, which was divided into three sections (duodenum, jejunum and ileum). The gene expression of digestive enzymes by RT-PCR was evaluated.The statistical design used was completely at random. For intestinal enzymes significant decreases were showed, where on fifth day post-weaning presented the lowest values (P<0.01). Between one and 10 days post-weaning there were differences (P<0.01). The duodenum showed the highest values of gene expression (P<0.01). Early weaning alters molecular expression of enzymes to enterocyte level, causing the decrease of intestinal absorption of nutrients, and probably the presentation of post-weaning diarrhea syndrome.
KEY WORDS: Aminopeptidases, Disaccharidases, Intestinal villi, RT-PCR, Weaning.
RESUMO
O objetivo desta pesquisa foi determinar a expressão dos genes das aminopeptidases e dissacaridasesaonível do enterocito de suinos durante períodos apos o desmame. A experiência foi conduzida no centro de produção de San Pablo da Universidade Nacional de Colômbia (Medellín) com 16 suinos desmamados aos 21 dias de vida. Os animais foram alimentados por 10 diascomuma dieta básica comleite e alguns de seus derivados, e aquele igualmente cumpriu todos os requisitos mínimos nutricionaís. Os suinos foram eutanasiados nos dias 1, 5, 7 y 10 pós-desmame. A extração completa do intestino pequeno foi realizada, que foi dividido emtrêsseções (duodeno, jejum e íleo). A expressão dos genes das enzimas digestivas por RT-PCR foi avaliada. O delineamento estatístico empregado foi completamente ao acaso. Para as enzimas intestinais as diminuições significativas foram apresentadas, onde no quinto diaapos o desmame apresentou os valores mais baixos (P<0.01). Entre um e 10 diasapos o desmame havian en huma diferença (P<0.01). O duodeno mostrou os valores mais elevados da expressão dos genes (P>0.01). O desmame precoce altera a expressão molecular das enzimas ao nível do enterocito, causando a diminuição da absorção intestinal dos nutrientes, e provavelmente a apresentação do síndrome da diarreia apos o desmame.
PALAVRAS CHAVES: Aminopeptidase, Desmame, Dissacaridase, RT-PCR, Vilosidades.
INTRODUCCIÓN
Los sistemas modernos de producción porcina han avanzado hacia la obtención de animales destetados a edades más tempranas y con mejores índices de conversión de alimento [1,2]. Como resultado, al momento del destete los lechones son ahora más livianos y su sistema digestivo está menos desarrollado, especialmente el intestino, lo que los hace más susceptibles a problemas digestivos en el periodo posdestete [3].
Desde el punto de vista nutricional, el destete implica el cambio de una dieta líquida (leche) ofrecida por la cerda, hacia una dieta sólida, a una edad en que los lechones no han tenido experiencia y no se encuentran preparados fisiológicamente para un cambio de alimento. Todos estos factores conllevan al acortamiento transitorio de las vellosidades intestinales, a la reducción en la capacidad de digestión y absorción de nutrientes [4], y al aumento de episodios diarreicos [5].
La adaptación exitosa al cambio de alimento requiere un profundo ajuste morfológico y enzimático por parte del tracto gastrointestinal, ya que durante esta etapa se presentan cambios en la morfología de las vellosididades/criptas, expresión y actividad de las enzimas de la membrana de borde en cepillo y población de microorganismos intestinales (E. coli y rotavirus) [6].
En la lactancia, las bacterias predominantes en estómago e intestino delgado de los lechones suelen ser lactobacilos y estreptococos. Bajo los sistemas modernos de producción porcina, el destete precoz provoca un periodo breve de ayuno y la desaparición de la población de lactobacilos del tracto gastrointestinal. Lo anterior, conlleva al aumento de la población enteropatógena, especialmente de E. coli.
La E. coli libera desde sus paredes productos proinflamatorios como el lipopolisacárido (LPS). El LPS es un agente causante de sepsis y es reconocido por cualquier hospedero mamífero como una entidad patogénica importante [7]. Aunado a esto, el cerdo recién destetado está sujeto a diferentes tipos de estrés causados principalmente por factores ambientales, etológicos e inmunológicos [4,5].
Debido a lo anterior, se desea implementar un modelo experimental que permita evaluar los efectos del destete temprano sobre la expresión molecular de las enzimas intestinales de la membrana de borde en cepillo (disacaridasas y aminopetidasas) en cerdos durante varios períodos posdestete.
MÉTODO
Consideraciones éticas. Todos los procedimientos experimentales fueron llevados a cabo de acuerdo a las guías propuestas por 'The International Guiding Principles for Biomedical Research Involving Animals' [8]. Esta investigación fue avalada por El Comité de Ética en la Experimentación Animal de la Universidad Nacional de Colombia, Sede Medellín (CEMED 001del 26 de Enero de 2009).
Localización. El trabajo de campo se realizó en el Centro San Pablo, perteneciente a la Universidad Nacional de Colombia, Sede Medellín, ubicado en el municipio de Rionegro, paraje 'El Tablacito', localizado a 2100 msnm, con una temperatura entre 12 y 18°C, correspondiendo a una zona de vida bosque muy húmedo Montano bajo (bmh-MB).
Animales. Se utilizaron 16 cerdos resultado de un cruce alterno Duroc x Landrace, destetados exactamente a los 21 días de edad, con un peso de 6.5 ± 0.5kg. Estos lechones fueron alojados en jaulas provistas de comedero de canoa, las cuales fueron ubicadas en un cuarto con temperatura controlada a 26 ± 3°C.Los animales dispusieron de agua a voluntad durante todo el experimento. Durante la lactancia no se suministró alimento sólido a los lechones.
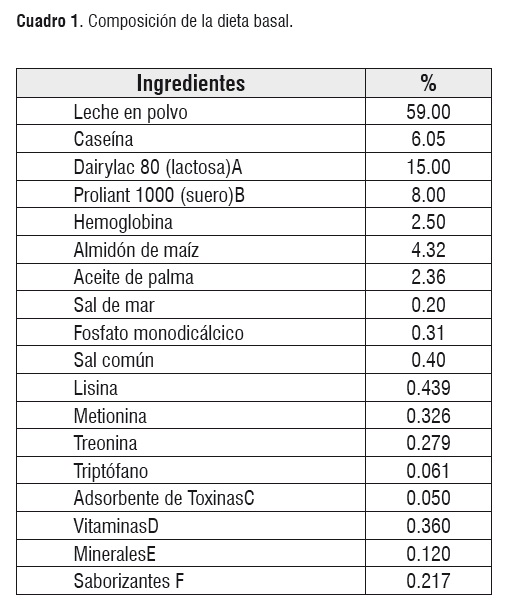
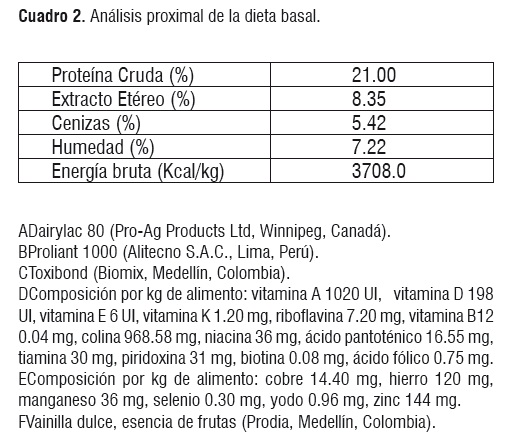
Dieta. La dieta basal ofrecida a los animales tuvo como componentes leche y algunos de sus derivados, además, fue enriquecida con vitaminas, minerales, y lisina HCL. Las dieta se balanceó para cumplir con todos los mínimos nutricionales requeridos y propuestos por el NRC [9] (Cuadros 1 y 2). La cantidad de alimento ofrecido por jaula fue de 300 g/día, sin embargo, se suministró alimento adicional cuando los animales lo requirieron. Las dietas experimentales se proporcionaron desde el día 1 al 10 posdestete.
Toma de muestras de tejido intestinal. Durante la fase experimental se sacrificaron 16 cerdos de la siguiente forma: el día inicial, o día 1 (día del destete), se sacrificaron cuatro cerdos, que representaron el grupo de referencia para verificar el estado general de salud y realizar la evaluación macroscópica del estado de los órganos de los animales antes de suministrar los LPS. Los días cinco, siete y 10 posdestete fueron sacrificados cuatro cerdos. Todos los cerdos fueron sacrificados 2.5 horas después de su última comida. Los animales se sedaron por inhalación de dióxido de carbono durante 3 minutos, y fueron sacrificados por exanguinación, mediante sección de la vena yugular.
Después del sacrificio, los cerdos se colocaron en posición de cúbito dorsal, se incidió la región abdominal y se extrajo completamente el intestino delgado desde la unión pilórica hasta la válvula íleo-cecal [10]. El intestino fue alineado y medido sin ningún tipo de tensión sobre una mesa. Posteriormente éste se dividió en tres regiones (duodeno, yeyuno, e íleon) de igual tamaño, y se tomaron 20 cm del centro de cada segmento. Una vez cortadas las porciones, la digesta contenida en cada una de ellas se removió mediante lavado por infusión con solución salina fría según lo descrito previamente [11]. Luego se obtuvieron varias submuestras (1 cm) de cada segmento y la mucosa de los segmentos intestinales fue separada mediante raspado con un portaobjetos. Las muestras para análisis de RNA fueron congeladas inmediatamente con nitrógeno líquido, y posteriormente se almacenaron en un congelador a –70°C hasta realizar las determinaciones de laboratorio.
Extracción de RNA total y chequeo de la calidad del material. Se extrajo el RNA total de las muestras de intestinos previamente almacenadas en nitrógeno líquido empleando el ULTRACLEANT MT issue & Cells RNA Isolation (Kit MO BIO Laboratories Inc, San Diego, CA, USA). En todos los casos se pesaron 25 mg de tejido (lo máximo recomendado por el fabricante) en una balanza analítica y se procedió con el protocolo descrito en el Kit. Para llevar a cabo la ruptura del tejido se emplearon morteros y nitrógeno líquido. Las muestras de RNA total obtenidas con el procedimiento permanecieron almacenadas a -80°C durante todo el experimento y sólo se tomaron alícuotas en hielo para realizar los análisis. Para evaluar la integridad del material extraído se corrieron todas las muestras en gel de agarosa con bromuro de etidio al 1% (100V por 50 min) para observar las bandas de rRNA (RNA ribosomal). En caso de no visualizar una buena cantidad de material o no ver claramente las bandas de rRNA, se repitió la extracción empleando condiciones idénticas.
Síntesis de cDNA a partir de RNA total. Para sintetizar del cDNA (DNA copia) a partir del RNA total extraído se empleó el QuantiTect® Reverse Transcription Kit (QIAGEN, Valencia, CA, USA). El Kit utiliza cebadores hexámericos aleatorios y cebadores de poli-Timidinas para maximizar la reacción de retro-transcripción, obteniendo tanto rRNA como mRNA. Para todas las reacciones de retrotranscripción se utilizó la misma cantidad de muestra (1µg de RNA en cada reacción). Se removieron los restos de DNA genómico y luego se adicionó la enzima y los nucleótidos trifosfatados para sintetizar el cDNA siguiendo las recomendaciones del fabricante. El cDNA obtenido se almacenó a -20°C hasta su utilización [12].
RT-PCR a partir de cDNA para las enzimas intestinales y el gen de expresión constitutiva. Los cebadores de los genes de interés y de expresión constitutiva (Ciclofilina) muestran en el cuadro 3. Estos cebadores fueron tomados de la literatura, verificando que su diseño hubiera sido realizado en los bordes intrón/exón para evitar la amplificación de DNA genómico. Adicionalmente, se sometieron a diversos análisis bioinformáticos para verificar su especificidad con el fragmento de mRNA o rRNA estudiado y la ausencia de estructuras secundarias, como la formación de lupas o dímeros entre sí o con el otro cebador. Adicionalmente, se escogieron cebadores que amplificaran fragmentos menores a 150 pares de bases, tal como lo recomiendan algunos investigadores [12,13].
Estrategia de normalización, tratamiento de datos obtenidos y cuantificación relativa. Para establecer los niveles de expresión de cada gen se empleó un método de cuantificación relativa usando un gen de expresión constitutiva (Ciclofilina), siguiendo las recomendaciones de diversas publicaciones en cuanto a la escogencia del gen y la estrategia global de normalización [17-20]. La cantidad de material del que se extrajo el RNA, la cantidad de RNA en la reacción de retrotranscripción y la cantidad de cDNA para la amplificación en la PCR fue idéntica para todas las muestras. El gen de expresión constitutiva escogido fue validado en ensayos anteriores bajo condiciones experimentales similares [14]. Los resultados obtenidos se analizaron utilizando el software The Image J (User Guide) Version 1.43.
Detección de la expresión de mRNA de las enzimas intestinales por RTPCR y cuantificación de los productos de PCR. La amplificación por RT-PCR del mRNA de LPH, SI, MGA, ApN, ApA y DDP- IV se realizó en muestras individuales de los segmentos proximal, medio y distal [15]. La densidad de los productos de RT-PCR de cada enzima fue expresada en unidades relativas a la densidad de la banda del gen de expresión constitutiva (gen de ciclofilina).
Diseño estadístico. El experimento se realizó según un diseño completamente al azar, para un total de 4 repeticiones por tratamiento (edad posdestete). El análisis estadístico de los datos obtenidos fue desarrollado utilizando el procedimiento de Modelos Lineales Generales (GLM) del SAS [21]. Para realizar la comparación de los promedios entre tratamientos se utilizó una prueba de Duncan (P > 0.05).
RESULTADOS
Los cerdos presentaron un buen estado de salud, sin embargo algunos mostraron incrementos en la temperatura rectal por encima de 38°C durante todo el experimento. No obstante, estos cerdos no presentaron síntoma alguno de enfermedad que causara su retiro y/o sacrificio inmediato. Además, al nivel en que se fijó el suministro diario de alimento no hubo sobrantes.
En este trabajo se comparó la expresión molecular de las disacaridasas y peptidasas intestinales en la dieta basal durante los periodos de experimentación con el fin de determinar el efecto exclusivo del destete sobre la expresión intestinal de enzimas. Los datos de expresión molecular de cada una de las enzimas en estudio se obtuvieron de la relación entre la expresión del gen de cada citoquina y la expresión del gen constitutivo (Ciclofilina). En los cuadros 4 y 5 pueden observarse los datos obtenidos con DB durante cada uno de los días de experimentación y secciones intestinales. Para las variables ApN, DpP-IV, y ApA (aminopeptidasas) se presentó una disminución estadística significativa (P<0.01) a partir del día uno posdestete (Cuadro 4), donde los animales con cinco días de destetados presentaron los menores valores (1.36, 1.75 y 2.22, respectivamente). En cada una de las variables en estudio se aprecia una recuperación parcial con el transcurso de los días, específicamente en el día 10 posdestete. No obstante, entre los días uno y 10 se presentó diferencia estadística significativa (P>0.01).
Para las disacaridasas en estudio (Cuadro 4) se presentaron diferencias significativas (P<0.01) a partir del día uno posdestete, donde MgA y SI presentaron su menor actividad al día cinco posdestete (2.31 y 3.97, respectivamente), mientras que se aprecia una recuperación parcial con el transcurso de los días, específicamente en el día 10 posdestete, observándose además, diferencia estadística significativa (P<0.01) con respecto al día uno posdestete. Para la variable LPH, se presentó diferencia estadística (P<0.01) entre cada uno de los períodos posdestete, observándose una disminución de la actividad de LPH con el transcurso de los días, considerándose este hecho normal, ya que el su sustrato disminuyó después del destete.
Para cada segmento intestinal (Cuadro 5) se presentaron diferencias significativas (P<0.01) en las diferentes variables en estudio, donde la parte proximal (duodeno) presentó los mayores valores de expresión molecular de las aminopeptidasasApN, DpP-IV, y ApA (1.55, 2.06 y 3.01, respectivamente), y para las disacaridasas LPH, MgA y SI (7.54, 1.87 y 3.17, respectivamente). Sin embargo, no se presentaron diferencias estadísticas significativas entre la parte media (yeyuno) y distal (íleon) del intestino delgado para las diferentes variables en estudio (P>0.01).
Discusión
En este estudio, se evaluó la expresión molecular de enzimas intestinales entre cada uno de los períodos posdestete y segmentos intestinales de cerdos, sin embargo son pocos los trabajos en los que se hayan evaluado tanto los efectos del destete, como el modelo animal utilizado en este experimento, de allí que se haya presentado cierta dificultad para comparar y discutir los resultados obtenidos. Pese a lo anterior, se considera importante continuar generando resultados para establecer la validez de los resultados.
En este estudio durante la fase temprana del destete, del día 1-5, pudo observarse que los valores de expresión de los mRNAs de las disacaridasas y peptidasas disminuyeron. La determinación de los niveles de mRNA de las diferentes enzimas ofrece información en diversos sentidos: síntesis y función. Ambos parámetros son cruciales desde el punto de vista de desarrollo y reflejan necesariamente que existen varios mecanismos entre los procesos de transcripción y traducción que pueden afectar la síntesis y la función de las nuevas proteínas (enzimas), y que a su vez pueden ser dependientes de otros factores tales como especie, edad, nivel de estrés y nutrición [22, 23].
Debido a lo anterior, cualquier anormalidad ocurrida durante estos procesos, podría afectar el desarrollo de glucolización y clivaje de las nuevas proteínas antes de su inserción en la membrana de borde en cepillo. Además, el destete precoz parece afectar las peptidasas a nivel postraduccional (maduración y estabilidad de la enzima), mientras que el destete regula la actividad de la maltasa a nivel transcripcional [24].
De acuerdo con las observaciones publicadas previamente por Egorova et al. [23], Torp et al. [25], Tarvid et al. [26], durante la lactancia y el destete la mayor expresión de los mRNAs de las disacaridasas y peptidasas se observaron principalmente en el segmento proximal. Al igual que en el caso anterior, la expresión de las diferentes enzimas intestinales en estudio, fue mayor en la parte proximal.
Como se mencionó anteriormente, el intestino desempeña un papel activo en procesos de digestión y absorción de nutrientes. Estos procesos pueden ser alterados drásticamente por la presencia de bacterias enteropatógenasa nivel de tracto posterior [27]. Los principales factores que influencian el desarrollo de la población microbiana en el tracto gastrointestinal son la composición y digestibilidad de la dieta ofrecida a los animales durante este período [28-30].
Las alteraciones en los procesos intestinales fueron en un principio consideradas como consecuencia de las reacciones alérgicas a las proteínas contenidas en los alimentos [4, 31]. Sin embargo, actualmente los patogénos entéricos son reconocidos como los principales causantes de dichas disfunciones a nivel intestinal [32].
CONCLUSIONES
Los datos obtenidos en este trabajo podrían sugerir que el destete temprano altera la expresión molecular de enzimas a nivel de enterocito, ocasionando la disminución de la absorción intestinal de nutrientes, y probablemente la presentación del síndrome de diarrea posdestete.
De los hallazgos obtenidos se desprende que es necesario realizar más investigaciones sobre la expresión génica de enzimas intestinales asociada a la fisiología digestiva, la patología, y la inmunología para mejorar la comprensión de los mecanismos causantes de problemas digestivos y sus posibles estrategias terapéuticas en el periodo posdestete.
REFERENCIAS
[1] TOUCHETTE, K.J., CARROLL, J.A., ALLEE, G.L., MATTER R.L., DYER, C.J., BEAUSANG, L.A., ZANNELLI, M.E. Effect of spray-dried plasma and lipopolysaccharide exposure on weaned pigs: I. Effects on the immune axis of weaned pigs. J. Anim. Sci., 80, 2002, p. 494-501. [ Links ]
[2] GÓMEZ, A. El destete y la fisiología del lechón. Memorias I seminario internacional sobre sistemas sostenibles de producción en especies menores. Universidad del Cauca. Popayán (Colombia), 2006. P34. [ Links ]
[3] REIS de SOUZA, T.C., MARISCAL, L.G., AGUILERA, B.A., CERVANTES, J.G.H. Digestibilidad de la proteína y energía en dietas para lechones complementadas con tres diferentes tipos de suero de leche deshidratado. Vet. Méx., 38(2), 2007, p. 141-151. [ Links ]
[4] LALLÈS, J.P., BOUDRY, G., FAVIER, C., LE FLOC'H, N., LURON, I., MONTAGNE, L., OSWALD, P.I., PIÉ, S., PIEL, C. and SÈVE, B.Gut function and dysfunction in young pigs: physiology. Anim. Res., 53, 2004; p. 301–316. [ Links ]
[5] WANG, Y., SHAN, T., XU, Z., LIU, J., FENG, J. Effect of lactoferrin on the growth performance, intestinal morphology, and expression of PR-39 and protegrin-1 genes in weaned piglets. J. Anim. Sci., 84, 2006, p.2636-2641. [ Links ]
[6] MARION, J., BIERNAT, M., THOMAS, F., SAVARY, G., LE BRETON, Y., ZABIELSKI, R., LE HUËROU-LURON, I. and LE DIVIDICH, J. Small intestine growth and morphometry in piglets weaned at 7 days of age. Effects of level of energy intake. Reprod. Nutr. Dev., 2002, 42: 339–354. [ Links ]
[7] AMADOR, P., GARCIA-HERRERA, J., MARCA, M.C., de la OSADA, J., ACIN, S., NAVARRO, M.A., SALVADOR, M.T., LOSTAO, M.P. AND RODRIGUEZ-YOLDI, M.J. Intestinal D-galactosetransport in anendotoxemiamodel in therabbit. J. Membr. Biol., 215, 2007; p. 125–133. [ Links ]
[8] CIOMS (Council for International Organizations of Medical Sciences). International Guiding Principles for Biomedical Research Involving Animals.Geneva: 1985, 28p. [ Links ]
[9] NRC. National Research Council. Nutrient Requirements of Swine. 10th Ed. Washington DC (USA): National Academy Press, 1998, 211 p. [ Links ]
[10] SEGALÉS, J. and DOMINGO, M. 2003. La necropsia en el ganado porcino, diagnóstico anatomopatológico y toma de muestras. Madrid (España): 2003, pp 10-14. [ Links ]
[11] REIS DE SOUZA, T.C. Y MARISCAL, L.G. Preferencia alimentícia y comportamiento zootécnico de lechones alimentados com dietas formuladas com diferentes tipos de suero de leche deshidratado. Téc. Pecu. Mex., 43, 2005, p.309-321. [ Links ]
[12] KUBISTA, M., ANDRADE, J.M.,BENGTSSON, M., FOROOTAN, A., JONÁK, J., LIND, K., SINDELKA, R., SJÖBACK, R., SJÖGREEN, B., STRÖMBOM, L., STÅHLBERG, A. ZORIC N.The real-time polymerase chain reaction. Mol. Aspects Med., 27, 2006, p.95-125. [ Links ]
[13] BUSTIN, S.A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. J. Mol. Endocrinol., 25, 2000, p.169-193. [ Links ]
[14] PAULIN, S.M., JAGANNATHAN, A., CAMPBELL, J., WALLIS, T.S. and STEVENS M.P. Net replication of Salmonella entericaserovars Typhimurium and Choleraesuis in porcine intestinal mucosa and nodes is associated with their differential virulence. Infect. Immun., 75, 2007, p. 3950-3960. [ Links ]
[15] PETERSEN, Y.M., BURRIN, D.G. and SANGILD, P.T. GLP-2 has differential effects on small intestine growth and function in fetal and neonatal pigs. Am. J. Physiol. Regulatory Integrative Comp. Physiol., 281, 2001, p. 1986-1993. [ Links ]
[16] LEE, D.N., CHUANG, Y.S., CHIOU, H.Y., WU, F.Y., YEN, H.T. and WENG CF. Oral administration recombinant porcine epidermal growth factor enhances the jejunal digestive enzyme genes expression and activity of early-weaned piglets. J. Anim. Physiol. Anim. Nutr. 92(4), 2008, p. 463-470. [ Links ]
[17] MULLER, P.Y., JANOVJAK, H., MISEREZ, A.R. and DOBBIE, Z. Processing of gene expression data generated by quantitative real time RT-PCR. Biotechniques,32, 2002, p.1372-1374, 1376, 1378-1379. [ Links ]
[18] VANDESOMPELE, J., DE PRETER K., PATTYN, F., POPPE, B., VAN ROY, N., DE PAEPE, A. and SPELEMAN, F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol, 2002. 3(7): p. RESEARCH0034. [ Links ]
[19] DHEDA, K., HUGGETT, J.F., CHANG, J.S., KIM, L.U., BUSTIN, S.A., JOHNSON, M.A., ROOK, G.A. and ZUMLA, A.The implications of using an inappropriate reference gene for real-time reverse transcription PCR data normalization. Anal Biochem.,344, 2005, p.141-143. [ Links ]
[20] HUGGETT, J., DHEDA, K., BUSTIN, S. and ZUMLA, A. Real-time RT-PCR normalisation; strategies and considerations. Genes Immun., 6, 2005, p. 279-84. [ Links ]
[21] SAS®. SAS/STAT Users Guide. Institute Inc. Statistical Analysis Systems Institute. Version 9.1th Ed. Cary, NC: SAS Institute Inc. 2006. [ Links ]
[22] TANG, M., LAARVELD, B., VANKESSEL, A.G., HAMILTON, D.L., ESTRADA, A., and PATIENCE, J.F. Effect of segregated early weaning on postweaning small intestinal development in pigs. J. Anim. Sci.,77, 1999, p.3191-200. [ Links ]
[23] EGOROVA, V.V., EGOROVA ,G., LASARENKO, L.V. Topography of digestive enzymes in the pig small intestine at the early stages of ontogeny in the norm and pathology. In: Lindberg JE, Ogle B, eds. Digestive Physiology of PigsUppsala:CABI Publishing, 2001, p.49-51. [ Links ]
[24] MARION, J., PETERSEN, Y.M., ROMÉ, V., THOMAS, F., SANGILD, P., DIVIDICH, J.L. and LE HUËROU-LURON, I. . Early Weaning Stimulates Intestinal Brush Border Enzyme Activities in Piglets, Mainly at the Posttranscriptional Level. J Pediatric. Gastroenterol. Nutr., 41, 2005, p. 401-410. [ Links ]
[25] TORP, N., ROSSI, M., TROELSEN, J.T., and DANIELSEN, E.M. Lactase-phlorizin hydrolase and aminopeptidase-N are differentially regulated in the small intestine of the pig. Biochem. J., 295, 1993; p. 177-82. [ Links ]
[26] TARVID, I., CRANWELL, P.D. and MA, L. The early postnatal development of protein digestion in pigs. II. Small intestinal enzymes. In: Souffrant WB, Hagemeister H, eds. Proceedings of the VIth International Symposium on Digestive Physiology In Pigs, Publication No. 80. Dummerstorf: EAAP, 1994:181-184. [ Links ]
[27] FAN, M.Z. Growth and ontogeny of the gastrointestinal tract. In: Xu. RJ, Cranwell P editors. The neonatal pig. Gastrointestinal physiology and nutrition. Nottingham University Press. 2002, p.31-60. [ Links ]
[28] NYACHOTI, C.M., OMOGBENIGUN, F.O., RADEMACHER, M. and BLANK, G. Performance responses and indicators of gastrointestinal health in early-weaned pigs fed low-protein amino acid-supplemented diets. J. Anim. Sci., 84,2006, p.125-134. [ Links ]
[29] MONTAGNE, L., BOUDRY, G., FAVIER, C., LE HUE¨ROU-LURON, I., LALLES, J.P. and SEVE, B. Main intestinal markers associated with the changes in gut architecture and function in piglets after weaning. Brit. J.Nutr., 97, 2007, p.45–57. [ Links ]
[30] RODRIGUES, M.M.A., SILVA, O.D.A., TAKETOMI, A.E., and HERNANDEZ-BLAZQUEZ, F. J. Ig A production, coliforms analysis and intestinal mucosa morphology of piglets that received probiotics with viable or inactivated cells. Pesq. Vet. Bras., 2007; 27: 241-245. [ Links ]
[31] DRÉAU, D. and LALLÈS, J.P. Contribution to the study of gut hypersensitivity reactions to soyabean proteins in preruminant calves and early-weaned piglets. Livest. Prod. Sci., 60, 1999, p.: 209–218. [ Links ]
[32] NABUURS, M.J., HOOGENDOORN, A., and VAN, ZIJDERVELDVAN B.A. Effect of supplementary feeding during the sucking period on net absorption from the small intestine of weaned pigs. Res. Vet. Sci., 61, 1996. P. 72–77. [ Links ]













