Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.11 no.1 Popayán Jan./June 2013
DESARROLLO DE UNA BEBIDA LÁCTEA CON EXTRACTOS DE CURUBA (Passiflora mollissima Bailey) COMO ANTIOXIDANTE NATURAL
DEVELOPMENT OF A MILK BEVERAGE WITH CURUBA (Passiflora mollissima Bailey) EXTRACTS AS NATURAL ANTIOXIDANT
DESENVOLVIMENTO DE UMA BEBIDA DE LEITE COM EXTRATOS CURUBA (Passiflora mollissima Bailey) COMO ANTIOXIDANTE NATURAIS
NELLY YOLIMA SÁNCHEZ 1, JOSÉ URIEL SEPÚLVEDA2, BENJAMÍN ALBERTO ROJANO3
1Ingeniera Química. Estudiante Maestría en Ciencia y Tecnología de los Alimentos, Facultad de Ciencias agropecuarias, Departamento de Ingeniería Agrícola y de Alimentos, Universidad Nacional de Colombia, Sede Medellín.
2Administrador de Empresas. Esp. Ciencia y Tecnología de Alimentos. Docente asociado, Facultad de Ciencias agropecuarias, Departamento de Ingeniería Agrícola y de Alimentos, Universidad Nacional de Colombia, Sede Medellín.
3Ingeniero Químico. Ph.D. Ciencias Químicas. Docente asociado Facultad de Ciencias, Escuela de Química, Universidad Nacional de Colombia, Sede Medellín.
Correspondencia: brojano@unal.edu.co
Recibido para evaluación: 12/10/2011 Aprobado para publicación: 08/02/2013
RESUMEN
La curuba es una fruta tropical, nutritiva y con un alto potencial antioxidante pero poco reconocida. El presente estudio investigó el efecto de la adición de extractos de curuba en concentraciones de 0,4%, 0,6% y 0,8% p/p con relación a un blanco (0%), sobre la capacidad antioxidante y la estabilidad oxidativa de una bebida fermentada con lactosuero, durante el almacenamiento. Se determinaron las características fisicoquímicas de las bebidas, el contenido de fenoles totales, la capacidad antioxidante por los métodos DPPH (2,2-difenil-1-picrilhidracilo) y ORAC (Capacidad de Absorción de Radicales de Oxígeno); se evaluó la oxidación lipídica por el método de TBARS (Sustancias Reactivas al Ácido Tiobarbitúrico) y se determinaron los cambios organolépticos mediante una prueba sensorial triangular. Los resultados obtenidos en el tiempo, variaron en los rangos: 15,46 - 302,96 mg ác. gálico/L para fenoles totales; 183,23 - 1.376,46 µM Tx en DPPH; 704,88 - 4.910,32 µM Tx en ORAC-H; 258,50 - 1.730,80 µmol Tx/100g en ORAC-L; 2,39 - 31,08 nmol MDA/g en TBARS; en la prueba triangular 0,4% y 0,6% no presentaron diferencias significativas (p>0,05), a diferencia de 0,8% (p<0,05), mostrando que los extractos de curuba incrementaron la capacidad antioxidante e inhibieron el proceso oxidativo de la bebida láctea con relación al blanco.
PALABRAS CLAVE: Passiflora mollissima B., Bebida láctea fermentada, Capacidad antioxidante, ORAC, TBARS.
ABSTRACT
The curuba is a tropical fruit, nutritious and high antioxidant potential but little recognized. This study investigated the effect of the addition of curuba extracts in concentrations of 0,4%, 0,6% and 0,8% w/w relative to a white (0%) in the antioxidant capacity and oxidative stability of a fermented milk beverage with whey during storage. We determined the physicochemical characteristics of the beverages, the total phenol content, antioxidant capacity by the methods DPPH (2,2-diphenyl-1-picrilhidracilo) and ORAC (Absorption Capacity Oxygen Radical) and assessed lipid oxidation by the method of TBARS (Thiobarbituric Acid Reactive Substances) and sensory changes were determined using a triangular sensory test. The results obtained in time for the three concentrations varied in the ranges: 15,46 - 302,96 mg ac. gallic/L for total phenols, 183,23-1.376,46 µM Tx DPPH; 704,88-4.910,32 µM Tx ORAC-H; 258,50-1.730,80 μmol Tx/100g ORAC-L; 2,39 - 31,08 nmol MDA/g in TBARS, in the triangle test 0,4% and 0,6% had no significant differences (p>0,05), a difference of 0,8% (p<0,05), showing that the curuba extracts increased the antioxidant capacity and inhibited the oxidative process of the milk beverage compared to white.
KEY WORDS: PassifloramollissimaB., Fermented milk beverage, Antioxidant capacity, ORAC, TBARS.
RESUMO
Curuba é um fruto tropical, nutritiva e potencial antioxidante alto, mas pouco reconhecido. O presente estudo investigou o efeito da adição de extratos de curuba nas concentrações de 0,4%, 0,6% e 0,8% w/w em relação a um branco (0%) na capacidade antioxidante e estabilidade oxidativa de um bebida fermentada com soro de leite durante o armazenamento. Nós determinamos as características físico-químicas das bebidas, o teor de fenóis totais, capacidade antioxidante pelo DPPH métodos (2,2-difenil-1-picrilhidracilo) e ORAC (Oxygen Capacidade de Absorção Radical) e oxidação lipídica avaliada pelo método de TBARS (Substâncias reativas ao Ácido Tiobarbitúrico) e alterações sensoriais foram determinados através de um teste triangular sensorial. Os resultados obtidos no tempo para as três concentrações variadas nas faixas: 15,46 - 302,96 mg ac. gálico/L de fenóis totais; 183,23 - 1.376,46 µM Tx em DPPH; 704,88 - 4.910,32 µM Tx em ORAC-H; 258,50 - 1.730,80 μmol Tx/100g em ORAC-L; 2,39 - 31,08 nmol MDA/g de TBARS, no teste de triângulo 0,4% e 0,6% não apresentaram diferenças significativas (p>0,05), uma diferença de 0,8% (p<0,05), mostrando que o extrato aumentou a capacidade antioxidante curuba e inibida de forma satisfatória o processo oxidativo do leite de consumo em relação o alvo.
PALAVRAS-CHAVE: PassifloramollissimaB., Beber leite fermentado, Capacidade antioxidante, ORAC, TBARS.
INTRODUCCIÓN
Las especies reactivas del oxígeno (ROS) son agentes causantes de un gran número de enfermedades humanas. Los componentes antioxidantes protegen contra los nocivos radicales libres, producidos por el metabolismo aeróbico y han sido asociados, con un menor riesgo de enfermedades crónicas, brindando beneficios para la salud [1].
El creciente interés en el estudio de los compuestos antioxidantes naturales se ha visto acompañado por un aumento en el mercado, de alimentos funcionales nutracéuticos [2]. Se ha encontrado que además de las frutas y verduras, diversos productos lácteos, y fracciones obtenidas de ellos, tienen propiedades antioxidantes, como por ejemplo, la leche, leche descremada, suero de leche, caseína y lactoferrina [3].
Durante la última década, importantes estudios abrieron un nuevo campo de investigación en sustancias bioactivas o biogénicos en los alimentos, a través de los procesos de fermentación [4]. Específicamente, las bebidas fortificadas a través de la adición exógena de compuestos funcionales o del uso de microorganismos que producen compuestos biogénicos o que tienen características prebióticas, como las leches fermentadas que son las bebidas funcionales más difundidas en el mercado. La combinación de compuestos biogénicos, especialmente cuando se extrae de fuentes naturales y de bacterias ácido lácticas funcionales, puede representar una opción biotecnológicamente innovadora, para introducir en el mercado nuevas bebidas funcionales. Actualmente, las bebidas a base de frutas y productos lácteos están recibiendo una considerable atención, debido a su potencial crecimiento en los mercados, por su sabor y valor nutritivo. Además, son especialmente útiles, en lugares donde hay una nutrición inadecuada, lo que podría conducir al control de enfermedades de deficiencia nutricional [5].
Las frutas y productos derivados, como algunas bebidas, constituyen una fuente de antioxidantes naturales en la dieta humana. Las bebidas a base de frutas, poseen componentes bioactivos como el ácido ascórbico, los tocoferoles, carotenoides y polifenoles, que ejercen sus efectos antioxidantes y anticancerígenos, actuando de forma aditiva y sinérgica [6]. Las frutas contienen diversos compuestos bioactivos como las vitaminas A, C y E y compuestos fenólicos; determinantes de la actividad antioxidante [7]. La curuba (Passiflora mollissima Bailey) pertenece a la familia Pasiflorácea y ha sido muy poco estudiada. Hay muy pocos reportes sobre el valor nutricional y los compuestos bioactivos de la curuba; la cual posee mayor capacidad reductora comparada con 15 frutas colombianas, usando las técnicas FRAP y midiendo el potencial de ionización por voltametría cíclica. Algunos autores, reportan por algunas técnicas (ABTS, DPPH y FRAP) diferencias significativas entre la capacidad antioxidante de la curuba y otras frutas colombianas y ecuatorianas [8, 9, 10]. Este estudio tiene como objetivo desarrollar una bebida fermentada con suero lácteo enriquecida con cultivos probióticos (L. casei) y con la adición de extractos de curuba (Passiflora mollissima Bailey), como antioxidantes y retardadores del proceso oxidativo, durante un periodo de almacenamiento de 25 días, del producto lácteo.
MÉTODO
Elaboración de las bebidas
La mezcla de leche, suero y sacarosa se pasterizó a 85°C por 15 minutos, se enfrió y se homogenizó a 1500 psi. Se adicionó el cultivo probiótico L. casei y se incubó a 41,5°C hasta alcanzar una acidez de 0,45. Se realizaron 4 tratamientos, a los cuales se les adicionó el extracto de curuba al 0% (blanco), 0,4%, 0,6% y 0,8% p/p. Las bebidas se almacenaron a 4°C por 25 días. Los análisis se realizaron cada cinco (5) días y los efectos en el tiempo de la adición de los extractos de curuba sobre la bebida láctea, fueron estudiados mediante un diseño completamente al azar con 3 repeticiones.
Método de extracción
Para la separación de las fases hidrofílica y lipofílica, se tomaron 10 g de bebida y se le adicionaron 16 mL de una solución de diclorometano-etanol (DM-E) (2:1, v/v). La mezcla se agitó en un vortex (Touch mini vortexer, Fisher Scientific) durante 90 s y luego, se centrifugó durante 8 min (2500 x g a -4°C, Universal 320 R, Hettich). La fase acuosa superior se retiró con una pipeta y posteriormente se adicionaron 10 mL de la solución de DM-E en el tubo de ensayo. La mezcla se agitó, se centrifugó nuevamente durante 6 min (2500 x g a -4°C) y se formó un pequeño precipitado y una fase superior orgánica que contenía la grasa de la bebida. Esta última, se filtró a un matraz de fondo redondo adecuado, el diclorometano fue eliminado mediante un rotavapor (Heidolph laborota 4011 digital) y las muestras se evaporaron hasta peso constante [11].
Propiedades fisicoquímicas
Se realizaron pruebas de acidez por titulación con NaOH 0,1N, utilizando como indicador fenolftaleína (AOAC 942.15, 1996), cenizas por gravimetría en mufla a 300°C hasta peso constante, materia grasa por el método de Babcock modificado (AOAC 989.04, 1990) y proteínas por el método de Kjeldahl (NTC-4657). El contenido de ácido ascórbico se cuantificó por cromatografía líquida de alta resolución (HPLC), usando un detector UV a 245 nm, una columna C-8 y como fase móvil, ácido fórmico 0,1% [12]. Los minerales se determinaron por el método de espectrofotometría U.V. (NTC-4981) para fósforo y por espectrofotometría A. A. (NTC-5151) para calcio. La determinación de azúcares reductores se realizó por HPLC [13]. La separación de sacarosa, glucosa y fructosa se llevó a cabo en una columna Bio-Rad, utilizando como fase móvil ácido sulfúrico 5 mM. La identificación de los picos se realizó comparando con estándares de sacarosa, glucosa y fructosa.
Contenido de metabolitos antioxidantes
Determinación de fenoles totales.La determinación de fenoles se realizó por el método colorimétrico de Folin-Ciocalteu [14]. En un tubo de reacción se adicionaron 50 μL de la fase acuosa de la bebida, 425 μL de agua destilada y 125 μL del reactivo Folin-Ciocalteu. Se agitó y luego se dejó en reposo por 6 minutos. Posteriormente, se adicionaron 400 μL de Na2CO3 al 7,1%. Después de 1 hora en la oscuridad, se leyó la absorbancia a 760 nm. Se construyó una curva patrón usando como estándar ácido gálico. Los análisis se realizaron por triplicado y los resultados se expresaron como mg de ácido gálico/L solución.
Medición de la capacidad antioxidante in vitro
Actividad atrapadora del radical libre DPPH.En un tubo de ensayo, se adicionaron 10 μL de la fase acuosa de la bebida y 990 μL de una solución de DPPH. Como referencia se usó la misma cantidad de DPPH y 10 μL del solvente de la muestra (agua). Se evaluó la capacidad antioxidante por medio de la disminución en la absorbancia luego de 30 min de reacción, a una longitud de onda de 517 nm. Se calculó el porcentaje de inhibición del radical y los resultados se expresaron como valores TEAC (Trolox Equivalent Antioxidant Capacity) (μmol de trolox/L solución) mediante la construcción de una curva patrón, usando como antioxidante Trolox. Los análisis se realizaron por triplicado [15].
Método ORAC (Oxygen radical absorbance capacity). El procedimiento experimental empleó Trolox como estándar y condiciones controladas de temperatura a 37°C. El ensayo se determinó por las siguiente metodología: diluyendo el Trolox en buffer fosfato 75 mM (pH 7,4) y en agua-acetona (1:1, v/v) para ORAC-H y en β-metilciclodextrina al 7% para ORAC-L. [16, 17]. Las lecturas se realizaron a una l de excitación de 493 nm y l de emisión de 515 nm. Para el desarrollo de la técnica se prepararon 3 mL de la siguiente solución: 21 μL de una solución de fluoresceína 10 μM, 2899 μL de buffer fosfato, 50 μL de AAPH 600 mM y 30 μL de la fase acuosa/lipofílica de la bebida o Trolox 500 mM (estándar). El efecto protector del antioxidante, se calculó usando las diferencias de áreas bajo la curva de decaimiento de la fluoresceína entre el blanco y la muestra, y se comparó contra la curva del Trolox. Los resultados fueron expresados como valores TEAC (μmol de trolox/L solución) de acuerdo con la siguiente ecuación:
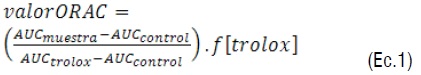
Donde AUC es el área bajo la curva y f es el factor de dilución de los extractos.
Peroxidación lipídica
Sustancias reactivas al ácido tiobarbitúrico (TBARS).La determinación del contenido de TBARS se llevó a cabo mediante el siguiente procedimiento. Los reactivos de TBA (ácido 2-tiobarbitúrico 0,67%), TCA (ácido tricloroacético 15%) y la muestra fueron mezclados, agitados y llevados a un baño de agua a 90°C. Luego de enfriarla, se le adicionó butanol. El complejo fluorescente formado fue leído en un espectrofluorímetro Perkin Elmer LS 55 a un l de excitación de 500 nm y l de emisión 550 nm. Los resultados fueron expresados como equivalentes de MDA (nmol/g de muestra) [18].
Evaluación sensorial
Se realizó una prueba triangular (ISO, 4120:2004), en un total de 36 panelistas para evaluar las diferencias significativas causadas por la adición del extracto de curuba a la bebida láctea en el día 25. Cada panelista recibió tres muestras a 4°C codificadas con tres dígitos para cada sesión, en la que dos eran el mismo tratamiento y una era diferente. El orden de presentación de las muestras fue aleatorio para cada miembro del jurado y la prueba se realizó en un cuarto iluminado por una bombilla amarilla, para ocultar diferencias visuales entre las muestras. Se les pidió a los panelistas elegir la muestra que era diferente de las otras dos. Los resultados se analizaron mediante la prueba binomial de un extremo, donde X es el número de juicios correctos y n el número total de panelistas, teniendo como criterio de significancia una p<0,05.
Análisis estadístico
Los datos fueron tratados estadísticamente realizando un análisis de varianza (ANOVA) y mínima diferencia significante (LDS), con el paquete estadístico SAS 9.2. Las regresiones lineales se realizaron en el paquete estadístico STATGRAPHICS Centurion XV. Un p<0,05 fue seleccionado como el criterio de diferencias significativas.
RESULTADOS
Propiedades fisicoquímicas
Los resultados de las determinaciones fisicoquímicas se presentan en la Cuadro 1. Los valores obtenidos de acidez y materia grasa están de acuerdo con la legislación colombiana para bebidas fermentadas, (Resolución número 02310 de 1986) 0,7% - 1,5 % ácido láctico y mín. 2,5%, respectivamente, y concuerdan con los valores obtenidos para bebidas fermentadas [19]. Los valores de cenizas no tuvieron mucha variación y coinciden con los reportados para yogurt [20]. El contenido de proteínas provienen del suero y la leche, porque no hubo ninguna variación entre los tratamientos; los resultados son superiores a los obtenidos para bebidas fermentadas [19]. En yogurescon frutas tropicales se encontraron valores de calcio superiores (1640 - 1730 mg/Kg) e inferiores para el fósforo (291 - 330 mg/Kg) en comparación con los encontrados en este estudio [20]. En general los valores de azúcares reductores encontrados no variaron mucho entre los tratamientos, sólo el valor de sacarosa del blanco es mayor y esto se debe al ajuste de sólidos solubles que se le realizó y al consumido por las bacterias. El contenido de ácido ascórbico se debe al extracto de curuba adicionado y aunque fue muy bajo, éste hecho puede atribuirse principalmente al tratamiento térmico al que fueron sometidas las bebidas y a la poca cantidad de extracto que fue adicionado; valores similar reportados para yogurt entero [21].
Contenido de metabolitos antioxidantes
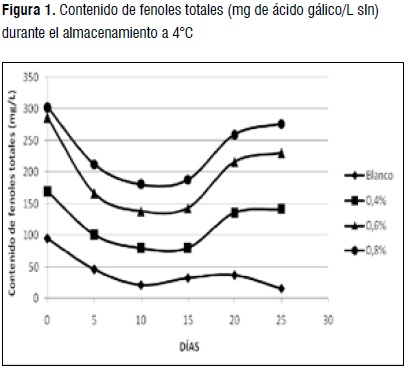
Determinación de fenoles totales. Los valores de fenoles totales variaron en un intervalo de 15,46 - 302,96 mg/L. La bebida que presentó mayor contenido de fenoles totales fue 0,8%. Aunque los valores obtenidos en este estudio, están dentro de los rangos reportados en la literatura (36 - 999 mg/L [9, 22], se esperaría un mayor contenido de fenoles debido a las conocidas propiedades antioxidantes in vitro de la leche, atribuidas a la presencia de factores antioxidantes. En este sentido, se han reportado disminuciones en el contenido de fenoles totales en bebidas lácteas ricas en polifenoles, debido a las interacciones in vitro entre los fenoles y las proteínas de la leche [23].
La Figura 1, muestra la variación de los fenoles totales durante el período de almacenamiento. El comportamiento del contenido de fenoles no fue uniforme observando una disminución inicial entre el día 0 hasta el día 10 para todos los tratamientos, siendo más significativa la disminución presentada entre los días 0 y 5 (p<0,05). El día 15 se observó un aumento de los fenoles (p<0,05) hasta el día 25 para los tratamientos que contenían extracto de curuba, mientras que en el blanco disminuyeron al final (p>0,05). Este comportamiento fue similar para procesos fermentativos [24]. El comportamiento para el blanco se debe a la degradación de las proteínas de la leche; el comportamiento para los tratamientos con el extracto de curuba puede atribuirse a que se pueden formar en el proceso proteolítico algunos aminoácidos, como la tirosina, que posee una cadena fenólica lateral; dando como resultado un aumento en la lectura del contenido de fenoles [25]. Otra posibilidad es que la utilización microbiana durante el proceso de fermentación produce acidificación en el medio y una hidrólisis de los polifenoles, que puede provocar la producción de ácidos fenólicos como el vanílico y el ácido p-hidroxibenzóico [26].
Medición de la capacidad antioxidante in vitro
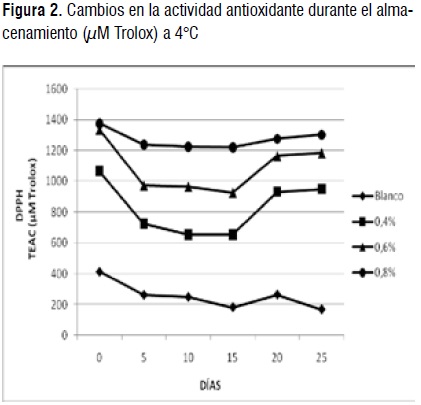
Actividad atrapadora del radical libre DPPH. Los valores obtenidos varían entre 183,23 y 1.376,46 μM Tx. Se nota un efecto de la concentración durante el proceso, el tratamiento con mayor actividad antioxidante es 0,8%, seguido de 0,6%, y 0,4%. Los valores obtenidos son similares a los encontrados en procesos fermentativos de yogures [24].
El efecto de la adición de extracto de curuba sobre la capacidad atrapadora del radical DPPH se muestra en la Figura 2. Todos los tratamientos con curuba presentaron una mayor actividad antioxidante que el blanco durante todo el período de almacenamiento. La capacidad atrapadora del radical disminuyó significativamente (p<0,05), en todos los tratamientos del día 0 al día 5, mientras que entre los días 5 y 15 la disminución fue muy leve (p>0,05). Los tratamientos 0,4%, 0,6% y 0,8% presentaron una mejoría en la capacidad antioxidante entre los días 15 y 25 siendo más pronunciada para los tratamientos 0,4% y 0,6% (p<0,05); el blanco, aunque tuvo un aumento el día 20, disminuyó su actividad antioxidante al final del tiempo de almacenamiento (p>0,05). Los resultados de la capacidad antioxidante medida por DPPH puede ser en parte, atribuidos al contenido de fenoles totales debido a que hubo una relación relativamente fuerte entre los resultados de ambos métodos (r=0,950; r2=90,31) [27, 24]. La reducción de la actividad antioxidante durante el almacenamiento entre los días 0 y 15 se puede atribuir a la creciente degradación de los compuestos fenólicos con actividad antioxidante y/o a la proteólisis de la proteína de la leche y los ácidos orgánicos [28], como resultado de la fermentación y posterior acidificación durante el almacenamiento. Por otro lado, el aumento de la actividad antioxidante para los tratamientos que contenían los extractos de curuba, puede ser atribuida a los compuestos presentes en esta fruta con alta capacidad antioxidante y a que las bacterias de la bebida láctea metabólicamente activas, incluso a baja temperatura, continúan su crecimiento microbiano durante el almacenamiento en refrigeración, alterando algunos de los compuestos fenólicos y por lo tanto, su actividad antioxidante [26].
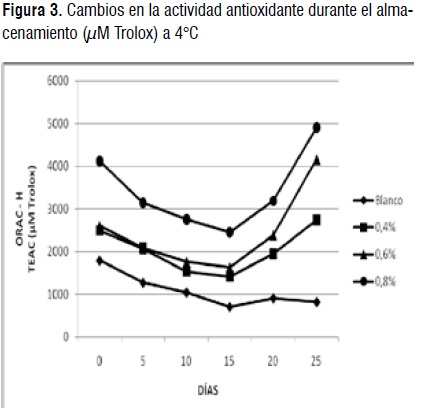
ORAC-Hidrofílico. Los valores de la actividad antioxidante varían entre 704,88 y 4910,32 μM Tx. El tratamiento 0,8% presentó el mejor potencial antioxidante al igual que en el método DPPH [27].
La Figura 3, presenta la variación de la actividad antioxidante de los tratamientos durante el tiempo de almacenamiento. Se observa una disminución en el potencial antioxidante entre los días 0 y 15 para todos los tratamientos, siendo más significativo para 0,8% (p<0,05). A partir del día 15 los tratamientos que contenían el extracto de curuba presentaron una mejoría en el potencial antioxidante, especialmente los tratamientos 0,6% y 0,8% (p<0,05) hecho que coincidió con el aumento del contenido de fenoles totales y DPPH. El blanco aumentó ligeramente entre el día 15 y 20 (p>0,05), pero disminuyó su potencial el día 25 (p>0,05). La relación entre el contenido de fenoles totales y ORAC-H fue moderadamente fuerte (r=0,889; r²=78,961), debido a que este método es extremadamente sensible y la actividad antioxidante también puede ser exhibida por compuestos no fenólicos [29].
Una disminución del potencial antioxidante puede estar relacionada con un menor contenido de compuestos fenólicos consumidos durante el proceso de protección oxidativo, mientras que el aumento, parece estar relacionado con la formación de nuevos compuestos con actividad antioxidante (que más tarde formaron los productos de reacción de Maillard, durante el almacenamiento prolongado, y los productos de hidrólisis de polifenoles y proteínas hidrosolubles); o por la fuerte tendencia de los fenoles a someterse a reacciones de polimerización, mediante el cual los oligómeros resultantes poseen grandes áreas disponibles para la deslocalización de las cargas [30, 31].
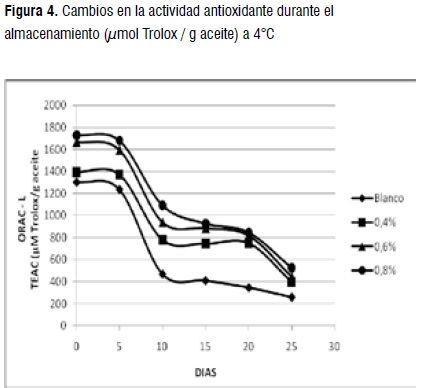
ORAC-Lipofílico. Los valores de la actividad antioxidante varían entre 258,50 y 1730,80 μmol Tx/100g. El tratamiento 0,8% como se ha observado igualmente en los métodos anteriores presentó el mejor potencial antioxidante, seguido de los tratamientos 0,6%, y 0,4%. Los valores encontrados están de acuerdo con los reportados para algunas frutas y hortalizas [32].
La figura 4 muestra la disminución de la actividad antioxidante durante el tiempo de almacenamiento. Todos los tratamientos que contenían el extracto de curuba siguieron la misma tendencia de disminución, siendo significativa la presentada entre los días 5 a 10 y 20 a 25 (p<0,05). La disminución del blanco fue mayor a partir del día 5 (p<0,05), lo que muestra una protección de la fase lipofílica por parte del extracto de curuba. Como se sabe, la capacidad antioxidante de un alimento proviene de la acción sinérgica combinada de una mezcla de compuestos, incluyendo compuestos fenólicos, carotenoides, vitaminas C y E, entre otros. Se ha encontrado que el ORAC-L de las frutas es considerablemente más bajo que el ORAC-H, debido a la baja cantidad de antioxidantes lipofílicos presentes en ellas en comparación con los hidrofílicos, a esto se puede atribuir la acentuada disminución observada del potencial antioxidante y al consumo de estos durante los primeros días del almacenamiento [33].
Peroxidación lipídica
Sustancias reactivas al ácido tiobarbitúrico (TBARS). Los valores obtenidos varían entre 2,39 y 31,08 (nmol MDA/g). Durante el período de almacenamiento, el tratamiento que presentó una mayor cantidad de TBARS fue 0,4%, seguido por 0,6% y finalmente 0,8%, que exhibió un mayor efecto protector en relación con el blanco. La Figura 5 muestra el desarrollo de la oxidación lipídica del aceite extraído de las bebidas en el tiempo. Al inicio del período de almacenamiento (días 0 y 10), los incrementos en la oxidación no son muy relevantes (p>0,05), pero a partir del día 10 se inicia la oxidación, principalmente, del blanco (p<0,05) hasta el día 25 donde el blanco y el tratamiento 0,4%, presentaron los mayores incrementos (p<0,05). Se reportó un comportamiento similar en yogures almacenados durante 28 días [34].
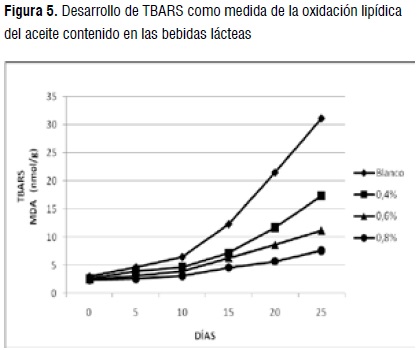
El comienzo de la oxidación puede ser atribuido a que durante el tratamiento térmico de la leche se puede inducir la formación de radicales alquilo, lo que favorece el inicio del proceso de oxidación [35]. Sin embargo, es razonable pensar que este fenómeno, si sucedió, no fue tan importante debido a que el tratamiento térmico no fue muy severo. Considerando que los valores más altos de TBARS se observan al final del tiempo de almacenamiento, que la magnitud de este aumento es pequeña y que las condiciones de almacenamiento de las muestras fueron favorables, es probable que el aumento de TBARS no esté directamente relacionado con un aumento sólo de MDA y por tanto, de la oxidación lipídica. Aparte del MDA que se deriva exclusivamente de hidroperóxidos, otras sustancias como diversos aldehídos obtenidos por diferentes vías de oxidación pueden reaccionar con el TBA [36] y dar como resultado un aumento en la lectura de TBARS. Los resultados obtenidos en esta prueba para los tratamientos que contienen los extractos de curuba revelan el efecto protector de esta fruta sobre el aceite y por tanto, su inhibición en la producción de compuestos de oxidación que deterioran la calidad de las bebidas lácteas.
Evaluación sensorial
Los resultados obtenidos mostraron que a concentraciones de 0,4% y 0,6% p/p, las bebidas no presentaban cambios significativos durante su almacenamiento (p>0,05), caso contrario pasó con la concentración de 0,8% p/p, donde 22 panelistas identificaron la muestra diferente (p<0,05) sin manifestar rechazo hacia la bebida. Teniendo en cuenta que la legislación colombiana tiene como periodo de vida útil de este producto, 15 días (Resolución 02319/1986) y las marcas comerciales tienen 21 días en promedio, a bajas concentraciones (0,4% y 0,6% p/p), el extracto de curuba no solo presenta un efecto protector sino que puede prolongar la vida útil del producto, manteniendo características deseadas por los consumidores.
CONCLUSIONES
Los extractos acuosos de curuba retardan el proceso oxidativo de bebidas lácteas convirtiéndolas en una buena alternativa nutracéutica. La curuba, es un aditivo natural que aporta un sabor nuevo y agradable, además de presentar múltiples beneficios a la salud humana, debido a su contenido de vitaminas, minerales y propiedades antioxidantes que retrasa eficientemente el proceso oxidativo de la bebida fermentada, manteniendo sus características organolépticas por un período de tiempo más extenso que en ausencia del extracto. La bebida láctea con una adición del 0,8% p/p de extracto de curuba presentó los mejores resultados al permanecer estable a la oxidación lipídica y proteica durante un periodo de 20 días a una temperatura de 4ºC.
REFERENCIAS
[1] KNEKT, P., KUMPULAINEN, J., JARVINEN, R., RISSANEN, H., HELIOVAARA, M., REUNANEN, A. HAKULINEN, T. and AROMAA, A. Flavonoid intake and risk of chronic diseases. American Journal of Clinical Nutrition, 76 (3), 2002, p. 560-568. [ Links ]
[2] ANDLAUER, W. and FÜRST, P. Nutraceuticals: a piece of history, present status and outlook. Food Research International, 35, 2002, p. 171-176. [ Links ]
[3] CALLIGARIS, S., MANZOCCO, L., ANESE, M. and NICOLI, M.C. Effect of heat-treatment on the antioxidant and pro-oxidant activity of milk. International Dairy Journal, 14, 2004, p. 421-427. [ Links ]
[4] GOBBETTI, M., Di CAGNO, R. and De ANGELIS, M. Functional microorganisms for functional food quality. CRC Critical Review Food Science Nutrition, 50 (8), 2010, p. 716-727. [ Links ]
[5] ZULUETA, A., ESTEVE, M.J., FRASQUET, I. and FRIGOLA, A. Vitamin C, vitamin A, phenolic compounds and total antioxidant capacity of new fruit juice and skim milk mixture beverages marketed in Spain. Food Chemistry, 103 (4), 2007, p. 1365-1374. [ Links ]
[6] LIU, R.H. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals. American Journal of Clinical Nutrition, 78 (3), 2003, p. 517S-520S. [ Links ]
[7] SÁNCHEZ-MORENO, C., PLAZA, L., De ANCOS, B. and CANO, P. Nutritional characterization of commercial traditional pasteurized tomato juices: carotenoids, vitamin C and radical-scavenging capacity. Food Chemistry, 98 (4), 2006, p. 749-756 [ Links ]
[8] BOTERO, M., RICAURTE, S., MONSALVE, C Y ROJANO, B. Capacidad reductora de 15 frutas tropicales. Scientia et Technica Año XIII, 33, 2007, p. 295-296. [ Links ]
[9] VASCO, C., RUALES, J. and KAMAL-ELDIN, A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chemistry, 111 (4), 2008, p. 816-823. [ Links ]
[10] CONTRERAS-CALDERÓN, J., CALDERÓN-JAIMES, L., GUERRA-HERNÁNDEZ, E. and GARCÍA-VILLANOVA, B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food Research International, 44 (7), 2011, p. 2047-2053. [ Links ]
[11] STEFANOV, I., VLAEMINCK, B. and FIEVEZ, V. A novel procedure for routine milk fat extraction based on dichloromethane. Journal of Food Composition and Analysis, 23 (8), 2010, p. 852-855. [ Links ]
[12] RIZZOLO, A. and BRAMBILLA, A. Evaluation of sampling and extraction procedures for the analysis of ascorbic acid from pear fruit tissue. Food Chemistry, 77 (2), 2002, p. 257-262. [ Links ]
[13] DÍAZ, H.F. Determinación de sacarosa, glucosa y fructosa en jugo de caña de azúcar por HPLC. Revista Industrial y Agrícola de Tucumán, 69 (1-2), 1992, p. 87-92. [ Links ]
[14] SINGLETON, V.L. and ROSSI, J.A. Colorimetry of totalphenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture, 16 (1), 1965, p. 144-158. [ Links ]
[15] ROJANO, B., GAVIRIA, C., GIL, M., SAEZ, J., SCHINELLA, G. y TOURNIER, H. Actividad antioxidante del isoespintanol en diferentes medios. Vitae, 15 (1), 2008, p. 173-181. [ Links ]
[16] OU, B., HAMPSCH-WOODILL, M. and PRIOR, R.L. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. Journal of Agricultural and Food Chemistry, 49 (10), 2001, p. 4619-4626. [ Links ]
[17] WU, X., GU, L., HOLDEN, J., HAYTOWITZ, D.B., GEBHARDT, S.E., BEECHER, G. and PRIOR, R.L. Development of a database for total antioxidant capacity in foods: a preliminary study. Journal of Food Composition and Analysis, 17 (3-4), 2004, p. 407-422. [ Links ]
[18] STERN, S., POTTER, T. and NEUN, B. HEP G2 hepatocyte lipid peroxidation assay. Nanotechnology characterization laboratory. National Cancer Institute at Frederick. SAIC-Frederick, Inc. NCL Method GTA-4, 2006, Version 1.0. [ Links ]
[19] LONDOÑO-URIBE, M.M. Bebida fermentada de suero con cultivo Lactobacillus casei [M.Sc. Tesis Ciencia y Tecnología de los Alimentos]. Habana (Cuba): Universidad de la Habana, Instituto de Farmacia y Alimentos, 2007, 37-41 p. [ Links ]
[20] BLANCO, S.C., PACHECO-DELAHAYE, E. y FRÁGENAS, N. Evaluación física y nutricional de un yogurt con frutas tropicales bajo en calorías. Revista Facultad de Agronomía, 32, 2006, p. 131-144. [ Links ]
[21] WALSTRA, P. Ciencia de la leche y tecnología de los productos lácteos. 1 ed. Zaragoza (España): Acribia, c2001, 60-300 p. [ Links ]
[22] SALAMANCA G., OSORIO, M.P. y MONTOYA, L.M. Elaboración de una bebida funcional de alto valor biológico a base de borojo (Borojoa patinoi Cuatrec). Revista Chilena de Nutrición, Marzo 37 (1), 2010, p. 87-96. [ Links ]
[23] DUPAS, C.J., MARSSET-BAGLIERI, A.C., ORDONAUD, C.S., DUCEPT, F.M. and MAILLARD, M.N. Coffee antioxidant properties: effects of milk addition and processing conditions. Journal of Food Science, 71 (3), 2006, p. 253-258. [ Links ]
[24] AMIRDIVANI, S. and BABA, A.S. Changes in yogurt fermentation characteristics, and antioxidant potential and in vitro inhibition of angiotensin-1 converting enzyme upon the inclusion of peppermint. LWT - Food Science and Technology, 44, 2011, p. 1458-1464. [ Links ]
[25] SHAH, N.P. Effect of milk-derived bioactives: an overview. British Journal of Nutrition, 84 (Suppl. 1), 2000, p. 3-10. [ Links ]
[26] BLUM, U. Effects of microbial utilization of phenolic acids and their phenolic acid breakdown products on allelpathic interactions. Journal of Chemical Ecology, 24 (4), 1998, p. 685-708. [ Links ]
[27] CILLA, A., PERALES, S., LAGARDA, M.J., BARBERÁ, R., CLEMENTE, G. and FARRE, R. Influence of storage and in vitro gastrointestinal digestion on total antioxidant capacity of fruit beverages. Journal of Food Composition and Analysis, 24 (1), 2011, p. 87-94. [ Links ]
[28] CORREIA, I., NUNES, A., DUARTE, I.F., BARROS, A. and ELGADILLO, I. Sorghum fermentation followed by spectroscopic techniques. Food Chemistry, 90 (4), 2005, p. 853-859. [ Links ]
[29] MACDONALD-WICKS, L.K., WOOD, L.G. and GARG, M.L. Methodology for the determination of biological antioxidant capacity in vitro: a review. Journal of the Science of Food and Agriculture, 86 (13), 2006, p. 2046-2056. [ Links ]
[30] KLIMCZAK, I., MALECKA, M., SZLACHTA, M. and GLISZCZYNSKA-SWIGLO, A. Effect of storage on the content of polyphenols, vitamin C and the antioxidant activity of orange juices. Journal of Food Composition and Analysis, 20 (3-4), 2007, p. 313-322. [ Links ]
[31] PINELO, M., MANZOCCO, L., NÚÑEZ, M.J. and NICOLI, M.C. Interaction among phenols in food fortification: negative synergism on antioxidant capacity. Journal of Agricultural and Food Chemistry, 52, 2004, p. 1177-1180. [ Links ]
[32] BLASA, M., GENNARI, L., ANGELINO, D. and NINFALI, P. En: Bioactive foods in promoting health. Fruit and vegetable antioxidants in health. 1 ed. San Diego (USA): Academic Press, 2010, p. 37-58. [ Links ]
[33] RAUTENBACH, F. and VENTER, I. Hydrophilic and lipophilic antioxidant capacity of commonly consumed South African fruits, vegetables, grains, legumes, fats/oils and beverages. Journal of Food Composition and Analysis, 23 (7), 2010, p. 753-761. [ Links ]
[34] SERRA, M., TRUJILLO, A.J., GUAMIS, B. and FERRAGUT, V. Flavour profile and survival of starter cultures of yogurt produced from high-pressure homogenized milk. International Dairy Journal, 19 (2), 2009, p. 100-106. [ Links ]
[35] O'BRIEN, N.M. and O'CONNOR, T.P. En: Lipid Oxidation. Encyclopedia of Dairy Science. 1 ed. London (England): Academic Press, 2002, p. 1600-1604. [ Links ]
[36] SUN, Q., FAUSTMAN, C., SENECAL, A., WILKINSON, A. L. and FURR, H. Aldehyde reactivity with 2-thiobarbituric acid and TBARS in freeze-dried beef during accelerated storage. Meat Science, 57(1), 2001, p. 55-60. [ Links ]













