Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.11 no.1 Popayán Jan./June 2013
INTERACCIÓN MACROFAUNA-MICROBIOTA: EFECTOS DE LA TRANSFORMACIÓN DE RESIDUOS DE COSECHA SOBRE LA ACTIVIDAD DE ß-GLUCOSIDASA EDÁFICA
MACROFAUNA-MICROBIOTA INTERACTION: CROP RESIDUE TRANSFORMATION EFFECTS ON THE EDAPHIC ß-GLUCOSIDASE ACTIVITY
INTERAÇÃO MACROFAUNA-MICROBIOTA: EFEITOS DA TRANSFORMAÇÃO DOS RESÍDUOS DE COLHEITA SOBRE A ATIVIDADE DA ß-GLUCOSIDASE EDÁFICA
1Ph.D. Grupo SISINPRO. Departamento de Ciencias Agropecuarias. Universidad del Cauca.
2Ph.D. Grupo MACORA. Departamento de Ingeniería. Universidad Nacional de Colombia, Sede Palmira.
Correspondencia:rmadrinanm@palmira.unal.edu.co
Recibido para evaluación: 06/10/2012. Aprobado para publicación: 26/03/2013.
RESUMEN
La interacción macroinvertebrados-microorganismos-biomasa vegetal es un eje fundamental en el ciclaje del carbono. En algunos agroecosistemasresultan abundantesresiduos de cosecha que frecuentemente son incinerados, como sucede en la caña de azúcar en Colombia. Se estudió la transformación de residuos de cosecha a través de la interacción entre ensamblajes de poblaciones de larvas de escarabajos y poblaciones de microorganismospropiciadas por los mencionados macroinvertebrados, considerando la cantidad consumida y evaluando la actividad de β-glucosidasa resultante en el suelo. De ésta, se registraron diferencias significativas en los tratamientos aplicados, evidenciándose que son precisamentedos especies selectas de Oryctini(Coleoptera: Scarabaeoidea), históricamente catalogados como plagas, las que a través de su interacción sinérgica con la microbiota edáfica, propician altos niveles de actividad de ß-glucosidasa. Los resultados indican que el escarabajo rinoceronte, Podischnusagenor Oliver, además de ser el mayor consumidor de residuos de cosecha, aporta positivamente al cultivo de la caña de azúcar, toda vez que no se le restrinja el acceso a material que satisfaga sus requerimientos alimentarios. El escarabajo torito, StrategusaloeusLinné, en asocio con P. agenor presentó un comportamiento similar.
PALABRAS CLAVE: Descomposición, Dynastinae, Celulasa, Caña Azucarera.
ABSTRACT
In soils, the macro invertebrate-microorganism-biomass interaction is a fundamental axis for carbon cycling. Sugarcane is a major biomass-producing, abundant crop residues are left on the field. These crop residues are frequently burned before harvesting in Colombia. This work studied the sugar cane residues transformation by scarab larvae and microorganisms interactions, taking account of the β-glucosidase activity. The crop residues consumption by population assemblages of three Dynastinae scarab species was evaluated. Significative differences in β-glucosidase activity were found betweenthe population assemblages and respecting the control treatment. It was shown that precisely two Oryctini (Coleoptera: Scarabaeoidea) species, historically regarded as pests, are the ones whichthrough their synergic interaction with the edaphic microbiota, led to high ß-glucosidaselevels in soils. Results indicate that the rhinoceros beetle Podischnusagenor Oliver is the major litter consumer and positively contributes to sugar cane crops, as far as its feeding requirements are not restricted by pre-harvest burning.StrategusaloeusLinné, in association with P. agenor displayed a similar behaving.
KEYWORDS: Decomposition, Dynastinae,Cellulase, Sugar Cane.
RESUMO
A interação macroinvertebrados-microorganismos-biomassa vegetal é um eixo fundamental na ciclagem do carbono. Em alguns agroecosistemas se geram abundantes resíduos de colheita, que freqüentemente são incinerados, como é o caso da cana de açúcar na Colômbia. Examinou-se a transformação dos resíduos de colheita mediante a interação entre ensambladuras de poblações de larvas de besouros e poblações de microorganismos, as quais são propiciadas pelos citados macroinvertebrados, para considerar a quantidade consumida e avaliar a atividade da β-glucosidase que fica no solo. Registraram-se diferenças significativas da atividade da β-glucosidase nos tratamentos aplicados. Evidenciou-se que precisamente são duas espécies seitas de Oryctini (Coleoptera: Scarabaeoidea), historicamente catalogadas como plagas, as quais propiciam altos níveis da atividade da ß-glucosidase mediante sua interação sinérgica com a microbiota edáfica. Os resultados indicam que o besouro rinoceronte, Podischnusagenor Oliver, além de ser o maior consumidor dos resíduos de colheita, tem faces positivas no cultivo da cana de açúcar, toda vez que não se limiteseuaceso ao material que satisfaça seus requerimentos alimentícios.StrategusaloeusLinné em asociação com P. Agenor presenteou um comportamento similar.
PALAVRAS CHAVE: Decomposição, Dynastinae,Celulasa, Cana-Açúcar.
INTRODUCCIÓN
En cultivos como la caña de azúcar en Colombia continuamente se generan considerables cantidades de fitomasa, que son objeto de manejo inadecuado como la incineración. En consecuencia, grandes cantidades de CO2 son liberadas a la atmósfera, pudiendo, de manera alterna, incorporarse compuestos de carbono al suelo, preservando la productividad del agroecosistema en el largo plazo.
Con el avance de la ciencia ganamos conciencia de que el suelo es el escenario de procesos decisivos de los ciclos de nutrientes como el carbono, el nitrógeno, el fósforo, entre otros. Una opción económicamente factible de fomentar la captura de carbono por el suelo está en favorecer procesos naturales que permitan la transformación oportuna de los residuos de los cultivos y su incorporación al suelo. Un proceso estrechamente asociado a esto es el de la descomposición, donde la biota del suelo, en forma secuencial, transforma física y bioquímicamente los residuos orgánicos (vegetales, animales, microbianos) para satisfacer su sustento [1, 2], propiciando a la vez el reciclaje de nutrientes [3]; y dando lugar al almacenamiento de compuestos orgánicos estables como el humus [4].
Las actividades de alimentación de la macrofauna edáfica influyen significativamente sobre la estabilidad y la transformación de residuos y de la materia orgánica del suelo; pudiendo modificar dicho entorno [5]. Así, la macrofauna edáfica fragmenta los residuos vegetales y los mezcla con el suelo, incrementando su superficie en un factor de 50 a 200, facilitando la colonización por microorganismos saprófitos [6].
Los insectos masticadores mezclan los alimentos con su saliva antes de la ingesta. En casos especiales, las enzimas presentes en la saliva son expulsadas del cuerpo y vertidas sobre el alimento antes de la ingesta, dando inicio a una digestión de efecto al menos parcial, conocida como rumen externo [7].
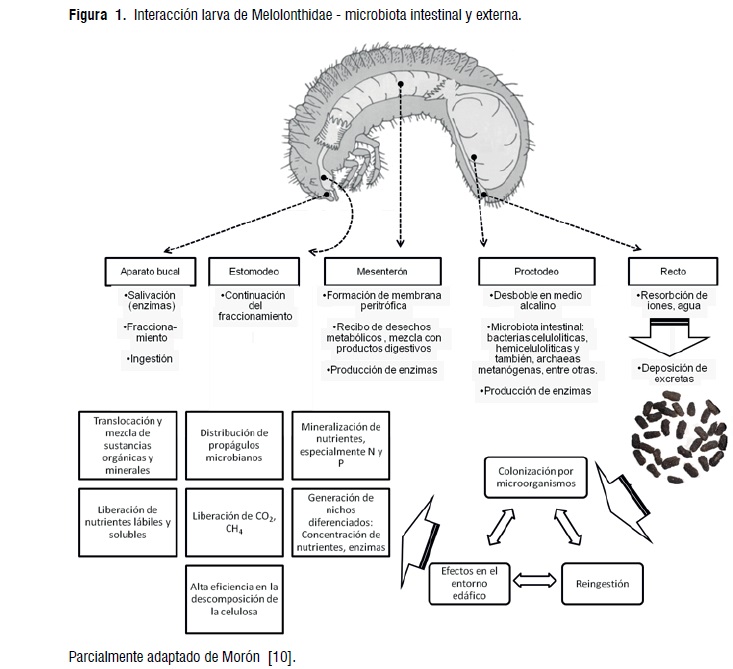
En los Scarabaeidae larvales, el fraccionamiento y parte del almacenamiento de los alimentos consumidos se llevan a cabo en el estomodeo, mientras que la mayor parte de las enzimas son secretadas al mesenteron, donde realmente se concentran la digestión y la absorción de los nutrientes [8],(Figura 1).
Los materiales remanentes son transportados al proctodeo, que está protegido por una delgada capa cuticular, provista de engrosamientos epiteliales [11], y es ensanchado en muchas larvas xilófagas, detritívoras y humívoras, en especial en los escarabajos. Los intestinos de las larvas están habitados entre otras por bacterias celulolíticas, hemicelulolíticas y también, archaeas metanógenas [12]. La participación de microorganismos intestinales en el desdoble enzimático de los constituyentes poliméricos se ha comprobadoen el mesenteron, el proctodeo y en la hemolinfa de larvas de Dynastinae [13] y de Cetoniinae [14]. Se difiere entre una producción directa de enzimas para la procura de los nutrientes sin la mediación de otros organismos; y una indirecta, resultante del mutualismo con los microorganismos intestinales [15], en algunas especies de insectos edafícolas.
Luego de la deposición, las heces quedan sometidas a incubación durante algunos días, suele haber reingestión de los pellets por parte de los artrópodos edafícolas para absorber los compuestos liberados por los microorganismos y, ocasionalmente, parte de la biomasa microbiana [1]. La rápida colonización del material recientemente excretado por parte de una asociación de microorganismos, hace parte del rumen externo. Los microorganismos inician la digestión de celulosa, donde también la coprofagia constituye una fuente importante de enzimas y de metabolitos, posibilitando una eficiente utilización de los alimentos [11].
Parte del material orgánico más recalcitrante de los pellets, esseparado de los nutrientes lábiles e integrado a estructuras compactas como los agregados órgano-minerales, quedando así resistente a un posterior desdoble en el suelo. Luego de la defecación, los demás nutrientes remanentes pueden soportar un ataque microbiano breve pero intenso, y la actividad microbiana en ellos decrece en el largo plazo [16] y en la medida que los nutrientes lábilesson consumidos.
Los residuos de cosecha de caña con cosecha en verde pueden albergar larvas de varias especies de escarabajos. Su presencia allí reduce la pérdida de humedad y la relación C : N, indicando que el mecanismo de alimentación de estos insectos induce una mayor actividad microbiana y acelerala descomposición de los residuos vegetales [17]. Aspectos relevantes de las especies de macroinvertebrados del mencionado agroecosistema fueron discutidos en Pardo-Locarnoet al. [18].
Las tres especies de escarabajos utilizadas en el presente trabajo, comunes en agroecosistemascomo el estudiado, habían sido seleccionadas en una fase previa a este trabajo y con base en Pardo-Locarno [19].Pertenecen a la subfamilia Dynastinae, dos de ellas particularmente a la tribu Oryctini, Strategusaloeus y Podischnusagenor, anteriormente reportadas como plagas en varias especies de palmáceas y en caña de azúcar [20]. Las larvas detercera especie, perteneciente a la tribu Cyclocephalini, son saprófagas y se alimentan con materia orgánica del suelo; y no se comprobó que causen perjuicio a las raíces de las plantas cultivadas [21].
En el presente trabajo se recurre al estudio de la actividad de la ß-glucosidasa puesto que su cualidad de enzima hidrolítica la convierte en índice de calidad del suelo y que al parecer, los organismos saprófitos son los mayores contribuyentes a su actividad [22]. La motivación de este estudio se fundamenta en el hecho de que los microorganismos endosimbióticos de varios macroinvertebrados edafícolas producen exoenzimasdegradadoras de celulosa y de compuestos fenólicos [23]; y que el desdoble enzimático de los polímeros de residuos vegetales es un paso decisivo de la digestión de dichos organismos [24]. En su presencia, los productos primarios de la hidrólisis son fermentados antes de que puedan ser absorbidos por el hospedero [24].
La descomposición microbiana de la celulosa es secuencialmente mediada por al menos 3 tipos de enzimas [25], entre ellas la ß-1,4-glucosidasa para obtener glucosa, fuente esencial de energía para los microorganismos [26]. La importancia de la ß-glucosidasa reside también en que cataliza un paso limitante de la degradación de materiales celulósicos al remover celobiosa, que ejerce efectos inhibitorios [27]. Así, la ß-glucosidasa es el factor que determina la descomposición de los carbohidratos en los suelos [28, 29].
El objetivo general del presente trabajo fue estudiar el aporte de escarabajos saproxilófagos a la transformación de la hojarasca de caña de azúcar y su impacto en algunos aspectos biológicos en el suelo. Para esto, fue necesario (i) cuantificar el consumo de residuos por parte de poblaciones de las larvas durante un ciclo del cultivo; y (ii) evaluar el impacto indirecto de las larvas sobre los productos resultantes de la descomposición a lo largo de un ciclo productivo del cultivo, con base en la actividad de la ß-glucosidasa.
Este estudio se realizó teniendo presente que las actividades enzimáticas solas, pueden ser insuficientes para describir el proceso de descomposición [30]. Estudios realizados en el marco de esta investigación y que resuelven este aspecto, se discutirán en otras publicaciones.
MÉTODO
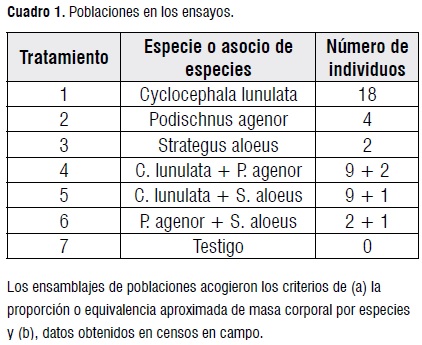
Las poblaciones de trabajo, larvas de 3 especies de escarabajos, secriaron enlaboratorio. El criterio para su selección fue el del predominio entre las especies saprófagas en la Reserva Natural El Hatico (R. N. El Hatico), constatado en el presente trabajo y reportado por Pardo-Locarno [19]. Estudiados los ciclos de vida de las especies [31], se ensamblaron poblaciones de larvas considerando experiencias de otras investigaciones [32, 33].
La crianza de los escarabajos y la ejecución de tres ensayos bajo condiciones controladas con diferentes duraciones (90, 180 y 360 días), tuvieron lugar en un laboratorio privado en Obando, municipio de Palmira. De manera paralela se condujo un ensayo de campo de 360 días en la R. N. El Hatico, en el municipio de El Cerrito, Valle del Cauca, donde se realiza manejo agroecológico, cultivando caña de azúcar con cosecha en verde. Resultan cerca de 60 Ton.Ha-1 de hojarasca por cosecha. El suelo es unhaplustollpáchicofrancoso fino.
Los ensayos de laboratorio y de campo de 360 días se realizaron simultáneamente con un ciclo productivo de caña a partir de marzo del 2008; el ensayo de laboratorio de 180 días inició en diciembre de 2008 y el de 90 días en marzo del 2009.No se manejó un ensayo de laboratorio unitario con muestreos sucesivos a lo largo del tiempo por motivos técnicos.
Las unidades experimentales en laboratorio fueron 84 microcosmos, consistentes en recipientes plásticos de 20 lcon perforaciones laterales de 3,5 mm para un adecuado intercambio de gases. En campo se utilizaron agrupaciones de tres mesocosmos del mismo tipo, provistos de cuatro ventanas aseguradas con angeo metálico galvanizado, dos laterales de 8 x 25 cm, y respectivamente una basal y apical de 22 cm de diámetro, posibilitando efectos del entorno: en los 96 mesocosmos, el único factor controlado sería la presencia de larvas de escarabajos seleccionadas.
Dentro de los recipientes se colocó una capa de suelde 10 cm de espesor, tomado de los sitios de ensayo y libre de escarabajos en cualquier estado de desarrollo. Encima se colocó una cantidad de residuos de caña previamente establecida. Los recipientes fueron tapados y resguardados en sus respectivas ubicaciones en laboratorio y en campo.
Se aplicaron siete tratamientos: seis ensamblajes poblacionales de larvas de tercer instar, tres de especies individuales de Dynastinae y tres combinaciones de dos especies; lo mismo que un tratamiento testigo carente de larvas de escarabajos (Cuadro 1).
El diseño experimental en laboratorio fue completamente al azar con tres réplicas; en campo fue de cuatro bloques completos al azar.
Mensualmente se sustituyeron pérdidas de larvas por micosis y por depredación. En laboratorio, se rotó semanalmente la ubicación de los microcosmos en los anaqueles y se restableció la humedad. En campo no se manejó la humedad. En ambos espacios se reabasteció hojarascasegún necesidad, y se tomaron medidas sanitarias contraenemigos naturales de las larvas de Dynastinae.
Evaluación del consumo de hojarasca. Finalizados los respectivos ensayos, se retiraron los residuos remanentes, incluyendo las partículas fragmentadas y se cuantificó por cada recipiente para restarlo de la cantidad inicial de hojarasca, y registrar así la respectiva cantidad consumida.
Obtención de muestras de los ensayos. Se extrajeron6núcleos de cada recipiente con un sacabocados. Las muestras de las ternas de mesocosmos se unieron para luego empacarlas, al igual que las muestras de los microcosmos, en bolsas de polietileno. Se remitieron a los laboratorios de la Universidad Nacional de Colombia, del Centro Internacional de Agricultura Tropical CIAT y de la División de Ecología del Suelo de la Universidad de Göttingen en Alemania, a temperatura ambiente, de acuerdo con DeForest [34]. Las muestras fueron tamizadas a 2 mm antes de iniciar los estudios enzimológicos.
Estimación de la actividad de la ß-glucosidasa. Se aplicó el método fluorimétrico computarizado, utilizando microplacas, como lo propusieron Marx et al. [35]. El protocolo implica la mezcla de la muestra con un búfer, lo mismo que la utilización de sustratos de referencia [34]y de sustratos modelo conjugados con la 4-metil-umbeliferona (MUB ), en nuestro caso, el 4-MUB-ß-D-glucopiranósido [36]. A la metodología se le realizó una adaptación específica en cuanto a la concentración de las soluciones estándar de trabajo, acogiendoa DeForest [34], pero reduciendo la incubación a 30 minutos.
Las muestras se suspendieron en 20 ml de agua destilada a razón de 0,5 g y se mantuvieron continuamente a 4 °C, en un vial Falcon de 50 ml. Antes de la preparación de las microplacas, se trataron con ultrasonido (Dr. Hielscher UP 200 S, Alemania) aplicando 50 Joul.s−1 por 120 s, manteniendo refrigeración.
Las muestras se agitaron permanentemente a 160 RPM (Agitador Merck HS 500), y antes de retirar alícuotas de 10 µl para colocarlas en la respectiva fosa de la microplaca, se agitó nuevamente durante 5 s con un vortexer a velocidad media.
Cada placa incluyó20 muestras con 4 réplicas (10 µl de suspensión), 100 µl de 4-MUB-D-glucopiranósido y 90 µl de búfer MES [36], obteniendo una concentración 500 µM de sustrato en cada fosa. En una de las dos columnas restantes en la microplaca se ubicaron 10 µl de suspensión de la muestra, formando una escala de incremento de 0 - 70 µl de la solución de trabajo de 4-MUB, y la cantidad del búfer necesaria para completar 200 µl por fosa; obteniendo concentraciones de 0, 50, 100, 150, 200, 250, 300 y 350 nM de la solución estándar; en la otra columna se ubicó la escala de incremento de sustrato estándar de control, completando con búfer a 200 µl.
Las lecturas de fluorescencia se realizaron con un fluorímetro de microplacas (Infinite M200, Tecan), luego de 5 segundos de agitación para homogeneizar el medio de reacción. Los datos de las lecturas de fluorescencia relativa fueron registrados mediante hoja electrónica, se ajustó una línea de regresión a los datos y se calculó el incremento de la tasa de fluorescencia para cada fosa.
Los datos resultantes fueron: (1) valores absolutos de las respectivas lecturas de fluorescencia de los 96 hoyos de los 35 ciclos de lectura considerados (unidades relativas de fluorescencia), utilizados para graficar las curvas estándar; y (2) tasas de incremento de fluorescencia (unidades relativas de fluorescencia producidas por minuto), convertidas a nmol 4-MUB min−1gMS−1.
Para el procesamiento de los datos, se estableció una curva de calibración que permitió comparar las diferentes muestras, los datos resultantes (en unidades relativas de fluorescencia min−1) se convirtieron en nmol de 4-MUB gMS−1 min−1 de acuerdo con el estándar representativo.
Finalmente se estimaron las actividades enzimáticas con base en el cálculo del incremento de la fluorescencia relativa, obteniendo el número de nmol de MUB hidrolizados, dividido por el número de minutos. Se promediaron los datos de las réplicas y se les calculó su correspondencia a 1 g de muestra en masa seca.
RESULTADOS
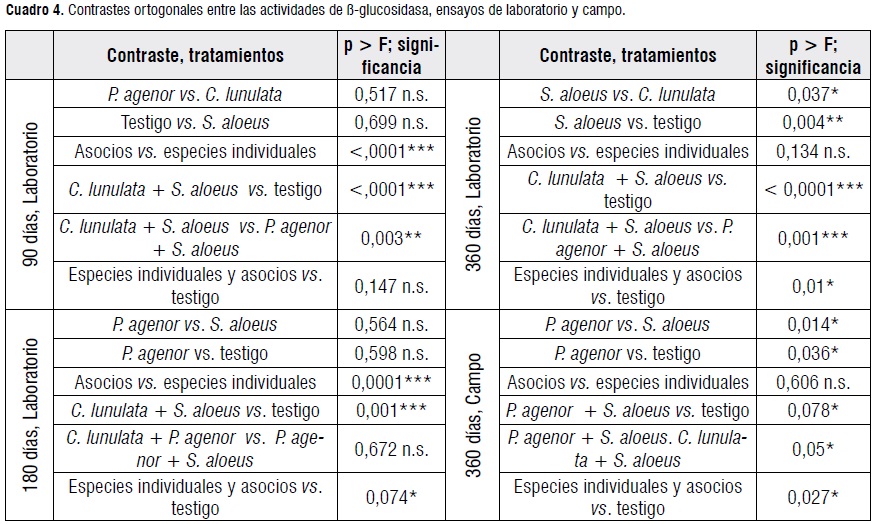
Análisis de datos. Se llevó a cabo un análisis de varianza utilizando el respectivo parámetro independiente como variable cuantitativa, aplicando para el ensayo en laboratorio procedimiento ANOVA del sistema SAS®; para el ensayo de campo fue necesario aplicar el procedimiento GLM del sistema SAS®. Al procedimiento ANOVA y al GLM con la suma de cuadrados de tipo III, les sucedió un análisis de contrastes ortogonales. Se estableció significativo el nivel α = 0,1, pretendiendo reducir el error tipo II, teniendo en cuenta la dificultad de controlar las variables ajenas al modelo.
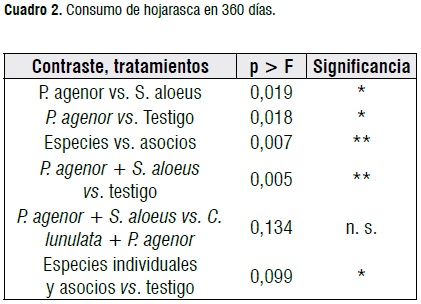
Consumo de residuos de cosecha. El consumo de hojarasca de caña en los tratamientos aplicados únicamente se evaluó en el ensayo de laboratorio de 360 días y hubo diferencias significativas en los contrastes ortogonales (Cuadro 2). Las desviaciones de la media de los valores oscilaron entre 150,83 g en el testigo y 37,93 g en C. lunulata + P. agenor. En campo no se realizó el registro de consumo de residuos debido a pérdida de datos asociados a decesos de larvas en varias unidades experimentales.
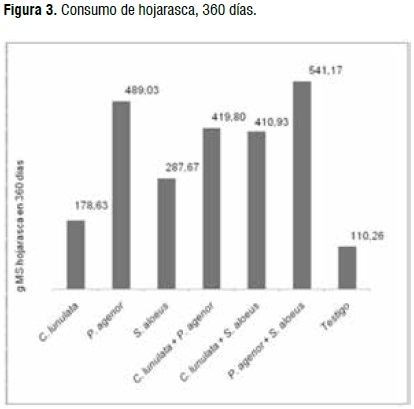
El mayor consumo se presentó en el asocio de P. agenor + S. aloeus, con un promedio de 541,17 g MS de residuos de cosecha. En orden decreciente le siguieron P. agenor como especie individual y el asocio C. lunulata + P. agenor (Figura 3).
Los registros demuestran el alto grado de adaptación de P. agenor a los residuos de caña de azúcar como alimento, al contrastar de manera significativa con S. aloeus. El asocio de P. agenor con las otras dos especies evaluadas genera un consumo superior al de las otras dos especies actuando individualmente. Desde una perspectiva ecológica, la intervención de los Dynastinae evaluados en los tratamientos, es significativa al contrastarla con el testigo (Cuadro 2); teniendo importancia el factor de los asocios.
El menor consumo de hojarasca se registró en C. lunulata, indicando que recurre a alimentos diferentes a los ofrecidos en el ensayo: material en estado de transformación más avanzado, manifestando su condición saprófaga [37].
Actividades enzimáticas. El sustrato utilizado en los ensayos fue un suelo rico en materia orgánica yen bases de intercambio. Esto limitó la expresión clara de los efectos de los tratamientos. Sin embargo, al recurrir a la enzimología, fue posible discriminar diferencias entre los efectos.En laboratorio se realizaron ensayos con tres duraciones diferentes, acogiendo a Navas et al. [38], quienes resaltaron la importancia de conocer el comportamiento de la actividad de las enzimas durante el proceso. En campo, se realizó un ensayo de 360 días.
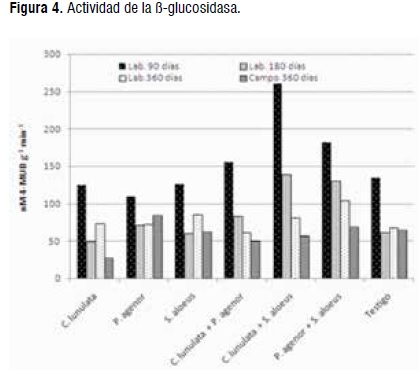
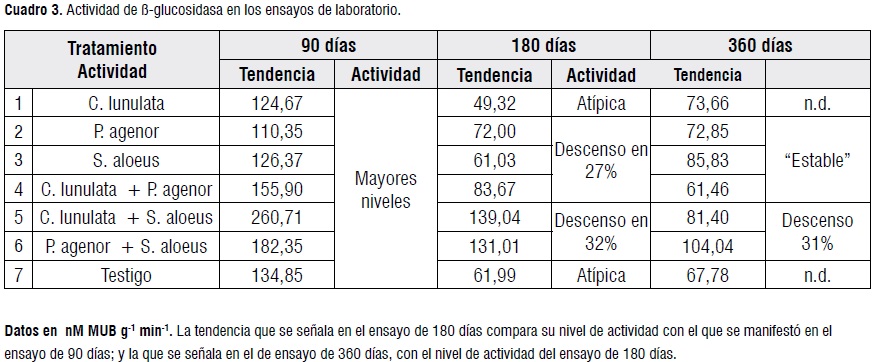
Los valores de actividad de ß-glucosidasa fueron altos en comparación con los reportados para trabajos similares. Los mecanismos a través de los cuales influyeron las larvas de Dynastinae fueron, entre otros, (i) la salivación asociada con sus actividades de alimentación [39], (ii) la secreción de enzimas celulolíticas en el mesenteron y el proctodeo [23], (iii) la digestión extraintestinal, y (iv) la coprofagia [11]. La actividad de la ß-glucosidasatendió adescender con la duración de los ensayos (Cuadro 3, Figura 4).
Los mayores niveles de actividad se registraron al final del ensayo de 90 días, indicando una intensa etapa de descomposición de los residuos de caña. El descenso en la actividad fue fuerte hasta los 180 días, y moderado o incluso manifestando estabilidad según el tratamiento, hasta los 360 días (Cuadro 3). A continuación, se sintetizan los resultados más destacados de los ensayos de laboratorio y en el de campo. Los contrastes ortogonales se aplicaron con el criterio de resaltar los comportamientos de mayor interés por cada ensayo, prescindiendo de guardar consistencia entre un ensayo y otro.
Ensayo de laboratorio de 90 días. Aquí, las actividades de ß-glucosidasa de los tratamientos de asocios superaron significativamente a las de tratamientos de especies individuales. Así, en el tratamiento C. lunulata + S. aloeus, la actividad de ß-glucosidasa fue significativamente mayor que en los tratamientos de especies individuales y en el testigo, sugiriendo una interacción del efecto de las dos especies (Cuadro 4).
Ensayo de laboratorio de 180 días. Los mayores niveles de actividad de ß-glucosidasa se presentaron en el asocio de C. lunulata+ S. aloeus, difiriendo significativamente del testigo; seguidos por P. agenor+ S. aloeus; ambos resultados consistentes con el ensayo de 90 días. También los asocios de especies, tomados en conjunto, propiciaron niveles significativamente mayores que los tratamientos de especies individuales (Cuadros 3 y 4).Así, los tratamientos de asocios permiten la perdurabilidad de una elevada actividad de ß-glucosidasa. El efecto de los tratamientos de especies individuales no difirió significativamente del testigo.
Ensayo de laboratorio de 360 días. Entre las especies individuales, la actividad de ß-glucosidasa propiciada por S. aloeussuperó significativamente a la de las otras dos especies, pero en conjunto, no arrojaron diferencias significativas frente al testigo. Por su parte, las actividades de los asocios de P. agenor + S. aloeus y de C. lunulata+ S. aloeussuperaron al testigo de manera altamente significativa (Cuadro4), contrastando con el asocio de C. lunulata+ P. agenor, que arrojó los niveles de actividad de ß-glucosidasa más bajos (Cuadro3).
Así, de manera consistente, en los tres ensayos de laboratorio se evidencia que S. aloeus en asocio con otra especie, condiciona superiores niveles de actividad de ß-glucosidasa. Los valores remanentes del ensayo de 360 días en laboratorio ascendieron a 104,04 nM 4-MUB g-1min-1.
Ensayo de campo de 360 días. Debido a decesos en las poblaciones de trabajo por micosis y depredación, fue necesario descartar unidades experimentales. Esto generó un desbalance en el modelo surgiendo la necesidad de aplicarel modelo lineal general (GLM) del sistema SAS® para interpretar los resultados. El efecto de los bloques por cierto, resultó ser no-significativo. Para el análisis estadístico de este ensayo fue necesario incluir una covariablepara corregir la ausencia parcial de poblaciones entre los monitoreos mensuales. Lo anterior se refleja en un coeficiente de determinación inferior (R2 = 0,60) y en un coeficiente de variación mayor (33,98%) que en los ensayos de laboratorio; comprometiendo la confiabilidad. Sin embargo, al tratarse de resultados obtenidos bajo condiciones de entorno natural y que ciertamente reflejan comportamientos reveladores, no se les descarta. Divergiendo del ensayo de laboratorio de 360 días, hubo diferencias significativas entre el alto nivel de ß-glucosidasa propiciado por P. agenorfrente al registrado enS. aloeus como especies individuales. Las dos especies asociadas,propiciaron actividades significativamente mayores que el testigo y que las del asocio de C. lunulata+ S. aloeus. Recuérdeseque éste había arrojado los valores más altos en los ensayos de laboratorio (Cuadro 4).
Los altos niveles de actividad de ß-glucosidasa en este trabajo pueden explicarse por la inducción de su síntesis asociada con el aporte residuos de cosecha que entra al sistema [40] y el efecto de los tratamientos dado por la secreción en la porción posterior del proctodeo de las larvas y por la prolífica población microbiana de las excretas [23].
A partir de los resultados obtenidos se puede inferir que los comportamientos estudiados condicionan una cuantiosa liberación de glucosa, que a su vez favorece la actividad de las comunidades microbianas del suelo, redundando en la continuidad de los procesos de transformación de los residuos en el suelo de cultivo de caña y en consecuencia, favoreciendo la incorporación de carbono al suelo. Debe asumirse que el desdoble de la celulosa asistido por las larvas de los Dynastinae solo avanza hasta un cierto punto. El grado de eficiencia de la digestión de fibras por larvas de escarabajos saprófagos es cercano al 28% [41]. Aun considerando el efecto del rumen externo y el de la coprofagia [7], el aporte directo al desdoble de la celulosa por parte de las larvas, solo es parcial.
Los valores remanentes de actividad registrados en el suelo de cultivo de caña de cosecha en verde probablemente no representan los más bajos posibles, puesto que con ocasión de la cosecha casi anual, los residuos nuevamente aportados se colocan en otro encalle (espacio entre surcos). En el sistema de manejo del encalle del 1 x 2, la misma calle recibe nuevamente residuos de cosecha cada tercer año.
Relación entre el consumo de residuos de cosecha de caña de azúcar y la actividad de ß-glucosidasa. Se registró una correlación débil y positiva (r = 0,385) al comparar los resultados de consumo de residuos y los de actividad de ß-glucosidasa en el ensayo de laboratorio de 360 días. El valor reportado revela que la actividad de la ß-glucosidasa también está determinada por otros factores no relacionados en este documento, por ejemplo la correlación entre la actividad microbiana y la actividad de la ß-glucosidasa [42]; o también la fracción de la enzima en condición abiótica, sujeta procesos de complejamiento y de sorción [42], que probablemente experimentó variaciones debido al efecto de los tratamientos.
CONCLUSIONES
Entre los comportamientos de las especies estudiadas, P. agenor mostró ser el mayor consumidor de residuos de caña de azúcar, que de manera comparativa bajo condiciones de campo, condiciona niveles superiores de actividad de ß-glucosidasa. Su similar desempeño en asocio con las otras dos especies de Dynastinae estudiadas, reflejan un significativo aporte al desdoble y a la incorporación de residuos al suelo, seguramente obedeciendo a su alto grado de adaptación a las condiciones del entorno de cultivo de caña con manejo de cosecha en verde.
Los altos niveles de actividad de ß-glucosidasa registrados en los tratamientos de asocio de C. lunulatay S. aloeus y de P. agenor y S. aloeus en laboratorio, sugieren una especial interacción entre las especies.
El hecho de que los resultados obtenidos en laboratorio y en campo,de manera consistente, arrojaron niveles superiores de consumo y de actividades de ß-glucosidasa en el caso de los tratamientos de asocio de especies, indica la importancia de un cierto grado de diversidad de especies de escarabajos en las funciones de transformación de residuos de cosecha en el suelo.
Desde el punto de vista metodológico, el ensayo de campo, a pesar de estar interferido por variables no controladas, arrojó resultados consistentes con los obtenidos en laboratorio.
AGRADECIMIENTOS
A la Universidad del Cauca, especialmente al Departamento de Ciencias Agropecuarias, a la Universidad Nacional de Colombia, Sede Palmira, y al Servicio Alemán de Intercambio Académico DAAD, por el respaldo y apoyo brindados. A la R.N.El Hatico y a la familia Molina Durán; a Elena Gómez por su apoyo en laboratorio de cría; alos doctores Stefan Scheu, Alex Jousset y Olaf Butenschön de la Georg-August Universität de Göttingen, R.F.A. AHarold Villota B. por su contribución en las labores de los ensayos.
REFERENCIAS
[1] EKSCHMITT, K., LIU, M., VETTER, S., FOX, O. and WOLTERS, V. Strategies used by soil biota to overcome soil organic matter stability. Geoderma, 128, 2005, p. 167-176. [ Links ]
[2] ŠTURSOVÁ, M. and BALDRIAN, P. Effects of soil properties and management on the activity of soil organic matter transforming enzymes and the quantification of soil-bound and free activity. Plant and Soil, 338 (1-2), 2011, p. 99-110.
[3] CROWTHER, T.W., JONES, T.H., BODDY, L. and BALDRIAN, P. Invertebrate grazing determines enzyme production by basidiomycete fungi. Soil Biology and Biochemistry, 43 (10), 2011, p. 2060-2068. [ Links ]
[4] SWIFT, M.J., HEAL, O.W. and ANDERSON, J.M. Decomposition in terrestrial ecosystems. Los Angeles (USA): University of California Press, 1979, 370 p. [ Links ] [5] WOLTERS, V. Invertebrate control of soil organic matter stability. Biology and Fertility of Soils, 31, 2000, p. 1-10. [ Links ]
[6] LAVELLE, P. and SPAIN, A. Soil Ecology. Dordrecht, The Nederlands: Kluwer Academic Publishers, 2001, 654 p. [ Links ]
[7] ZIMMER, M. and TOPP, W. The role of coprophagy in nutrient release from feces of phytophagous insects. Soil Biology and Biochemistry, 34 (8), 2002, p. 1093-1099. [ Links ]
[8] TERRA, W.R. and FERREIRA, C. Insect digestive enzymes: properties, compartmentalization and function. Comparative Biochemistry & Physiology, 109B, 1994, p. 1-62 [ Links ]
[9] GULLAN, P.J. and CRANSTON, P.S. The insects: An outline of entomology. Canberra (Australia): Blackwell Sci., 2000, 470 p. [ Links ] [10] MORÓN, M.A. Escarabajos, 200 millones de años de evolución. 2 ed. Zargoza (España): Instituto de Ecología, A.C. y Sociedad Entomológica Aragonesa, 2004, 204 p. [ Links ]
[11] WEISS, M.R. Defecation Behavior and Ecology of Insects. Annu Rev Entomol, 51, 2006, p. 635-661. [ Links ] [ Links ]
[13] BAYON, C. Volatile fatty acids and methane production in relation to anaerobic carbohydrate fermentation in Oryctes nasicornis larvae (Coleoptera: Scarabaeidae). Journal of Insect Physiology, 26, 1980, p. 819-828. [ Links ]
[14] LEMKE, T., STINGL, U., EGERT, M., FRIEDRICH, M.W. and BRUNE, A. Physicochemical conditions and microbial activities in the highly alkaline gut of the humus-feeding larva of Pachnoda ephippiata (Coleoptera: Scarabaeidae). Applied & Environmental Microbiology, 69, 2003, p. 6650-6658. [ Links ]
[15] GOBAT, J.M., ARAGNO, M. and MATTHEY, W. The living soil. Fundamentals of Soil Science and Soil Biology. Plymouth, U.K: Science Publishers, Inc., 2004, [ Links ]
[16] LAVELLE, P. Faunal activities and soil processes: adaptive strategies that determine ecosystem function. Adv. Ecol. Res., 27, 1997, p. 93-132. [ Links ] [17] LASTRA, L.A. y GÓMEZ, L.A. Efectos de la cosecha en verde sobre los insectos asociados con la caña de azúcar. Cenicaña, Serie Técnica (35), 2006, p. 165. [ Links ]
[18] PARDO-LOCARNO, L.C., STECHAUNER-ROHRINGER, R. y MORÓN, M. A. Descripción de larva y pupa, ciclo de vida y distribución del escarabajo rinoceronte Podischnus agenor Oliver (Coleoptera: Melolonthidae) en Colombia, con una clave para larvas de tercer estadio de Dynastinae neotropicales. Kempffiana, 5 (2), 2009, p. 20-42. [ Links ]
[19] PARDO-LOCARNO, L.C. Macroinvertebrados edafícolas en agroecosistemas del municipio de El Cerrito (Valle), con énfasis en la comunidad de escarabajos Melolonthidae (Coleoptera: Scarabaeoidea). Cali, Colombia: Universidad del Valle, 2009, 174 p. [ Links ]
[20] PARDO-LOCARNO, L. C., MONTOYA-LERMA, J., BELLOTTI, A.C. and VAN SCHOONHOVEN, A. Structure and composition of the white grub complex (Coleoptera: Scarabaeidae) in agroecological systems of Northern Cauca, Colombia. Florida Entomologist, 88 (4), 2005, p. 355-363. [ Links ]
[21] DELOYA, C.Cyclocephala lunulata Burm. (Coleoptera: Melolonthidae, Dynastinae) asociada al cultivo de maíz (Zea mays) en Pueblo Nuevo, Morelos, México. In: Morón M. A.; Aragón A., editors. Avances en el estudio de la diversidad, importancia y manejo de los Coleópteros edafícolas americanos. México: Benemérita Universidad Autónoma de Puebla y Sociedad Mexicana de Entomología, A.C., Puebla, 1998, p. 121-130. [ Links ]
[22] DICK, R.P. and KANDELER, E. Enzymes in soils. In: Daniel H., editor. Encyclopedia of Soils in the Environment. Oxford (England): Elsevier, 2005, p. 448-456. [ Links ]
[23] ZIMMER, M. and TOPP, W. Microorganisms and cellulose digestion in the gut of the woodlouse Porcellio scaber. Journal of Chemical Ecology, 24, 1998, p. 1397-1408. [ Links ]
[24] LI, X. Transformation and Mineralization of Organic Matter by the Humivorous Larva of Pachnoda ephippiata (Coleoptera: Scarabaeidae). Konstanz (Germany): Universität Konstanz, 2004, 139 p. [ Links ]
[25] BUSTO, M.D., ORTEGA, N. and PÉREZ-MATEOS, M. Studies on microbial ß-D-glucosidase immobilized in alginate gel beads. Process Biochemistry, 30 (5), 1995, p. 421-426. [ Links ]
[26] LIU, H.Q., FENG, Y., ZHAO, D.Q. and JIANG, J.X. Evaluation of cellulases produced from four fungi cultured on furfural residues and microcrystalline cellulose. Biodegradation, 23 (3), 2012, p. 465-472. [ Links ]
[27] ENARI, T.M. and MARKKANEN, P. Production of cellulolytic enzymes by fungi. Advances in Biochemical Engineering, 5 1977, p. 1-24. [ Links ]
[28] TACHAAPAIKOON, C., KOSUGI, A., PASON, P., WAEONUKUL, R., RATANAKHANOKCHAI, K., KYU, K., ARAI, T., MURATA, Y. and MORI, Y. Isolation and characterization of a new cellulosome-producing Clostridium thermocellum strain. Biodegradation, 23 (1), 2012, p. 57-68. [ Links ]
[29] KAUSAR, H., SARIAH, M., MOHD, H., ZAHANGIR, M. and RAZI, M. Isolation and screening of potential actinobacteria for rapid composting of rice straw. Biodegradation, 22 (2), 2011, p. 367-375. [ Links ]
[30] BENDING, G.D., TURNER, M.K., RAYNS, F., MARX, M.C. and WOOD, M. Microbial and biochemical soil quality indicators and their potential for differentiating areas under contrasting agricultural management regimes. Soil Biology and Biochemistry, 36 (11), 2004, p. 1785-1792. [ Links ]
[31] STECHAUNER-ROHRINGER, R. y PARDO-LOCARNO, L.C. Redescripción de inmaduros, ciclo de vida, Distribución e importancia agrícola de Cyclocephala lunulata Burm. (Coleoptera: Dynastinae) en Colombia. Boletín Científico Centro de Museos Museo de Historia Natural, 14 (1), 2010, p. 203-220. [ Links ]
[32] ESPINOSA-ISLAS, A., MORÓN, R.M. Á., SÁNCHEZ, A.H., BAUTISTA, H.N. y ROMERO N.J. Complejo gallina ciega (Coleoptera: Melolonthidae) asociado con céspedes en Montecillo, Texcoco, Estado de México. Folia Entomol Mex., 44 (2), 2005, p. 95-107. [ Links ]
[33] PARDO LOCARNO, L.C. Aspectos Sistemáticos y Bioecológicos del Complejo Chisa (Coleoptera: Melolonthidae) de Caldono, Norte del Cauca, Colombia. Cali(Colombia): Universidad del Valle, 2002, 139 p. [ Links ]
[34] DEFOREST, J.L. The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and l-DOPA. Soil Biology and Biochemistry, 41 (6), 2009, p. 1180-1186. [ Links ]
[35] MARX, M.C., WOOD, M. and JARVIS, S.C. A microplate fluorimetric assay for the study of enzyme diversity in soils. Soil Biology and Biochemistry, 33 (12-13), 2001, p. 1633-1640. [ Links ]
[36] SIGMA- ALDRICH. Product Directory Home. Available: http://www.sigmaaldrich.com/life-science/biochemicals/biochemical-products.html?TablePage=14572942[cited 15 april de 2010] [ Links ].
[37] RATCLIFFE, B.C. The Dynastinae Scarab beetles of Costa Rica and Panama. Lincoln, Nebraska (USA): University of Nebraska State Museum, 2003, 506 p. [ Links ]
[38] NAVAS, M.J., BENITO, M. y MASAGUER, A. Evaluación de parámetros bioquímicos en un calcaric skeletic cambisol bajo diferentes usos de suelo. Agronomía Trop., 59 (2), 2009, p. 219-225. [ Links ]
[39] ROSS, H.H. Introducción a la entomología general y aplicada. Barcelona (España): Omega, S. A., 1956, 536 p. [ Links ]
[40] GEISSELER, D. and HORWATH, W.R. Relationship between carbon and nitrogen availability and extracellular enzyme activities in soil. Pedobiologia, 53 (1), 2009, p. 87-98. [ Links ]
[41] RÖSSLER, M.E. Ernährungsphysiologische Untersuchungen an Scarabaeidenlarven. Insect Physiol., 6, 1961, p. 62-80. [ Links ]
[42] KNIGHT, T.R. and DICK, R.P. Differentiating microbial and stabilized ß-glucosidase activity relative to soil quality. Soil Biology & Biochemistry, 36, 2004, p. 2089-2096. [ Links ]