Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.11 no.1 Popayán Jan./June 2013
CUANTIFICACIÓN DE ENFERMEDADES EN LÍNEAS PROMISORIAS Y VARIEDADES DE FRÉJOL EN QUEVEDO, ECUADOR
DISEASES QUANTIFICATION IN PROMISSORY LINES AND VARIETIES OF BEAN IN QUEVEDO, ECUADOR
QUANTIFICAÇÃO DE DOENÇAS EM LINHAGENS PROMISSORAS E VARIEDADES DE FEIJÃO EM QUEVEDO, EQUADOR
FELIPE RAFAEL GARCÉS-FIALLOS.1
1Ingeniero Agrónomo, Maestro en Agronomía (Fitopatología). Docente Investigador, Facultad de Ciencias Agrarias, Universidad Técnica Estatal de Quevedo-UTEQ, Quevedo, Los Ríos, Ecuador. Casilla postal: 73.
Correspondencia: felipegarces23@yahoo.comRESUMEN
El rendimiento del cultivo de fréjol (Phaseolus vulgaris L.) es disminuido por el ataque de las enfermedades a lo largo del ciclo del cultivo, disminuyendo los ingresos de los agricultores en la zona central del Litoral Ecuatoriano. El objetivo de la investigación fue identificar cuales son las enfermedades que se presentan, y cuantificar las mismas en 21 materiales genéticos de fréjol en el cantón Quevedo. Se describieron los agentes causales de la muerte de plántulas luego de la emergencia, así como las enfermedades presentes en el agroecosistema de fréjol. También se cuantificó la severidad (%) de enfermedades foliares en plantas y por parcela, roya (Uromyces appendiculatus), mustia hilachosa (Rhizoctonia solani), así como la incidencia (%) de virosis y pudriciones radiculares. Fueron encontrados patógenos causantes de la muerte de plántulas (Fusarium spp., R. solani y Macrophomina phaseolina), enfermedades foliares predominantes (U. appendiculatus y R. solani), la presencia de virosis y finalmente los microorganismos promotores de pudriciones radiculares (fusariosis, pudrición de rhizoctonia y macrofomina). Fue evidenciado comportamiento diferenciado entre los cultivares evaluados. Los materiales que obtuvieron una menor intensidad de problemas fitosanitarios fueron el CAL - 96, EVG - 06 - 103, Cf4 0-0-4-8, INIAP-473 y Cf4 0-0-12-5.
PALABRAS CLAVE: Phaseolus vulgaris L., Roya, mustia Hilachosa, Virosis, Pudriciones radiculares
ABSTRACT
The yield of beans (Phaseolus vulgaris L.) is diminished by the onslaught of disease throughout the crop cycle, reducing farmers' incomes in the central part of the Ecuadorian coast. The objective of this research was to identify which are the diseases that occur, and quantify them in 21 bean genetic materials in Quevedo city. Described the agents causing the damping off after emergence, and the diseases present in the bean agroecosystem. Also quantified the severity (%) of foliar diseases in plants and per plot, rust (Uromyces appendiculatus), web blight (Rhizoctonia solani) and incidence (%) of virus and root rot. Pathogens were found in the damping off (Fusarium spp. and R. solani), predominant foliar diseases (U. appendiculatus, R. solani and Macrophomina phaseolina), the presence of viruses and microorganisms promoters eventually root rot (fusarium, rhizoctonia and macrofomina). Different pattern was evident among the cultivars evaluated. The materials were a lower intensity of phytosanitary problems were the CAL - 96, EVG - 06 - 103, Cf4 0-0-4-8, INIAP-473 and Cf4 0-0-12-5.
KEYWORDS: Phaseolus vulgaris L., Rust, Web Blight, Virus, Root Rot.
RESUMO
O rendimento da cultura (Phaseolus vulgaris L.) é diminuído pelo ataque das doenças ao longo de seu ciclo, diminuindo os ingressos de agricultores da parte central do Litoral Equatoriano. O objetivo da pesquisa foi identificar quais são as doenças que se apresentam, e quantificá-las em 21 materiais genéticos de feijoeiro na cidade de Quevedo. Foi descrito os agentes causais da morte de plântulas logo da emergência, assim também as doenças presentes no agroecosistema de feijoeiro. Igualmente, quantificou-se a severidade (%) de doenças foliares em plantas e em parcelas, ferrugem (Uromyces appendiculatus), mela (Rhizoctonia solani), assim como a incidência (%) de viroses e podridões radiculares. Foram encontrados patógenos que induzem da morte de plântulas (Fusarium spp., R. solani e Macrophomina phaseolina), doenças foliares predominantes (U. appendiculatus e R. solani), a presencia de viroses e finalmente os microorganismos promotores de podridões radiculares (fusariosis, podridão de rhizoctonia y macrofomina). Foi evidenciado comportamento diferenciado entre as cultivares avaliadas. Os materiais que obtiveram uma menor intensidade de problemas fitossanitários foram o CAL - 96, EVG - 06 - 103, Cf4 0-0-4-8, INIAP-473 e Cf4 0-0-12-5.
PALAVRAS-CHAVE: Phaseolus vulgaris L., Ferrugem, Mela, Viroses, Podridões Radiculares.
INTRODUCCIÓN
La familia Fabaceae es constituida por muchos géneros y especies, siendo las principales la soya [Glycine max (L.) Merrill] y el fréjol (Phaseolus vulgaris L.) [1]. En el Ecuador, esta leguminosa es consumida ampliamente en todo el territorio nacional, siendo también fuente de ingresos para pequeños y medianos productores [2]. Esta leguminosa es sembrada bajo condiciones de secano, generalmente en terrenos de ladera en asociación con maíz, en suelos poco fértiles, con problemas de enfermedades y manejo agronómico. Los cultivadores del fréjol en su mayoría son agricultores pequeños, orientados a la producción para el autoconsumo, sin descartar la existencia de áreas donde los agricultores producen para el mercado [3].
El promedio de la superficie total cosechada en el Ecuador en los cinco últimos años fue de 22.186 ha, correspondientes a 3.410 ha para fréjol arbustivo y 18.776 ha para volubles, siendo el rendimiento promedio para fréjol seco de 350 kg.ha-1 y para legumbre verde es de 1.340 kg.ha-1 [4]. En el país la siembra de esta leguminosa se efectúa de septiembre a noviembre, prefiriendo las variedades de colores claros: amarillo (canario), blanco (caballero) y rojo [5].
La importancia del fréjol en el Ecuador, radica en que es uno de los alimentos predilectos de la población, por su valor accesible y el contenido de grasas y proteínas, incluso su valor nutritivo es comparado con la carne roja. Actualmente no existe materiales de fréjol con alta adaptación para la cuenca alta del Río Guayas, ya que los materiales que se han establecido ha sido germoplasma extranjero, o a su vez materiales nacionales con adaptación a condiciones agroclimáticas diferentes a las del lugar.
Como cualquier otro cultivo en el Ecuador, existen daños y pérdidas ocasionadas por plagas y enfermedades, incidiendo en mayor proporción estas últimas como virosis (Bean golden mosaic virus-BGMV, Bean common mosaic virus-BCMV y Bean rugose mosaic virus-BRMV), bacteriosis [Xanthomonas axonopodis pv. phaseoli (Smith) y Pseudomonas syringae pv. tabaci (Burkholder)] y micosis [Colletotrichum lindemuthianum (Sacc. & Magnus), Phaeoisariopsis griseola (Sacc.), Rhizoctonia solani (Kuhn), Uromyces appendiculatus (Pers.:Pers.), Erysiphe polygoni (DC), Alternaria spp. y Cercospora sp. en las legumbres] [1, 2, 6, 7, 8 y 9].
Los rendimientos del material genético existente en el país, y específicamente en el Trópico Húmedo Ecuatoriano no compensan la inversión realizada por los agricultores, los cuales en su mayoría son pequeños y medianos con agricultura de subsistencia, por lo que la UTEQ, viene trabajando en el mejoramiento de este cultivo en esta zona del Ecuador, con el objetivo de contar con germoplasma con buenas características sanitarias para este lugar.
Por lo expresado, el objetivo de esta investigación fue identificar y cuantificar las enfermedades presentes en las líneas promisorias F5 del cruzamiento Cf4 (Cf1 0-14-1-2 x EVG-06-248) y variedades comerciales de fréjol durante la época seca del año 2010, en el cantón Quevedo.
MÉTODO
Desarrollo del experimento
La presente investigación se realizó durante la época seca del año 2010 desde septiembre hasta diciembre, en la Finca Experimental La María, localizada en el km. 7,5 vía Quevedo-El Empalme, cuyas coordenadas geográficas son 79° 30´ 08´´ de longitud Este y 01° 00´ 35´´ latitud Sur.
La preparación del terreno fue realizada mediante un pase de arado y dos de rastra, dos días antes de la siembra. Las semillas fueron previamente desinfectadas con Methylbenzimidazol-2-ylcarbamate en dosis de 3 cm3 por cada 500 g de semilla. La siembra fue realizada el 20 de septiembre de 2010 de forma manual utilizando un espeque, a una distancia de 0,20 m entre planta x 0,50 m entre hileras. La fertilización se realizó a los 14 y 30 días después de la siembra (DDS) utilizando una fuente de N (urea al 46%) en dosis de 100 kilogramos ha-1. Se realizaron aplicaciones de los herbicidas Prometrina en pre-emergencia, y Propanoato en forma de éster metílico en post-emergencia, en dosis de 1,5 y 1 L/ha, respectivamente, ayudándose con dos deshierbas manuales. El control de insectos plagas se realizó utilizando los insecticidas Lambdacihalotrina, Clorpirifos, y Imidacloprid con dosis de 0,2; 2,0 y 0,5 L/ha, respectivamente. No se aplicó fungicida en la parte aérea. La cosecha fue realizada a los 84 DDS. La necesidad hídrica del cultivo fue compensado con cuatro riegos por aspersión.
Material genético utilizado y diseño experimental
Los materiales de fréjol evaluados en este experimento, fueron 17 líneas promisorias F5 del cruzamiento Cf4 (Cf1 0-14-1-2 x EVG-06-248): Cf4 0-0-2-1, Cf4 0-0-2-4, Cf4 0-0-2-6, Cf4 0-0-5-4, Cf4 0-0-3-11, Cf4 0-0-10-8, Cf4 0-0-10-9, Cf4 0-0-16-7, Cf4 0-0-15-3, Cf4 0-0-12-5, Cf4 0-0-16-8, Cf4 0-0-2-2, Cf4 0-0-4-4, Cf4 0-0-4-8, Cf4 0-0-4-9, Cf4 0-0-12-3 y Cf4 0-0-16-6, una línea promisoria avanzada obtenida en la UICYT (EVG-06-103), y tres variedades comerciales (Cuarentón, INIAP-473 y CAL-96).
Fue empleado un Diseño de Bloques Completos al Azar (DBCA) con 21 tratamientos y 3 repeticiones.
Descripción de agentes causales de la muerte de plántulas luego de la emergencia
Fueron recolectadas plántulas al azar que presentaban sintomatología de damping off, en todos los tratamientos. Estas muestras fueron llevadas al Laboratorio de Microbiología de la UTEQ, donde se lavaron y, colocaron en cámara húmeda en placas de vidrio para su posterior observación e identificación al microscopio 40x.
Área Abajo la Curva de Progreso de la enfermedad (AACPE) dada por la severidad (%) de enfermedades foliares en plantas marcadas
Se marcaron cuatro plantas por tratamiento (dos en cada hilera de la parcela útil) con cuerdas de polietileno color amarillo. A estas plantas se les evaluó la severidad (evaluación visual de cada uno de los materiales vegetales, considerándose enferma la planta que presentaba necrosis o muerte del tejido foliar). Esta actividad fue desarrollada durante seis semanas (25/10, 10/11, 08/11, 15/11, 22/11 y 29/11) con intervalos de siete días. Para la cuantificación de la severidad se utilizó una fitopatometría subjetiva, utilizando la siguiente escala arbitraria: 1: 0-25%, 2: 26-50%, 3: 51-75%, y 4: 76-100% de necrosis o tejido muerto en la planta.
Área Abajo la Curva de Progreso de la enfermedad (AACPE) dada por la severidad (%) de enfermedades foliares por parcela
La variable fue medida mediante una evaluación visual de toda la parcela (cuatro hileras), considerándose enfermas las plantas que presentaban muerte del tejido foliar (área foliar necrosada en la parcela), similar a la metodología descrita por Garcés [2]. Esta actividad fue desarrollada durante seis semanas (25/10, 10/11, 08/11, 15/11, 22/11 y 29/11) con intervalos de siete días.
Severidad de la roya (Uromyces appendiculatus) y mustia hilachosa (Rhizoctonia solani)
La cuantificación de la severidad de estas enfermedades se realizó durante el estadío fenológico R8 (inicio del llenado de vainas e incremento del tamaño de la semilla, comenzando la senescencia) según la escala descrita por Hall [9]. Cuatro plantas fueron escogidas al azar en el campo en cada uno de los tratamientos, luego fueron arrancados tres trifolios, uno en cada estrato (inferior, medio y superior) de la planta, los mismos que rápidamente fueron acondicionados en fundas plásticas. En el Laboratorio de Microbiología de la UTEQ, a esos trifolios les fueron extraídos el folíolo central, totalizando doce folíolos por tratamiento, siendo en estos cuantificada la severidad (pústulas/cm2) de la roya y de mustia hilachosa (lesiones/folíolo), utilizando un estereoscopio con lente binocular óptico de 2X de ampliación visual.
Incidencia (%) de virosis
Esta variable se cuantificó durante el estadío fenológico R7 (aparecimiento de la primera vaina con la corola de la flor colgada o desprendida) según la escala de Hall [9]. Se contabilizó cada una de las plantas de la parcela útil, mediante una evaluación visual de los síntomas ocasionados por virus, utilizando algunas referencias [1, 7 y 9].
Incidencia (%) de pudriciones radiculares
Esta actividad se llevó a cabo después de la cosecha, observando la parte inferior del tallo e inicial de la raíz de cada una de las plantas de toda la parcela útil (dos hileras centrales), para posteriormente mediante una evaluación visual en función de la sintomatología presentada por el patógeno, cuantificar su incidencia.
Análisis estadístico
Para las variables fitosanitarias de severidad (%) de enfermedades foliares en plantas marcadas y por parcela, sus promedios obtenidos fueron integralizados como Área Abajo la Curva de Progreso de la Enfermedad (AACPE), conforme la ecuación de integración trapezoidal [10]. Para la comparación entre las medias de los tratamientos se empleó la prueba de rangos múltiples de Tukey al 5% de probabilidad del error. Para realizar estos análisis estadísticos, se utilizó el programa estadístico SASM-AGRI [11]. Para la relación entre los individuos se obtuvo el promedio de todas las variables sanitarias evaluadas, midiéndola por medio del coeficiente de similaridad, mediante el análisis de conglomerados, utilizando el método de Ward, utilizando el programa INFOSTAT [12].
Condiciones climáticas
Los datos meteorológicos se obtuvieron en la División de Meteorología, Departamento de Sinóptica del Instituto Nacional Autónomo de Investigaciones Agropecuarias (INIAP), Quevedo.
RESULTADOS
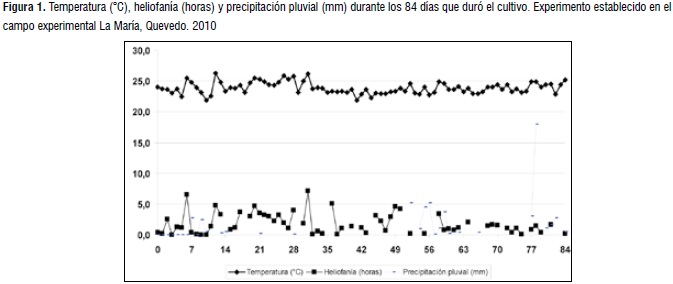
La temperatura promedio a lo largo del cultivo fue de 23,88 °C, una heliofanía total de 116,30 horas y una precipitación pluvial total de 55 mm. Las condiciones climáticas registradas durante el tiempo que se estableció el cultivo, se asemejan a los años anteriores (Figura 1).
Las enfermedades encontradas y evaluadas en esta investigación, fueron la roya (U. appendiculatus), mustia hilachosa (R. solani), virosis y pudriciones radiculares (Fusarium spp., R. solani y Macrophomina phaseolina).
Algunas de estas enfermedades como la roya, pudrición radicular y virosis (BCMV), fueron descritas también por Ernest et al. [13] en los valles del río Mira y Chota, en el norte del Ecuador. Estos autores no evidenciaron la ocurrencia de mustia hilachosa, siendo tal vez, a que esta enfermedad, constituye la principal enfermedad del fréjol en los trópicos húmedos, donde la elevada temperatura y humedad forman las condiciones favorables para el desarrollo de la enfermedad [14]. Así mismo, la mustia hilachosa se presenta en terrenos infectados con períodos prolongados de lluvias, temperatura y humedad relativa promedio de 24º C y 80% [15, 16]. Por otro lado, específicamente en la parte alta del río Guayas, esta enfermedad tiene importancia única, pues es la que predomina sobre las demás, convirtiéndose así en un problema para quién cultiva esta leguminosa [2]. Sin embargo, todavía no se ha identificado una línea de fréjol común que tenga un alto nivel de resistencia a la mustia hilachosa en diferentes regiones geográficas [17].
Descripción de agentes causales de la muerte de plántulas luego de la emergencia
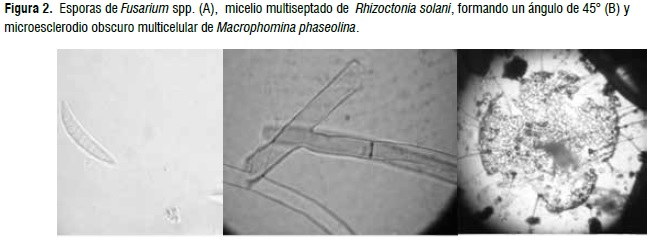
Los organismos patogénicos encontrados fueron Fusarium spp., R. solani y M. phaseolina, los mismos que se visualizan en la Figura 2. En relación al primero se encontró conidias hialinas, multiseptadas, arqueadas, con ausencia de clamidosporas. Mientras que para el segundo microorganismo, no mostró esporas, presentando micelio blanquecino con ángulo de 45 y 90°. Ya para el tercero, fue encontrado microesclerodios obscuros multicelulares y de tamaño variable. Las características encontradas en los organismos causantes de la muerte de plántulas (damping off), coinciden con la de varios autores [6, 7, 9, 18, 19, 20 y 21]. Estos mismos microorganismos están catalogados como patógenos necrotróficos [22], y una de las formas de diseminación es vía semilla [23]. En función de estas aseveraciones, la posible fuente de inóculo primario se encontró en la semilla o a su vez en el suelo a causa de los anteriores establecimientos de cultivos como los de fréjol y soya. También, estos patógenos han sido encontrados en semillas de fréjol miúdo [24] (Fusarium spp.) y en fréjol cultivar Carioca [25] (R. solani), aseverando más aún la hipótesis de la diseminación vía semilla. Cuanto mayor el grado de humedad de la semilla, mayor es la incidencia de estos hongos [26]. Ya para M. phaseolina, esta enfermedad ha sido confirmada en Brasil y México como un serio problema en cultivos de fréjol [27, 28].
Área Abajo la Curva de Progreso de la enfermedad (AACPE) dada por la severidad (%) de enfermedades foliares en plantas marcadas
Las enfermedades foliares (roya y mustia hilachosa) encontradas y evaluadas se muestran en la Figura 3. Se evidenció diferencia significativa entre los tratamientos, teniendo valores entre 5,7 en la variedad CAL-96 y 14,3 unidades para la línea Cf4 0-0-3-11 (Cuadro 1). El promedio de los testigos dados por la línea avanzada EVG-06-103 y las variedades Cuarentón, INIAP-473 y CAL-96, obtuvieron 8,70 unidades, a diferencia de la media de las líneas promisorias Cf4 que obtuvieron 11,66 unidades.
Área Abajo la Curva de Progreso de la enfermedad (AACPE) dada por la severidad (%) de enfermedades foliares por parcela
Para esta variable también fue avaluada la roya y mustia hilachosa. La comparación de medias mostró diferencia significativa entre los tratamientos evaluados, destacándose con menores unidades de área variedad CAL-96 con 47, 5, mientras que las líneas Cf4 0-0-5-4 y Cf4 0-0-3-11 acumularon medias de 150,0 y 151,2, respectivamente (Cuadro 1). El promedio de las líneas promisorias Cf4 alcanzó 112,58 unidades, mientras que los testigos obtuvieron 79,48 unidades.
Nechet y Halfeld-Vieira [16] también relatan diferencias significativas entre genotipos de fréjol caupi (Vigna unguiculata) en relación a la severidad de la mustia hilachosa, pues a nivel de campo observaron valores de área abajo la curva de progreso de la enfermedad de 335 (IT 87B719) a 668 (Pitiúba) para materiales de comportamiento erecto y de 101 (Canapuzinho) a 145 (Tracuateua) para materiales de comportamiento rastrero.
Severidad de la roya (Uromyces appendiculatus) y mustia hilachosa (Rhizoctonia solani)
La comparación de medias mostró diferencia estadística significativa entre los tratamientos, tanto para la roya como para la mustia hilachosa (Cuadro 1). Para el caso de la roya, la variedad CAL-96 presentó el menor número de pústulas/cm2 (0,54), siguiéndoles la línea avanzada EVG-06-103 y promisoria Cf4 0-0-16-7 (3,81) y por último la variedad comercial INIAP-473 (5,77), mientras que para la mustia hilachosa, la línea avanzada EVG-06-103 y la variedad comercial CAL-96 con 1,78, presentaron los promedios de severidad inferiores a los demás. Los promedios más altos de severidad obtenidos para las dos enfermedades fue la línea promisoria Cf4 0-0-16-6 (41,39 pústulas para la roya y 10,61 lesiones para la mustia hilachosa).
Las diferencias estadísticas significativas encontradas durante el estadío fenológico R8 entre los genotipos estudiados, demuestran el comportamiento diferenciado para la roya y mustia hilachosa, siendo estas diferencias encontradas en la literatura para la primera [29, 30 y 31] y para la segunda enfermedad [2, 32, 33 y 34].
Incidencia (%) de virosis
Aunque no existió diferencia estadística entre los tratamientos, se destacó la línea Cf4 0-0-10-9 con 27,6% de incidencia, al contrario de la variedad comercial Cuarentón que obtuvo 49,3% (Cuadro 2). Los promedios de las líneas Cf4 versus los testigos mostraron 35,09% para los primeros y 34,73% para los segundos. La sintomatología presentada fueron amarillamiento, enrolamiento, retorcimiento y diminución de tamaño de los folíolos, así como enanismo en plantas (Figura 4). Otros autores también encontraron diferente comportamiento de genotipos a algunas virosis [33 y 35]. El control del mosaico común del fréjol (Bean common mosaic vírus-BCMV), debe ser iniciado con escoger un cultivar (resistente) y la semilla (buena calidad sanitaria) a ser utilizada para el establecimiento del cultivo [9]. Por otro lado, otro virus como el mosaico dorado del fréjol (Bean golden mosaic virus-BGMV), puede ser controlada por la adición de genes de líneas susceptibles, por cruzamientos dialélicos o no, seguida de sucesivas generaciones de autofecundación y presencia del virus.
Incidencia (%) de pudriciones radiculares (fusariosis, pudrición de rhizoctonia y macrofomina)
Se presentaron diferencias estadísticas para pudrición de R. sonali y Macrophomina phaseolina (Cuadro 2). Para la fusariosis Cf4 0-0-10-9 mostró la incidencia más baja (17,0%), mientras que la otra línea promisoria Cf 4 0-0-16-6 obtuvo la mayor incidencia (44,7 %) Por otro lado, para la mustia hilachosa la variedad comercial INIAP-473 obtuvo 2,7% de incidencia, y la línea promisoria Cf4 0-0-5-4 alcanzó 23,6%. Por último el comportamiento sanitario en función de macrofomina, el menor promedio lo consiguió la línea promisoria Cf4 0-0-16-6 con 13,3% de incidencia y el mayor fue para la variedad comercial INIAP-473 con 41,7%.
La incidencia de Fusarium spp. evaluada a nivel de campo en dos épocas, obtuvo en la primera época de siembra 80% de incidencia en la primera evaluación y de 100% en las siguientes, lo que confirma la uniformidad de la infestación del suelo, afirmando también que la severidad de la pudrición se incrementó conforme avanzó el ciclo de cultivo en el grupo de materiales evaluados, no observando altos niveles de resistencia a Fusarium spp., ya que la mayoría de los genotipos resultaron susceptibles a esta enfermedad [34]. Estos valores de incidencia fueron mayores a los encontrados en la investigación, ya que fueron obtenidos en experimentos de fréjol establecidos en suelos con alta incidencia de Fusarium spp. Para la pudrición de R. solani, el valor encontrado de incidencia más alta de 23,6 (línea promisoria Cf4 0-0-5-4), es mayor a la severidad obtenida por Miranda et al. [37] (3,55 y 4,88%) utilizando una fitopatometría subjetiva (notas de 1 a 9). Así también, la presencia de macrofomina ocasionada por M. phaseolina encontrada y evaluada en este experimento, ha sido relatada por Hartman et al. [38] causando pudrición de raíces, tallo, ramas y frutos en diferentes especies botánicas, mencionando Bianchini et al. [7] al fréjol como hospedero de esta enfermedad. Las pudriciones radiculares de Fusarium spp. y R. solani ocurren aisladamente como en asociación sinérgica [39 y 40]. Esto es relevante, ya que en esta investigación fue encontrado un complejo de pudriciones radiculares, incluso Casa et al. [41] mencionan al complejo de Fusarium spp., F. solani, M. phaseolina y R. solani, como causantes de pudriciones radiculares en fréjol, confirmando la ocurrencia de estos patógenos en la presente investigación.
Análisis de conglomerados
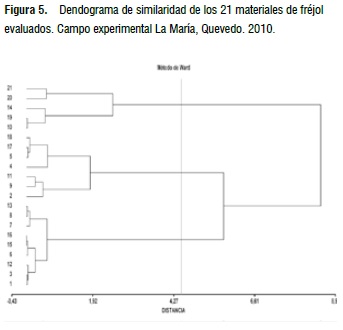
En función del análisis de conglomerados, utilizando el método de Ward, se obtuvo una distancia euclidiana promedio de 8,96 y una correlación cofenética de 0,539 (Figura 5), siendo separado el germoplasma en tres grupos, en función del comportamiento a todas las enfermedades, destacándose el tercero con una menor intensidad (CAL-96, EVG-06-103, Cf4 0-0-4-8, INIAP-473 y Cf4 0-0-12-5), por presentar características fitosanitarias superiores.
CONCLUSIONES
Fueron encontrados patógenos causantes de la muerte de plántulas (Fusarium spp. y R. solani), enfermedades foliares predominantes (U. appendiculatus y R. solani), la presencia de virosis y finalmente los microorganismos promotores de pudriciones radiculares (fusariosis, pudrición de rhizoctonia y macrofomina).
Existieron diferencias estadísticas significativas en la mayoría de variables evaluadas, exceptuándose la incidencia de virosis, pudrición radicular de fusariosis y la media de las pudriciones, confirmando el comportamiento diferenciado existente en el germoplasma evaluado.
Los materiales que obtuvieron una menor intensidad de la enfermedad fueron el CAL-96, EVG-06-103, Cf4 0-0-4-8, INIAP-473 y Cf4 0-0-12-5.
Se recomienda seguir evaluando los cinco materiales superiores, realizando otros experimentos como distanciamiento, fertilización y en diferentes lugares, para en un futuro poder lanzar el mejor material como una variedad para esta zona del Ecuador continental.
REFERENCIAS
[1]GARCÉS, F.R. Doenças causadas por vírus na cultura de feijoeiro. Ciencia y Tecnología, 3(2), 2010, p. 1-6. [ Links ]
[2]GARCÉS, F.R. Modelo de ponto crítico para estimar danos causados pela mela na cultura do feijoeiro. Ciencia y Tecnología, 4(1), 2011, p. 1-4. [ Links ]
[3]LÉPIZ, R. Informe segunda fase 1991-1993. Proyecto de fríjol del CIAT para la zona andina. Quito (Ecuador): PROFRIZA, 1994, 71 p. [ Links ]
[4]INEC. El rendimiento promedio para el fréjol seco [online]. Available: http://www.preduza.org/le1_3.htm [citado 23 de Agosto de 2010] [ Links ].
[5]PERALTA, E., VÁSQUEZ, J., LÉPIZ, R. y PINZÓN, J. Producción de semillas de fréjol voluble o trepador. Publicación miscellanea. N° 63. Quito (Ecuador): INIAP, 1994, 32 p. [ Links ]
[6]AGRIOS, G.N. Plant Pathology. 5 ed. Amsterdam (Holanda): Elsevier, 2005, 922 p. [ Links ]
[7]BIANCHINI, A., MARINGONI, A.C. e CARNEIRO, S.M.T.P.G. Doenças do feijoeiro (Phaseolus vulgaris). Em: Manual de Fitopatologia (KIMATI, H., AMORIM, L., REZENDE, J.A.M., BERGAMIN FILHO, A. e CAMARGO, L.E.A.). Agronômica Ceres, 2(4),2005, p. 333-349. [ Links ]
[8]GARCÉS, F.R., DENARDIN, N., REIS, E.M., MANHAGO, D.D., ALMEIDA, R. e FORCELINI, C. A. Incidência de Cercospora sp. em vagens de feijoeiro no município de Passo Fundo. Tropical Plant Pathology. 34(Suplemento), 2009, p. S169. [ Links ]
[9]HALL, R. Compendium of bean diseases. 2 ed. St. Paul (United States of America): American Phytopathological Society, 1994, 73 p. [ Links ]
[10]CAMPBELL, C.L. and MADDEN, L.V. Introduction to Plant Disease Epidemiology. New York (United States of America): John Wiley & Sons Inc., 1990, 532 p. [ Links ]
[11]CANTERI, M.G., ALTHAUS, R.A., VIRGENS-FILHO, J.S., GIGLIOTI, E.A.E. e GODOY, C.V. SASM - Agri: Sistema para análise e separação de médias em experimentos agrícolas pelos métodos Scoft - Knott, Tukey e Duncan. Revista Brasileira de Agrocomputação, 1(2), 2001, p. 18-24. [ Links ]
[12]INFOSTAT. InfoStat versión 2004. Grupo InfoStat, Córdoba (Argentina): Universidad Nacional de Córdoba, FCA, 2004. [ Links ]
[13]ERNEST, E.G., FALCONÍ-CASTILLO, E., PERALTA-IDROVO, E. y KELLY, J. Encuesta a productores para orientar el fitomejoramiento en frijol en Ecuador. Agronomía Mesoamericana, 19(1), 2008, p. 7-18. [ Links ]
[14]RIBEIRO-COSTA, G. Estratégias para o manejo integrado da mela do feijoeiro causada por Thanatephorus cucumeris [Tese de Doutorado em Fitopatologia]. Brasília D.F. (Brasil): Universidade de Brasília, Instituto de Ciências Biológicas, 2007, 114 p. [ Links ]
[15]RODRÍGUEZ, E., LORENZO, E., ACOSTA, M., GONZÁLEZ, F., MORA, B. y GODOY, G. Manejo de la mustia hilachosa (Thanatephorus cucumeris (Frank)) en el cultivo del frijol común (Phaseolus vulgaris L.). Agronomía Mesoamericana, 10(1), 1999, p. 99-108. [ Links ]
[16]NECHET, K.L. e HALFELD-VIEIRA, B.A. Reação de cultivares de feijão-caupi à mela (Rhizoctonia solani) em Roraima. Fitopatologia Brasileira, 32, 2007, p. 424-428. [ Links ]
[17]BEAVER, J.S., GODOY, C., ROSAS, J.C. y STEADMAN, J. Estrategias para seleccionar frijol común con mayor resistencia a mustia hilachosa, Agronomía Mesoamericana, 13(1), 2002, p. 67-72. [ Links ]
[18]ALEXOPOULOS, G.J., MIMS, C.W. and BLACKWELL, M. Introductory Mycology. 4 ed. New York (United States of America): Jhon Wiley & Sons, 1996, 869 p. [ Links ]
[19]BARNETT, H.L. and HUNTER, B.B. Ilustrated Genera of Imperfect Fungi. 4 ed. St. Paul (United States of America): American Phytopathological Society, 1998, 218 p. [ Links ]
[20]MENEZES, M. e OLIVEIRA, S.M.A. Fungos Fitopatogênicos. Recife (Brasil): Imprensa Universitária da UFRPE, 1993, 277 p. [ Links ]
[21]SMITH, W.H. Germination of Macrophomina phaseolina sclerotia as effected by Pinus lambertiana root exudate. Canadian Journal of Microbiology, 15, 1968, p. 1387-1391. [ Links ]
[22]MICHEREFF, S.J., ANDRADE, E.G.T.D. e MENEZES, M. Ecologia e manejo de patógenos radiculares em solos tropicais. Recife (brasil): Imprensa Universitária da UFRPE, 2005, 398 p. [ Links ]
[23]DHINGRA, O.D. Teoria da transmissão de patógenos fúngicos por sementes. Em: Sementes: Qualidade Fitosanitaria (Zambolim, L.), Viçosa (Brasil): Universidade Federal de Viçosa, 2005, p. 75-112. [ Links ]
[24]MERTZ, L.M., HENNING, F.A., SOUZA MAIA, D.M., MENEGHELLO, G.E., HENRIQUES, A. e MADAIL, R. Qualidade fisiológica e sanitária de sementes de feijão-miúdo beneficiadas em mesa gravitacional. Revista Brasileira de Sementes, 29(3), 2007, p. 1-08. [ Links ]
[25]OLIVEIRA, J.A., BASTOS DE ANDRADE, M.J. e FRAGA, A.C. Eficiência de fungicidas no tratamento de sementes de feijão (Phaseolus vulgaris L.) para o controle da podridão radicular causada por Rhizoctonia solani Kuhn. Revista Brasileira de Sementes, 19(1), 1997, p. 91-95. [ Links ]
[26]FRANCISCO, F.G. and USBERTI, R. Seed health of common bean stored at constant moisture and temperature. Sci. Agric., 65(6), 2008, p.613-619. [ Links ]
[27]VIANA, F.M.P. e de SOUZA, N.L. Efeito da interação temperatura-tensão de água sobre germinação de microescleródios de Macrophomina phaseolina. Fitopatologia Brasileira, 27(3), 2002, p. 268-272. [ Links ]
[28]MAYEK-PÉREZ, N., LÓPEZ-CASTAÑEDA, C., LÓPEZ-SALINAS, E. y ACOSTA-GALLEGOS, J.A. Herencia de la resistencia genética a Macrophomina phaseolina (Tassi) Goid. en frijol. Agrociencia, 35(6), 2001, p. 637-648. [ Links ]
[29]GONZÁLEZ, M. y GARCÍA, E. Evaluación de fungicidas en el control de la roya del frijol (Uromyces appendiculatus). Agronomía Mesoamericana, 7(1), 1996a, p. 86-89. [ Links ]
[30]GONZÁLEZ, M. y GARCÍA, E. Evaluación de la resistencia a la roya (Uromyces appendiculatus) en 64 variedades de frijol común en Cuba. Agronomía Mesoamericana, 7(1), 1996b, p. 90-94. [ Links ]
[31]GONZÁLEZ, M. y GARCÍA, E. Evaluación de las pérdidas por roya en frijol (Phaseolus vulgaris L.) en diferentes épocas de siembra en cuba. Agronomía Mesoamericana, 7(1), 1996c, p. 95-98. [ Links ]
[32]GODOY, M.L., DÍAZ, C.G., VÁSCONEZ M.G., DEFAZ D.E. y GONZÁLEZ O. B. Evaluación de dos variedades de fréjol durante tres épocas de siembra bajo sistema de cultivo asociado con maíz. Ciencia y Tecnología, 4(1), 2011, p. 5-11. [ Links ]
[33]LEÓN, S.LL., FAURE, Á.B., RODRÍGUEZ, M.O., BENÍTEZ, G.R., SUÁREZ, G.Y. y RODRÍGUEZ, R.R. Selección de nuevas variedades de frijol común (Phaseolus vulgaris L.) frente a las principales enfermedades del cultivo en Cuba. Fitosanidad, 12(1), 2008, p. 27-31. [ Links ]
[34]NAVARRETE-MAYA, R. y ACOSTA-GALLEGOS, J. Reacción de variedades de frijol común a Fusarium spp. y Rhizoctonia solani en el Altiplano de México. Agronomía Mesoamericana, 10(1), 1999, p.37-46. [ Links ]
[35]ECHEMENDÍA-GÓMEZ, A.J., RAMOS-GONZÁLEZ, P.L., PERAL-PÉREZ, R., PORRAS-GONZÁLEZ, A.C. y GONZÁLEZ-ARIAS, G.A. Selección de genotipos de frijol común (Phaseolus vulgaris L.) resistentes al virus del mosaico dorado amarillo del frijol (BGYMV) por hibridación de ácidos nucleicos. Fitosanidad, 11(4), 2007, p. 3-11. [ Links ]
[36]JULIATTI, F.C., MORAES, S.A., SILVA, H.D. e BORGES, M.H.C. Seleção de progênies de feijoeiro F4 resistentes ao Bean Golden Mosaic Virus. Fitopatologia Brasileira, 30, 2005, p. 279-285. [ Links ]
[37]MIRANDA, D.B.A., LOBO-JÚNIOR, M. e CUNHA, M.G. Reação de cultivares do feijoeiro comum às podridões radiculares causadas por Rhizoctonia solani e Fusarium solani f. sp. phaseoli. Pesquisa Agropecuária Tropical, 37(4), 2007, p. 221-226. [ Links ]
[38]HARTMAN, G.L., SINCLAIR, J.B. and RUPE, J.C. Compendium of Soybean Diseases. 4 ed. St. Paul (United States of America): American Phytopathological Society, 1999, 100 p. [ Links ]
[39]CARDOSO, J.E. e COSTA, J.L. da S. Interações entre fungos de solo patógenos do Caupi. Fitopatologia Brasileira, 13(2), 1988, p. 143. [ Links ]
[40]PIECZARKA, D.J. and ABAWI, G.S. Effect of Interaction Between Fusarium, Pythium, and Rhizoctonia on severity of Bean Root Rot. Phytopathology, 68(3), 1978, p. 403-408. [ Links ]
[41]CASA, R.T., KRIEGER, I., KUHNEM JUNIOR, P.R., BOGO, A., MOREIRA, E.N. e PONTEL RIZZI, F. Podridão radicular em feijão no sistema plantio direto. Revista de Ciências Agroveterinárias, 10(1), 2011, p. 37-43. [ Links ]