Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biotecnología en el Sector Agropecuario y Agroindustrial
versão impressa ISSN 1692-3561
Rev.Bio.Agro vol.11 no.1 Popayán jan./jun. 2013
EFICIENCIA DE CONSORCIOS MICROBIANOS PARA TRATAMIENTO DE AGUAS RESIDUALES EN UN SISTEMA DE RECIRCULACIÓN ACUÍCOLA
EFFICIENCY OF MICROBIAL CONSORTIUM FOR WASTEWATER TREATMENT IN A RECIRCULATING AQUACULTURE SYSTEM
EFICIÊNCIA DE CONSÓRCIOS MICROBIANOS NO TRATAMENTO DE ÁGUAS RESIDUÁRIAS NUM SISTEMA DE RECIRCULAÇÃO AQÜÍCOLA
IVÁN ANDRÉS SÁNCHEZ O.1, DOLLY MARGOT REVELO R.2, ÁLVARO E. BURBANO M.3, ROBERTO GARCÍA C.4, CAMILO GUERRERO R.5
1Ingeniero Civil M.Sc. Profesor Asistente Dpto. de Recursos Hidrobiológicos Universidad de Nariño, Pasto
2 Bióloga M.Sc. Profesora Departamento de Biología, Universidad de Nariño
3 Ingeniero en Producción Acuícola M.Sc. Profesor Departamento de Matemáticas, Universidad de Nariño
4Ingeniero en Producción Acuícola. Profesor Departamento de Recursos Hidrobiológicos, Universidad de Nariño
5 Ingeniero en Producción Acuícola. Laboratorista Dpto. de Recursos Hidrobiológicos, Universidad de Nariño
Correspondencia: iaso@udenar.edu.co
Recibido para evaluación: 19/11/2011. Aprobado para publicación: 20/10/2012.
RESUMEN
Los filtros biológicos viabilizan el reuso de aguas residuales (AR) en sistemas de recirculación acuícola (SRA), su desempeño depende entre otros factores, del tipo de filtro, medio soporte e inóculo utilizado. Se evaluaron las eficiencias de diferentes inóculos para el tratamiento de AR provenientes del cultivo de trucha arcoiris mediante biofiltros de flujo ascendente en un SRA. Se utilizó un tanque para cultivo con control de nivel, un filtro con bolsas de lienzo para retención de sólidos y seis biofiltros de diámetro 3" con arena como medio soporte y tiempo de retención hidráulica (TRH) de 11 min. Los inóculos utilizados fueron: R1-control: aguas del SRA; R2-lodos estación piscícola; R3-agua laguna aereada relleno sanitario Antanas (RSA); R4-sedimentos de acuarios; R5-lodos laguna aereada RSA; R6-lodos reactor sulfidogénico RSA. No hubo diferencias estadísticamente significativas entre los reactores para remoción de DQO, fósforo, amoniaco y nitritos, cuyas remociones medias fueron de 45,3; 15,1; 4,7 y 27,2% respectivamente. Hubo diferencias estadísticas entre reactores para remoción de color y nitratos, las mejores eficiencias fueron para: color R6:38,8% y R1:37,3%; para nitratos R5:47,3% y R6:42,8%; demostrándose la influencia de consorcios microbianos en los SRA.
PALABRAS CLAVE: Acuicultura, Conservación del agua, Filtros biológicos, Consorcios microbianos
ABSTRACT
Biological filters enable wastewater reuse in recirculating aquaculture system (RAS), their performance depends upon some factors, as biofilter type, supporting media and inocculant used. The efficiency of different inoculants for the wastewater treatment (WWT) from rainbow trout farming by using upflow biofilters in a RAS were evaluated. A plastic tank for fries farming with water level control, a filter with fabric bags for solids retention and six upflow biofilters of 3" diameter with sand as carrier and hydraulic retention time (HRT) of 11 min were used. The used inoculants were: R1-Control: RAS water; R2-slugdes from a fish culture farm; R3- water from aerated lagoon of Antanas landfill (AL); R4-aquarium sediments; R5-sludges from aerated lagoon of AL; R6-sludges from sulfidogenic reactor of AL. There no were significant differences registered between the reactors for COD, phosphorous, ammonium, and nitrite removal, which average removal efficiencies were 45,3; 15,1; 4,7 and 27,2% respectively. There were significant differences registered between reactors for color and nitrates removal, the best efficiencies were: color R6:38,8% and R1:37,3%; nitrates R5:47,3% and R6:42,8%; demonstrated the influence of microbial consortia in the RAS.
KEYWORDS: Aquaculture, Biological filters, Water conservation, Microbial consortium
RESUMO
Os filtros biológicos viabilizam o reuso de águas residuárias (AR) em sistemas de recirculação aqüícola (SRA), o seu desempenho depende, entre outros fatores, do tipo de biofiltro, meio suporte e do inoculo utilizado. Foram avaliadas as eficiências de diferentes inóculos para o tratamento de AR da criação de truta arco-íris por meio de biofiltros de fluxo ascendente num SRA. Foi utilizado um tanque para criação com controle do nível; um filtro com sacolas de tela para retenção dos sólidos e seis biofiltros de diâmetro 3" com areia como meio suporte e tempo de retenção hidráulica (TRH) de 11 min. Os inóculos utilizados foram: R1-controle: águas do SRA; R2-lodos estação piscícola; R3-água lagoa aerada aterro sanitário Antanas (ASA); R4-sedimentos de aquários; R5-lodos lagoa aerada ASA; R6-lodos reator sulfidogénico ASA. Não houve diferenças estatisticamente significativas entre os reatores para remoção de DQO, fósforo, amônio e nitritos, cujas remoções médias foram de 45,3; 15,1; 4,7 e 27,2% respectivamente. Houve diferenças estatísticas entre reatores para remoção de cor e nitratos, as melhores eficiências foram para: cor R6:38,8% e R1:37,3%; nitratos R5:47,3% e R6:42,8%; demonstrando a influência de consórcios microbianos nos SRA.
PALAVRAS-CHAVE: Aqüicultura, Conservação da água, Filtros biológicos, Consórcio microbiano
INTRODUCCIÓN
En el SRA de esta investigación se tuvo en cuenta la importancia de la capacidad de los microorganismos para actuar en consorcio sobre el tratamiento de AR de acuacultura, en particular en reactores aerobios de lecho fijo y flujo ascendente.
Los biofiltros son reactores que incluyen un medio fijo para la unión y crecimiento de microorganismos en forma de biopelícula o en suspensión [1]; existen grandes diferencias en la densidad y composición bacteriana entre diferentes SRA [2]; además, debido a que cada especie de pez introduce su microbiota nativa, la diversidad del filtro varía de un SRA a otro [2].
La calidad del agua de un SRA se ve afectada por la presencia y acumulación de heces, alimento no digerido, parásitos y flocs bacterianos que pueden incrementar el estrés de los organismos cultivados [3]. Los lodos son fuente de importantes microorganismos que usan compuestos orgánicos e inorgánicos en sus procesos metabólicos contribuyendo al tratamiento de las AR, por ello es pertinente evaluar consorcios microbianos de origen diferente.
En los sistemas de cultivo de productos acuáticos, se excretan altos niveles de nitrógeno amoniacal debido al alto contenido de proteína del alimento y a la alta densidad de producción; por lo tanto, no solo hay que mantener en niveles aceptables el amonio, sino también las concentraciones de nitrito, CO2 y sólidos suspendidos o carga orgánica [4].
El amonio es el principal producto de desecho del catabolismo de proteínas y es excretado como amonio ionizable por los organismos acuáticos; en el agua el amonio existe en dos formas: amonio no ionizado, NH3-, y amonio ionizado, NH4+, la concentración relativa de cada una de estas formas es primariamente una función del pH, de la temperatura y de la salinidad. Las funciones de los microorganismos son claves ya que la materia orgánica (MO) es mineralizada por bacterias heterotróficas sobre los filtros y sobre el agua de cría y el nitrógeno de las proteínas es descompuesto a amonio por las enzimas bacterianas. Brambilla et al. [3] y Schreirer et al. [1] detallan las principales actividades asociadas con las unidades de la biofiltración de los SRA y los microorganismos participantes, se destacan los siguientes procesos: nitrificación (oxidación del amonio y oxidación del nitrito), desnitrificación (autotrófica dependiente de sulfito y heterotrófica), reducción desasimilativa del nitrato a amonio, oxidación anaeróbica del amonio (anammox), reducción del sulfato, oxidación del sulfito y metanogénesis; pese a que la identidad de los microorganismos presentes en un biofiltro aún es ampliamente desconocida [5, 2], las comunidades bacterianas son importantes al igual que los peces en términos de los procesos directamente relacionados con su actividad y su efecto sobre la calidad del agua [6], en este sentido algunos de los principales parámetros para especies de agua fría, tales como la trucha son (mg/L): Nitrógeno Amoniacal Total (<1), NH3-N (<0,02), Nitrito-N (<0,1) y Fósforo (0,01-3) [7]. Por su parte, la legislación ambiental Colombiana establece los valores permisibles de ciertos parámetros de calidad del agua para vertimientos en cuerpos receptores [8, 9].
El objetivo de esta investigación fue estimar la eficiencia de seis diferentes consorcios microbianos inoculados sobre filtros de lecho fijo y flujo ascendente destinados al tratamiento de AR de un SRA para cultivo de trucha arcoiris, evaluando DQO, color, fósforo, amonio, nitritos y nitratos.
MÉTODO
Localización
El proyecto se desarrolló en el laboratorio de hidráulica y recirculación del programa de Ingeniería en Producción Acuícola (IPA), Departamento de Recursos Hidrobiológicos de la Universidad de Nariño, a 2540 msnm.
Infraestructura y funcionamiento del sistema
El SRA estuvo conformado por un tanque de cultivo en fibra con diámetro 1,28 m, altura de 0,87 m y un volumen de 0,991 m3, en él se distribuyó el aire proveniente de un blower por tubería PVC y manguera de ½" con piedra difusora. El drenaje central con rebalse externo en tubería PVC estuvo acoplado a una caja reguladora de nivel.
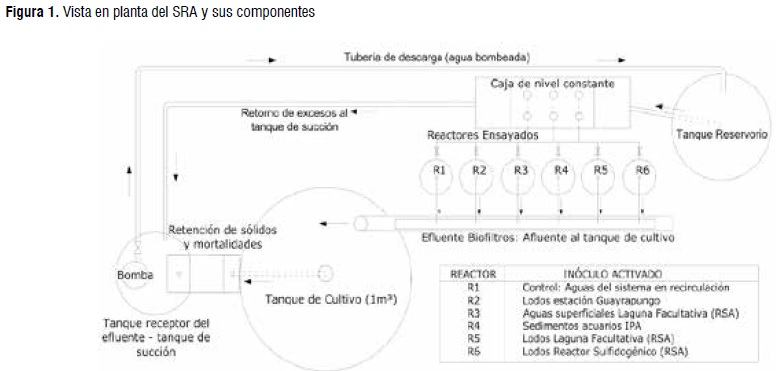
Como pre-tratamiento del efluente la caja de control de nivel tuvo dos placas perforadas y un filtro de bolsa en lienzo, soportado en tubería perforada de PVC de 4" dentro de un tanque de succión donde una bomba sumergible elevó el líquido hacia un tanque reservorio que reguló el flujo hacia una caja de nivel constante (CNC) en acrílico, desde la que se distribuyó el agua por gravedad en manguera hacia los 6 biofiltros ensayados. La vista en planta del SRA evaluado se presenta en la Figura 1.
os reactores de flujo ascendente se construyeron en tubería PVC sanitaria de 3" de diámetro y altura de 1,0 m. El caudal se controló con válvulas tipo bola de PVC. El efluente de los reactores se colectó en un canal que retornó el líquido mezclado hacia el tanque de cultivo. Para uniformizar la velocidad del flujo los biofiltros tuvieron en su base un falso fondo en lámina acrílica perforada con 115 agujeros de diámetro 3,57 mm, sobre ella se dispusieron tres capas granulares, con carga hidráulica de 0,15 m y borde libre de 0,05 m.
Equipo
Se utilizó: blower marca Sweetwater; motobomba sumergible Pedrollo de 0,5 HP; colorímetro HACH DR 700; conductivímetro portátil HACH CO-150; balanzas para 4000 ± 0,1 g y 160±0,01 mg; cabina de flujo laminar; espectrofotómetro UV-VIS Lambda 11; horno para secado de muestras; mufla; oxímetro YSI 50A; pH metro pH 56; termómetro; reactor COD HACH; estufa.
Materiales
Se utilizaron: redes y nasas; jeringas; ictiómetro; bala de oxígeno; balanceado comercial; piedras difusoras; serie de tamices de Taylor números 20, 40, 60 y 80; tanque de 1 m3; tanques plásticos de 100 L; alevines de trucha arcoiris (Onchorynchus mykiss) provenientes de la estación de jaulas flotantes IntiYaco de la Universidad de Nariño, ubicada en el lago Guamués.
Transporte de animales, aclimatación en laboratorio
Los ejemplares se sometieron a ayuno previo de 24 horas, se empacaron en bolsas plásticas con 1/3 de agua y con 2/3 de volumen de oxígeno. En cada bolsa se agregaron 15 g de NaCl, como tratamiento profiláctico, se introdujeron en un tanque de 1,0 m3 por 15 min para homogeneizar la temperatura del líquido y con recambios se homogenizó pH, los animales se mantuvieron en él por 7 días, suministrándoles alimento a saciedad.
Muestreo, manejo y alimentación
El peso promedio inicial de los animales fue 24,11 ± 5,9 g, durante el período de preensayo (1,5 meses) se midieron peso y longitud para calcular la ración alimenticia diaria. Se utilizó balanceado comercial con 48% de proteína, la cantidad de suministrada diariamente se calculó con una tasa de alimentación del 3% del peso vivo, distribuyéndose en tres comidas. El segundo muestreo se realizó a los 30 días de la siembra; los muestreos subsecuentes se tomaron cada quince días. El incremento de peso periódico se calculó como la diferencia entre los promedios de peso final menos el peso inicial entre el tiempo.
Monitoreo de parámetros fisicoquímicos
De la CNC y los efluentes de cada reactor se tomaron muestras compuestas en horario de la mañana para los análisis físico-químicos, según los protocolos definidos por APHA - AWWA - WPCF [10]. Los parámetros monitoreados diariamente fueron: pH, CO2, alcalinidad (Alc), dureza (Dur), temperatura (Tem) y oxígeno disuelto (OD); los monitoreados dos veces por semana fueron: DQO, fósforo (P), color aparente, amonio (NH4+), nitritos (NO2-), nitratos (NO3-). Con base en los resultados obtenidos se calcularon las respectivas eficiencias de remoción.
Inoculación de los reactores
Los inóculos y los medios de cultivo aplicados para el medio soporte de los reactores fueron: R1-control, agua del SRA agua destilada esterilizada (ADE); R2-lodos y agua filtrada y esterilizada estación Guayrapungo; R3-agua superficial laguna aireada relleno sanitario Antanas (RSA), medio de cultivo según Shi et al. [11]; R4-sedimentos acuarios y agua de acuario filtrada IPA; R5-lodos laguna aereada RSA, medio de cultivo según Molinuevo et al. [12]; R6-lodos reactor sulfidogénico RSA, ADE - lixiviado (1:1), según Burbano [13].
Caracterización de bacterias cultivables
Se hicieron dos recuentos de bacterias al inicio y final del experimento, para ello se tomaron 10 g de arena de cada reactor y se suspendieron en 90 mL de solución de nutrientes esterilizada. Para liberar las bacterias adheridas a las partículas de arena se empleó agitación en Shaker por 24 horas a 180 rpm. Posteriormente se hizo recuento de células viables empleando el método de dilución seriada y siembra en placa utilizando medios de cultivo selectivos y/o diferenciales para bacterias oxidantes de amonio (BOA) [14], oxidantes de nitrito (BON), desnitrificantes, termorresistentes, productoras de pigmentos, precipitantes de hierro y reductoras de sulfato (BRS) [15].
Caracterización materiales granulares
Cada filtro estuvo conformado por tres capas de material granular: una primera capa de triturado con tamaños de 3/8" a #4, seguida por una de material de tamaño #4 a #8, cada una con altura de 0,05 m. Sobre la segunda capa se colocaron 0,60 m de la arena utilizada como medio filtrante tamaño #20 a #40, localizadas en ese orden según el sentido del flujo ascendente.
La caracterización de los materiales se basó en los procedimientos establecidos en las Normas Técnicas Colombianas: Absorción y densidad para agregados gruesos, NTC 176 [16]; análisis por tamizado para agregados finos y gruesos, NTC 77 [17]. Se calcularon los coeficientes de uniformidad (CU) y de curvatura (CC) del material con base en las ecuaciones descritas por IMTA [18].
Manejo Hidráulico del sistema
El TRH de operación de los biofiltros fue de 11 min; sin embargo, debido a la variabilidad presentada por la colmatación del medio, fue necesario abrir las válvulas para restaurar el flujo y garantizar el TRH. En los 6 reactores se registró un caudal medio de 1,92 L/min, representando para el tanque un recambio cada 8,58 h, inferior al recomendado por Timmons et al. [7].
La colmatación del medio soporte hizo necesario el lavado de los biofiltros con interrupción de la filtración, retiro de los medios granulares y lavado con agua declorinada para remoción de los sólidos. Una vez lavados los medios se separaron por tamizado y se retornaron a los biofiltros.
Diseño experimental, análisis estadísticoLos parámetros que reportan eficiencia del sistema (color, NO2-, NO3-, NH4+, P y DQO) se muestrearon 2 veces por semana. Ya que la colmatación de los filtros requirió del lavado del medio soporte se consideró el tiempo entre el lavado como un factor de bloqueo, por ello se corrió un diseño de bloques aleatorios con submuestreo y se utilizó el paquete estadístico SAS versión 9,0. Tales parámetros cumplieron con los supuestos de normalidad y homoscedasticidad con excepción del color y los parámetros monitoreados diariamente (pH, CO2, Alc, Dur, Tem y OD), para los cuales se optó por la prueba no paramétrica de Kruskal-Wallis, con el paquete estadístico Statgraphics® Centurión XVI.
RESULTADOS
Granulometría y densidad del medio granular compuesto
Las densidades de los materiales utilizados en las unidades de biofiltración fueron: para la arena #20-#40: 2,68 g/cm3; material #8-#20: 2,23 g/cm3; #4-#8: 2,67 g/cm3.
A partir de la granulometría del material compuesto, se obtuvieron los valores de D60=0,70 mm; D10=0,45 mm y D30=0,52 mm, los valores calculados de CC y CU fueron de 0,86 y 1,55 respectivamente. Aunque la arena fue altamente uniforme por estar entre los tamices #20 y #40, no hubo uniformidad en el material compuesto por la variedad de tamaños y un CC cercano a 1.
Incremento de peso periódico
La carga inicial del sistema fue de 0,83 kg/m3. El incremento promedio diario de peso fue de 1,58 g/d, valor similar al reportado por Paredes y Montenegro [19], de 1,7 g/d en alimentación de trucha arcoiris con implementación de un promotor natural de crecimiento.
Datos de los parámetros de calidad del agua
Parámetros medidos diariamente pH. Hubo diferencias significativas entre las medianas de los reactores R2, R3, R4, R5 y R6 con respecto a la entrada o afluente bruto (AB). El R1 no mostró diferencias con respecto al AB. Los valores: mínimo, medio y máximo de pH registrados en los reactores fueron de 4,3; 5,1 y 7,0 respectivamente; además, los valores medios calculados para cada uno de los reactores fueron mayores o iguales a 5, lo que los ubica en el rango de valores permitido por la legislación ambiental vigente para vertimiento de efluentes líquidos [8, 9].
El R1-control fue colonizado principalmente por microorganismos provenientes del tanque de cultivo, lo que pudo propiciar su trabajo en rangos de pH similares a los de éste. En general los reactores tendieron a acidificarse a lo largo del tiempo, ello contribuyó a que la fracción no ionizada del amonio se mantuviera en bajos rangos [7], permaneciendo así la forma menos tóxica del amoniaco en la unidad de cultivo.
CO2. No hubo diferencias significativas entre las medianas de valores de CO2 en el efluente de los reactores ni con respecto al valor del AB. Este parámetro registró un valor medio de 16 mg/L, según Timmons et al. [7], está dentro de los rangos normales para condiciones de cultivo prolongadas.
Alcalinidad y dureza. Hubo diferencias significativas entre las medianas de los valores de Alc de los reactores R2, R3, R4 y R6 con respecto al AB. Los valores de Alc fueron en general bajos, con promedio de 2,9 mg/L de CaCO3, aumentando después de los recambios parciales.
Los reactores no registraron diferencias estadísticas significativas para Dur cuyos valores oscilaron de 19 a 21 mg/L, cercanos al límite inferior recomendado para acuacultura [7], ello pudo incidir sobre los bajos niveles de pH.
Los bajos valores de Alc podrían asociarse a los procesos microbianos relativos a la nitrificación en la cual por cada g de amoníaco nitrificado se requiere de 7,14 g de alcalinidad [7]. En el proceso de nitrificación hay una significativa cantidad de Alc consumida por bacterias autotróficas que la usan como fuente de carbono inorgánico y se producen altos niveles de CO2, para aguas con baja Alc inicial esto puede ser un limitante y requieren de la adición de Alc para mantener una adecuada concentración (100 a 150 mg/L CaCO3), si el consumo de Alc no es compensado, el pH del sistema cae y los bajos pH pueden resultar en unas especies de carbono inorgánico que cambian de bicarbonato a CO2 disuelto y el incremento de éste podría afectar algunas especies acuícolas ya que el producto final de la reacción es nitrógeno-nitrato que en moderadas concentraciones normalmente no es tóxico [4]. La nitrificación es atribuida a bacterias que incluyen BOA, BON y bacterias de anammox [1, 20], los recuentos de bacterias cultivables realizados en esta investigación (datos no mostrados) indicaron la presencia de bacterias del ciclo del N en los reactores.
Temperatura. No hubo diferencias significativas entre los reactores, los valores registrados durante la investigación variaron entre 14 y 16°C, en los rangos recomendados para el cultivo de trucha arcoiris [7], esto influyó en la ganancia de peso y el crecimiento obtenidos. De igual manera, dichas temperaturas se encuentran dentro del rango de valores apropiados para el vertimiento de efluentes líquidos en cuerpos receptores definidos por la legislación ambiental [8, 9].
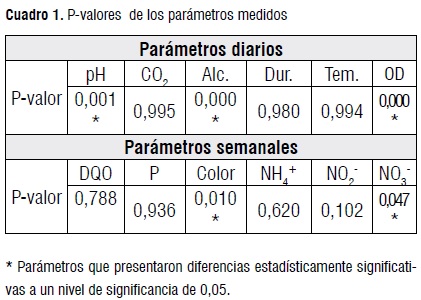
Oxígeno disuelto. Aunque no hubo diferencias entre las medianas de los reactores, todos difirieron respecto al AB, cuya concentración osciló entre 3,8 y 4,8 mg/L. En los efluentes de los reactores se registraron valores entre 1 y 2 mg/L y un promedio de 1,6 mg/L. Esta situación evidenció el consumo de OD por los procesos biológicos del tratamiento de AR en los reactores. El OD es demandado a la entrada de los biofiltros por las bacterias heterotróficas, lo que suele limitar los procesos de nitrificación, pues por cada g de nitrógeno amoniacal oxidado a nitrito se requieren 4,57 g de oxígeno. Timmons et al. [7] afirmaron que niveles de 2 mg/L de OD en el efluente de biofiltros son adecuados para mantener a un máximo la tasa de nitrificación. El Cuadro 1 presenta los P-valor de los parámetros medidos en el AB y en los reactores.
DQO. Hubo diferencias altamente significativas para remoción de DQO en el tiempo pero no entre reactores (Cuadro 1). El lavado afectó positivamente la remoción de MO según las eficiencias alcanzadas en el segundo bloque (Figura 2), ya que se propició la retención progresiva de sólidos y se garantizó flujo homogéneo de agua que conlleva a la mayor disponibilidad de OD. En ambos bloques los porcentajes de remoción oscilaron entre el 30,1 y el 61,5%, tales valores fueron similares o ligeramente inferiores a las eficiencias reportadas por algunos autores para filtros percoladores [21, 22]; de igual manera, fueron menores a las reportadas para biofiltros aireados sumergidos [23].
Las concentraciones medias reportadas en los efluentes de los reactores R1, R2, R3, R4, R5 y R6 fueron de 17,3; 17,3; 16,6; 15,8; 15,4 y 14,7 mg/L respectivamente, valores inferiores a los límites máximos exigidos por la legislación ambiental [9].

Algunas de las bacterias heterotróficas que descomponen la MO pertenecen a géneros como Bacillus (bacterias termorresistentes) y Pseudomonas (bacterias productoras de pigmentos). Estas últimas además pueden realizar funciones de desnitrificación [20]. Diversas bacterias pueden emplear compuestos orgánicos constituidos por hierro y lo logran precipitar como una señal del uso del sustrato (bacterias del ciclo del hierro) en la obtención de energía. En esta investigación se confirmó en los reactores la presencia de bacterias termorresistentes, productoras de pigmentos y bacterias precipitantes de hierro, en los recuentos realizados (datos no mostrados).
Fósforo. Según los resultados del ANOVA hubo diferencias significativas para la remoción de P respecto al tiempo pero no hubo diferencias entre reactores (Cuadro 1).
Los reactores R1, R2, R3, R4, R5 y R6 reportaron unas eficiencias promedio de remoción del P de 16,9; 9,4; 8,6; 13,7; 13,9 y 27,9% respectivamente. En términos generales, la remoción de P fue mayor durante el primer bloque, el lavado incidió negativamente, excepto para el R6 que presentó eficiencias cercanas al 30% en ambos bloques. El R6 se inoculó con lodo sulfidogénico, en el cual se destacan BRS, se ha asumido que estas bacterias coexisten con las bacterias desnitrificantes del azufre [24], Barak y van Rijn [25] demostraron que la remoción de fosfato del agua en el sistema fue principalmente mediado por organismos desnitrificantes, lo que podría explicar los resultados obtenidos para esta investigación.
Color. Hubo diferencias significativas para la remoción de color en el tiempo y entre reactores (Cuadro 1); lo cual se confirmó con la prueba LSD que reveló tres grupos de reactores: R5, R6, R1; R2; y R4, R3. Las eficiencias medias de remoción de color calculadas para los reactores R1, R2, R3, R4, R5 y R6 fueron de 37,3; 30,8; 11,0; 16,8; 35,2 y 38,8% respectivamente. Cabe resaltar que para el R6, que presentó el mayor porcentaje de remoción de este parámetro, sobresalieron los recuentos de bacterias termorresistentes, precipitantes de hierro y colonias pigmentadas de BRS.
Amonio. No hubo diferencias en cuanto a su remoción ni en el tiempo ni entre los reactores (Cuadro 1). La Figura 3 ilustra los promedios de eficiencia de remoción de NH4+ en los reactores para los dos bloques establecidos por el tiempo.
La similitud en las eficiencias de remoción pudo deberse a que el tiempo de maduración de los inóculos en los biofiltros no fue suficiente para demostrar los efectos de cada uno. Algunos investigadores han demostrado que es necesario un periodo de aclimatación que puede ser alcanzado por una carga ligera inicial con el organismo o con adición de amonio y nitrito, siendo los tiempos normales de aclimatación de 2 a 3 semanas o mayores [26, 27].
Se observó una disminución de la remoción de NH4+ posterior al lavado (Figura 3). La oxidación del NH4+ es función principal de bacterias del ciclo del nitrógeno (N) bajo condiciones aeróbicas o anaeróbicas; el conteo de bacterias de esta investigación (datos no mostrados) demostró la presencia de BOA y BON en todos los reactores. Sin embargo, en el proceso anammox, el NH4+ que es oxidado a nitrito bajo condiciones anóxicas (anammox) requiere menos del 50% de oxígeno comparado con los procesos de nitrificación-desnitrificación y no hay adición de donadores de electrones in(orgánicos) [5]. Probablemente las bacterias de anammox en SRA están simultáneamente activas por las bacterias nitrificantes. Esto podría significar que en los sistemas de acuacultura, las BOA o las arqueas oxidantes de amonio (AOA), convierten el amonio excretado por los peces, bajo condiciones óxicas en nitrito. Este nitrito y el amonio adicional es luego usado por las bacterias de anammox en partes anóxicas del reactor para formar gas nitrógeno, removiendo tanto nitrito como amonio a partir del sistema sin necesidad de la desnitrificación [5].
Nitritos. No hubo diferencias significativas para la remoción de nitritos entre los reactores (Cuadro 1) pero si influyó el tiempo. Las eficiencias promedio de remoción de NO2- en los reactores R1, R2, R3, R4, R5 y R6 fueron de 39,2; 26,0; 18,0; 22,3; 33,3 y 25,3% respectivamente.
Se observó que la remoción de nitrito fue diferente en cada bloque, por ello se concluye que el lavado afectó esta remoción, cuyo valor aumentó después del lavado en los reactores R1; R2; R4; y R5. La remoción de NO2- es atribuida a las bacterias nitrificantes que comprenden las BOA, las BON y las bacterias de annamox [1, 20]. Se registraron algunos valores de eficiencia negativos, lo que sugiere prevalencia temporal de los procesos de oxidación de NH4+ con relación a los de oxidación del NO2-. Los recuentos bacterianos realizados a partir de cada reactor (datos no mostrados) sugirieron predominancia de las bacterias nitrificantes y también la presencia de BRS, las cuales pueden utilizar otros aceptores de electrones que no contienen azufre e incluyen NO3- y NO2-, hierro férrico, arsenato, cromato y uranio, y sorprendentemente O2, considerando la naturaleza anaeróbica estricta de las BRS [28].
Nitratos. Según los resultados de la ANOVA, hubo diferencias significativas en la remoción de NO3- entre los reactores (Cuadro 1) y también influyó el tiempo. La Figura 4 presenta los promedios de eficiencia de remoción de NO3- en los reactores para los dos bloques.
Cada reactor presentó diferente eficiencia en la remoción de nitratos, la que fue principalmente afectada por el lavado en R3 y R4. En ambos bloques el R5 presentó la mayor remoción de NO3-, del orden del 47%, seguido por el R6. El R3 presentó la más baja eficiencia con un valor del 1,8%.
La remoción de nitratos puede atribuirse a las bacterias desnitrificantes, las cuales reducen el nitrato en gas dinitrógeno por las metaloenzimas nitrato reductasa (Nar), nitrito reductasa (Nir), reductasa del óxido nítrico (Nor) y reductasa del óxido nitroso (Nos) [20]. Estas bacterias presentaron altos recuentos (datos no mostrados) en todos los reactores y en ambos bloques, tal prevalencia podría sustentar las diferencias obtenidas en la remoción de nitrato. Cabe resaltar que para el R5 se obtuvo un recuento sobresaliente de bacterias heterotróficas (productoras de pigmentos y precipitantes de hierro).
El lavado incidió en la eficiencia de remoción de NO3- pues fue mayor en el bloque 1, indicando que la función de las bacterias desnitrificantes se pudo afectar en el segundo bloque ya que el lavado permitió mejor circulación de agua, la cual porta OD; esta explicación puede aplicarse al R3, reactor al que se pudo haber realizado un lavado más agresivo generando una eventual pérdida de estas bacterias. Adicionalmente, en el bloque 2 y para el R3 no se obtuvo crecimiento de BOA (datos no mostrados), las cuales aportan en su reacción bioquímica nitrato lo que pudo influir en los resultados obtenidos.
CONCLUSIONES
El SRA reportó diferencias estadísticamente significativas de la eficiencia de consorcios microbianos para la remoción de color y nitratos.
El consorcio microbiano de los lodos laguna aereada RSA (R5) fue más eficiente en cuanto a la remoción de nitratos con un valor medio de 47,3%.
El inóculo de lodos reactor sulfidogénico RSA (R6) presentó la mejor eficiencia de remoción de color (38,8%).
No se registraron diferencias estadísticamente significativas entre los reactores para remoción de DQO, fósforo, amonio y nitritos, cuyas remociones medias fueron de 45,3; 15,1; 4,7 y 27,2% respectivamente. La alta superficie específica de la arena propició el desarrollo de biopelícula en los reactores; sin embargo, su incorporación demanda eficientes mecanismos de pretratamiento y tratamiento primario en términos de remoción de sólidos, dado que el pequeño espacio entre partículas hace susceptible al sistema de tratamiento.
Los efluentes de los reactores evaluados se ajustan a las directrices de la normatividad ambiental en cuanto a las concentraciones de DQO y valores de temperatura y pH para su vertimiento en cuerpos de agua receptores.
AGRADECIMIENTOS
Los autores agradecen por su apoyo a: Departamento de Recursos Hidrobiológicos, Consejo Facultad de Ciencias Pecuarias, Empresa Municipal de Aseo de Pasto EMAS, Profesor Marco Antonio Imuez Figueroa, Estudiantes Programa IPA: Jessica Hernández Agreda, María Fernanda Montenegro Viteri y Danilo Duarte Jurado
REFERENCIAS
[1] SCHREIER, H.J., MIRZOYAN, N. and SAITO, K. Microbial diversity of biological filters in recirculating aquaculture systems. Current Opinion in Biotechnology, 21 (3), 2010, p. 318-325. [ Links ]
[2] SUGITA, H., NAKAMURA, H. and SHIMADA, T. Microbial communities associated with filter materials in recirculating aquaculture systems of freshwater fish. Aquaculture, 243 (1-4), 2005, p. 403-409. [ Links ]
[3] BRAMBILLA, F., ANTONINI, M., CECCUZZI, P., TEROVA, G. and SAROGLIA, M. Foam fractionation efficiency in particulate matter and heterotrophic bacteria removal from a recirculating seabass (Dicentrarchus labrax) system. Aquacultural Engineering, 39 (1), 2008, p. 37-42. [ Links ]
[4] EBELING, J.M., TIMMONS, M.B. and BISOGNI, J.J. Engineering analysis of the stoichiometry of photoautotrophic, autotrhophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems. Aquaculture, 257 (1-4), 2006, p. 346-358. [ Links ]
[5] VAN KESSEL, M.A.H.J., HARHANGI, H.R., VAN DE PAS-SCHOONEN, K., VAN DE VOSSENBERG, J., FLIK, G., JETTEN, M.S.M., KLAREN, P.H.M. and OP DEN CAMP, H.J.M. Biodiversity of N-cycle bacteria in nitrogen removing moving bed bifilters for freshwater recirculating aquaculture systems. Aquaculture, 306 (1-4), 2010, p. 177-184. [ Links ]
[6] MICHAUD, L., BLANCHETON, J.P., BRUNI, V., and PIEDRAHITA, R. Effect of particulate organic carbon on heterotrophic bacterial population and nitrification efficiency in biological filters. Aquacultural Engineering, 34 (3), 2006, p. 224-233. [ Links ]
[7] TIMMONS, M.B., EBELING, M., WHEATON, F.W., SUMMERFELT, S.T. and VINCI, B.J. Sistemas de recirculación para la acuicultura. 1 ed. Santiago (Chile): Fundación Chile, 2002, 747 p. [ Links ]
[8] COLOMBIA. ALCALDÍA MAYOR DE BOGOTÁ. Decreto 1594 de Junio 26 de 1984: usos del agua y residuos líquidos. Bogotá (Colombia): 1984, 55 p. [ Links ]
[9] COLOMBIA. DEPARTAMENTO TÉCNICO ADMINISTRATIVO DEL MEDIO AMBIENTE (DAMA). Resolución 1074 del 28 de octubre de 1997: estándares ambientales en materia de vertimientos. Bogotá (Colombia): 1997, 3 p. [ Links ]
[10] APHA, AWWA and WPCF. Métodos normalizados para el análisis de aguas potables y residuales. 17 ed. Madrid (España): Ediciones Días de Santos S.A., 1992, 1605 p. [ Links ]
[11] SHI, X.Y., YU, H.Q., SUN, Y.J. and HUANG, X. Characteristics of aerobic granules rich in autotrophic ammonium-oxidizing bacteria in a sequencing batch reactor. Chemical Engineering Journal, 147 (2-3), 2009, p. 102-109. [ Links ]
[12] MOLINUEVO, B., GARCÍA, M.C., KARAKASHEV, D. and ANGELIDAKI, I. Anammox for ammonia removal from pig manure effluents: Effect of organic matter content on process performance. Bioresource Technology, 100 (7), 2009, p. 2171-2175. [ Links ]
[13] BURBANO, O. Tratamiento biológico de lixiviados del Relleno Sanitario Antanas por filtros anaerobios [Tesis Biología]. Pasto (Colombia): Universidad de Nariño, Facultad de Ciencias Naturales y Matemáticas, 2002, 104 p. [ Links ]
[14] KIM, J-H., GUO, X., KUMAR BEHERA, S. and PARK, H-S. A unified model of ammonium oxidation rate at various initial ammonium strength and active ammonium oxidizer concentrations. Bioresource Technology, 100 (7), 2009, p. 2118-2123. [ Links ]
[15] MOTTA DE MUÑOZ, B., RODRÍGUEZ, C., MONTENEGRO, H., MARULANDA, J., CORREA, A. y BENDECK, M. Métodos analíticos del laboratorio de suelos. 5 ed. Bogotá (Colombia): IGAC, 1990, 790 p. [ Links ]
[16] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS (ICONTEC). Norma Técnica Colombiana NTC 176. Bogotá (Colombia), 1995, 12 p. [ Links ]
[17] INSTITUTO COLOMBIANO DE NORMAS TÉCNICAS (ICONTEC). Norma Técnica Colombiana NTC 77: Bogotá (Colombia), 2007, 10 p. [ Links ]
[18] INSTITUTO MEXICANO DE TECNOLOGÍA DEL AGUA (IMTA). Mecánica de suelos: Instructivo para el ensaye de suelos. 1 ed. México (México): IMTA, 1990, 413 p. [ Links ]
[19] PAREDES, R.A. y MONTENEGRO, J.J. Evaluación de un promotor de crecimiento natural en el cultivo intensivo de trucha arcoiris en jaulas flotantes en la estación experimental INTIYACO, Lago Guamuez, Nariño, Colombia [Tesis pregrado Ingeniería en Producción Agrícola]. Pasto (Colombia): Universidad de Nariño, Facultad de Ciencias Pecuarias, 2010, 85 p. [ Links ]
[20] KRISHNANI, K.K. Detection and diversity of nitrifying and denitrifying functional genes in coastal aquaculture. Aquaculture, 302 (1-2), 2010, p. 57-70. [ Links ]
[21] SPELLMAN, F.R. Handbook of water and wastewater treatment plant operators. 2 ed. Boca Raton (USA): CRC Press, 2009, 825 p. [ Links ]
[22] ROMERO ROJAS, J.A. Tratamiento de aguas residuales, teoría y principios de diseño. 3 ed. Bogotá (Colombia): Editorial Escuela Colombiana de Ingeniería, 2010, 1248 p. [ Links ]
[23] VON SPERLING, M. Introducción a la calidad del agua y al tratamiento de aguas residuales. Principios del tratamiento biológico de aguas residuales.1 ed. Pasto (Colombia): Editorial Universitaria Universidad de Nariño, 2012, 468 p. [ Links ]
[24]YAMASHITA, T., YAMAMOTO-IKEMOTO, R. and ZHU, J. Sulfate-reducing bacteria in a denitrification reactor packed with wood as a carbon source. Bioresource Technology, 102 (3), 2011, p. 2235-2241. [ Links ]
[25]BARAK, Y. and VAN RIJN, J. Biological phosphate removal in a prototype recirculating aquaculture treatment system. Aquacultural Engineering, 22 (1-2), 2000, p. 121-136. [ Links ]
[26]GUTIERREZ-WING, M.T. and MALONE, R.F. Biological filters in aquaculture: Trends and research directions for freshwater and marine applications. Aquacultural Engineering, 34 (3), 2006, p. 163-171. [ Links ]
[27]MALONE, R.F. and PFEIFFER, T.J. Rating fixed film nitrifying biofilters used in recirculating aquaculture systems. Aquacultural Engineering, 34 (3), 2006, p. 389-402. [ Links ]
[28]TANG, K., BASKARAN, V. and NEMATI, M. Bacteria of the sulphur cycle: An overview of microbiology, biokinetics and their role in petroleum and mining industries. Biochemical Engineering Journal, 44 (1), 2009, p. 73-94. [ Links ]