Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Biotecnología en el Sector Agropecuario y Agroindustrial
versión impresa ISSN 1692-3561
Rev.Bio.Agro vol.11 no.spe Popayán dic. 2013
BIOPROSPECCION DE BACTERIAS PRODUCTORAS DE POLIHIDROXIALCANOATOS (PHA’s) EN EL DEPARTAMENTO DE NARIÑO
BIOPROSPECTING OF POLYHYDROXYALKANOATES (PHA’s) PRODUCING BACTERIA IN THE DEPARTMENT OF NARIÑO
BIOPROSPECÇÃO DE BACTÉRIAS PRODUTORAS DE POLIHIDROXIALCANOATOS (PHA’s), NO DEPARTAMENTO DE NARIÑO
1 Biólogo, Investigador Grupo de Biotecnología Microbiana, Universidad de Nariño. ivra636@gmail.com.
2*Ph.D. Ciencias Biológicas Área Microbiología. Director Grupo de Biotecnología Microbiana, Universidad de Nariño.
Correspondencia: pabfdez@gmail.com
Recibido para evaluación: 14-03-2013. Aprobado para publicación: 17-07-2013.
RESUMEN
Los polihidroxialcanoatos (PHA’s), gránulos intracelulares acumulados por bacterias en ambientes con desbalance Carbono/Nitrógeno, Carbono/Fósforo tienen propiedades físico-químicas similares a plásticos convencionales, pero son biodegradables. Sin embargo, los elevados costos de producción de los PHA’s conllevan a la búsqueda de estrategias con la menor inversión posible; por ello, en esta investigación se exploraron diferentes ambientes del departamento de Nariño en búsqueda de bacterias productoras de PHA’s y se seleccionaron aquellas con potencial industrial. La detección presuntiva de bacterias PHA’s a partir de muestras de suelo y agua, se realizó utilizando Rojo Nilo, los aislamientos seleccionados se sometieron a una fermentación Batch y el polímero obtenido se caracterizó por cromatografía de gases y cromatografía de gases-espectrometría de masas. Aquellos aislamientos con mayor acumulación de polímero se caracterizaron mediante pruebas bioquímicas y la secuencia parcial del gen rRNA 16S.Finalmente, se evaluó la producción de PHA’s utilizando como sustrato aguas residuales domésticas. Se obtuvo 189 aislamientos bacterianos que produjeron desde 0,01gL-1 hasta 5,24gL-1 del homopolimero Poli-3-hidroxibutirato o el copolímero Poli-3-hidroxibutirato-co-3-hidroxivalerato. Así mismo, se recuperó 0,111gL-1 de Poli-3-hidroxibutirato a partir de las aguas residuales. Desde esta perspectiva las bacterias silvestres productoras de PHA’s del departamento de Nariño tienen potencial en procesos ambientales e industriales.
PALABRAS CLAVES: Suelos de Nariño, Laguna de la Cocha, río Pasto, Polihidroxibutirato, Polihidroxivalerato,
ABSTRACT
The polyhydroxyalkanoates (PHA’s) intracellular granules accumulated by bacterial species in environments with imbalance in Carbon/Nitrogen, Carbon/Phosphorus have similar physicochemical properties to conventional plastics, but are biodegradable. However, the high cost of PHA’s lead to strategies of production, but with the lowest possible investment, therefore, in this study we explore different environments in Nariño department to search and selecting PHA’s producing bacteria with industrial potential.The presumptive detection of PHA’s bacteria isolated from soil and water samples were performed using the Nile Red dye, isolates selected were subjected to batch fermentation and the polymer obtained was characterized by gas chromatography and gas chromatography-mass spectrometry. Those isolates with increased accumulation of polymer were characterized by biochemical tests and partial sequencing of the16SrRNAgene. Finally, was evaluated the production of PHA’s using as substrate domestic wastewater. 189 bacterial isolates were obtained, which produce from 0,01gL-1 to 5,24 gL-1 of homopolymer poly-3-hydroxybutyrate or poly-3-hydroxybutyrate-co-3-hydroxyvalerate. Likewise, were recovered 0,111gL-1 of Poly-3-hydroxybutyrate from wastewater. From this perspective, wild bacteria producing PHA’s isolated in Department of Nariño have different potential to advance environmental and industrial processes.
KEYWORDS: Soils of Nariño,Laguna de la Cocha, río Pasto, Polyhydroxybutyrate, Polyhydroxyvalerate,
RESUMO
Polihidroxialcanoatos (PHA’s) são grânulos intracelulares acumulados por bactérias em ambientes com desequilíbrio de Carbono / Nitrogênio, Carbono /Fósforo, estes compostos têm propriedades físico-químicas semelhantes a os plásticos convencionais, mas são biodegradáveis. No entanto, os altos custos de produção dos PHA’s levam a estratégias no processo de produção com o menor investimento possível, portanto, no presente estudo, foram explorados diferentes ambientes em Nariño, na procura de bactérias produtoras de PHA’s com potencial de aproveitamento industrial. A detecção presuntiva de bactérias produtoras de PHA´s isoladas a partir de amostras de solo e água foi realizada utilizando o corante Vermelho do Nilo, os isolados selecionados foram submetidos a uma fermentação em lotes (Batch), e o polímero obtido foi caracterizado por cromatografia em fase gasosa e espectrometria de massa-cromatografia gasosa. Os isolados com maior acúmulo foram caracterizados por provas bioquímicas e pelo sequenciamento parcial do gene 16S rRNA. Finalmente, foi avaliada a produção de PHA’s usando como meio de cultura águas residuais domesticas. Foram obtidos 189 isolamentos bacterianos, os quais produzem desde 0,01gL-1 até 5,24gL-1 do homopolímero Poli-3-hidroxibutirato ou do copolímero Poli-3-hidroxibutirato-co-3-hidroxivalerato. Do mesmo modo foram recuperados 0,111gL-1 de Poli-3-hidroxibutirato a partir de aguas residuais. Desde esta perspectiva as bactérias silvestres produtoras de PHA’s do departamento de Nariño apresentam potencial para adiantar diferentes processos ambientais e industriais.
PALAVRAS CHAVE: Solos de Nariño,Laguna de la Cocha,Río Pasto, Polihidroxibutirato, Polihidroxivalerato,
INTRODUCCIÓN
Los polihidroxialcanoatos (PHA’s) son gránulos intracelulares que se acumulan en diferentes especies bacterianas bajo estrés nutricional generado por exceso en una fuente de carbono y déficit de otros nutrientes como nitrógeno, fósforo y magnesio [1]. Estos biopolímeros tienen propiedades físicas, químicas y mecánicas similares a los plásticos de origen petroquímico, [2,3] por lo tanto, exhiben un amplio rango de aplicación en la industria, la medicina, la farmacología y la agricultura;sin embargo, al contrario de los polímeros convencionales como el polipropileno o el polietileno, los PHA’s se sintetizan desde recursos renovables [4, 5] son biodegradables, insolubles en agua, no tóxicos y exhiben propiedades termoplásticas [6, 7].
Dentro del grupo de microorganismos productores de PHA´s se destacan algunas bacterias Gram negativas (las más utilizadas a escala industrial) comoWautersiaeutropha, Methylobacteriumorganophyllum, Pseudomonasoleovoransy recombinantes de Escherichiacoli, así como también se reportan algunas Gram positivas de los génerosClostridium, Streptomyces, Staphylococcus, Corynebacterium, Nocardia, Rhodococcus[8] yBacillus[9, 10, 11, 12, 13].
Aunque las ventajas de los PHA’s son evidentes, el costo de producción de estos biopolímeros es elevado;1kg de PHA’s cuesta entre 3.5 a 5 euros, comparado con 1 euro por kg de polipropileno [14]. Por esta razón, en los últimos años han surgido varias alternativas para mejorar la producción de PHA’s con la menor inversión posible; en este orden de ideas, es oportuno realizar un “screening” de bacterias silvestres productoras de PHA’s, pues si bien es cierto que las concentraciones naturales de este polímero bacteriano son significativamente bajas; se ha reportado que la microbiota de muestras ambientales puede ser inducida para mejorar significativamente su producción modificando el sustrato o la estrategia de alimentación empleada [15, 16]. Al respecto, Fosteret al., [17], propone que el estrés generado por el ambiente puede aumentar de 14 a 40 veces la producción de PHA’s.
En Colombia existen pocos grupos de investigación dedicados al estudio de las bacterias productoras de PHA’s y su potencial industrial; se han realizado algunos trabajos con cepas de referencia desaprovechando el potencial de las bacterias silvestres y limitando los procesos aplicados por los cuidados que se deben tener para evitar la propagación de microorganismos ajenos a un ecosistema en particular. En esta investigación se exploraron diferentes ambientes del departamento de Nariño en búsqueda de bacterias productoras de PHA’s y se seleccionaron aquellas con potencial para adelantar procesos en el campo industrial y ambiental.
MÉTODO
Muestreo
En el desarrollo de este estudio se exploraron diferentes suelos del departamento de Nariño y ambientes acuáticos como la Laguna de la Cocha y el río Pasto.
Las muestras de suelo se colectaron a 15cm de profundidad en sentido horizontal a la superficie.Los municipios muestreados fueron:El Rosario, Chachagüí, El Tablón, Buesaco, Guaitarilla, Imués, Guachucal, Cumbal, La Florida, Sandona, Iles, Tuquerres, Ospina, Cumbal, Matituy y Pasto.
Para las muestras de ambientes acuáticos,en la Laguna de la Cocha se ubicaron tres puntos de muestreo alrededor de la corota, de cada sitio se tomó un litro de agua a 10 cm de la superficie. Por otra parte, en el cauce principal del río Pasto se ubicaron cinco estaciones de muestreo cuando este hace su recorrido por la ciudad; en cada estación se definieron parcelas de cinco metros de longitud con un ancho determinado por el cauce del río y se colectó una muestra compuesta, superficial hasta conformar cinco réplicas cada una con litro y medio de agua [18, 19].
Todas las muestras se refrigeraron y se llevaron al laboratorio de Biotecnología Microbiana de la Universidad de Nariño en el menor tiempo posible.
Aislamiento presuntivo de bacterias productoras de PHA’s
De cada una de las muestras de suelo se tomaron diez gramos,se maceraron y se re-suspendieron ennoventa mililitrosdeagua destilada estéril. A continuación se prepararon dilucionesseriadas hasta 10-6 y se realizó siembra por profundidad en cajas de Agar Plate Count suplementado con glucosa (15g L-1) y Rojo Nilo al 0,1%.
Para el caso de las muestras tomadas en la Laguna de la Cocha se realizó diluciones seriadas hasta 10-6; posteriormente, las diluciones pares se inocularon por superficie (0,1 mL) en un medio de cultivo compuesto por agar - agar (15 g L-1), agua de la cocha y Rojo Nilo al 0,1%. Finalmente, a partir de las muestras tomadas en el río Pasto se realizaron diluciones seriadas hasta 10-8; de cada dilución se tomó 0,1 mL y se inoculó en cajas de Agar Plate Count suplementado con glucosa 15 g L -1 y Rojo Nilo al 0,1% [20].
En todos los casos las cajas se llevaron a incubación por 72h a temperatura ambiente y la detección presuntiva de bacterias acumuladoras de PHA’s se evaluó cada 24h mediante observación de los cultivos bajo luz ultravioleta en el equipo Benchtop 3UV Transilluminator. Las colonias que presentaron fluorescencia rosada o naranja se seleccionaron como positivas para la acumulación del polímero [21, 22]. Las colonias con fluorescencia positiva se purificaron en agar nutriente y se conservaron a -20°C en caldos con glicerol y a temperatura ambiente en tubos con agar nutritivo inclinado [23].
Selección de bacterias productoras de PHA’s
Para evaluar la producción de PHA’spor los aislamientos seleccionados se realizó una fermentación tipo Batch en caldo base compuesto por peptona bacteriológica 2,5 g L-1, extracto de levadura 2,5 g L-1 y glucosa 15 g L-1; se aplicó un diseño experimental de bloques al azar con tres réplicas por aislamiento [24].Las unidades experimentales fueron balones de 500 mL con 250 mL de caldo base y se utilizó un inóculo al 10% de los aislamientos bacterianos previamente activados. Los balones se llevaron a incubación a 30°C y 100 rpm en un shaker termostatado marca DiES. Para cuantificar la producción de PHA’sse utilizó el protocolo descrito por Fernándezet al.,[20] a partir de 10 mL de muestra.
Caracterización del polímero acumulado por cromatografía de gases (GC) y cromatografía de gases acoplado a espectrometría de masas (GC-MS). El polímero obtenido a partir de los aislamientos que presentaron la mejor producción en g L-1 de PHA’s se diluyó en 1 mL de cloroformo y 1 mL de agente derivatizante metanol: ácido sulfúrico (85:15 v/v). Esta mezcla se sometió por dos horas a 90°C; se enfrióy se adicionó 1 mL de NaCl al 0,1%; finalmente, se eliminó la fase acuosa y se adicionó sulfato de sodio anhídrido para deshidratar completamente la muestra [25, 20].
El análisis de cromatografía de gases se realizó en los laboratorios especializados de la Universidad de Nariño; para esto, se inyectó 1 µL de la fase orgánica en el cromatógrafo de gases GC 17A Shimadzu, equipado con una columna capilar de sílica fundida MDN-5 de 30 m de longitud, 0,25 mm de diámetro interno y 0,25 µm de espesor de película (Supelco). El inyector y el detector de temperaturas de flama ionizante se configuraron a 250°C, como fase móvil se utilizó helio AP. El programa de temperatura fue de 60°C durante 2 minutos incrementándose 6°C por minuto hasta un máximo de temperatura de 220°C [20].
La confirmación por espectrometría de masas se realizó en un equipo GCMS - QP5000 Shimadzu. Los compuestos se identificaron por comparación con la base de datos NIST y espectro de masas de un estándar de copolímero butirato - valerato.
Caracterización bioquímica y molecular mediante la secuencia del gen 16S rRNA de los aislamientos bacterianos que presentaron la mayor acumulación de PHA’s
El perfil bioquímico de los aislamientos seleccionados se estableció mediante pruebas API 50CHB. Este procedimiento se inicio activando los aislamientos en caldo nutritivo, después de 24h de incubación a 30°C se realizó la inoculación en las galerías API como lo indica el fabricante (BIOMEREUX).Los resultados fueron evaluados a las 24 y 48h de incubación a 30°C.
Para la caracterización molecular la extracción de DNA bacteriano se realizó con el protocolo de Riveraet al., [26] modificando las gravedades (g) en la centrifugación. Para verificar la integridad del DNA se prepararon geles de agarosa al 1% [27]. Como marcador de tamaño molecular se utilizó lambda Hind III y las condiciones de corrida fueron 60V, 73mA, 37w por 2 horas y 15 minutos. El gel fue visualizado en el foto-documentador Benchtop 3UV Transilluminator.
La amplificación del gen 16S rRNA se realizó con los primers 27F 5' AGA GTT TGA TCM TGG CTC AG 3' [28] y 1041R 5' CGG TGT GTA CAA GAC CC 3' [29] los cuales amplifican un fragmento aproximado de 1500 pb. El volumen de PCR por reacción fue de 50 µL utilizando Gotaq polimerasa (PROMEGA). En este procedimiento se utilizó un termociclador marca Labnet MULTIGENE, modelo Multigene Gradient con las siguientes condiciones de corrida: 95°C por 2 minutos; 30 ciclos de: 94°C por 2 minutos, 55°C por 1 minuto y 72°C por 3 minutos y una extensión final de 10 minutos a 72°C [30]. Los fragmentos fueron visualizados en geles de agarosa al 1% y comparados con el marcador de tamaño molecular 1kb Ladder (PROMEGA) para verificar el tamaño esperado del amplicon.Una vez obtenidas las secuencias se visualizaron en el programa Chromas lite versión 2.01 y se editaron con el programa BioEdit versión 7.0.4. Finalmente, la secuencia parcial final obtenida después del proceso de edición se comparo en las bases de datos del GenBank (www.ncbi.nlm.nih.gov/genbank/)[31].
Producción de PHA’s a partir de aguas residuales domésticas
Para evaluar la producción de PHA’s a partir de un sustrato económico se utilizaron aguas residuales domésticas sin esterilizar obtenidas directamente desde el colector Juan 23 ubicado en el sector de Torobajo en la salida norte de la ciudad de Pasto.Este experimento se realizó en un bioreactor de flujo ascendente operado en un sistema de fermentación continua; el bioreactor tiene un volumen total de 5,5 L y un volumen de trabajo de 2 L. Como inóculo del bioreactor se utilizó el aislamiento E1M10 RP obtenido desde las aguas residuales del río Pasto.
En este sentido, para obtener PHAs a partir de aguas residuales, del bioreactor se colectó 90 mL de muestra y se centrifugó a 6461 g por 10 minutos, se eliminó el sobrenadante y elpellet se trató con hipoclorito de sodio al 5% y EDTA 10 mM, se llevó a baño maría por hora y media a 60°C, transcurrido este tiempo se centrifugó a 6461 g por 10 minutos, se eliminó el sobrenadante y al precipitado obtenido se le realizaron lavados sucesivos con agua, acetona y metanol, realizando una centrifugación a 6461 g por 10 minutos entre cada lavado. Posteriormente, elpellet se llevó a secar a temperatura ambiente. A continuación el producto obtenido se resuspendió en cloroformo grado HPLC, se maceró y se centrifugó a 6461 g por 10 minutos, se recuperó el sobrenadante, se agregó igual volumen de metanol frío y se dejó a -20°C toda la noche. Al día siguiente se centrifugó a 6461 g por 20 minutos y el precipitado obtenido se dejó secar por 12h a temperatura ambiente.Finalmente, se realizó la caracterización del polímero por cromatografía de gases.
Tratamiento estadístico
Para establecer si existen diferencias estadísticamente significativas en la cantidad de bacterias totales y acumuladoras de PHA’s presentes en los ambientes muestreados; así como en la producción de PHA’s por los aislados seleccionados se aplicó la prueba no paramétrica de Kruskal - Wallis.
RESULTADOS
Al analizar la cantidad de bacterias productoras de PHA’spresentes en las muestras analizadas se encontraron diferencias estadísticamente significativas con un p<0,001. Se diferenciaron un total de 189 aislamientos bacterianos detectados como positivos para la acumulación de PHA’sal emitir fluorescencias naranja o rosada cuando se exponían las placas de petri a luz ultravioleta. De estos aislamientos el 71% (134) fueron obtenidos de los diferentes suelos del departamento de Nariño, el 6% (11) de la Lagua de la Cocha y el 23% (44) del río Pasto. El 51% (96) corresponden a bacterias Gram negativas, el 49% (93) a bacterias Gram positivas y con respecto a la morfología microscópica se encontraron Bacilos, cocos, estafilococos, diplococos, cocobacilos y bacterias filamentosas.
Al evaluar la acumulación de PHA’s por los aislamientos obtenidos se encontró que existen diferencias estadísticamente significativas con un p valor = 0,0015 en la producción del biopolímero. La cantidad de polímero recuperada fue de 0,01 g L-1 a 0,88 g L-1 en muestras de suelo y desde 0,88 g L-1 hasta 5,24 g L-1 en muestras provenientes de ambientes acuáticos (Laguna de la Cocha y río Pasto). Así mismo, los análisis por cromatografía de gases indican que el 83% de las muestras evaluadas forman un pico con tiempo de retención similar al éster de metilo 3-hidroxibutirato y el 17% de las muestras forman dos picos con tiempo de retención similares a los éster de metilo 3-hidroxibutirato: 3-hidroxivalerato. (Figura1a y 1b).
Posteriormente, mediante análisis de cromatografía de gases acoplado a espectrometría de masas (GC-MS) se identificó que los PHA’s sintetizados por los aislamientos evaluados son: 3 metil hidroxibutirato y el copolímero 3 metilhidroxibutirato - co- 3 metil hidroxivalerato (Figura 1c y 1d). Por lo tanto, se seleccionaron el aislamiento FBL2 como mejor productor del copolímero P(3HB-co-3HV) y elaislamiento E1M10 RP como mejor productor del homopolimero P(3HB).
El aislamiento FBL2 obtenido a partir de muestras de suelo, mediante el perfil bioquímico generado con pruebas API 50CHB se caracterizó comoBacillus mycoides FBL2 (%ID = 98,3 y T= 0,67); esta cepa alcanzó una producción del copolímero P(3HB-co-3HV) de 0,3 g L-1. Por otra parte, el aislamiento E1M10RP obtenido del río Pasto alcanzó una roducción de 5,24 g L-1 del homopolimero P(3HB); este aislamiento se caracterizó mediante el gen rRNA 16S, al comparar la secuencia parcial final obtenida con la base del GenBank se encontró que tiene un 96% de identidad conBacillus subtilis. Por lo tanto, se concluye que el aislamiento bacteriano E1M10 RP corresponde a una bacteria del generoBacillus y tiene un 96% de probabilidad que pertenezca a la especieBacillus subtilis.
Entre los microorganismos productores de PHA’s las bacterias del generoBacilluscomo:Bacillus sp. JMa5 [9],B. mycoides RLJ B-017 [10],B. amyloliquefaciens DSM7,B. laterosporus,B. licheniformis, B. macerans,coagulans,B. brevis,B. sphaericus ATCC 14577 [12],B. cereus, B. circulans,B. firmus G2,B. sphaericus X3,B. megaterium Y6 [11],B. B. thuringiensis [13], entre otros, se han caracterizado por sintetizar diferentes homo y copolímeros tales como P(3HB), P(3HB-co-3HV), P(3HB-co-3HHx), P(3HB-co-4HB-co-3HHx), P(3HB-co-6HHx-co-3HHx).
B. mycoides se ha reportado como una bacteria cuyo hábitat natural es el suelo y se ha reconocido como promotora del crecimiento de las plantas especialmente asociada a raíces de coníferas[32]forma filamentos radiales con giro levógiro o dextrógiro y su habilidad de formar esporas le confiere alta resistencia al estrés ambiental [33].
La particularidad deB. mycoides FBL2 es queacumulade manera natural y en un medio suplementado con glucosa el copolímero P (3HB-co-3HV) en una proporción 95:5, sin embargo, cuando al medio se le adiciona propionato la proporción de la fracción valerato se incrementa en un 76%[20].
Con respecto aB. subtilis la información acerca este microorganismo como productor de PHA’s aún es escasa [34, 35], en suelos de diferentes pastizales de Ankara en Turquía identificaron 8 cepas de B. subtilis que produjeron hasta 0,204 g L-1 de PHB en un medio con caldo nutritivo. Por su parte, Bello y Brandl [36], reportaron una producción de 3,337 g L-1 de PHB por la cepaB. subtilis 2344 en dos medios diferentes compuestos por sacarosa y glucosa. Porwalet al., [37], reportaron la producción 0,19 g L-1 de PHB por B. subtilis en un medio suplementado con glucosa como fuente de carbono, y Tamdogan y Sidal, [38], determinaron queB. subtilis ATCC 6633 produjo 0,01 g L-1 con manitol como fuente de carbono.B. subtilis E1M10RP caracterizado en este estudio produce 5,24 g L-1 de P(3HB) a partir de glucosa; teniendo en cuenta los trabajos citados anteriormente la bacteria obtenida en este estudio alcanzó uno de los rendimientos más altos en producción del homopolímero P(3HB) y es posible que optimizando las condiciones de cultivo, el sistema de fermentación y los regímenes de alimentación se mejore significativamente la producción de este biopolímero.
En este sentido, ya que B. subtilis E1M10 RP alcanzó una buena producción de PHB y es una bacteria aislada del río Pasto se utilizó como inóculo para evaluar la producción de PHA’s a partir de las aguas residuales que se vierten al río Pasto. Para esto se utilizó un bioreactor de flujo ascendente operado bajo un sistema de fermentación continua, el tiempo de retención fue de 9h con un caudal de 222ml h-1. Después de aplicar el protocolo de extracción de PHA’s se obtuvo 0,111 g L-1 de polímero, al realizar los análisis por cromatografía de gases se detectaron picos con tiempos de retención similares al del éster de metilo 3 hidroxibutirato observado en el patrón (4,850 minutos) (Figura 2). Por lo tanto, se puede concluir que en este trabajo fue posible recuperar P(3HB) a partir de las aguas residuales vertidas al río Pasto.
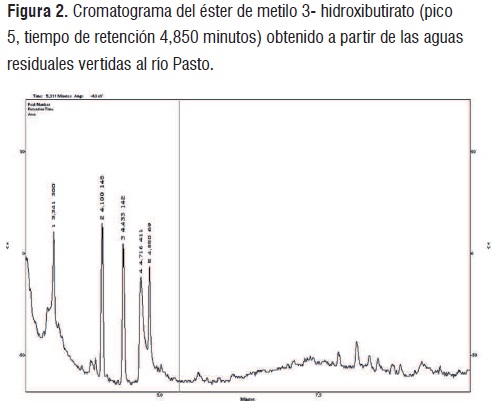
Cabe aclarar que en esta investigación se utilizó agua residual sin esterilizar y aún hace falta optimizar las condiciones de fermentación, por lo tanto, es posible mejorar los rendimientos, ya que, bajo las condiciones del experimento realizado y teniendo en cuenta que el caudal de las aguas residuales que se vierten al río Pasto en promedio es de 3195 L s-1 se podrían obtener hasta 1,2 toneladas de polímero en 9 horas de tratamiento.
De esta manera, los datos aportados en esta investigación se convierten en la base para adelantar otros procesos que permitan el tratamiento de las aguas residuales en el departamento de Nariño y recuperar un biopolímero con potencial industrial ya que, se ha establecido que los costos de obtención de los PHA’s se pueden reducir más de la mitad si se utilizan subproductos o sustancias de desecho como sustrato para los microorganismos productores [39, 40, 41, 42, 43].
CONCLUSIONES
A partir de la microbiota silvestre presente en diferentes ambientes del Departamento de Nariño se logró obtener biopolímeros de interés industrial como el poli-3-hidroxibutirato (hasta 5,24 g L-1) y el copolímero poli-3-hidroxibutirato : poli-3-hidroxivalerato (hasta 0,3 g L-1).
Algunas de las bacterias silvestres productoras de PHA’s del departamento de Nariño fueronBacillus mycoides FLB 2 y Bacillus subtilis E1M10 RP reportadas como microorganismos potencial en la producción industrial de este biopolímero.
Es posible obtener polihidroxibutirato a partir de aguas residuales y utilizando bacterias silvestres del departamento de Nariño.
AGRADECIMIENTOS
A Edith Mariela Burbano Ph.D. docente programa de Biología, Universidad de Nariño, por su apoyo y asesoría especialmente en los métodos moleculares.
REFERENCIAS
[1] ANDERSON, A. and DAWES, E. Occurrence, metabolism, metabolic role, and industrial uses of bacterial Polyhydroxyalkanoates. Rev. Microbiol., 54, 1990, p. 4450-4472. [ Links ]
[2] RHU, D., LEE, W., KIM, J. and CHOI, E. Polyhydroxyalkanoate (PHA) production from waste. Water Science and Technology, 48 (8), 2003, p. 221-228. [ Links ]
[3] VOLOVA, T., GLADYSSHEV, I., TRUSOVA, Y. and ZHILA, N. Degradation of polyhydroxyalkanoates in eutrophic reservoir.Polymer Degradation and Stability, 92, 2007, p. 580 - 586. [ Links ]
[4] RUIZ, A., ALMEIDA, A., LÓPEZ, I. y PETTINARI, J. Bioplásticos: una alternativa ecológica. RevistaQuímicaViva,3, 2004, p. 122 - 133. [ Links ]
[5] ANASTASSIOS, C., SISKA, H., CHOUHAN, B. and DIETER, J. Structural Basis of poly(3-Hidroxybutyrate) Hydrolysis by PhaZ7 Depolymerase fromPaucimonaslemoignei. J. Mol. Biol., 382, 2008, p. 1184-1194. [ Links ]
[6] LLANA, S. and JAY, D. Process design for microbial plastic factories: metabolic engineering of polyhydroxyalkanoates. Current Opinion in Biotechnology, 14, 2003, p.475-483.B. [ Links ]
[7] REHM, B. Biogenesis of microbial polyhydroxyalkanoate granules: a platform technology for the production of tailor made bioparticules. Curr.Issues Mol. Biol., 9, 2007, p. 41-42. [ Links ]
[8] VALAPPIL, P., BOCCACCINI, R., BUCKE, C. and ROY, I. Polyhydroxyalkanoates in Gram positive bacteria: insights from the generaBacillus andStreptomyces. Antonie van Leeuwenhoek, 91, 2007, p.1-17. [ Links ]
[9] WU, Q., HUANG, H., HU, G., CHEN, J., HO, K. and CHEN, G.Production of poly-3-hydroxybutyrate byBacillus sp. JMa5 cultivated in molasses media. Antonie van Leeuwenhoek,80, 2001, p. 111-118. [ Links ]
[10] BORAH, B., THAKUR, P. and NIGAM, J. The influence of nutritional and environmental conditions on the accumulation of poly-ß-hydroxybutyrate inBacillus mycoidesRLJ B-017.J ApplMicrobiol.,92, 2002, p. 776-783. [ Links ]
[11] KATIRCIOGLU, H., ASLIM, B., YÜKSEKDAÐ, Z., MERCAN, N. and BEYATLI, Y.Production of poly-ß-hydroxybutyrate (PHB) and differentiation of putativeBacillus mutant strains by SDS-PAGE of total cell protein. Afr. J.Biotechnol.,2, 2003, p.147-149. [ Links ]
[12] YILMAZ, M., SORAN, H. and BEYATLI, Y. Determination of poly-ß-hydroxybutyrate (PHB) production by someBacillus sp. World J.Microbiol.Biotechnol.,21, 2005, p. 565-566. [ Links ]
[13] PORWAL, S.H., KUMAR, T., LAL, S., RANI, A., KUMAR, S., CHEEMA, S., PUROHIT, H., SHARMA, R., KUMAR, S., PATEL, S. and KALIA, V. Hydrogen and polyhydroxybutyrate producing abilities of microbes from diverse habitats by dark fermentative process.Bioresource Technology, 99, 2008, p. 2444-2451. [ Links ]
[14] LEE, S.Y., CHOI, J., and LEE, S.H. Production of Polyhydroxyalkanoates by fermentation of bacteria. Macromol. Symp., 159, 2000, p. 259-266. [ Links ]
[15] LABUZEK, S. and RADECKA I. Biosynthesis of PHB tercopolymer byBacilllus cereus UW85.J. Appl.Microbiol.,90, 2001, p.353-357. [ Links ]
[16] VALAPPIL, P., RAI, R., BUCKE, C. and ROY, I. Polyhydroxyalkanoate biosynthesis inBacillus cereus SPV under varied limiting conditions and an insight into the biosynthetic genes involved. J. Appl.Microbiol.,104, 2008, p. 1624-1635. [ Links ]
[17] FOSTER, L., SAUFI, A. and HOLDEN, P. Environmental concentrations of polyhydroxyalkanoates and their potential as bioindicators of pollution. Biotechnology Letters, 23, 2001, p. 893-898. [ Links ]
[18] MOSTACEDO, B. y FREDERICKSEN, T. Manual de métodos básicos de muestreo y análisis en ecología vegetal. Santa Cruz(Bolivia):BOLFOR, 2000, p. 3 - 19. [ Links ]
[19] AMERICAN PUBLIC HEALTH ASSOCIATION, AMERICAN WATER WORKS ASSOCIATION, WATER ENVIRONMENT FEDERATION (APHA, AWWA, WEF). Standard Methods for the examination of water & wastewater. 21ed.2005, 900 p. [ Links ]
[20] FERNÁNDEZ, P., ORTIZ, F., BURBANO, O., GUERRERO, M. y ESPAÑA, J. Influencia de las fuentes de carbono y nitrógeno en el crecimiento bacteriano y síntesis de polihidroxialcanoato de una cepa deBacillusMicoides FBL2. Revista Centro de Estudios en Salud, 1 (7), 2006, p. 34-42. [ Links ]
[21] OSTLE, A. and HOLT, J. Nile Blue A as a Fluorescent Satín forPoly-ß-Hydroxybutyrate. Applied and Environmental Microbiology, 44 (1), 1982, p. 238-241. [ Links ]
[22] SPIEKERMANN, P., REHM, B., KALSCHEUER, R., BAUMEISTER, D.andSTEINBUCHEL, A. Sensitive, Viable -Colony Staining Method Using Nile Red for Direct Screening of Bacteria That Accumulate Polyhydroxyalkanoic Acids and Other Lipid Storage Compounds. Arch.Microbiol., 171, 1999, p. 73-80. [ Links ]
[23] TORTORA, G. FUNKE, B.andCASE, C.H. Microbiology an introduction. 10 ed. Boston (USA): Pearson Education, 2010, 960 p. [ Links ]
[24] SEGURA, J. Notas de diseños experimentales. Facultad de medicina veterinaria y Zootecnia.Yucatán (México): Universidad Autónoma de Yucatán,2000, 59 p. [ Links ]
[25] BRAUNEGG, G., LEFEBVRE, G. and GENSER, K. Polyhydroxyalkanoates, Biopolyesters from renewable resources: Physiological and engineering aspects. Journal of Biotechnology. 65, 1998, p. 127-161. [ Links ]
[26] RIVERA, I., CHOWDHURY, M., HUQ, A., JACOBS, D., MARTINS, M. and COLWELL, R. Enterobacterial Repetitive Intergenic Consensus Sequences and the PCR to Generate Fingerprints of Genomic DNAs fromVibrio cholerae O1, O139, and Non-O1 Strains.Appl. Environ. Microbiol. 61, 1995, p. 2898-2904. [ Links ]
[27] SAMBROK, J., FRITSCH, E. andMANIATIS, T. Molecular cloning: A laboratory manual. 2ed. New York (USA): Cold Spring Harbor Laboratory Press, 1989, 1448 p. [ Links ]
[28] LANE, D. 16S/23S rRNA sequencing. In: STACKEBRANDT, E. e OODFELLOW, M. (Ed.). Nucleic acid techniques in bacterial systematics. England: John Wiley & Sons, Chichester, 1991, p.115-163. [ Links ]
[29] NUBEL, U., ENGELEN, B., FELSKE, A., SNAIDR, J., WIESHUBER, A., AMANN, R., LUDWIG, W. and BACKHAUS, H. Sequence Heterogeneities of Genes Encoding 16S rRNAs inPaenibacilluspolymyxa Detected by Temperature Gradient Gel Electrophoresis. J.Bacteriol., 178, 1996 .p. 5636-5643. [ Links ]
[30] SOUZA, C., BURBANO-ROSERO, E., ALMEIDA, B., BARRETO, C. and RIVERA, I. Chitinolytic Bacteria Diversity Isolated from Marine Ecosystems with Different Levels of Anthropogenic Activity in São Paulo State, Brazil. Sao Paulo (Brasil): The ISME Journal (In press), 2012. [ Links ]
[31] COLE, J., WANG, Q., CARDENAS, E., FISH, J., CHAI, B., FARRIS, R., KULAM-SYED-MOHIDEEN, A., MCGARRELL, D., MARSH, T., GARRITY, G. and TIEDJE, J. The Ribosomal Database Project: improved alignments and new tools for rRNA analysis. Nucleic Acids Res., 37, 2009, p. D141-D145. [ Links ]
[32] DAFFONCHIO, D., BORIN, S., FROVA, G., GALLO, R., MORI, E., FANI, R. and SORLINI, C. A Randomly Amplified Polymorphic DNA Marker Specific for theBacillus cereus Group Is Diagnostic forBacillus anthracis. Appl. Environ. Microbiol., 65 (3), 1999, p. 1298 - 1303. [ Links ]
[33] DI FRANCO, C., BECCARI, E., SANTINI, T., PISANESCHI, G., and TECCE, G. Colony shape as a genetic trait in the pattern-formingBacillus mycoides.BMC microbiology, 2 (33), 2002. p. 1-15. [ Links ]
[34] ASLIM, B., YUKSEKDAG, Z. and BEYATLI, Y. Determination of PHB growth quantities of certain Bacillus species isolated from soil. Turkish Electronic Journal of Biotechnology, 2002, p. 24-30. [ Links ]
[35] SINGH, M., PATEL, S. and KALIA, V.Bacillus subtilisas potential producer for polyhydroxyalkanoates.Microbial cell factories. BioMed Central, 2009, p. 1-11. [ Links ]
[36] BELLO, G. y BRANDL, H. Selección de bacterias productoras de polihidroxibutirato. Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar (ICIDCA). Redalyc, 41 (2), 2007, p. 10-18. [ Links ]
[37] PORWAL, S.H., KUMAR, T., LAL, S., RANI, A., KUMAR, S., CHEEMA, S., PUROHIT, H., SHARMA, R., KUMAR, S., PATEL, S. and KALIA, V. Hydrogen and polyhydroxybutyrate producing abilities of microbes from diverse habitats by dark fermentative process.BioresourceTechnology, 99. 2008, p. 5444-2451. [ Links ]
[38] TAMDOGAN, N. and SIDAL, U. Investigation of poly-ß-hydroxybutyrate (PHB) production byBacillus subtilisATCC 6633 under different conditions. KafkasUniv Vet FakDerg, 17, 2011, p. 173-176. [ Links ]
[39] DIONISI, D., CARUCCI, G., PETRANGELI, M., PAPINI, P., RICCARDI, C., MAJONE, M.andCARRASCO, F., Olive oil mill effluents as a feedstock for production of biodegradable polymers.Water, 10, 2005, p. 2076-2084. [ Links ]
[40] ALBUQUERQUE, M., EIROA, M., TORRES, C., NUNES, B., andREIS, M. Strategies for the development of a side stream process for polyhydroxyalkanoate (PHA) production from sugar cane molasses. J. Biotechnol., 130, 2007, p. 411-421. [ Links ]
[41] COATSB, E., LOGE, F., SMITH, W., THOMPSON, D.andWOLCOTT, M. Functional stability of a mixed microbial consortium producing PHA from waste carbon sources. Applied Biochemistry and Biotechnology, 136, 2007, p. 909 - 926 [ Links ]
[42] BENGTSSON, S., WERKER, A., CHRISTENSSON, M., and WELANDER, T. Production of polyhydroxyalkanoates by activated sludge treating a paper mill wastewater.Bioresour.Technol., 99, 2008, p. 509-516. [ Links ]
[43] ALBUQUERQUE, M., CONCAS, S., BENGTSSON, S. andREIS, M. Mixed culture polyhydroxyalkanoates production from sugar molasses: the use of a 2-stage CSTR system for culture selection. Bioresource Technology, 101, 2010, p. 7112 - 7122. [ Links ]













