Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.11 no.spe Popayán Dec. 2013
IDENTIFICACIÓN DE CEPAS NATIVAS CON POTENCIAL PARA OBTENCIÓN DE POLIHIDROXIALCANOATOS -(PHAs)EN LODOS ACTIVADOS
IDENTIFICATION OF STRAINS NATIVE WITH POTENTIAL TO OBTAIN POLYHYDROXYALKANOATES - (PHAS) IN ACTIVATED SLUGDES
IDENTIFICAÇÃO DE ESTIRPESNATIVAS COMPOTENCIAL PARA A OBTENÇÃO POLIHIDROXIALCANOATOS -(PHAS) EM LODOS ATIVADOS
ANA LORENA ARROYAVE R.1, MARIANA CARDONA B.2 Y LINA MARÍA AGUDELO E.3
1Microbióloga Industrial y Ambiental. Escuela de Microbiología. Universidad de Antioquia
2Magister en Ingeniería. Grupo de Biotransformación. Universidad de Antioquia
3PhD en Ingeniería. Grupo de Biotransformación. Universidad de Antioquia
Correspondencia: agudelo.linamaria@gmail.com
Recibido para evaluación: 17/04/2013. Aprobado para publicación: 07/10/2013.
RESUMEN
Los Polihidroxialcanoatos son poliésteres naturales que se han convertido en una excelente alternativa para remplazar los plásticos convencionales. Son biocompatibles y biodegradables y en corto tiempo pueden ser reducidos a dióxido de carbono y agua. Son sintetizados intracelularmente por diferentes bacteriasy pueden ser obtenidos a partir de una gran variedad de sustratos, en los que se incluyen algunos desechos agroindustriales. Con el objetivo de identificar cepas nativas con potencial para la producción de Polihidroxialcanoatos se llevó a cabo una bioprospección en los lodos de la Planta deTratamiento de Aguas Residuales de San Fernando (Itagüí-Antioquia). Se aislaron en agar selectivo 19 colonias, de las cuales se seleccionaron las colonias con oxidasa positiva. Se realizó la activación y siembra de las bacteriasen medio mínimo de sales (MSM) líquido, para establecer el porcentaje de acumulación de los Polihidroxialcanoatos.Las cepas LM-3D, LAR-4D, LAR-5B,LAR-5E, presentaron un porcentaje de acumulación de PHAs de 2, 10, 4, 3 %, respectivamente y la cepaLM-3F presentó un porcentaje de acumulación del 25%, con respecto a los otros aislados. Tras el análisis bioquímico se determinó que las cepas productoras de PHAs fueron Shingomonas paucemobilis, Aeromonas hydrophila y Aeromonas sobria.
PALABRAS CLAVES: Biopolímeros, Bioprospección, Aguas residuales, Aislamiento, Lodo activado recirculado (LAR), Licor mixto (LM).
ABSTRACT
Polyhydroxyalkanoates are natural polyesters with excellent characteristics to replace conventional plastics. They are bio-compatibles and biodegradables and in a short time they can be reduced to carbon dioxide and water. They are intracellular synthetized by different bacteria and they can be obtained from a large variety of substrates, including some agriculture wastes. The main target is to identify native strains with potential to produce polyhydroxyalkanoates. A bio-prospection was performed in the sludge of San Fernando's waste water plant (Itagüí-Antioquia). 19 colonies were isolated in a selective agar, and then the colonies with positive oxidase were selected. The activation and cultivation were carried in a liquid minimum salt medium (MSM) to establish the biopolymer accumulation rate. The strains LM-3D, LAR-4D, LAR-5B, LAR-5E exhibiteda pHAs accumulation rate of 2, 10, 4, 3% respectively, and the strain LM-3F exhibited a 25% of biopolymer accumulation rateagainst others. Upon the biochemical analysis it was established that polymer producer strains were Shingomonas paucemobilis, Aeromonas hydrophila and Aeromonas sobria.
KEYWORDS: Biopolymers, Bio-prospection, Wasted wáter, Isolation. Activated slugde, Mixed liquor.
RESUMO
Polihidroxialcanoatossão poliésteresnaturais comexcelentes característicaspara substituiros plásticos convencionais. Eles sãobio-compatíveis ebiodegradáveisenum curto espaço detempo que podemser reduzidosa dióxido decarbono e água.Eles sãosintetizadosintracelularpordiversas bactériase podemser obtidosa partir de umagrandevariedade de substratos, incluindoalguns resíduosagrícolas.O objetivoprincipalé identificarcepasnativascompotencialpara a produção depolihidroxialcanoatos. Abioprospecçãofoi realizadano lododeáguas residuais dafábrica deSanFernando (Itagüí-Antioquia). 19colôniasforam isoladasemágarseletivo, e, em seguida, foram selecionadas ascolônias comoxidasepositiva.A ativaçãoe cultivoforam realizadosem um meiosalmínimolíquido(MSM) para estabelecer ataxa de acúmulode biopolímeros. As cepas LM-3D, LAR-4D, LAR-5B, LAR-5E exibiu umataxa dePHAsacúmulo de2, 10, 4, 3%, respectivamente, ea tensãoLM-3F exibiua 25% da taxa de acúmulode biopolímeroscontra os outros.Após aanálise bioquímicafoi estabelecidoque as cepasprodutorasde polímerosforamShingomonaspaucemobilis, AeromonashydrophilaeAeromonassobria.
PALAVRAS-CHAVE: Biopolímeros, Bioprospecção, Desperdíciode água, Isolamento, Ativadoslugde, Licor misto.
INTRODUCCIÓN
Los polímeros derivados del petróleo se han convertido en elementos indispensables para la vida cotidiana gracias a las diversas propiedades mecánicas y fisicoquímicas que presentan [1]. La capacidad global total de producción de productos plásticos se incrementó dramáticamente de 1,5 millones de toneladas en 1950, a 245 millones de toneladas en 2008.La producción en 2011 fue cerca de 280 millones de toneladas y se estima que la tasa de crecimiento anual sea de 9% [2,3,4]. Los plásticos son empleados en múltiples industrias y generalmente tienen un tiempo de uso corto; y debido a que no son degradados fácilmente por medio de procesos naturales, se acumulan y permanecenen el ambiente por mucho tiempo, generando así uno de los mayores problemas de contaminación ambiental [5,6,7,8].
Como alternativa, muchas investigaciones alrededor del mundo están siendo orientadas hacia el desarrollo de plásticos biodegradables con propiedades similares a los plásticos convencionales, pero con tiempos de degradación más cortos [9,10,11]. Dentro de estos materiales se encuentranlos Polihidroxialcanoatos (PHAs), que son poliésteres naturales sintetizados por diferentes bacterias.Los PHAs son biocompatibles y biodegradables lo que representa ventajas con relación a los plásticos derivados del petróleo [12]. Estos biopolímeros pueden ser sintetizados por una gran cantidad de microorganismos a partir de diferentes sustratos agrícolas. Existen más de 300 clases de bacterias productoras de PHAs, de las cuales se pueden obtener hasta 150 tiposde estos materiales con diferentes propiedades [13,14].Las características del biomaterial y su aplicación final dependerán del microorganismo y la fuente de carbono utilizados para su obtención.
Aunque son muchos los microorganismos los que pueden sintetizar PHAs, sólo unos cuantos son capaces de producirlo a gran escala [3]. La elección del microorganismo para la producción industrial del biopolímero varía dependiendo de factores como la habilidad celular para utilizar fuentes de carbono no costosas, la velocidad de crecimiento, la velocidad de síntesis del biopolímero, la calidad y cantidad de PHA y el costo de los procesos de recuperación [15]. A nivel industrial se emplean cepas como la Ralstonia eutropha, Alcaligenes latus, Azotobacter vinelandii, Pseudomonas oleovorans, Paracccus denitrificans, Protomonas extorquens y E. coli recombinante [11].
El objetivo de esta investigación fue el aislamiento y caracterización de cepas nativas con potencial para la obtención de biopolímeros Polihidroxialcanoatos (PHAs),que puedan ser empleadas a futuro en procesos biotecnológicos de producción a gran escala. Las muestras fueron aisladas de los lodos activados de una planta de tratamiento de aguas residuales, que han sido establecidos como nichos óptimos para el crecimiento de microorganismos productores de estos biopolímeros [16].
MÉTODO
Recolección de muestras de lodos
Las muestras de los lodos fueron obtenidas de la Planta de Tratamiento de Aguas Residuales de San Fernando, ubicada en el municipio de Itagüí adscrito al Área Metropolitana del Valle de Aburrá. Con el fin de lograr obtener una mayor variedad en el tipo de microorganismos aislados las muestras fueron recolectadas en dos puntos diferentes de la planta. La primera muestra fue tomada del Lodo Recirculado o de Retorno (LAR); correspondiente al lodo de los sedimentadores finalesque es recirculado a lostanques de aireación. La segunda muestra fue tomada del Licor Mixto (LM); correspondiente al lodo activado del tanque de aireación mezclado con aguas residuales en el tanque de sedimientación secundario. Las muestras fueron recolectadas y almacenadas en frascos tapa rosca y fueron conservadas a 4°C durante el traslado hacia el Laboratorio de Biotecnología Microbiana y Biología Molecular de la Universidad de Antioquia y fueron procesadas inmediatamente.
Aislamiento de los microorganismos
Para el aislamiento de los microorganismos se tomaron muestras de cada lodo (lodo activado recirculado (LAR) y licor mixto (LM)) y se realizaron diluciones seriadas desde 10-1hasta 10-5utilizando agua peptonada estéril. En placas con medio selectivo Mc.Conkey se inocularon por dispersión 100μl de cada dilución. Las placas se incubaron a 35°C por 48 horas, el procedimiento fue realizado por duplicado para cada dilución. Una vez finalizado el tiempo de incubación se realizaron los análisis macroscópico y microscópico de las placas.El agar Mc.Conkey es un medio selectivo y diferencial que permite aislar y diferenciar bacilos entéricos fermentadores y no fermentadores de lactosa. Las colonias aisladas de bacterias que fermentan la lactosa presentan una coloración rosada y las colonias que permanecen incoloras no la fermentan. A partir del aislamiento en el medio Mc Conkey se seleccionaron las colonias incoloras no fermentadoras de lactosa. Este criterio de selección fue basado en las bacterias reportadas en la literatura como mayores productoras de PHAs tales la como Pseudomonas, Rhizobium, Ralstonia, Alcaligenes quepresentan esta característica.
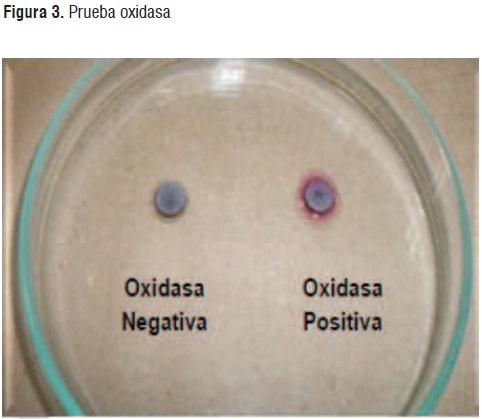
Las bacterias no fermentadoras de lactosa seleccionadas fueron posteriormente aisladas en medio TSA (Tripticasa Soya Agar). A los cultivos puros obtenidos se les realizó laprueba de tinción Gram para determinar si eran Gram-negativas o Gram positivas y establecer su morfología microscópica. También se les realizó la prueba de oxidasa para establecer si los aislados corresponden a las Pseudomonas (oxidasa positiva) o al grupo de las Enterobacterias (oxidasa negativa). Esta prueba consistió en colocar una gota grande de agua destilada estéril en una placa de Petri, y sobre ésta se suspendió una porción del cultivo a analizar, luego sobre el cultivo se colocó un disco indicador de oxidasa (disco Taxo N), que contienen los componentes de la reacción. La aparición de una coloración púrpura a los 5 minutos del contacto fue tomada como una reacción positiva. Los bacilos Gram negativos no fermentadores de lactosa, positivos para la prueba de oxidasa fueron seleccionados como microorganismos potenciales para la producción de los biopolímeros
Determinación de Bacterias productoras de Polihidroxialcanoatos (PHAs)
Debido a que los microorganismos fueron conservados en medio sólido, la activación se llevó a cabo en 25mL de Caldo Enriquecido Tripticasa Soya (TSB-marca Merck) que contiene por litro, 17,0 g de Peptona de caseína; 3,0 g de Peptona de harina de soya; 2,05 g de Glucosa; 5,00 g de NaCl y 2,5 g K2HPO4. La fermentación para determinar la producción de PHAs fue realizada en 50mL de Medio Mínimo de Sales (MSM) líquido, que contienepor litro, 6,7 g de Na2HPO4.7H2O; 1,5 g de KH2PO4; 1,0 g (NH4)2SO4; 0,2 g de MgSO4.7 H2O; 60 mg de Citrato de Hierro y Amonio; 10 mg de CaCl2.2H2O y 1 mL de elementos traza (0,3 g de H3BO3; 0,2 g de CoCl2.6H20; 0,1 g de ZnSO4.7H2O; 30 mg de MnCl2.4H2O; 30 mg de NaMoO4.2H2O; 20 mg de NiCl2.6H2O; 10 mg de CuSO4.5H2O [17]; y con 10 g/L de glucosa como fuente de carbono.Las fermentaciones fueron realizadas a 30°C por 72 horas. La determinación de la acumulación del biopolímero se realizó mediante la técnica de tinción con Sudan Black [18].
Caracterización de aislamientos bacterianos
Las cepas que presentaron acumulación del biopolímero fueron caracterizadas utilizando el Kit API #20 NE (Biomerieux) específico para bacterias Gram-negativas no fermentadoras de Lactosa. Para la determinación del género y familia de los microorganismos aislados se empleó la base de datos ApiwebTM (Biomerieux) [19]
Conservación de microorganismos productores de Polihidroxialcanoatos (PHAs)
La conservación de las cepas se realizó siguiendo el protocolo de crioconservación descrito por Simione, et al. (1998) [20]. Los microorganismos fueron activados entubos tapa rosca con 10 mL demedio Luria Bertani (LB) que contiene por litro, 10,0 g de Triptona; 5,0 g de Extracto de Levadura y 10,0 g de NaCl. La activación fue realizada durante 8 horas a 35°C. Una vez transcurrido el tiempo de activación se tomaron 0,7 mL del cultivo y se transfirieron a un criovial de 2mL, que contenía 0,3 mL de glicerol al 10% y que fue adicionado como agente crioconservador. Luego de una vigorosa mezcla en vórtex los crioviales fueron guardados en nevera a -20°C para su uso en posteriores experimentaciones.
RESULTADOS
De la siembra del lodo activado recirculado (LAR) en agar Mc.Conkey, fueron aisladas ocho colonias posibles productoras de PHAs y del Licor Mixto (LM) se aislaron once colonias. En la Figura 1 se presentan las imágenes de las colonias del lodo activado recirculado (LAR) sembradas en el agar Mc. Conkey en cajas Petri. Como se observa en la Figura 1b se aprecian una gran cantidad de cepas fermentadoras de lactosa que han producido un coloración rosa característica en el cultivo. En la Figura 1a y 1c se aprecian colonias individuales a las que a partir de la descripción macroscópica del crecimiento se lograron establecer características como el borde la forma, la elevación, la superficie, el tamaño, el color y el contraste con la luz.
En la Figura 2 se observan las imágenes de los cultivos correspondientes a las cepas aisladas del Lico Mixto. Al igual que en las muestras de lodo LAR se aprecian ambos tipos de cepas:las productoras de lactosa que pueden ser apreciadas en algunas partes de las cajas Petri en las Figuras 2b y 2c; y las no productoras de lactosa como se observa en la Figura 2a. También en estas imágenes es posible apreciar algunas diferencias en las características macroscópicas de las cepas aisladas. Se observan diferencias en el color, la elevación y el contraste a la luz, algunas de las cepas son blancas, cremosas y elevadas y otras son amarillentas, opacas y planas.
Se logró la purificación de las cepas lactosa negativas mediante la siembra en agar TSA; y empleando la tinción Gram se logró establecer que todas las 19 colonias aisladas son cepas Gram negativas. A partir del análisis microscópico se estableció que la morfología corresponde a bacilos largos para 7 cepas y 12 cepas corresponden a bacilos cortos
Mediante la prueba oxidasa positiva se lograron seleccionar 5 colonias del lodo LAR y 6 colonias del lodo LM. En la Figura 3 se presenta una imagen de la prueba oxidasa realizada a las colonias aisladas. Como se aprecia la coloración lavanda la presencia de enzimas oxidasas. La reacción de la oxidasa se debe a la presencia de un sistema citocromooxidasa que activa la oxidación del citocromo que es reducido por el oxígeno molecular que produce agua o peróxido de hidrógeno según la especie bacteriana.El oxígeno actúa por tanto como aceptor final de electrones en la cadena transportadora de electrones. Por lo general, el sistema citocromo-oxidasa sólo se encuentra en los organismos aerobios, algunos anaerobios facultativos y, excepcionalmente, en algún microaerófilo (Vibrio fetus), pero los anaerobios estrictos carecen de actividad oxidasa [21].
A partir de las fermentaciones realizadas en medio MRS con las 11 cepas seleccionadas y mediante la técnica de tinción con Sudan Black se lograron de detectar 5 cepas con potencial de producción de polihidroxialconoatos (PHAs). Las cepas LAR-4D, LAR-5B, LAR-5E, provenientes del lodo activado recirculado y las cepas LM-3D, LM-3F aisladas del licor mixto fueron positivas para la tinción, lo que es un indicativo de la acumulación del biopolímero en las células bacterianas. Haciendo una estimación de la cantidad de colorante acumulado por las bacterias se logró establecer un porcentaje de acumulación del PHAs en las células. Las cepas LM-3D, LAR-4D, LAR-5B, LAR-5E presentaron porcentajes de acumulación de 2, 10, 4, 3 %, respectivamente. La cepa LM-3F presentó un porcentaje de acumulación de 25%, lo que la convierte en la cepa nativa más prometedora en la producción de PHAs aislada de estos lodos.
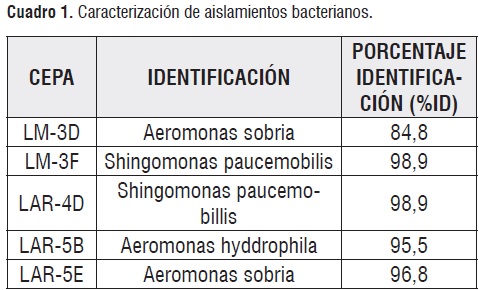
Empleando el sistema comercial API #20 NE (Biomerieux), se logró la identificación de las cepas, las cuales se identificaron comoShingomonas paucemobilis, Aeromonas hydrophila y Aeromonas sobria.En elcuadro 1se presentan las 5 cepas caracterizadas con los respectivos porcentaje de identificación (% Id) que el sistemas API asigna para cada caso. Como se aprecia la cepa LM-3F que presentó mayor acumulación de PHA, corresponde a la Shingomonas paucemobilis y fue aislada a partir del licor mixto (LM).Aunque las muestras fueron tomadas a partir de lodos diferentes (Licor Mixto y Lodos Activados Recirculados), no se observan diferencias en las especies aisladas, se obtuvieron Aeromonas sobria y Shingomonas paucemobillis en ambas muestras.
Existen reportes en la literatura que demuestran que estas especies pueden acumular diferentes PHAs y pueden utilizar una variedad de fuentes de carbono. Lee, et al, 2000 [22], reportó que la Aeromonas hydrophila aislada de muestras de aguas residuales produce 95,7 g/L de P(3HB-co-3HHx) al utilizar diferentes fuentes de carbono como ácido laúrico o ácido oleico.
Por su parte, Giavasis et al., 2006 [23], reportó la acumulación de 12,4 g/L de PHB en células de Shingomonas paucemobilis, valores que pueden son comparables con los reportados para Ralstonia eutropha.Aunque son pocos los reportes enfocados en el potencial de utilización de bacterias nativas de lodos activados en la producción de PHAs, los lodos activados son considerados como ecosistemas ricos y diversos en bacterias acumuladoras de PHAs [24].
Las bacterias empleadas en la producción de PHAs se pueden dividir en dos grupos dependiendo de las condiciones de cultivo requeridas para la síntesis. En el primer grupo se encuentran las bacterias que producen el biopolímero mediante un medio de cultivo limitado de alguno de los nutrientes esenciales tales como el N, P, Mg y S y con un exceso de fuente de carbono. Entre ellas se encuentran las bacteriasA. eutrophus, Protomonas extorquens, y Protomonas oleovorans. En el segundo grupo se encuentran las bacterias que no requieren de un medio de cultivo limitado de nutrientes esenciales para la síntesis de PHAs y que pueden acumular el polímero durante el crecimiento. Entre ellas se tienen a la Alcaligenes latus, una cepa mutante de Azotobacter vinelandii, y la cepa E. coli recombinante [11,13,25].
CONCLUSIONES
A partir de las muestras de lodos activados de una planta de tratamiento de aguas residuales, se aislaron cinco cepas nativas con potencial para la producción de polihidroxialcanoatos (PHAs). Las cepas aisladas fueron identificadas como Areomonas sobria, Shingomonas paucemobilis y Aeromonas hydrophila. Aunque existen algunos reportes en la literatura sobre la producción de biopolímeros a partir de estas bacterias es necesario establecer el verdadero potencial de producción de biopolímeros de las cepas nativas aisladas. Mediante la evaluación de los medios de cultivo y las condiciones de operación a emplear en las fermentaciones se podrá establecer a qué grupo pertenecen. Esta investigación constituye solo la etapa inicial del proceso que se requiere en la obtención de cepas nativas productoras de biopolímeros.
REFERENCIAS
[1] CORTÉS,L.Construcción de una biblioteca de mutantes PHA-negativo de Pseudomonas putida por transposon mini Tn5 y evaluación de los genes afectados. [trabajo de grado para optar al título de Microbióloga Industrial]. Sao Pablo (Brasil):Pontificia Universidad Javeriana, Facultad de ciencias,2008, 83p. [ Links ]
[2] LUXEMBOURG. JRC. EUROPEAN COMMISSION 2007.Consequenses, Opportunities and chanllenges of modern biotechnology for Europe.Sevilla(España): 2007, 145p. [ Links ]
[3] CHANPRATEEP, S. Current trends in biodegradable polyhydroxyalkanoates. Journal of Bioscience and Bioengineering. 110(6), 2010, p. 621-632. [ Links ]
[4] BRUSELAS. PLACTICSEUROPE, Association of plastics Manufacturers. 2012. Plastics - the Facts:an analysis of European plastics production, demand and waste data for 2011. Bruselas (Bélgica): 2012, p. 1-36. [ Links ]
[5] BRAUNEGG, G., LEFEBVRE, G., GENSER, K. Polyhydroxyalkanoates, biopolyesters from renewable resourse: Physiological and engineering aspects.Journal of Biothenology. 87, 1998, p.137-146. [ Links ]
[6] RAMÍREZ, M., OCAMPO C., VANEGAS D.Producción de Biopolímeros en reactores CSTR y AIRLIFT, empleando desechos industriales. Revista Investigaciones Aplicadas, 1(1), 2008, p. 35-37. [ Links ]
[7] TINOCO, R.M.Plásticos Biodegradables.Revista ¿Cómo ves?, 79, 2007, p.22-25. [ Links ]
[8] REDDY, C, GHAI, R, RASHMI, K.V. Polyhydroxyalkanoates: an overview. Bioresour Technol, 87, 2003, p. 137-146. [ Links ]
[9] HOSSAIN, M.S. Plastic pollution threat to health, environment. The New Nation. Bangladesh's Independent News Sourse. 2008 [online]. Available:http://www.enn.com/pollution/article/38956[citado 6 junio 2013] [ Links ]
[10] SEGURA, D. NOGUEZ, R.y ESPIN, G.Contaminación ambiental y bacterias productoras de plásticos biodegradables en: una ventana al quehacer científico. México D.F. (México): Instituto de Biotecnología, capítulo 31, 2008, p. 361-372. [ Links ]
[11] LEE, S. Y.Plastic bacteria?Progress and prospects for polyhydroxyalkanoate production in bacteria.Trends Biotechnol,14, 1996, p. 431-438. [ Links ]
[12] SURIYAMONGKOL, P., WESELAKE, R., NARINE, S., MOLONEY, M., SHAH, S.Biotechnological approaches for the production of polyhydroxyalkanoates in microorganisms and plants: A review. Biotechnology Advances,25 (2), 2007, p.148-175. [ Links ]
[13] BARBOSA, M., ESPINOSA, A., MALAGÓN, D., MORENO, N. Producción de poli-ß-hidroxibutirato (PHB) por ralstonia eutropha ATCC 17697. Revista de La Facultad de Ciencias Pontificia Universidad Javeriana. 10 (1), 2005, p. 45-54. [ Links ]
[13] REHM, B.H.A. Polyester synthases: natural catalysts for plastics. Biochem. J. 376(1), 2003, p.15-33. [ Links ]
[14] LEE, S.Y. and CHOI, J. Production of microbial polyester by fermentation ofrecombinant microorganisms. T. Scheper. Advances in biochemicalengineering/biotechnology.71, 2001, p. 183-207. [ Links ]
[15] UNITED STATES OF AMERICA. NATIONAL CENTER FOR CLEAN INDUSTRIAL AND TREATMENT TECHNOLOGIES. Activities Report: October 1998-September 1999. Michigan (United States):2000, 62p. [ Links ]
[16] RAMSAY, B.A., LOMALIZA, K., CHAVARIE, C., RAMSAY, J.A. Production of poly-b-hydroxybutyric-co-b-hydroxyvaleric acids. Appl. Environ. Microbiol., 56, 1990, p. 2093-2098. [ Links ]
[17] BURDON, K. Fatty material in bacteria and fungi revealed by staining, drying and fixed slide preparations. J. Bacteriol. 15, 1946, p. 240-245. [ Links ]
[18] SALAZAR DE VEGAS E., NIEVES, B., RUÍZ, J., VILA, J. Utilidad del sistema API 20NE para identificar especies del género acinetobacter y otros bacilos gramnegativos no fermentadores. Revista de la Sociedad Venezolana de Microbiología. 28, 2008, p. 89-95. [ Links ]
[19] DAY, J. and STACEY, G. Cryopreservation and Freeze-Drying Protocols. 2 ed. Totowa (New Jersey): Humana Press, 2007, 347p. [ Links ]
[20] CORTÉS, J. A. Recursos Didácticos para Biología [online]. Available: http://www.joseacortes.com/microbiologia/pruebasbioq/oxidasa.htm.[citado marzo 2013] [ Links ].
[21] LEE, S.H., OH, D.H., AHN, W.S., LEE, Y., CHOI, J. and LEE, S. Y. Production of poly(3-hydroxybutyrateco-3 hydroxyhexanoate) by high-cell-density cultivation of aeromonas hydrophila. Biotechnol. Bioeng., 67, 2000, p. 240- 244. [ Links ]
[22] GIAVASIS, L., HARVEY and MCNEIL, B. The effect of agitation and aeration on the synthesis and molecular weight of gellan in batch cultures of sphingomonas paucimobilis.Enzyme Microb. Tech., 38, 2006, p. 101-108. [ Links ]
[23] VISHNUVARDHAN, R, THIRUMALA M., KISHORE R., MAHMOOD S.K. Isolation of bacteria producing polyhydroxyalkanoates (PHA) from municipal sewage sludge. World J Microbiol. Biotechnol., 24, 2008, p. 2949-2955. [ Links ]
[24] KHANNA, S., SRIVASTAVA, A. K., Recent advances in microbial polyhydroxyalkanoates. Process Biochemistry, 40, 2005, p.607-619. [ Links ]