Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.12 no.1 Popayán Jan./June 2014
BACTERIAS AISLADAS DEL JUGO DE FIQUE CON ACTIVIDAD ANTAGÓNICA SOBREPhytophthora infestans (Mont.) de Bary
BACTERIA ISOLATED FROM SISAL JUICE WITH ANTAGONIC ACTIVITY AGAINST Phytophthorainfestans (Mont.) de Bary
BACTERIAS ISOLADAS DO SUCO DE FIQUE COM ACTIVIDADE ANTAGONICA FRENTE APhytophthorainfestans (Mont.) de Bary
IVAN DARIO OTERO R.1, ANDRES MAURICIO HURTADO B.2,OSCAR ARANGO B.3, PABLOFERNÁNDEZ I.4* FERNANDO JAVIER MARTINEZ S.5, ZHAIRA STEPHANIEPARRA G.5.
1 Universidad de Nariño.Biólogo, Grupo de Biotecnología Microbiana. Pasto, Nariño, Colombia.
2Universidad de Nariño.Director Grupo de Tecnologías Emergentes en Agroindustria.Ph.D. Ingeniería Química.Pasto, Nariño, Colombia.
3Universidad de Nariño.M.Sc. Ingeniería Ambiental y Sanitaria. Pasto, Nariño, Colombia.
4Universidad de Nariño. Director Grupo de Biotecnología Microbiana, Ph.D. Ciencias Biológicas Área Microbiología. Pasto, Nariño, Colombia.
5Universidad de Nariño. Ingenieros Agroindustriales. Pasto, Nariño, Colombia.
Correspondencia: pabfdez@gmail.com
Recibido para evaluación: 04-06-2013. Aprobado para publicación: 28-04-2014.
RESUMEN
Phytophthora infestans (Mont.) de Bary, causa pérdidas considerables en todas las áreas donde se cultivan Solanáceas. Su manejo se realizapor métodos químicos, biológicos y tradicionalmente por los agricultores utilizando jugo de fique. Se aislaron bacterias presentes en el jugo de fique y se evaluó el antagonismo contra P.infestans empleando el principio de la técnica de Bauer-Kirbyel. Se seleccionó el aislado con mayor inhibición para realizar una fermentación en jugo de fique estéril y pruebas de antagonismo contra P. infestans en cajas de agartomate enmendadas con caldo fermentado. Finalmente, se realizó la caracterización molecular del aislado seleccionado mediantela secuencia parcial del gen ribsomal 16S rRNA. Se obtuvo 41 aislados, de los cuales ocho presentaron inhibición del crecimiento In Vitro de P. infestans. Se seleccionó el aislado M46 para las pruebas de antagonismo en placas de agar tomate enmendadas con 200 µLde caldo fermentado y se alcanzó un porcentaje de inhibición del 95,4% del crecimiento de P. infestans. El aislado M46 se identificó como Bacillus spcon un porcentaje de identidad del 85% con B. cereus. La cepa de Bacillus spM46 tiene potencial como agente de control para el patógeno P.infestans.
PALABRAS CLAVE: Antagonismo, Oomycete, Bacillus sp,Técnica de Bauer-Kirby
ABSTRACT
Phytophthorainfestans (Mont.) de Bary, has caused considerable losses in all areas where are cultivated the Solanaceae. Its control has been done by chemical, biological, and traditionally by farmersusing sisal juice. We isolated bacteria present in the sisal juice.These were tested for antagonism to P.infestans using the principle of Bauer-Kirby technique. The isolate with most inhibition zone was submeted to fermentation in sterile sisal juice and was also tested for antagonism against P.infestans on tomato agar amended with the fermented broth. Finally, we performed the molecular characterization of isolates selected using the 16S rRNA gene ribosomal. We obtained a total of 41 isolates, eigth of which showed good growth inhibition in vitro of P. infestans. The M46 Isolate was selected for testing of antagonism in tomato agar plates amended with 200μl of fermented broth and reached a rate of 95,4% inhibition of growth of P.infestans. The M46 isolate was identified as Bacillus spM46 with a percentage identity of 85% with Bacillus cereus. The strain of Bacillus sp. M46 has potential as a control agent for the pathogen P.infestans.
KEYWORDS: Antagonism, Oomycete, Bacillus sp, Bauer-Kirby technique
RESUMO
Phytophthorainfestans (Mont.) de Bary, causou perdas consideráveis em todas as áreas onde foram cultivadas as Solanaceae. Seu controle tem sido feito por compostos químicos, biológicos, e tradicionalmente os agricultores ocontrolam-ló diretamente usando suco de sisal. Foram isoladas bactérias do suco de sisal, as quais foram testados para o antagonismo de P.infestans utilizando o principio da técnica de Bauer-Kirby. O isolado com maior inibição foi levado a fermentação com suco de sisal estéril e posteriormente submetido ao proceso de antagonismo contra P.infestans no meio de cultura de ágar tomate com caldo fermentado. Finalmente, foi realizada a caracterização molecular de isolados selecionados usando o gene 16S rRNAribsomal. Obtivemos um total de 41 isolados, dos quais 8 mostraram uma boa inibicao de crecimentoin vitro de P. infestans. O isolado M46 foi selecionado para o teste de antagonismo em placas do meio de cultura ágar tomate alterado com 200μl de caldo fermentado, este alcançou uma taxa de 95,4% de inibição do crescimento In vitro de P.infestans. O isolado M46 foi identificado como Bacillussp com uma identidade percentual de 85% a cepa de B.cereus. Bacillussp M46 tem um potencial como agente de controle para o patógenoP.infestans.
PALAVRAS-CHAVE: Antagonismo, Oomycete, Bacillus sp, Técnica de Bauer Kirby
INTODUCCIÓN
El OomicetoPhytophthorainfestans (Mont) De Bary,agente causal de la gota o “tizóntardío” de la papa, se considera como la enfermedad más importante de este cultivo y la mayor causa del uso de agroquímicos [1]. Este patógeno se encuentra ampliamente difundido en todos los lugares del mundo donde se desarrolla el cultivo de la papa, así como en las zonas donde se produce tomate, especie en la que igualmente causa grandes pérdidas debido a la reducción en rendimientos y los altos costos de manejo.Su incidencia en aquellas áreas se acentúaen épocas de alta humedad relativa y temperaturas bajas, ocasionando la muerte de hojas, tallo y tubérculos de la planta [2,3,4].
La prevención y el manejo de esta enfermedad ha sido una gran preocupación en diferentes áreas a nivel mundial [5]. Al respecto, Govers (2001)[6] opina que la clasificación errónea de P. infestans como hongo, ha causado muchas décadas de retraso, dado que gran parte de los ingredientes activos de los fungicidas no son tan efectivos para el control de los Oomicetos, además, se ha limitado el conocimiento de la biología de este patógeno. Es de destacar, que el desarrollo de fungicidas debe estar asociado a enzimas particulares y otros procesos bioquímicos que son únicos para los Oomycetes, puesto que poseen una maquinaria bioquímica y molecular diferente a otros hongos fitopatógenos [6]. En la actualidad, el control efectivo del tizóntardío se basa en el uso de fungicidas de síntesis química [4], lo que permite reducir las pérdidas causadas por esta enfermedad. No obstante, el manejo indiscriminado de estos productos, ocasiona efectos perjudiciales en la salud de los productores, los consumidores y el medio ambiente, permitiendo además la aparición de poblaciones nuevas y más agresivas de P. infestans[5,7,8]. Por esta razón, recientemente se buscan nuevas alternativas para el control de la enfermedad entre las que se destaca el uso de microorganismos o compuestos naturales como el jugo de fique. El jugo de fique es un subproducto orgánico de origen vegetal, resultante de la obtención de fibras de plantas del género Furcraea [9], estácompuesto por agua, celulosa, parte orgánica y amorfa (con sacarosa, proteínas, nitrógeno, fósforo, calcio, potasio, saponinas y sapogeaninas) y minerales [10]. Su uso en la agricultura tradicional ha sido empírico y existen experiencias por parte de agricultores quienes hablan de las bondades de su utilización como repelente, fertilizante, herbicida, fungicida, líquido edáfico y con propiedades curativas en enfermedades foliares de actividad sistémica [3,10]. En este sentido, con el objetivo de determinar el papel de los microorganismos del jugo de fique, en este estudio se evaluó la actividad antagónica de bacterias aisladas del jugo de fique sobre el patógeno P. infestans.MÉTODO
Aislamiento de microorganismos a partir del jugo de fique
Para el aislamiento de los microorganismos se realizó una fermentación batch del jugo de fique durante 6 días a 30°C, cada dos días de fermentación se tomaron 10 mL de muestra y se realizaron diluciones seriadas hasta 10-6, de las tres últimas diluciones se tomaron 100µL y se inocularon en cajas de Agar PlateCount (PCA) suplementadas con jugo de fique. Los aislados obtenidos se agruparon teniendo en cuenta la descripción de sus atributos culturales como: forma, margen, elevación, superficie, textura o consistencia, propiedad óptica, tamaño, configuración y color [11,12,13,14,15]. Además, se hizo una descripción de sus características microscópicas a través de la respuesta que presentaron a tinción de Gram [11,12,13].
Pruebas de antagonismocontraPhytophthora infestans
Los aislados obtenidos del jugo de fique se inocularon en caldo nutritivo suplementado con glucosa (20 g.L-1) y se sometieron a un proceso de fermentación por 9 días, a 32°C y 130 rpm. Se realizó la extracción de los metabolítos de acuerdo al protocolo del Instituto de Investigaciones Biológicas Clemente Estable[16] con las siguientes modificaciones:se reemplazó el ácido trifluoroacético por ácido tricloroacético y se agregó acetato de etilo en proporción 1:1. Los extractos obtenidos se sometieron a las pruebas de antagonismo contra P. infestans en agar tomate y aplicando la técnica de sensidiscos, los cuales fueron impregnados con 150 µL de cada solución de metabolítos obtenida.Posteriormente, se ubicaron en cajas de petri previamente inoculadas con discos de 1,36 cm de diámetro del patógeno; las cajas se llevaron a incubación a una temperatura promedio de 18°C. y se siguió el crecimiento del patógeno durante ocho días, finalmente se midió el halo de inhibición generado por el sensidisco frente al patógeno.
A continuación, el aislado que presentó la mejor inhibición del crecimiento de P. infestans se sometió a un proceso de fermentación durante 6 días en 100 mL de jugo de fique filtrado y esteril. Este medio se inoculó con la bacteria seleccionada a una densidad óptica de 0,015 ± 0,01 y se llevó a incubación a 32°C y 100rpm. Transcurrido este tiempo para la evaluación de los antagonistas se utilizó un cultivo previo de P. infestans en agar-tomate del cual se tomaron discos de 1,36 cm de diámetro inoculados con el patógeno y se sembraron en cajas de agartomate, enmendado con 200 µL(10000 ppm) del caldo fermentado por el aislamiento seleccionado. Después de ocho días de incubación a una temperatura promedio de 18°C se evaluó el crecimiento de P. infestans en cada unidad experimental por medición del diámetro de crecimiento. Los ensayos se realizaron por triplicado y como control se utilizaron cajas de agar tomate sin enmendar.
Secuenciación de un fragmento del gen 16S rRNA del aislado bacteriano más antagónico dePhytophthora infestans
Se realizo la extracción de DNA del aislamiento bacteriano que presentó la mayor inhibición del crecimiento de P. infestans utilizando el protocolo de Rivera et al. (1995) [17]. Para la amplificación de un fragmento del gen16S rRNA se utilizaron los cebadores A (Directo) 5’ GGAGCAAACAGGATTAGATACCC 3’ y J (inverso) 5’ TTCTCCTAGGGCTACCTTGTTAC 3’ [18].
Para la reacción de PCR se utilizó un volumen final de 50 µL con los siguientes componentes:5µL Buffer KCL, 1µL MgCl2 25mM,1µL cebador A directo 20µM, 1µL cebador J inverso 20µM, 0,2µL MixDNTPs 2mM,0,4µL Taq polimerasa, 1µLde muestra de DNA y se completo el volumen con 40,4µL de agua miliQ. El programa de amplificación fue el siguiente: 95°C por 2 min; 30 ciclos con las siguientes características: 94°C/2 min, 55°C71 min y 72°C/3 min; la extensión final fue de 10 min a 72°C. El producto de la PCR fue visualizado en gel de agarosa al 1%. Los amplificados se enviaron a MACROGEN (Corea) para su secuenciación.Una vez obtenidas las secuencias se visualizaron en el programa Chromas lite versión 2.01,cada secuencia fue verificada en su totalidad y se descartaron las que presentaron ruidos por contaminación, por falta de purificación o errores de traqueado propios del secuenciador utilizado en el proceso de secuenciación por MACROGEN.Posteriormente, la secuencia seleccionada fue editadaen el programa BioEdit versión 7.0.4. Finalmente, se comparó con la base de datos GenBank [18].
RESULTADOS
Aislamiento de microorganismos a partir del jugo de fique
Se obtuvieron 41 aislados, los cuales presentaron características macroscópicas de forma: puntiforme (20%), irregular (15%) y circular (65%), margen: entero (80%), irregular (14%), lobulado y ondulado (3%); elevación: plana (78%), elevada (9%), umbonada (7%) convexa y montañosa (3%); superficie: lisa (94%), áspera y rugosa (3%); textura: mantecosa (97%) y pegajosa (3%); propiedad óptica: brillante (14%), brillante traslucida (10%) y opaca (76%); tamaño: pequeña (37%) y mediana (63%); configuración: redonda (73%), irregular (14%), redonda con margen festoneado (5%) y filiforme (8%).
Todos los aislados se conservaron en tubos con agar nutritivo inclinado y se mantienen en el Cepario del Grupo de Biotecnología Microbiana de la Universidad de Nariño.
La caracterización microscópica permitió determinar que 25 aislados eran Gram positivos (60%), 14 Gram negativos (34%) y 2 Gram variables (6%). Las agrupaciones morfológicas encontradas fueron: cocobacilos Gram negativos (15%), Bacilos esporulados Gram positivos (32%), Bacilos grandes Gram positivos (15%), Bacilos cortos Gram positivos (4%), Bacilos cortos Gram negativos (19%), Bacilos grandes Gram variables (5%) y Cocos Gram positivos (10%).
Los aislados bacterianos encontrados en este estudio utilizaron el jugo de fique como sustrato para su crecimiento, dado que éste contiene una serie de compuestos como celulosa, sacarosa, glucosa, fructosa, proteínas, fosforo, calcio, potasio, minerales y agua [10], los cuales, pueden ser aprovechados por diferentes comunidades bacterianas. Por lo tanto, el jugo de fique se convierte en un medio de cultivo para determinadas poblaciones microbianas que a través de un proceso de bioconversión metabólica pueden transformar este sustrato en metabolítos bacterianos de interés.
Pruebas de antagonismos contra Phytophthora infestans
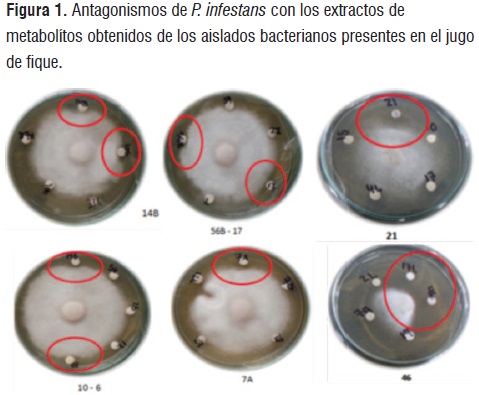
Utilizando el protocolo de extracción de metabolitos del Instituto de Investigaciones Biológicas Clemente Estable[16]con modificaciones, se encontró que existen diferencias estadísticas significativas en la inhibición del crecimiento de P. infestans (P<0,05) entre los cuales se destacan los aislados bacterianos: M21, M105, M14B, M56B, M6, M7A, M17 y M46 (figura 1).
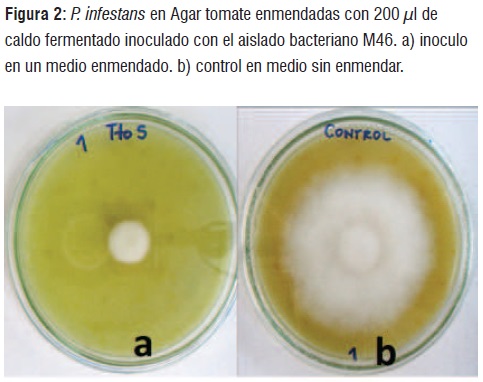
Teniendo en cuenta que el aislado M46 presentó la mayor inhibición del crecimiento de P. infestans, este microorganismo se sometió a fermentación durante 6 días a 35°C y 100rpm en jugo de fique estéril,después del ensayo de antagonismo en cajas de agar tomate enmendadas con caldo fermentado,se encontró un porcentaje de inhibición del crecimiento de P. infestansdel 95,46%, en contraste, con el tratamiento control, que únicamente estaba conformado por jugo de fique sin fermentar con la bacteria M46 donde se observó crecimiento normal del patógeno (figura 2).
Teniendo en cuenta estos resultados se puede concluir que son las bacterias presentes en el jugo de fique las responsables del control del fitopatógeno cuando los agricultores adicionan jugo de fique sobre cultivos de papa y otras solanáceas, ya que se observó un efecto inhibitorio In vitro del crecimiento de P. infestans con los metabolítos bacterianos impregnados en sensidiscos y en agar tomate enmendado con jugo de fique fermentado con el aislado M46.
Caracterización molecular parcial del aislamiento bacteriano M46
De acuerdo con los resultados del análisis de la secuencia parcial del gen ribosomal 16S rRNAse concluye que el aislado M46es una bacteria que pertenece al géneroBacillus sp, y presentó un 85% de identidad con la especie Bacillus cereus EIF 59 con código de acceso HM480354.
Discusión
Como se evidencia en los resultados, el uso de microorganismos para el control biológico de las enfermedades es una alternativa eficiente que contribuye al desarrollo de una agricultura sostenible y disminuye los efectos asociados a la aplicación sistemática de productos químicos que ocasionan efectos como el resurgimiento de microorganismos, desarrollo de resistencia genética, contaminación del ambiente y afectaciones a la salud humana [19,20].
La actividad antagónica de algunos microorganismos frente a otros está relacionada con la síntesis de moléculas tóxicas volátiles y enzimas hidrolíticas, lo cual a su vez, depende del sustrato utilizado para el crecimiento del microorganismo, las relaciones con otros microorganismos presentes en el ecosistema y la fracción celular activa [19]. En general, entre los agentes de control biológico más utilizados se encuentran los géneros: Agrobacterium, Arthrobacter, Azotobacter, Enterobacter, Flavobacterium, Pseudomonas, Rhizobium, Serratia, Streptomyces, Xanthomonas, Trichoderma y Bacillus [20, 21].
Es de señalar que las especies del género Bacillus, como la cepa M46 reportada en este trabajo, son de interés como agentes de control biológico porque tienen rápido crecimiento en medio liquido, forman endosporas resistentes al calor y producen varios tipos de metabolitos de naturaleza peptídica y lipopeptídica, entre los que se encuentran micobacilinas, iturinas, bacilomicinas, micosubtilinas, fungistatinas, metabolítos antifúngicos volátiles y enzimas quitinolíticas, razón por la cual, estos microorganismos se han reportado como eficientes para el control de hongos fitopátogenos de los géneros Rhizoctonia, Alternaria, Sclerotinia, Fusarium, Uromyces, Gaeummanomyces, Pythium y Phytophthora[20, 22, 23].
Así mismo, especies del genero Bacillus como Bacillus firmus se ha reportado como agente inhibitorio del crecimiento micelial In vitro de Phytophthora capsisci Leo, con un porcentaje de inhibición del 41% [19].Sin embargo, con Bacillus sp.M46 se obtuvo inhibición del 95,46% para el crecimiento de P. infestans;en consecuencia los metabolitos producidos por esta bacteria tienen potencial de uso en el sector agrícola dado su carácter orgánico y biodegradabilidad y de esta manera se contribuye a disminuir el impacto ambiental que causan los fungicidas xenobióticos [24, 25].
Yongjun et al.[26] evaluaron la eficiencia de resistencia en plantas de tomate inducidas por aislados de rhizobacteria (Burkholderia gladioli, Miamiensis avidus, Acinetobacter quenomo sp y B.cereus) contra la enfermedad del tizón tardío causada por P. infestans. Encontraron que en hojas de plantas pre-inoculadas con los aislados bacterianos se presentó una aparente lesión tres días después de la inoculación, sin embargo, cinco días más tarde, la severidad de la enfermedad fue menos que la de las plantas control. Los rangos de protección por la pre-inoculación con los aislados bacterianos alcanzaron el 50%.
Considerando los anteriores resultados, es posible elaborar un bioinsumo para utilizar In situ Bacillus sp. M46 como agente controlador de fitopatógenos, ya que es necesario implementar métodos alternativos para elcontrol de P. infestansdebido a la creciente demanda por la seguridad de los productos agrícolas, la aparición de poblaciones de patógenos resistentes a fungicidas, y los problemas ambientales causados por el uso desmedido de los fungicidas.
En este estudio se probó que bacterias presentes en el jugo de fique tienen actividad antagónica frente al patógeno P. infestans de manera individual crecidas en un medio con glucosa y también utilizando como sustrato el jugo de fique que se considera como un residuo agroindustrial causante de graves problemas de contaminación en los sectores aledaños al procesamiento de la cabuya
CONCLUSIONES
Probablemente los metabolitos producidos por las comunidades microbianas presentes en el jugo de fique son las que ejercen control biológico de P. infestans cuando los agricultores aplican jugo de fique sobre los cultivos de papa y otras Solanaceas.
Bacillus sp.M46 tiene potencial como agente de control biológico de P. infestans utilizando jugo de fique como sustrato para su crecimiento.
Es posible utilizar jugo de fique como sustrato para el crecimiento de bacterias antagónicas de P. infestansy contribuir así a la preservación del medio ambiente y a la sostenibilidad de los cultivos que son infectados por este phytopatogeno.
AGRADECIMIENTOS
Los autores expresan su agradecimiento al Ministerio de Agricultura y Desarrollo Rural por la financiación de este trabajo.
A Edith Mariela Burbano Ph.D. docente programa de Biología, Universidad de Nariño, por su asesoría en los métodos moleculares.
A Guido Ernesto Villota Calvachi, Biólogo, técnico laboratorio Biotecnología Microbiana, Universidad de Nariño, por su apoyo en los diferentes experimentos de laboratorio desarrollados en esta investigación
REERENCIAS
[1] COLOMBIA. CADENA PRODUCTIVA NACIONAL DEL FIQUE CADEFIQUE. Guía ambiental del subsector fiquero. 2 ed.Bogotá (Colombia): Ministerio de Ambiente, Vivienda y Desarrollo Territorial, 2006, 122 p. [ Links ]
[2] ESCALANTE, M. y FARRERA, R. Epidemiología del tizón tardío (Phytophthora infestans Mont De Bary) de la papa en zonas productoras del estado Táchira, Venezuela. Biotecnología en el sector agropecuario y agroindustrial, 16(1), 2004, p. 47-54. [ Links ]
[3] MARTÍNEZ, E. y OSORIO, J. Estudios preliminares para la producción de un biosurfactante bacteriano activo contra Phytophthora infestans (Mont.) De Bary. Revista CORPOICA - Ciencia y Tecnología Agropecuaria, 8(2), 2007, p. 5-16. [ Links ]
[4] CARRILLO, A., GÓMEZ, I., COTES, J.M. y ÑÚSTEZ, C.E. Efecto de algunos aceites esenciales sobre el crecimiento de Phytophthora infestans (Mont.) de Bary en condiciones de laboratorio. Agronomía Colombiana, XXVIII(2), 2010, p. 245-253. [ Links ]
[5] JARAMILLO, S. Monografía sobre Phytophthorainfestans (Mont) de Bary. Medellín (Colombia): Universidad Nacional de Colombia sede Medellín, Facultad de Ciencias Agropecuarias,2003, 141 p. [ Links ]
[6] GORVES, F. Misclasification of pest as "fungi" puts vital research on wrong track. Nature, 2001, p. 411-633. [ Links ]
[7] GRIFFITH, G.W. and SHAW, D.S. Polymorphisms in Phytophthorainfestans: four mitochondrial haplotips are detected after PCR amplification of DNA from pure cultures or from hots lesions. Applied of EnvironmentalMicrobiology, 64(10), 1998p. 4007-4014. [ Links ]
[8] GIRALDO, D., JUAREZ, H., PÉREZ, W., TREBEJO, I., YZARRA, W.y FORBES, G. Severidad del tizón tardío de la papa (Phytophthorainfestans) en zonas agrícolas del Perú asociado con el cambio climático. Revista Peruana Geo-Atmoesférica RPGA, (2), 2010, p. 56-67. [ Links ]
[9] OCHOA, J.C. y JARAMILLO, L. Uso del jugo de fique como aditivo orgánico en el hormigón. Scientia et Technica, XIII(36), 2007, p. 454-459. [ Links ]
[10] PANTOJA, A. y LATORRE, L. Evaluación de tratamientos térmicos para la inactivación de las enzimas polifenol oxidasa y peroxidasa en el jugo de fique (Furcraea gigantea Vent.) producido en el departamento de Nariño [Tesis pregrado Ingeniería Agroindustrial].Pasto (Colombia): Universidad de Nariño, Facultad de Ingenieria Agroindustrial, 2010. [ Links ]
[11] WINN, W., ALLEN, S., JANDA, W., KONEMAN, E., PROCOP, G., SCHRECKENBERGER, P. and WOODS, G. Color Atlas and Textbook of Diagnostic Microbiology. 5 ed.Philadelphia (USA): Lippincott Williams and Wilkins,1997, p. 98-100. [ Links ]
[12] BENSON, H. Microbiological Applications: Laboratory Manual in general microbiology. 8 ed. Texas (USA): The McGraw-Hill Companies, 2001, p. 55- 71. [ Links ]
[13] HARLEY, J. and PRESCOTT, L. Laboratory Exercises in Microbiology.5 ed. Texas (USA): The Mc Graw-Hill companies, 2002,p. 31-68. [ Links ]
[14] PÍREZ, M. y MOTA, M. Temas de Bacteriología y Virología Médica:morfología y Estructura Bacteriana. 2 ed.Montevideo (Uruguay): Universidad de la República, Departamento de Bacterología y Virología, Oficina del libro FEFMUR, 2006, p. 26-27 [ Links ]
[15] DÍAZ, G. Fundamentos y Técnicas de Análisis Microbiológicos: Morfología y Estructura Bacteriana. Madrid (España): 2009, p. 6-9. [ Links ]
[16] URUGUAY. INSTITUTO DE INVESTIGACIONES BIOLÓGICAS CLEMENTE ESTABLE. Practico de laboratorio para bioquímica II: Metabolítosproducidos por bacterias rizosféricas promotoras del crecimiento vegetal. Montevideo (Uruguay): 2004, 11 p. [ Links ]
[17] RIVERA, I.G., CHOWDHURY, M.A., HUQ, A., JACOBS, D., MARTINS, M.T. and COLWELL, R.R.Enterobacterial Repetitive Intergenic Consensus Sequences and the PCR to Generate Fingerprints of Genomic DNAs from Vibrio cholerae O1, O139, and Non-O1 Strains. Applied and Environmental Microbiology, 61, 1995, p. 2898-2904. [ Links ]
[18] REVELO, D. Diseño de iniciadores y validación de una metodología molecular para la selección de bacterias de diferentes géneros acumuladoras de polihidroxialcanoatosPHAs [Tesis Maestría en Ciencias Microbiológicas]. Bogotá (Colombia): Universidad Nacional de Colombia, 2005. [ Links ]
[19] LAGUNAS, J., ZAVALETA, E., OSADA, S., ARANDA, S., LUNA, I. y VAQUERA, H.Bacillusfirmuscomo agente de control biológico de PhytophthoracapsiciLeo.en Jitomate (LycopersiconesculentumMill). Revista Mexicana de Fitopatología, 19(001), 2001,p. 57-65. [ Links ]
[20] REINOSO, Y., CASADESÚS, L., GARCIA, A., GUTIÉRREZ, J. yPAZOS, V.Aislamiento, selección e identificación de bacterias del género Bacillusantagonistas de Pectobacteriumcarotovorum.Fitosanidad, 10(3), 2006, p. 187-191. [ Links ]
[21] BASURTO, M., SAN AMBROSIO, M., GARCIA, J. y VÁZQUEZ, M. Cambios en la estructura celular durante la actividad antagonica de Bacillussubtiliscontra Rhizoctoniasolaniy Fusarium verticillioides. Acta microscópica,19(2), 2010, p. 138-144. [ Links ]
[22] REINOSO, Y., VAILLANT, D., CASADESÚS, L., GARCÍA, E. y PAZOS, V. Selección de cepas de Bacillus y otros géneros relacionados para el control biológico de hongos fitopatógenos. Fitosanidad, 11(1), 2007, p. 35-40. [ Links ]
[23] HERNÁNDEZ, F.D., LIRA, R.H., CRUZ, L., GALLEGOS, G., GALINDO, M., PADRÓN, E. y HERNÁNDEZ, M. Potencial antifúngico de cepas de Bacillusspp. y extracto de Larrea tridentatacontra Rhizoctoniasolanien el cultivo de papa (Solanumtuberosum L). RevistaInternacional de Botánica experimental, 77, 2008, p. 241-252. [ Links ]
[24] ZHU, G., HUANG, F., FENG, L., QIN, B., YANG, Y., CHEN, Y. and LU, X. Sensitivities of PhytophthorainfestanstoMetalaxyl, Cymoxanil, and Dimethomorph. Agricultural Sciences in China, 7(7), 2008, p. 831-840. [ Links ]
[25] FONTEM, D.A., OLANYA, O.M., TSOPMBEHG, G.R. and OWONA, M.A.P. Pathogenicity and metalaxyl sensitivity of Phytophthorainfestansisolates obtained from garden huckleberry, potato and tomato in Cameroon. Crop protection, 24, 2005, p. 449-456. [ Links ]
[26] YONGJUN, A., SEOGCHAN, K., KIDEOK, K., BYUNG, K. and YONGCHULL, J. Enhanced defense responses of tomato plants against late blight pathogen Phytophthorainfestansby pre-inoculation with rhizobacteria. Crop protection, 29, 2010, p. 1406-1412. [ Links ]