Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.12 no.2 Popayán July/Dec. 2014
BIODEGRADACIÓN ANAEROBIA DE UN MATERIAL BIODEGRADABLE BAJO DIGESTIÓN ANAEROBIA TERMÓFILA
ANAEROBIC BIODEGRADATION OF A BIODEGRADABLE MATERIAL UNDER ANAEROBIC-THERMOPHILIC DIGESTION
BIODEGRADAÇÃO ANAERÓBICA DE UM MATERIAL BIODEGRADÁVEIS EM DIGESTÃO ANAERÓBIA TERMOFÍLICA.
1Universidad del Cauca,Facultad de Ciencias Agrarias, Grupo ASUBAGROIND. Ingeniero Agroindustrial. Popayán, Colombia
2 Universidad del Cauca, Profesor Facultad de Ciencias Agrarias, Grupo ASUBAGROIND. Ingeniero agroindustrial, MSc. Popayán, Colombia.
Correspondencia: rcmunoz@unicauca.edu.co
Recibido para evaluación: 12-12-2013. Aprobado para publicación: 15-06-2014.
RESUMEN
Este trabajo determinó la biodegradación anaerobia de un polímero (muestra de ensayo) obtenido por extrusión de almidón nativo de yuca, ácido poliláctico y policaprolactona. Inicialmente se preparó un inóculo metanogénico termófilo a partir de desechos sólidos urbanos. La concentración final de metano en el gas generado y pH del medio, alcanzaron valores del 59,6% y 7,89 respectivamente. El montaje del ensayo de biodegradación se efectuó según los estándares contenidos en la norma ASTM D5511. Los porcentajes de biodegradación obtenidos después de 15 días de digestión fueron: 77,49%, 61,27%, 0,31% para la referencia positiva, la muestra de ensayo y referencia negativa respectivamente. Debido a que la referencia positiva presenta valores de biodegradación superiores al 70%, se deduce que el inoculo utilizado presenta características y actividad microbiana adecuada. Un 61,27% de biodegradación, una concentración de metano en gas de 59,35% y un pH final de 7,71 en los reactores correspondientes a la muestra de ensayo, revelan la capacidad que tiene el polímero extruido para ser degradado en condiciones anaerobias termófilas de altas concentraciones de sólidos.
PALABRAS CLAVE: Almidón, Acido poililáctico, Policaprolactona.
ABSTRACT
This paper dertermined the anaerobic biodegradation of a polymer obtained by extrusion process of native cassava starch, polylactic acid and polycaprolactone. Initially a thermophilic - methanogenic inoculum was prepared from urban solid waste. The gas final methane concentration and medium’spH reached values of59,6% and 7,89 respectively. The assay assembly was carried out according ASTM D5511 standard. The biodegradation percent of used materials after 15 day of digestion were: 77,49%, 61,27%, 0,31% for cellulose, sample and polyethylene respectively. Due cellulose showed biodegradation levels higher than 70% it’s deduced that the inoculum conditions were appropriate. A biodegradation level of 61,27%, 59,35% of methane concentration in sample’s evolved gas and a medium’s finale pH of 7,71 in sample’s vessels, reveal the extruded polymer´s capacity to be anaerobically degraded under thermophilic - high solid concentration conditions.
KEYWORDS: Starch, Polylactic acid, Polycaprolactone
RESUMO
Este estudo determino a biodegradação anaeróbica de um polímero obtido por extrusão de amido de mandioca nativo, ácido polilático e policaprolactona. Inicialmente, um inóculomethanogenicthermophilic foi preparado a partir de resíduos sólidos urbanos. A concentração final de gás de metano gerado e o pH do meio, atingiu valores de 59,6% e 7,89 respectivamente. Montagem do ensaio de biodegradação foi realizado de acordo com as normas contidas na norma ASTM D5511. As taxas de biodegradação do material 3 sob teste, após 15 dias de digestão foram 77,49%, 61,27%, 0,31% de celulose, e polietileno de amostra de teste, respectivamente . Uma vez que a celulose não tem valores superiores a 70% de biodegradação, verifica-se que as condições de inoculo utilizado eram adequadas. A biodegradação 61,27%, uma concentração de gás de metano de 59,35% e um pH final de 7,71 na amostra de ensaio correspondente para os reactores, revelam a capacidade do polímero para ser extrudido condições degradadas termofílica anaeróbica de alto teor de sólidos.
PALAVRAS-CHAVE: Amido, Ácido polilático, Policaprolactona.
INTRODUCCIÓN
Actualmente el uso de polímeros sintéticos en diversas actividades humanas constituye un problema ambiental grave. Mundialmente, se consumenmás de 140 millones toneladas de plástico anuales, de las cuales más del 60% se acumulan anualmente en vertederos o ambientes marinos, amenazando así, la integridad de algunos ecosistemas y su importancia biológica [1].
En esfuerzos por mitigar los impactos negativos generados por la mala disposición de polímeros derivados de poliolefinas, en ocasiones, estoscompuestos son adicionados con agentes pro-oxidantes que aceleran el proceso de foto/termo-degradación, sin embargo la bioasimilación o mineralización de los oligómeros o monómeros resultantes no ha sido totalmente comprobada [2].
Durante los últimos 30 años se han desarrollado compuestos plásticos biodegradables provenientes de diferentes fuentes animales, vegetales y microbianas. Los residuos producidos a partir de esta nueva generación de plásticos pueden emplearse, junto a desechos orgánicos, como sustrato en procesos de degradación aerobia o anaerobia, en plantas de compostaje o biogasificación [3].No obstante,es necesariovalidar su capacidad de biodegradación en ambientes naturales mediante protocolos normalizados.
Este trabajo plantea la necesidad de validar la biodegradación anaerobia de películas termoplásticas a base de almidón nativo de yuca, en las cuales es necesario evaluar y comprobar si el material que las compone se puede considerar biodegradable según normatividad vigente, por lo que se busca implementar un método de biodegradación para materiales biodegradables, que simule las condiciones presentes en un sistema de biogasificación termófila (>40°C) bajo altas concentraciones de sólidos totales (>20%), basado en el estándar ASTM D5511.
MÉTODO
La metodología planteada a continuación tuvo como propósito evaluar el ritmo de biodegradación anaerobia termófila de empaques biodegradables bajo altas concentraciones de sólidos conbase al estándar ASTM D 5511-02.
Preparacióndel Inóculo
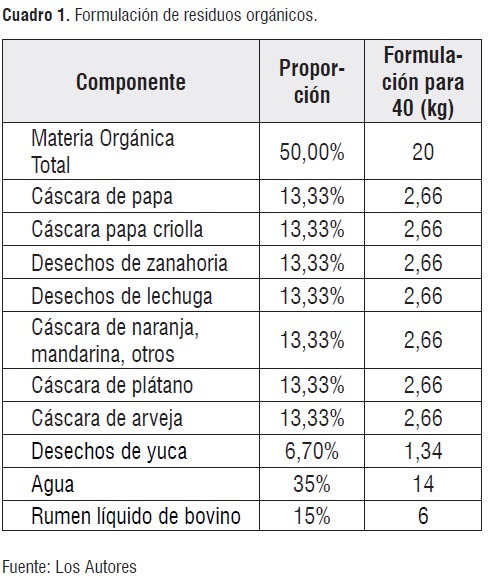
Formulación y caracterización de los residuos orgánicos. Se obtuvo el material orgánico acorde al cuadro 1. [4]:
Mediante el uso de una balanza JAVAR CW 15 (máx= 15 kg+/-0,5) se pesaron los componentes de la formulación, se trituraron hasta un tamaño de partícula menor a 3 mm y se caracterizaron mediante la valoración de los siguientes parámetros:
Carbono orgánico total. Se determina mediante el protocolo descrito por Nelson & Somers [5].
Materia seca o sólidos totales. Determinada a 105°C según lo precisado por la norma APHA 2540 B (Solidos totales por secado a 103-105°C).
Nitrógeno total (NH+4 – N). La prueba se efectúo según las pautas establecidas por la norma ASTM D 3590 “Metodologías para la evaluación de Nitrógeno Total Kjeldahl en agua”
Acondicionamiento del Inóculo
El sustrato empleado como medio de cultivo, se preparó a partir de la mezcla de materia orgánica triturada, agua libre de cloro y rumen bovino líquido y fresco según las proporciones consignadas en el cuadro 1.
En principio, se valoró el pH de la mezcla con ayuda de un pH metro OAKTON referencia ARCON pH 5, previa calibración de dos puntos en buffers DIN (pH=7, pH=4) como indica la norma ASTM 1293 “Metodologías para la evaluación de pH en agua”, y se ajustó con carbonato de calcio y bicarbonato de sodio en proporción 2:1, hasta un valor cercano a 6,5. Por último se cargó, cerró y encendió el digestor anaerobio y se inició al proceso a 52oC. Durante la primera etapa del proceso (etapa acidogénica) fue necesario llevar registro diario de la evolución del pH en la mezcla degradada. Para ello se extrajo una pequeña muestra de material contenido en el biorreactor.Debido a la elevada acidez y contenido de materia orgánica de la mezcla de residuos, fue necesario ajustar los niveles de pH con carbonato de calcio y bicarbonato de sodio, a valores cercanosa 6,5, durante los primeros 5 días de degradación.
A un tiempo de retención aproximado de 55 días y proporción de metano de 55% (medido con ayuda del sensor infrarrojo de CH4 HITECH referencia HITOX IR 600) se detuvo la digestión y se extrajo el exceso de líquido mediante tamizado hasta una concentración aproximada de 20% sólidos totales. Posteriormente el inóculo se llevó a post-fermentación durante 7 días a 55°C.
El equipo para la preparación del inóculo anaerobio,comprendió un reactor de aluminio de 40 L inmerso en un baño maría termostatado. El reactor se encontraba acoplado a un sistema de recolección de gas (equipado con un sensor de metano de lectura por infrarrojoHITECH referencia HITOX IR 600) y a un sistema de toma de muestra. El gas producido diariamente se retuvo en un cilindro plástico invertido, mediante la aplicación de presión negativa generada por el peso de una columna de agua, que fue elevada con el uso una bomba de vacío.
Caracterización del inóculo
El inóculo obtenido se diluyó en agua destilada en proporción 5:1 (agua: Inóculo) y se efectuaron las siguientes pruebas por triplicado.
Medición de pH. Mediante el uso de pH metro marca OAKTON referencia ARCON pH 5 calibrado, basándose en el estándar ASTM D1293.
Nitrógeno total (NH+4 – N). Mediante el Método Macro-Kjeldahl según ASTM D3590.
Ensayode Biodegradación Anaeróbica
Materiales de Prueba. Para el ensayo se emplearon tres tipos de materiales de prueba:
Filtro delgado Scheleicher & Schuel 595 (Peso específico: 85 g/m2,Espesor: 0,19 mm, %Celulosa > 95%), como referencia positiva.
Polietileno de baja densidad (LDPE) (Densidad: 0,95 g/cm3. Espesor: 0,3 mm) suministrado por la empresa “Popaplast S.A.”, como referencia negativa.
Polímero Biodegradable (muestra de ensayo), obtenido en el laboratorio de reología y empaques de la Facultad de Ciencias Agrarias de la Universidad del Cauca por extrusión en tornillo simple de una mezcla de almidón termoplástico (TPS), ácido poliláctico (PLA), policaprolactona (PCL) y un agente acoplante.
Caracterización de los materiales de Prueba. Se efectuaron mediciones de Carbono Total Oxidable (Matus, et al., 1997), sólidos volátiles (Métodos Estandarizados 2440E.),sólidos totales (Métodos Estandarizados 2440B.),nitrógeno total (NH+4 – N) (ASTM D3590), para cada uno de los materiales de prueba.
Montaje y seguimiento del ensayo de biodegradación anaerobia. En el montaje y seguimiento del ensayo de biodegradación anaerobia, se empleó un equipo compuesto por un grupo de 12 biorreactores de vidrio, con capacidad máxima de 800 mL, sumergidos en sistema de baño maría termostatado y conectados tanto a un sistema patronado de acumulación de gases mediante columna de agua a presión negativa (el agua debe ser llevada a pH = 2,0 mediante adición de ácido clorhídrico para impedir la disolución del CO2 en el agua) como a un sensor infrarrojo de metanoHITECH referencia HITOX IR 600.
Se dispusieron grupos de tres repeticiones para cada material de prueba y se procedió a cargar cada biorreactor con aproximadamente 500 g de inóculo homogenizado previamente. Con ayuda de una balanza analítica SCALTEC SBA 32 (máx= 120 g d=0,0001) se pesan por triplicado aproximadamente 5 g de muestra de ensayo, 2,5 g de referencia positiva (celulosa) y 5 g de referencia negativa (polietileno LDPE) (pulverizadas en molino analítico) y se incorporaron individualmente a los grupos de biorreactores según correspondía.
La prueba se inició el día cero al término del encendido del equipo y de la estabilización de la temperatura a 52°C ± 2°C y se prolongó durante 30 días. El volumen de gas recolectado se mide diariamente y los porcentajes de metano en el instante en el que los acumuladores alcanzan su máximo nivel.
Cálculo, Reporte y Análisisestadístico
Se convirtieron los volúmenes de gas medidos a volúmenes de gas a condiciones estándares de temperatura y presión, y se efectuó la debida corrección por humedad [6]:
Posteriormente se calculó la cantidad de carbono gaseoso producido en cada ensayo en gramos, según la ley de gases ideales:
Luego se determinó el porcentaje de biodegradación de la siguiente manera:
Se calcularon los errores estándar de los porcentajes de biodegradación así:
Finalmente se halló el intervalo de confianzacon una confiabilidad del ((1-α)*100%) para el porcentaje de biodegradación de la siguiente manera:
RESULTADOS
Preparación del Inóculo
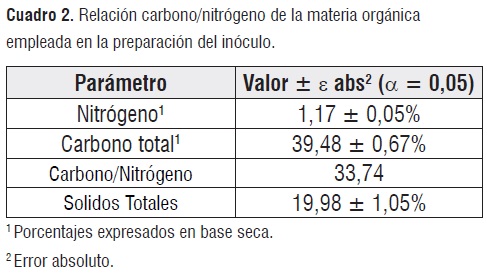
Caracterización de los residuos orgánicos. El cuadro 2 presenta los resultados correspondientes al proceso de caracterización de la materia orgánica acopiada. La relación carbono/nitrógeno óptima para el desarrollo de procesos de biodegradación anaerobia se encuentra en el intervalo de 25/1 a 30/1. Como se observa en el cuadro 2, la materia orgánica obtenida presento valores ligeramente superiores al intervalo óptimo aconsejado. Esta condición se evidencia eneldescenso de pH observado durante los primeros días de fermentación, debido a la acumulación de ácidos grasos volátiles (AGV)provenientes de la hidrolisis y acidogenesis de del exceso de carbono presente [7].
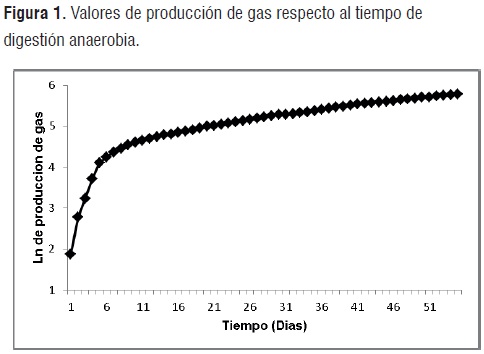
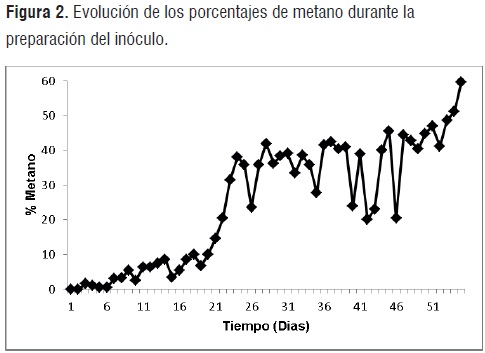
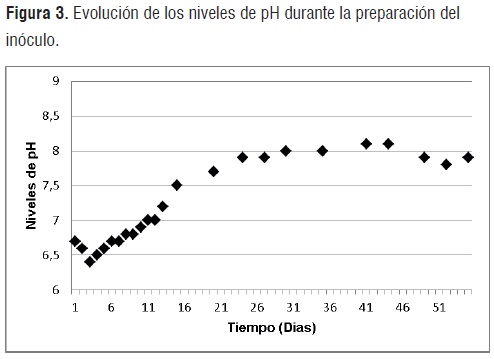
Acondicionamiento del Inóculo. Las figuras 1, 2 y 3, presentan los volúmenes de gas, niveles de pH y porcentajes de metano obtenidos durante los 55 días que permaneció en digestión anaerobia la mezcla de residuos orgánicos, agua y rumen líquido de bovino.
Producción de gas. Sobre los altos volúmenes de gas obtenidos durante los primeros 11 días de digestión (etapa acidogénica), influye la adición de bicarbonato de sodio y carbonato de calcio que tienden a generar considerables cantidades de gas (CO2). A partir del día 11, hasta finalizar la degradacion de la mezcla, los volúmenes de gas producidos tienden a estabilizarse, exhibiendo una disminución en el ritmo de producción de gas respecto a la etapa acidogénica.
Porcentajes de metano. Los porcentajes de metano en gas en el transcurso de los primeros 20 días de degradación no superan el 10% debido, probablemente, a la ausencia o baja concentración de sustratos metanogénicos (acetato principalmente) y las altas concentraciones de H2 que pueden reducir la actividad de las bacterias metanogénicas [8]. En este punto las bajas cuotas de metano generado son producto de la actividad de bacterias metanogénicas utilizadoras de hidrógeno.
A partir del día 34 los porcentajes de metano exhiben un acentuado aumento debido, probablemente, a la disminución del CO2en el gaspor solubilizacióny por el aumento de la actividad de las bacterias metanogénicas acetoclásticas, finalizando al termino del día 55 en 59,6%, valor que similar al alcanzado por López, 2005. Este porcentaje final de metano, revela la aptitud del inóculo en la medida que se asemeja a el valor mínimo sugerido por Yagi[9]
pH del medio. Durante los 5 días posteriores al inicio de la digestión anaerobia, se observó un leve descenso del pH respecto a los valores iniciales. Este descenso se presentó debido a una acusada solubilización de macromoléculas en el medio, y a su consecuente conversión hacia ácidos propíonico y butírico principalmente [10].
La acumulación de estos ácidos junto a la baja alcalinidad del medio condujo a una disminución de los valores de pH descritos. Así mismo, debido a la incapacidad del sistema para amortiguar estos cambios de pH fue necesario ajustar este parámetro (a valores superiores a 6,5) mediante la adición de bicarbonato de sodio y carbonato calcio.
Durante periodo comprendido entre los días 11 y 30, se observa un incremento paulatino de los niveles de pH (que se atribuyen a un aumento de la solubilidad del CO2 y por ende de la eficacia del tampón CO2/HCO3-) que posteriormente se estabilizan hasta alcanzado el día 44 de degradación. Esto es un indicio de que el sistema es capaz de autorregularse y ha alcanzado el equilibro de poblaciones microbianas y procesos químicos que propenden hacia la metalogénesis. Sin embargo, durante los últimos 6 días de digestión se advierte una leve disminución del pH que puede resultar de la disminución de la alcalinidad debido a las modificaciones en el equilibrio CO2/HCO3 cuando las cantidades de gas comienzan a disminuir [8].
Caracterización del Inóculo
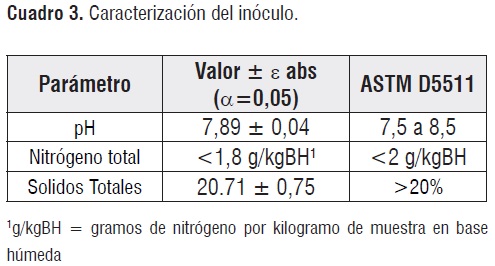
Las características químicas valoradas en el inóculo metanogénico logrado se resumen en el cuadro3.
Las pruebas de caracterización revelan la capacidad del inóculopara ser empleado en el ensayo de biodegradación, ya que el cuadro 5 revela que los valores medidos coinciden con los rangos establecidos por la norma ASTM D5511.
Ensayode Biodegradación anaerobia
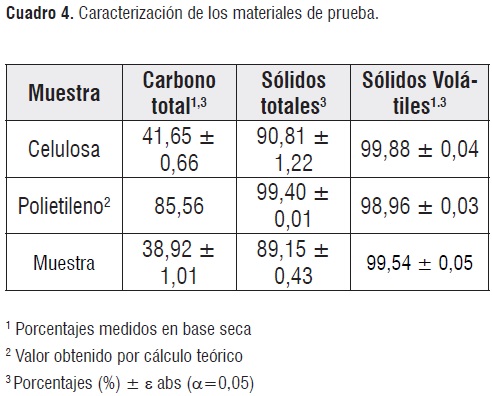
Caracterización de los materiales de prueba. Los resultados de las pruebas de caracterización de los materiales empleados en el ensayo se resumen en el cuadro4.
Los valores plasmados en el anterior cuadro, se emplean en la determinación del parámetro Ct de la ecuación 3
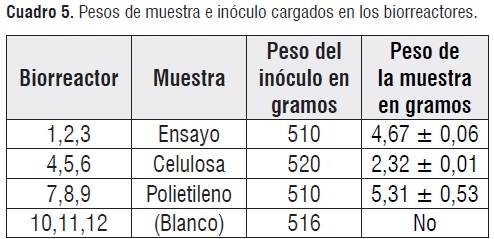
Montaje del ensayo de biodegradación anaerobia.El cuadro5, resume las cantidades de material e inóculo cargadas en cada biorreactor. En este caso se decidió usar valores inferiores a 5g de muestra por 300 g de inóculopara evitar la acidificación del reactor por acumulación de ácidos grasos volátiles o la perturbación del equilibrio de microorganismos en el inóculo.
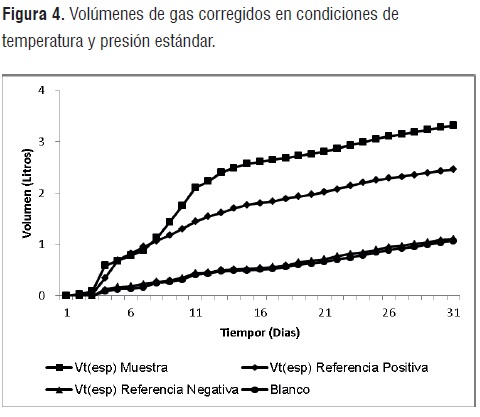
Producción de biogás. Las cantidades y desviaciones estándar de la producción total de gas en Vt (esp)tras 30 días de digestión, están resumidas en la figura 4. Como se puede observar a partir de los niveles de producción de gas alcanzados, la actividad del inóculo (blanco) es menor comparado con los volúmenes generados por las referencias positivas y la muestra, lo que revela que el inóculo fue estabilizado durante el periodo de post fermentación.
Tanto el blanco como la referencia negativa presentan un incremento lineal de los volúmenes diarios de gas producidos, tendencia que se adjudica a la degradación de los residuos de materia orgánica aún presentes en el inóculo.
Por otro lado, las elevadas pendientes observadas en las curvas de producción de gas de la muestra de ensayo y referencia positiva durante los primeros 13 días de degradación se deben esencialmente a la naturaleza altamente hidrolizable de los enlaces glucosídicos o éster presentes en el almidón termoplástico y/o en la celulosa respectivamente. Por otro lado, los cambios apreciados en la curva de producción de gas de la muestra de ensayo durante los dias 4 al 12, pueden corresponder a los cambios de sustrato sufridos por el metabolismo bacteriano debido a la heterogeneidad de este material.Finalmente a partir del día 13 los volumenes de gas generados por la muestra de ensayo y referencia positiva se estabilizan y adquieren un comportamiento ascendente similar a la del blanco. Lo que señala que los sustratos susceptibles de biodegradación se han agotado.
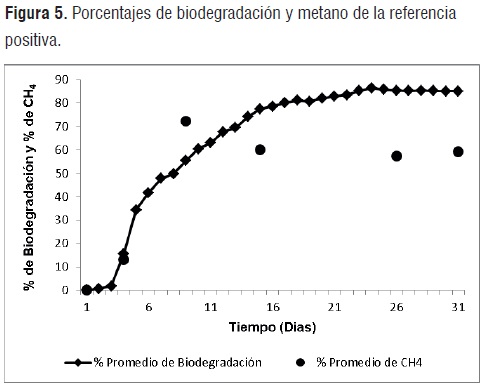
Porcentajes de biodegradación.La figura 5, resume los porcentajes de biodegradación de la referencia positiva respecto al tiempo de degradación.
Transcurridos 15 días de ensayo, la muestra de celulosa alcanza un porcentaje de biodegradacióndel 77,49% ± 2,05. Según la norma, la idoneidad del inóculo se verifica si tras un periodo de 15 días la celulosa exhibe valores de biodegradación superiores al 70%. Se puede comprobar la eficacia del inóculo (para degradar sustratos biodegradables) mediante este parámetro establecido por la norma ASTM D5511 .Durante los últimos 5 días de ensayo los porcentajes de degradación de la celulosa llegan a sus límites máximos (85%) y que concuerdan con los obtenidos por diferentes autores [11]
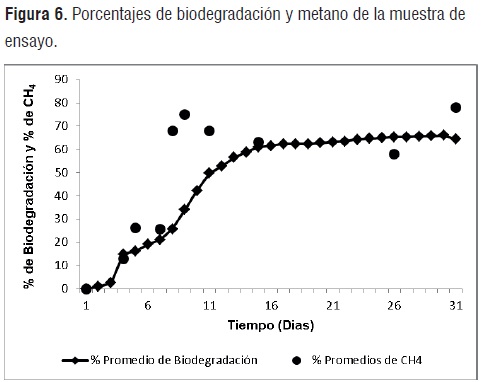
La figura 6, resume los porcentajes de biodegradación y metano de la muestra de ensayo respecto al tiempo de degradación. La muestra de ensayo presentó, tras 30 días de digestión, un nivel de biodegradación de 65,89%. Es posible distinguir una fase de latencia de 3 días del inóculo microbiano y una fase exponencial escalonada hasta el término del día 15, momento en el cual se comienza a apreciar una disminución del ritmo, pero manteniendo un ligero incremento en el porcentaje de biodegradación. La primera tendencia se atribuye al fenómeno de adaptación del conjunto microbiano al material o al proceso de estabilización del mismo después del estrés sufrido durante su transferencia desde el recipiente de acondicionamiento hasta los biorreactores donde se desarrolló el ensayo. La fase exponencial escalonada posiblemente sobreviene debido a que la muestra de ensayo comprende una asociación de cuatro diferentes componentes. En la última etapa, a pesar que disminuye el ritmo de degradación, el porcentaje de biodegradación conserva un comportamiento levemente ascendente, posiblemente debido a la lenta degradación de los residuos no solubilizados de almidón, aun acoplado a la mezcla binaria por efecto del agente acoplante y las bajas tasas de degradación que presenta el PLA (especialmente su porción cristalina) a temperaturas menores a 58°C y reducidos tamaños de partícula[12]
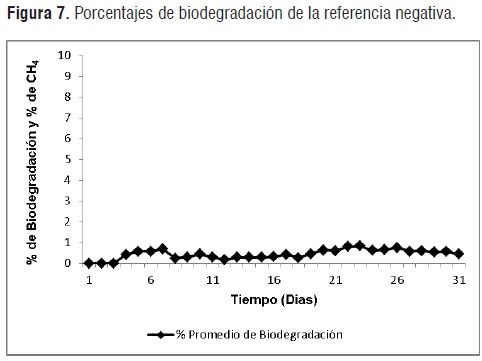
En la figura 7, se presentan los porcentajes de biodegradación de la referencia negativa respecto al tiempo de degradación. Como era de esperarse, la prueba reveló porcentajes despreciables de biodegradación para el polietileno de baja densidad. Este compuesto altamente recalcitrante de gran peso molecular e hidrófobo, presenta condiciones adversas para el ataque microbiológico. [13].
Se debe aclarar quedebido a la asunción teórica de que los porcentajes de gases suplementarios (H2S, H2, CO), comprenden cerca del 1 a 2% del total de gas generado por la degradacion los materiales de prueba, los porcentajes de biodegradación reales serán levemente menores.
Porcentajes de metano. Los porcentajes de metano medidos durante el proceso de degradación de la muestra de ensayo y referencia positiva, presentan un marcado aumento durante los primeros 10 días de digestión, con picos máximos de 79% y 71% respectivamente, que se derivan del consumo de sustratos metanogénicos generados durante las etapas previas (a la metalogénesis) del proceso de degradación anaerobia (hidrogeno, dióxido de carbono y acetato principalmente). Estos valores coinciden aproximadamente, con el momento en el cual se percibe una disminución del ritmo de la producción de gas, como consecuencia de la finalización de las etapas hidrolítica y acetogénica que tienden a generar los mayores volúmenes [8].
La disminución de los porcentajes de metano advertidos a partir del día 10 en la muestra de ensayo y del día 9 en la referencia positiva se atribuyen al agotamiento de los sustratos metanogénicos y la hidrólisis/acidogénesis de los residuos de polímeros resistentes (almidón acoplado, PLA y fracciones cristalinas de celulosa) y a la leve disminución del pH del medio que puede reducir la solubilidad del CO2 en la fracción líquida[14].
El aumento final(al día 30 de ensayo)de estos valores(porcentajes de metano en gas)en ambos grupos de biorreactores (muestra de ensayo y referencia positiva) se atribuye, posiblemente, al consumo de los productos de hidrólisis de los fragmentos persistentes mencionados (almidón acoplado, PLA y fracciones cristalinas de celulosa).
CONCLUSIONES
La ASTM no define criterios cuantitativos para certificar la potencial biodegradabilidad anaerobia de polímeros ya que los efluentes anaerobios requieren procesos aerobios posteriores para estabilizarse completamente. Sin embargo su estudio es imperante ya que estos plásticos son muchas veces desechados en ambientes anaerobios. Algunos autoresindican que porcentajes de mineralización superiores al 60% manifiestan la aptitud del polímero para ser degradado biológicamente. Por lo tanto bajo las condiciones de la prueba, la muestra de ensayo exhibe niveles adecuados de biodegradación en ambientes anaerobios termófilos de altas concentraciones de sólidos al presentar un 63% de biodegradación en 30 días.
Igualmente, debido a que los porcentajes de metano en la muestra de ensayo alcanzan niveles elevados (mayor a 55%) y el pH final de los reactores mantiene valores (7,73; 7,71; 7,80; y 7,72 para la referencia positiva, muestra de ensayo, referencia negativa y blanco respectivamente) favorables para el desarrollo de bacterias metanogénicas, se puede inferir que el material es adecuado para ser sometido a sistemas de biodegradación anaerobia termófila en altas concentraciones de sólidos.
AGRADECIMIENTOS
A la Universidad del Cauca, al Ministerio de Agricultura y Desarrollo Rural y al Centro Regional de Productividad e Innovación del Cauca.
REFERENCIAS
[1] SIVAN. S. New perspectives in plastic biodegradation. Current Opinion in Biotechnology, 22(3), 2011, p. 422-426 [ Links ]
[2] ABRUSCI, C., PABLOS, J. L., CORRALES,T.,LÓPEZ-MARÍN, J., MARÍN,I. and CATALINA, F. Biodegradation of photo-degraded mulching films based on polyethylenes andstearates of calcium and iron as pro-oxidant additives. International Biodeterioration& Biodegradation, 65, 2011, p. 451-459. [ Links ]
[3] YAGI, H., FUMI, N., MASAHIRO, F. and MASAO, K. Anaerobic biodegradation tests of poly(lactic acid) and polycaprolactone using new evaluation system for methane fermentation in anaerobic sludge. Polymer Degradation and Stability, 94, 2009, p. 1397-1404. [ Links ]
[4] LÓPEZ-MARTÍNEZ, G. Digestión anaerobia de residuos sólidos orgánicos urbanos: Revista Científica Universidad de los Andes, 2005. [ Links ]
[5] ARTEAGA, G.A., HUERTA, A.I., GARCÍA, E. y MARTÍN, G.A. Almacenes de carbono y estabilidad de la materia orgánica del suelo en un agroecosistema cafetalero en la sierra sur de Oaxaca, México. Tropical and Subtropical Agroecosystems, 15, 2012, p. 611 - 620. [ Links ]
[6] YAGI, H. Anaerobic biodegradation tests of poly(lactic acid) and polycaprolactone using new evaluation system for methane fermentation in anaerobic sludg. Polymer Degradation and Stability, 94, 2009, p. 1397-1404. [ Links ]
[7]KHALID,A.,ARSHAD,M.,ANJUM,M.,MAHMOOD,T. and DAWSON,L.The anaerobic digestion of solid organic waste.Waste Management,31(8), 2011, p. 1737-1744 [ Links ]
[8] LI, Y., PARK, S.Y. and ZHU, J. Solid-state anaerobic digestion for methane production from organic waste. Renewable and Sustainable Energy Reviews, 15, 2011, p. 821-826. [ Links ]
[9] YAGI, H., NINOMIYA, F., FUNABASHI, M. and KUNIOKA, M. Thermophilic anaerobic biodegradation test and analysis of eubacteria involved inanaerobic biodegradation of four specified biodegradable polyesters. Polymer Degradation and Stability, 98, 2013, p. 1182-1187 [ Links ]
[10] CHANDRA, R., TAKEUCHI, H. and HASEGAWA, T.Methane production from lignocellulosic agricultural crop wastes: A review in context to second generation of biofuel production.Renewable and Sustainable Energy Reviews16(3), 2012, p. 1462-1476 [ Links ]
[11] KOLSTAD, J., VINK, E., DE WILW, B. and DEBEER, L. Assessment of anaerobic degradation of IngeoPolylactides under accelerated landfill conditions. Polymer Degradation and Stability, 97, 2012, p. 1131-1141. [ Links ]
[12] YAGI, H. Anaerobic Biodegradation of Poly (Lactic Acid) Film in Anaerobic Sludge. Journal of Polymers and the environment, 20, 2012. [ Links ]
[13] CHO,H.S.,MOON,H.S.,KIM, M.,NAM,K. and KIM, J.Y.Biodegradability and biodegradation rate of poly(caprolactone)-starch blend and poly(butylene succinate) biodegradable polymer under aerobic and anaerobic environment. Waste Management, 2011. p. 475-480 [ Links ]
[14] FERNÁNDEZ, J. Optimización de la digestión anaerobia seca de la Fracción Orgánica de los Residuos Sólidos Urbanos (FORSU) en reactores en fases de temperatura [Tesis Doctoral Ingeniería]. Cádiz (España): Universidad de Cádiz, Departamento de Ingeniería Química, Tecnología de Alimentos y Tecnologías del Medio Ambiente, 2010, 373p. [ Links ]