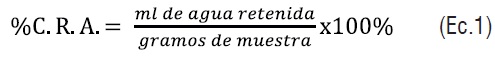Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.12 no.2 Popayán July/Dec. 2014
PROPIEDADES FUNCIONALES DEL ALMIDON DE SAGU (Maranta arundinacea)
FUNCIONALES PROPERTIES SAGO STARCH (Maranta arundinacea)
PROPRIEDADES FUNCIONAISDO AMIDO DE ARARUTA (Maranta arundinacea)
CLEMENTE GRANADOS C.1, LUIS ENRIQUE GUZMAN C.2, DIOFANOR ACEVEDO C.3*, MARÍA DÍAZ M.4, ANA HERRERA A.4
1Universidad de Cartagena.M. Sc. Ciencia y Tecnología de Alimentos, Docente del Programa Ingeniería de Alimentos. Cartagena, Colombia.
2Universidad de Cartagena.Esp. Ingeniería Sanitaria y Ambiental, Docente del Programa Ingeniería de Alimentos. Cartagena, Colombia.
3Universidad de Cartagena, Programa Ingeniería de Alimentos .Ph.D. Ingeniería Alimentos, Docente Facultad de Ingenierías. Cartagena, Colombia.
4Universidad de Cartagena. Ingeniera de Alimentos. Cartagena, Colombia.
Correspondencia: diofanor3000@gmail.com
Recibido para evaluación: 14-06-2012. Aprobado para publicación: 03-02-2014.
RESUMEN
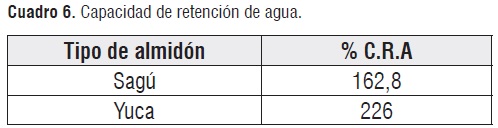
El sagú (Maranta arundinacea) cuyo rizoma es utilizado en algunas zonas de Colombia para la elaboración de productos destinados a la alimentación humana. Se extrajo el almidón y se determinaron las propiedades funcionales, los almidones presentaron alta capacidad de retención de agua% CRA (162,8% para el sagú, respecto al 226% de la yuca), un alto índice de absorción de lípidos, % I.A.L (51% para sagú, respecto al 82,25% del almidón de yuca. La temperatura de gelatinización esrelativamente baja (65-75°C a 10 minutos para sagú respecto al almidón de yuca con 70-75°C en 20 minutos), posee un alto porcentaje de amilopectina (77% para el almidón de sagú, en comparación con 83,3% para el almidón de yuca) por tanto es un gel que no retrograda y forma una pasta estable. Por lo que se concluye que se puede usar como alternativa promisoria en la industria alimentaria.
PALABRAS CLAVE:Espuma, Solubilidad, Rizoma, Hinchamiento, Amilopectina.
ABSTRACT
Marantaarundinacea sago whose rhizome is used in parts of Colombian for the production of products intended for human consumption. Starch was extracted and determined the functional properties of starches presented high water capacity % CRA (162,8% for sago, compared to 226% of cassava), a high rate of absorption of lipids %I.A.L (51% for sago, compared to 82,25% of cassava starch).Gelatinization temperature is relatively low (65-75°C at 10 minutes compared to sago starch cassava with 70-75°C in 20 minutes), has a high percentage of amylopectin (77% for sago starch, compared with 83,3% for cassava starch) is a gel so that no retrograde and from a stable paste. As it is concluded that can be used as an alternative promising in the food industry.
KEYWORDS: Foam, Solubility, Rhizome, Swelling, Amylopectin.
RESUMO
Maranta arundinacea araruta cujo rizoma é usado em partes da Colômbia para a produção de produtos destinados ao consumo humano. O amido foi extraído e determinado propriedades funcionais de amidos apresentado de água de altasegurando% CRA capacidade (162,8% Para sagu, em comparação com 226% demandioca), uma alta taxa de absorção de lípidos %IAL (51% para araruta,emcomparaçãocom 82,25% de fécula de Mandioca. A temperatura de gelatinização é relativamente baixa (65-75°C durante 10 minutos em comparação com sagu amido de mandioca com 70-75°C em 20 minutos), tem uma elevada percentagem de amilopectina (77% para o amido de sagu, em comparação com 83,3% de fécula de mandioca), por conseguinte, é um gel que se forma uma pastaretrógrada e estável. Como conclusão de que pode ser usado como uma alternativa promissora na indústria alimentar.
PALAVRAS-CHAVE: Espuma, Solubilidade, Rizoma, Amilopectina, Inchaço.
INTRODUCCIÓN
Sagú (Maranta arundinaceaL.) es una planta de la familia Marantaceae, reconocida como una manifestación de la biodiversidad silvestre y cultivada en el neotrópico, desde Panamá hasta Ecuador [1,2,3,4]. Se propaga por rizomas (tallos subterráneos) cilíndricos, tuberosos y carnosos tradicionalmente utilizados para la fabricación de harina, almidón y afrecho y como fuente para alimentación de humanos y animales [1,2]. De su familia, la M. arundinaceaes la de mayor importancia económica, ya que sus raíces y tubérculos se utilizan como una fuente de almidón [1]. Las propiedades fisicoquímicas y funcionales de los almidones de los vegetales promisorios estarán influenciadas en gran medida por sus estructuras granular y molecular [5].
El uso del almidón en la formulación y aplicaciones industriales dependen depropiedades como: Gelatinización, retrogradación;solubilidad, hinchamiento, absorción de agua, sinéresis y comportamiento reológico de sus pastas y geles [5]. El objetivo del presente trabajo fue la extracción y caracterización fisicoquímica y funcional del almidón de sagú (M. arundinacea).
MÉTODO
El almidón de yuca utilizado en este trabajo como patrón de comparación es del tipo industrial y se adquirió en una distribuidora de productos químicos de la ciudad de Cartagena (Bolívar–Colombia).
Obtención del almidón de sagú
Para la obtención del almidón, de las muestras de sagú, se siguió la metodología propuesta por el CORPOICA [6].
Lavado. Los rizomas se depositaron en un tanque y se remojaron durante una hora para que la tierra se ablande. Luego, con la ayuda de una pala de madera se agitaron hasta lograr el desprendimiento de la tierra, la arena y demás impurezas. A continuación se dejó el tanque en reposo para lograr la sedimentación de las impurezas pesadas y por encima de manera manual se retiraron las impurezas livianas que flotan en la superficie del agua. En este momento se retiró el agua con los lodos y el tanque se volvió a cargar con agua limpia y se repitieron las operaciones de agitación de los rizomas y sedimentación de las impurezas hasta que el agua salió limpia.
Rallado de los Rizomas. Para liberar el almidón de las células del rizoma es necesario romperlas, esto se realizó con el rallado donde la fibra se corta rompiendo las paredes celulares. El rallado se realizó manualmente con ralladores metálicos. Para la operación de tamizado se utilizó un marco de madera, con una malla de tela fina y resistente (muselina)soportada por una malla metálica. Este tamiz se coloca sobre canecas metálicas o plásticas, en las cuales se recibe el agua con el almidón en suspensión o “lechada”.
Extracción del almidón. Para la extracción del almidón se siguió la metodología empleada por Hernández-Medina y sus colaboradores [2]. Los rizomas de sagú, se pelaron y rayaron; la masa resultante del rayado se depositó en unos recipientes con solución de bisulfito de sodio a 1.500 ppm de S02, en una relación 1:1 (v/v). Posteriormente, la lechada de almidón fue filtrada a través de un tamiz (Montinox, México®) de 80 μm de apertura de malla, eliminando la fibra.El filtrado se dejó sedimentar a 4°C, durante 4 h. Transcurrido este tiempo, la mayor parte del líquido sobrenadante se eliminó por sifoneo y la lechada de almidón se lavó tres veces con agua destilada; luego del último lavado se centrifugó a 2500 rpm, durante 12 min con la finalidad de recuperar el almidón. Posteriormente, se secó en una estufa de convección a 55°C durante 24 h y el producto obtenido fue molido usando un molino analítico (IKA, Alemania®) y tamizado a 100 μm. La muestra de almidón fue almacenada en frascos de vidrio con tapa hermética a temperatura ambiente (21-24°C) para su posterior análisis.
Lavado del Almidón. El principal objetivo de esta operación fue obtener un almidón de buena calidad, desde el punto de vista de presentación, libre de residuos e impurezas. El lavado del almidón consistió en operaciones sucesivas de adición de agua, decantación del almidón y evacuación del agua.
Secado del Almidón. Después del lavado se realizó la operación de secado, para eliminar parte de la humedad del almidón. El secado del almidón se efectuó mediantela exposición a los rayos del sol, extendiéndolo en bandejas metálicas.
Empaque y Almacenamiento. Luego de secado, el almidón es recogido, desterronado y empacado en bolsas plásticas por libras.
Caracterización química
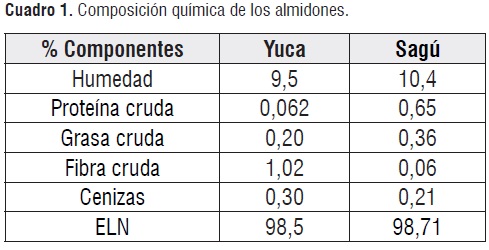
Los análisis realizados a los almidones de yuca y de sagú fueron: Humedad (Método 925.09), proteína cruda (Método 954.01), grasa cruda (método 920.39), fibra cruda (método 962.09), cenizas (método 923.03) y carbohidratos totales como Extracto Libre de Nitrógeno (ELN)[7].
Estabilidad en refrigeración y congelación
Para evaluar la estabilidad en refrigeración y congelación se aplicó el método propuesto porHernández-Medina y sus colaboradores [2]. Se realizó la gelificación y el almacenamiento a 4 y -10°C, respectivamente, luego se centrifugó y midió el agua separada del gel de almidón en períodos de 24 horas durante 240 h.
Solubilidad y la capacidad de hinchamiento
Para determinar la solubilidad y la capacidad de hinchamiento de los almidones se empleó la metodología propuesta porHernández-Medina y sus colaboradores [2].
Capacidad de retención de agua (CRA)
Para determinar esta propiedad, se adicionó a un tubo de centrifuga 20mL de la dispersión de almidón al 1% (p/p), seagitaron y colocaron en bañode maría a 80°C durante 15 min, con agitación durante 5 y 10 minutos. Posteriormente, los tubos fueron centrifugados a 2300 rpm/15 min utilizando una centrifuga marca Wheaton, RMC 2®.El sobrenadante fue decantado y los tubos dejados en reposo. Después de 10 minutos los tubos fueron drenados. Posteriormente fueron pesados y la ganancia en peso fue utilizada para calcular la capacidad de retención de agua según Bryant y Hamaker [8] (ecuación 1).
Determinación de la Viscosidad
Para determinar la viscosidad de las muestras se utilizó la técnica aplicadapor Valdés y sus colaboradores[1]. Donde se empleó un viscosímetro Brookfield DV-E para leer la viscosidad en centipoises (cP). La viscosidad de un gel de almidón preparado por calentamiento indirecto es medida como una fuerza de torsión sobre una aguja rotante con temperatura y velocidad constante [9].
Densidad Aparente
La densidad aparente del almidón puede ser determinada utilizando la relación entre el peso del almidón que ocupa un volumen conocido [9], empleandola técnica usada por Smith yBemiller [10].
Índice de absorción de lípidos (I.A.L)
Representa la cantidad de aceite adsorbida por 100 g de concentrado proteico [2]. Se utilizó la técnica empleada porGranito y sus colaboradores[11],en la cual se agregó un exceso de aceite (3mL) a 0,5g de muestra en tubos graduados decentrifuga, los cuales se agitaron por un minuto; luego se colocaron a 24°C por 30 min y posteriormente se centrifugó a una velocidad de 3200 rpm, para finalmente medir el volumen de aceite excedente. El I.A.L se calcula mediante la ecuación 2.
Capacidad emulsificante
Para determinar ésta propiedad se utilizó la técnica empleada por Granito y sus colaboradores [11]. Para ello se mezcló 1g de la muestra con 20mL de agua,seguidamentese agitó durante 15minajustándose a pH 7,0 y por último secompletó el volumen a 25mL con agua destilada. Posteriormente, se mezclaron en una licuadora Oster (mod. 465) 25mL de esta solución con 25mLde aceite de maíz. El producto obtenido se centrifugó a 1300 rpm durante 5 min. La altura de la capa emulsificada con respecto al total del líquido se expresó en términos de porcentaje [12].
Capacidad espumante y estabilidad de la espuma
Para cuantificar estas propiedades funcionales se mezclaron 2g de muestra con 100mL de agua por 5min a velocidad máxima, en una licuadora Oster (mod 465). Transcurrido este tiempo, se transfirió a un cilindro graduado y se midió el volumen final a los 30s [13].La capacidad espumante se expresó como el porcentaje de aumento en volumen, yla estabilidad de la espuma se midió a intervalos de tiempo de 10 y 30 min.
Temperatura de Gelatinización
Los gránulos de almidón son insolubles en agua fría; cuando estos se calientan en solución a temperaturas altas alcanzan una temperatura específica en la cual se inicia el hinchamiento de los gránulos. Esta temperatura es llamada temperatura de gelatinización [13]. Para medir la temperatura de gelatinización se empleó la técnicaaplicada por Garnica [14]. Por lo cual se procedió a pesar 10 g de almidón, los cuales se disolvieron en agua destiladae inmediatamente se completó su volumen hasta 100 mL.Adicionalmente en un vaso deprecipitados de 250 mL se calentó agua a 85°C; de la suspensión del almidón en agua se tomaron 50 mL y se transfirieron a un vaso de precipitados de 100 mL el cual se introdujo en el vaso de precipitados con el agua a 85°C; la suspensión de almidón se agitó constantemente hasta que se formó una pasta, registrando constantemente la temperatura con un termómetro hasta que ésta permaneció estable por unos segundos tomándose esta lectura como la temperatura de gelatinización. Los Valores de referencia para la temperatura de gelatinización en almidones de yuca varían entre 57,5 y 70°C.
RESULTADOS
Obtención del almidón y análisis fisicoquímico
El contenido de proteína de los almidones evaluados mostró diferencia estadística p<0,05.En la cuadro 1 se listan las composiciones de los dos almidones. Los bajos contenidos de proteína cruda del almidón de yuca 0,062%,se encuentran dentro del nivel permitido por la FDA para almidones de maíz (0,35%), los cuales los hacen factibles para la producción de jarabes con alto contenido de glucosa, evitándose así las reacciones de Maillard que se pueden presentar durante el proceso de producción de estos productos [2].
Estabilidad a la refrigeración y congelación
La evaluación de la estabilidad a la refrigeración y congelación consiste en verificar la expulsión del agua o sinéresis, contenida en los geles como consecuencia de la reorganización de las moléculas de almidón [2]. El almidón de yuca almacenado a temperatura de refrigeración de 4°C presentó una sinéresis de solo un 2%; menor que la presentada a temperatura de -10°C con un 2,6%.
Mientras que el almidón de Sagú presentó mayorsinéresis en el último día de almacenamiento en refrigeración, con 6% (cuadro 2) de agua expulsada, y en congelación la sinéresis fue más alta que en refrigeración y aumento con los días de almacenamiento, teniendo 10%(cuadro 3) de agua expulsada en el último día. SONI & SHARMA [2] mencionan que cuando los almidones se someten a sucesivos ciclos de congelación, su estructura se ve afectada, ya que hay una redistribución y dilución de las pastas de almidón por el crecimiento y disolución de los cristales de hielo. De acuerdo con estos resultados, los almidones de sagú pueden ser utilizados en aquellos alimentos que requieren ser almacenados en refrigeración y necesitan cierta exudación de humedad para proporcionar una apariencia fresca, como los flanes o salsas.
Solubilidad
Los resultados obtenidos muestran que el sagú tiene más baja solubilidad, que la yuca (cuadro 4). Este comportamiento también puede deberse al tamaño del granulo y la organización supra molecular de los componentes del almidón. El índice de solubilidad del almidón es la capacidad de reaccionar con agua y disolverse en ella, igualmente indica el grado de asociación existente (enlace intra-granular) entre los polímeros del almidón- amilosa/amilopectina [15]. El almidón de sagú mostró un bajo índice de solubilidad de 4 muy inferior al de la yuca con 7, lo que indica que se requiere una temperatura superior a 60°C para que los gránulos de almidón de sagú absorban agua.
Hinchamiento
El poder de hinchamiento se relaciona con la capacidad de absorción de agua de cada almidón. El poder de hinchamiento de los almidones es una propiedad de su contenido de amilopectina, siendo la amilosa un diluyente e inhibidor del hinchamiento [14]. Debido a lo anterior, el almidón de yuca fue el que presentó mayor poder de hinchamiento.
Capacidad de retención de agua
En los resultados obtenidos el porcentaje de retención de agua del sagú es inferior al de la yuca. Por lo anterior los datos obtenidos pueden ser atribuidos a la diferencia en la relación amilosa/amilopectina, así como también a la diferencia en la distribución en la longitud de la cadena como fue reportado en otros almidones [2].
Viscosidad
El almidón de sagú nativo presento los valores más altos de viscosidad en comparación con el almidón de yuca.
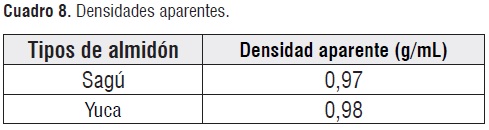
En la cuadro 8se observa como la densidad aparente del almidón de yuca y el sagú no son tan significativas, acercándose a la del agua.
Contenido de amilosa y amilopectina
En la cuadro 9 se puede observar que el almidón de sagú tiene mayor porcentaje de amilosa; lo que indica que es más soluble y tiene mayor tendencia a presentar sinéresis que el de yuca.
Capacidad espumante
Estos resultados son similares a los obtenidos por Zhao y Wistler [16] puesto que la capacidad de espuma es baja en comparación con la de harina de trigo, pero es más alta la del almidón de sagú que el de yuca. Esta espuma es cremosa y de mayor estabilidad, lo que podría explicarse por el mayor porcentaje de proteínas en el sagú para incorporaraire, y reducir la tensión interfacial.
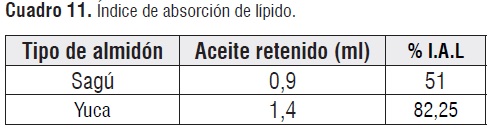
Índice de absorción de lípidos
La Cuadro 11 muestra que el índice de absorción de lípidos del almidón de sagú es inferior en comparación con el almidón de yuca.
Gelatinización
En la cuadro 12 se observa que el almidón de sagú gelifica a temperaturas y tiempos menores que el almidón de yuca. Estos datos concuerdan con los obtenidos por Shao y Tseng[17]. La gelatinización va a depender en alto grado del origen botánico del almidón, ya que este determina la relación entre las fracciones amilosa y amilopectina. Estos resultados surgieren la posibilidad de usar este almidón en la industria de alimentos y farmacéutica.
CONCLUSIONES
Los almidones presentaron alta capacidad de retención de agua, un alto índice de absorción de lípidos, la temperatura de gelatinización esrelativamente baja, el almidón de sagúposee un alto porcentaje de amilopectina, por tanto, es un gel que no retrograda y forma una pasta estable. En general las propiedades fisicoquímicas y funcionales obtenidas anteriormenteindican que el almidón de sagú se puede usar como alternativa promisoria en la industria alimentaria.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al grupo de Investigaciones Proyectos Alimentarios (PROAL)del programa Ingeniería de Alimentos de la Universidad de Cartagena.
REFERENCIAS
[1] VALDÉS, M., ORTIZ, S. y SÁNCHEZ, T. Morfología de la planta y características de rendimiento y calidad de almidón de sagú. Acta Agronómica, 59 (3), 2010, p. 372-380. [ Links ]
[2] HERNÁNDEZ-MEDINA, M., TORRUCO-UCO, J., CHEL-GUERRERO, L. and BETANCUR-ANCONA, D. Caracterización fisicoquímica de almidones de tubérculos cultivados en Yucatán, México. Ciência e Tecnologia de Alimentos, 28 (3), 2008, p. 718-726. [ Links ]
[3] PIPERNO, D. Identifying crop plants with phytoliths (and starch grains) in Central and South America: a review and an update of the evidence. Quaternary International, 193(1-2), 2009, p. 146-159. [ Links ]
[4] CHEN, S. and SMITH, S. Phytolith variability in Zingiberales: A tool for the reconstruction of past tropical vegetation. Palaeogeography, Palaeoclimatology, Palaeoecology, 370, 2013, p. 1-12. [ Links ]
[5] MONTEIRO, M.V. y VEASEY, E.A. Raíces y tubérculos tropicales olvidados o subutilizados en Brasil.Revista Colombiana de Ciencias Hortícolas, 3(1), 2009, p. 110-125. [ Links ]
[6] CORPORACIÓN COLOMBIANA DE INVESTIGACIÓN AGROPECUARIA (CORPOICA). El Almidón de Achira o Sagú (Canna edulis, Ker): Manual Técnico para su Elaboración. Tibaitatá (Colombia): 2003, 33 p. [ Links ]
[7] OFFICIAL METHODS OF ANALYSIS OF THE AOAC INTERNATIONAL (AOAC).18th ed. W. Horowitz and G. W. Latimer Jr. Ed. Association of AnalyticalChemists. Maryland (United States): 2005, 780 p. [ Links ]
[8] CASTILLO, V.K.C., OCHOA, M.L.A., FIGUEROA, C.J.D., DELGADO, L.E., GALLEGOS, I.J.A., y MORALES, C.J. Efecto de la concentración de hidróxido de calcio y tiempo de cocción del grano de maíz (Zea mays L.) nixtamalizado, sobre las características fisicoquímicas y reológicas del nixtamal. Archivos Latinoamericanos de Nutrición, 59(4), 2009, p. 425-432. [ Links ]
[9] ORGANIZACIÓN DE LAS NACIONES UNIDAS PARA LA AGRICULTURA Y LA ALIMENTACIÓN (FAO). Guía técnica para producción y análisis de almidón de Yuca [online]. Disponible en: https://ftp.fao.org/docrep/fao/010/a1028s/a1028s03.pdf. [Citado 13 de Agosto de 2012] [ Links ].
[10] SMITH, J.R. and BEMILLER, N.J. In: Methods in Carbohydrate. Chemistry. London (England): AcademicPress, 1964, p. 233-240. [ Links ]
[11] GRANITO, M., GUINAND, J., PÉREZ, D. y PÉREZ, S. Valor nutricional y propiedades funcionales de Phaseolus vulgaris procesada: un ingrediente potencial para alimentos. Interciencia, 34(2), 2009, p. 64-70. [ Links ]
[12] RODRÍGUEZ-MIRANDA, J., RIVADENEYRA-RODRÍGUEZ, J., RAMÍREZ-RIVERA, E., JUÁREZ-BARRIENTOS, J., HERRERA-TORRES, E., NAVARRO-CORTEZ, R. y HERNÁNDEZ-SANTOS, B. Caracterización fisicoquímica, funcional y contenido fenólico de harina de malanga (Colocasia esculenta) cultivada en la región de Tuxtepec, Oaxaca, México. Ciencia y Mar, 15(43), 2011, p. 37-47. [ Links ]
[13] GRANITO, M., GUERRA, M., TORRES, A. y GUINAND, J. Efecto del procesamiento sobre las propiedades funcionales de Vigna Sinensis. Interciencia, 29(9), 2004, p. 521-526. [ Links ]
[14] GARNICA, A., PRIETO, L., ROCÍO, A. y CERÓN, M. Características funcionales de almidones nativos extraídos de clones promisorios de papa (Solanum tuberosum L. subespecie andigena) para la industria de alimentos. Alimentos Hoy, 19 (21), 2010, p. 125-129. [ Links ]
[15] MEDINA, C., PAREDES, A., RODRÍGUEZ, M., MORENO, M., BELÉN-CAMACHO, D., GARCÍA, D. y OJEDA, C. Evaluación de dos métodos de extracción de almidón a partir de cotiledones de mango. Bioagro, 22(1), 2010, p. 67-74. [ Links ]
[16] ZHAO, J. and WISTLER, R. L. Spherical aggregates of starch granules flavor carriers. Food Technology, 48 (7), 1994, p. 104-105. [ Links ]
[17] SHAO, Y. and TSENG, K. Gelations mechanism and rheological of rice starch. Cereal Chemistry, 72 (4), 1995, p. 393-400. [ Links ]