Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.13 no.1 Popayán Jan./June 2015
COMPARACIÓN GENÉTICA DE TRES FUENTES DEL CACAO Theobroma cacao L., MEDIANTE EL USO DE MARCADORES MICROSATÉLITES
GENETIC COMPARISON FROM THREE SOURCES OF COCOA Theobroma cacao L. USING MICROSATELLITES MARKERS
COMPARAÇÃO GENÉTICA ENTRE TRÊS FONTES DE CACAU Theobroma cacao L., UTILIZANDO MARCADORES MICROSSATÉLITES
XIMENA RUIZ-ERAZO1, MARTHA ALMANZA-PINZÓN2, YACENIA MORILLO-CORONADO3, ANA CRUZ MORILLO-CORONADO4
ALONSO GONZÁLEZ 5, ÁLVARO CAICEDO-ARANA6,JAIME EDUARDO MUÑOZ-FLORES71Universidad Nacional de Colombia, Sede Palmira, Facultad de Ciencias Agropecuarias, Grupo de investigación en Diversidad Biológica. Magister en Ciencias Agrarias. Palmira, Colombia.
2Universidad del Cauca, Facultad de Ciencias Agrarias, Departamento de Ciencias Agropecuarias. Doctorado en Ciencias Agropecuarias. Popayán, Colombia.
3Universidad de los Llanos, Facultad de Ciencias Agropecuarias. Doctorado en Ciencias Agropecuarias. Villavicencio, Colombia.
4Universidad Pedagógica y Tecnológica de Colombia, Facultad de Ciencias Agropecuarias. Doctorado en Ciencias Agropecuarias, Tunja, Boyacá.
5CORPOICA C.I, Cundinamarca, Director de Investigación y transferencia Tecnológica. Doctorado en Fisiología de plantas. Cundinamarca, Colombia.
6CORPOICA. C.I. Palmira, Investigador. Master Universitario en Citricultura. Palmira, Colombia.
7Universidad Nacional de Colombia, Sede Palmira, Facultad de Ciencias Agropecuarias, Director Grupo de Investigación en Diversidad Biológica. Doctorado en Ciencias Agropecuarias. Palmira, Colombia.
Correspondencia: ximenaruizerazo@gmail.com
Recibido para evaluación: 11 de Agosto de 2014. Aprobado para publicación: 17 de Mayo de 2015.
RESUMEN
Las poblaciones nativas de cacao Theobroma cacao L., son valoradas en mercados internacionales por sus características organolépticas propias de los cacaos de alta calidad. Sin embargo, esta calidad está amenazada por híbridos más productivos provenientes de material genético foráneo que gradualmente han ido reemplazando las poblaciones nativas. La diversidad y estructura genética de 165 materiales de cacao provenientes de la región de Tumaco y los bancos de germoplasma de Corpoica y Fedecacao fue evaluada mediante el análisis de doce loci ubicados por marcadores microsatélites. Los datos se procesaron mediante los programas: Arlequín ver. 3.5 y TFPGA ver. 1.3. Los marcadores fueron altamente discriminantes, informativos y representativos para la especie. Los promedios de heterocigosidad esperada (He) y observada (Ho) fueron 0,73 y 0,72, respectivamente, indicando alta variabilidad genética y alta tasa de heterocigotos en las tres poblaciones analizadas. El valor del índice de fijación FST= 0,0355 señala mínimos niveles de diferenciación genética entre las poblaciones y el promedio Nm = 6,80 indica que existe un elevado intercambio de genes. El análisis del clúster jerárquico utilizando agrupamiento UPGMA permitió confirmar la similitud genética existente entre las poblaciones.
PALABRAS CLAVE: Diversidad genética, Marcadores moleculares, Germoplasma.
ABSTRACT
Cocoa Theobroma cacao L. native populations are valued in international markets because their organoleptic characteristics typical of the high quality cocoas. Never the less, this quality is threatened by more productive hybrids, coming from foreign genetic material which has been replacing gradually the native populations. The genetic diversity and structure of 165 cocoa lines from Tumaco region and the germplasm banks of the Corpoica and Fedecacao institutions, was assessed through twelve loci analysis located by microsatellites markers. Resulting data were processed by the Arlequin ver. 3.5 and TFPGA ver. 1.3 software. Markers were highly discriminating, informative and representative for the species. The average of expected (He) and observed (Ho) heterozygosity were 0,73 and 0,72 respectively, indicating high genetic variability and high rate of heterocygotes in the analyzed populations. The fixation index value FST= 0,0355 indicates minimum levels of genetic differentiation among the populations, and the average Nm= 6,80 indicates a highly exchange of genes existence. The hierarchical cluster analysis using UPGMA grouping allowed confirming the existing genetic similarity among populations.
KEY WORDS:Genetic diversity, Molecular markers, Germplasm.
RESUMO
As populações nativas de cacau Theobroma cacao L., são valorizadas nos mercados internacionais por suas características organolépticas próprias dos cacaus de alta qualidade. No entanto, esta qualidade é ameaçada por plantas mais produtivas de material genético estrangeiro que têm sido gradualmente substituindo as populações nativas. A diversidade e estrutura genética dos 165 materiais de cacau da região de Tumaco e os bancos de germoplasma de CORPOICA e FEDECACAO foi avaliada através da análise de doze loci localizados por marcadores microssatélites. Os dados foram processados utilizando os programas: Harlequin ver. 3.5 e TFPGA ver. 1.3. Os marcadores foram altamente exigentes, informativos e representativos para a espécie. A média de heterozigosidade esperada (He) e observada (Ho) foram 0,73 e 0,72, respectivamente, indicaram alta variabilidade genética e alta taxa de heterozigotos nas três populações analisadas. O valor do índice de fixação FST = 0,0355 indica níveis mínimos de diferenciação genética entre as populações e os Nm média = 6,80 indica uma elevada troca de genes. O análise de cluster hierárquico utilizando análise de agrupamento confirmou a similaridade genética existente entre as populações.
PALAVRAS-CHAVE: Diversidade genética, Marcadores moleculares, Germoplasma.
INTRODUCCIÓN
El papel de la diversidad genética como aspecto fundamental para el mejoramiento genético es indiscutible. La necesidad de cuantificar y de conservar la biodiversidad en general y en particular la de los recursos genéticos agropecuarios locales, fue reconocida a través del Convenio sobre Diversidad Biológica [1]. Sin embargo, estos recursos han venido desapareciendo ante la expansión de los sistemas de producción intensivos y basados en el monocultivo, que promueven el uso de cultivares comerciales de reducida diversidad genética. Por lo tanto, las estrategias de conservación de germoplasma in situ y ex situ dependen del conocimiento, localización, distribución y extensión de la diversidad genética [2]. El cacao Theobroma cacao L. es nativo del trópico americano. Cuatrecasas (1964) [3] estableció que el género Theobroma proviene de la cuenca amazónica, bordeando zonas del Ecuador y Colombia, se dispersó a lo largo de la cordillera andina, hasta el Caribe y el Pacífico.
Según Cheesman (1944) [4] en esta región se diferencian dos grandes grupos de cacao, los criollos y los forasteros, los primeros considerados de alta calidad y buen sabor, y los segundos con características de precocidad y resistencia a enfermedades. Theobroma cacao L es la especie de mayor valor comercial a nivel mundial y una de las 22 especies que constituyen el género Theobroma; también se comercializan pero a nivel local T. bicolor, T. grandiflorum S. (copuazú) y T. angustifolium (cacao de montaña) [,5].
La industria del cacao es esencial desde la perspectiva social, el cultivo está vinculado por sus requerimientos edafoclimáticos a países en desarrollo localizados en la franja ecuatorial de América, Asia y África y de éste dependen una gran cantidad de agricultores [6]. La importancia del cacao radica en las almendras que se extraen por mazorca (30 a 40 semillas), al ser utilizadas ampliamente en la industria alimentaria, farmacéutica y cosmética. La industria genera divisas por unos 73.000 millones de dólares y de esta dependen cerca de 60.000 empleos en el mundo [7].
Los marcadores de microsatélites son una poderosa herramienta de discriminación de genotipos por sus características: codominantes, multialélicos y reproducibles [8]. El estudio analizó la diversidad y estructura genética de tres poblaciones de cacao Theobroma cacao L., del suroccidente colombiano, utilizando marcadores de microsatélites.
MÉTODO
Material vegetal
La investigación se realizó con 165 materiales de cacao: 93 provenientes del municipio de Tumaco (Nariño), 30 del Banco de Germoplasma de Corpoica (Palmira, Valle del Cauca) y 42 de la Granja Experimental Tierradura de Fedecacao (Miranda, Cauca). Fueron colectadas de 3 a 4 hojas jóvenes por ejemplar en excelente estado fitosanitario, transportadas en sílica-gel y maceradas en nitrógeno líquido hasta obtener 0,1 g de polvo fino para su almacenamiento a -80°C. El estudio se realizó en el Laboratorio de Biología Molecular de la Universidad Nacional de Colombia, Sede Palmira.
Extracción y cuantificación del ADN
La extracción del ADN genómico se realizó siguiendo el protocolo de Doyle y Doyle (1990) (modificado por Focus,1995) [9]. El ADN se cuantificó comparando las muestras con concentraciones conocidas de ADN del bacteriófago Lambda; las muestras fueron observadas en geles de agarosa al 0,8% teñidos con bromuro de etidio a una concentración final de 0,5 mg·mL-1 y visualizadas en un transiluminador KODAK.
Genotipificación de los microsatélites
El ADN de cada muestra se diluyó a 5 ng en un volumen de 50 µL. Los 12 oligonucleótidos sintetizados por Gentech (Genetics & Technology) fueron seleccionados de los estudios realizados por Lanaud et al (1999) [10] (Cuadro 1). Las pruebas de amplificación por PCR se realizaron en las siguientes condiciones: volumen final 12,5 µL, que contenían: 1 U de Taq-polimerasa (Thermo scientific), 10 ng ADN, 0,2 mM de dNTPs en mezcla, 2 mM MgCl2, 50 mM KCl, 10 mM Tris-HCl con pH 8,3 y 2 pmol de cada oligonucleótido. El ciclo de amplificación utilizado fue de 94°C por 2 min, 30 ciclos a 94°C por 1 min, 50°C a 57°C por 1 min, 72°C por 2 min; posteriormente 72°C por 5 min. Al producto de la amplificación se le adicionaron 3,5 µL de buffer de carga para geles desnaturalizantes (formamida 98%, azul de bromofenol 0,05% y cianol de xileno), la mezcla se desnaturalizó a 95°C por 5 min. Se utilizaron 5 µL para la siembra en geles de poliacrilamida 4% (urea 5M, 0,5X buffer TBE) tomando como patrón de tamaño molecular el Ladder DNA® 10 pb 50 mg ( Invitrogen); el tiempo de corrida en la electroforesis fue de aproximadamente 45 min, a 80 V y el gel fue teñido con nitrato de plata.
Análisis estadístico
Los patrones de bandas se registraron en una matriz de Excel. Dos análisis se realizaron en las poblaciones: diversidad genética y estructura genética. El análisis de diversidad consideró las siguientes medidas: número de alelos (NA), número promedio de alelos por locus (NPA), número efectivo de alelos (ENA), contenido de información polimórfica (PIC) y valores de heterocigosidad observada y esperada (Ho y He), se utilizó el software ARLEQUIN ver 3.5 [11] y Gen Alex ver 6.5 [12]. El análisis de estructura genética fue realizado con base en los F estadísticos [13]: promedio del coeficiente de cruzamiento (inbreeding coefficient) (FIS), Índice de fijación genético global (FIT), promedio del índice de fijación (FST) y Número de migrantes (Nm); Análisis de varianza molecular (AMOVA) y construcción de un dendrograma con el método UPGMA (Unweighted Pair Group Method using Arithmetic Averages) descrito por Sneath y Sokal (1973) [14] y el coeficiente de distancia de Nei (1972) [15] utilizando el software TFPGA ver 1.3 [16].
RESULTADOS
Diversidad genética
Los doce pares de iniciadores microsatélites utilizados fueron altamente discriminantes e informativos para determinar el nivel de polimorfismo y la identidad genética de los 165 materiales de cacao. Los promedios de los índices de diversidad fueron altos, con valores entre 0,72 y 0,73, se generaron un total de 85 alelos con un rango entre 5 – 9 alelos por locus y un promedio de polimorfismo PIC de 0,71 (Cuadro 2). Osorio (2009) [17] reportó la misma cantidad de alelos para MTcCIR 7, MTcCIR 12 y MTcCIR 33 al realizar la caracterización del banco de germoplasma de cacao del Instituto Amazónico de investigaciones científicas SINCHI. También expresa, que los marcadores moleculares tipo microsatélites presentan alto número de alelos por locus, y fueron polimórficos e informativos para el estudio realizado. Además, sugiere que son una herramienta eficiente para el análisis de diversidad genética y la identificación de materiales duplicados. Resultados similares de altos niveles de diversidad genética han sido reportados por Loor et al (2009) [18] al analizar 322 plantas de cacao Nacional recolectadas de diferentes zonas geográficas de la Región Costera Ecuatoriana.
Los marcadores MTcCIR 58 y MTcCIR 33 presentaron los índices de diversidad más altos, mayor variabilidad genética, y poder discriminante. Resultados semejantes fueron obtenidos por Cryer et al (2006) [19], quienes registran estos marcadores porque presentan mayor cantidad de alelos y se constituyen como altamente polimórficos y representativos para la especie. Londoño et al (2011) [20], reportan resultados similares con los marcadores MTcCIR 12 y MTcCIR 25, estos presentaron la mayor variabilidad entre los clones de cacao evaluados, y en consecuencia, mayor poder discriminante. Por esta razón, sugieren su inlusión en estudios de caracterización, definición de origen probable o para la conformación de una colección nuclear (core collection) que represente la mayor diversidad genética posible con el menor número de materiales, a fin de reducir los costos de mantenimiento. Los marcadores MTcCIR 3 y MTcCIR 7 presentaron índices bajos (<0,60), y por lo tanto son los menos representativos de la diversidad genética de la muestra evaluada.
Los promedios de heterocigosidad observada Ho y esperada He indican alta variabilidad genética entre individuos (), revelando alta tasa de heterocigotos, explicada en parte por las características de autoincompatibilidad que presentan algunos materiales de la especie [21], lo que impide altas frecuencias de autopolinización o consanguinidad. Irish et al (2010) [22] encontraron promedios altos de He y Ho de 0,66 y 0,65, respectivamente, en una colección de cacao local del banco de germoplasma que tiene USDA-ARS en su estación de agronomía tropical, señalando que los materiales presentan un gran potencial de variabilidad genética para programas de mejoramiento genético; además, el estudio señala a los marcadores como herramienta eficaz para mejorar la precisión y eficiencia genética en los programas de conservación de germoplasma de cacao, ya que permitieron identificar duplicados y materiales mal etiquetados. Afirmación que coincide con lo expuesto por Sánchez y colaboradores (2007) [23] al analizar la diversidad genética de accesiones de Theobroma cacao L., del banco de conservación a cargo de CORPOICA, los investigadores manifiestan que la detección y análisis de diversidad genética en clones de cacao, es de gran importancia para el mejoramiento genético del cultivo; por consiguiente, la diversidad encontrada puede aprovecharse para la selección de nuevas variedades de interés en cuanto a calidad y resistencia a patógenos, situación que redundaría en mejores ingresos para los productores y para la industria nacional, creando fuentes de trabajo y bienestar para los pequeños agricultores.
Estructura genética
El promedio del coeficiente de cruzamiento (FIS: -0,0057) y los promedios de los índices de fijación (FST: 0,0355) y fijación total (FIT: 0,0301) de los individuos que conforman las tres poblaciones presentan niveles altos de heterocigosidad confirmando los resultados del índice de diversidad genética de la heterocigosidad observada (Cuadro 2). Además, primero, el promedio cercano a cero del índice de fijación (FST) señala que la diferenciación genética es prácticamente nula, y segundo, el promedio mayor a 4 del número de migrantes por generación (Nm: 6,80) muestra que el flujo genético presenta un elevado intercambio de genes, sugiriendo que las poblaciones se comportan como una gran población más o menos panmíctica.
Resultados similares fueron obtenidos por Sereno et al (2006) [24] y Zhang et al (2008) [25] al analizar la diversidad genética de poblaciones de cacao Forastero procedentes de Brasil y de Perú respectivamente, determinando que la diferenciación genética entre individuos era muy baja con valores de 0,018 y 0,055 para Brasil y Perú, respectivamente e indicando que los promedios de FIS de 0,318 y de 0,234, para las poblaciones de Brasil y Perú, respectivamente, confirmaban la hipótesis que 'los individuos de las distintas poblaciones de cacao Forastero presentan altos niveles de polimorfismo'. Los análisis de estos estudios coinciden con lo reportado por Rorer (1926) [26] al afirmar, que la sucesiva introducción de germoplasma foráneo que data de finales de 1890, y el subsecuente flujo genético que tuvieron estas accesiones con las poblaciones nativas de cacao produjeron altos niveles de diversidad genética en las poblaciones de cacao. Por otro lado, Reategui et al (2009) [27] evaluaron con marcadores microsatélites la variabilidad genética de Bertholletia excelsa en la región Madre de Dios (Perú), sugiriendo que las localidades analizadas parecen formar parte de una única población panmíctica, probablemente mucho más amplia (lado boliviano y brasilero) y que la variabilidad genética observada está relacionada a las características de desarrollo vegetativo y reproducción de la planta (perennidad, edad, tiempo de generación, sistema alógamo, modo de dispersión, modo de polinización) y a su alta demografía.
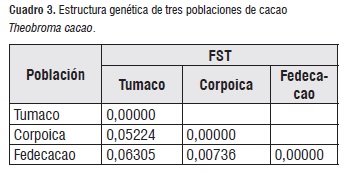
El análisis de estructura genética entrepoblaciones indica que Tumaco y Fedecacao están genéticamente menos relacionadas que Tumaco y Corpoica y a su vez existe mayor similitud genética entre Corpoica y Fedecacao (cuadro 3), estos resultados sugieren flujo genético entre los bancos de germoplasma y mínimas diferencias en sus estructuras genéticas y estarían acordes con la procedencia de las muestras analizadas, ya que los bancos de germoplasma de Corpoica y Fedecacao comparten la gran mayoría de genotipos que han sido seleccionados por características de productividad, resistencia, calidad y patronaje, etc, además, en estos bancos se desarrollan y producen la mayoría de clones comerciales de cacao cuya tecnología se transfiere a productores de todo el país, incluyendo a la zona de Tumaco, dando como resultado un origen genético similar y las diferencias genéticas que se obtienen estarían representadas por las hibridaciones naturales que se dan entre los cacaos comerciales y los materiales de cacao antiguos que los productores tienen en sus fincas.
Los resultados del AMOVA indican que el mayor porcentaje de variación corresponde a diferencias genéticas de los individuos que conforman cada población independientemente de su sitio de origen o de la población a la que pertenecen, seguido por la variación encontrada entre las poblaciones (cuadro 4). La variación de individuos dentro de las poblaciones, correspondiente al 0,18, es considerada como no significativa y por lo tanto, permite concluir que no existió variación individual dentro de cada población formada. Los resultados son semejantes a lo reportado por Zhang et al, (2009) [28] quienes caracterizaron una colección de Cacao internacional de Costa Rica; donde encontraron 15,4% de diferencia entre grupos y 84,6% dentro de los grupos, considerando como principal causa el mal etiquetado de árboles y las diferencias que existen del cacao nacional y los introducidos. Adicionalmente, Zhang et al, (2007) [29] realizaron un estudio para determinar la variación en la estructura genética del cacao ecuatoriano, reportando una variación dentro de los grupos de 76% y de 24% entre grupos; sugiriendo que la paternidad común de los arboles nacionales ecuatorianos que han contribuido a la formación del cacao Refractario, compartiendo antecedentes genéticos similares.
El dendograma (Figura 1) generado a partir de los datos obtenidos con los doce pares de iniciadores microsatélites confirmó la similitud genética existente entre las tres poblaciones de cacao analizadas, observándose por tanto, que los materiales de cacao, están agrupados en un solo clúster.
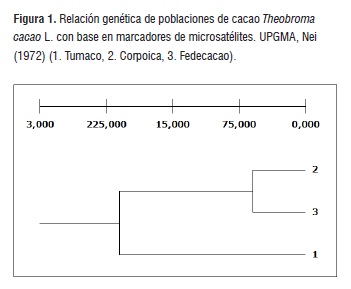
El cluster muestra valores bajos para las distancias genéticas entre las poblaciones estudiadas, notándose que la población de Tumaco se diferencia de las poblaciones de Corpoica y Fedecacao (distancia genética de Nei's de 0,21), mientras que las distancias genéticas entre las poblaciones de Fedecacao y Corpoica son mínimas (distancia genética de Nei's de 0,06). Estos resultados coinciden con los análisis de diversidad y estructura genética, confirmando que las poblaciones estudiadas son similares genéticamente, posiblemente porque hacen parte de bancos de germoplasma y contienen materiales genéticos de igual procedencia.
Resultados similares fueron reportados por Romero et al. (2010) [30] con plantas de cacao pertenecientes a cuatro cultivares diferentes y conservadas como colecciones ex situ en la Región Amazónica del Ecuador, el análisis del clúster jerárquico permitió confirmar la afinidad genética existente entre las 41 plantas analizadas y el grupo de cacao Nacional ecuatoriano, sugiriendo que las diferentes poblaciones de cacao Nacional están genéticamente emparentadas tanto con los grupos Criollos y Forasteros; igualmente, la estructura genética se caracterizó por presentar altos niveles de heterocigosidad dentro de los individuos de un mismo grupo y por mostrar bajos niveles de diferenciación genética entre poblaciones. Resultados que se asemejan a la presenta investigación, donde no hay grandes diferencias genéticas entre las poblaciones pero si existe alta variabilidad entre los individuos que las conforman.
CONCLUSIONES
Los marcadores de microsatélites del estudio fueron altamente discriminantes y demostraron tener alto nivel de exactitud para verificar la identidad genética y para agrupar a las tres poblaciones de cacao provenientes de Tumaco (Nariño), Corpoica (Palmira, Valle del Cauca) y Granja Experimental Tierradura (Miranda, Cauca). La estructura genética de las poblaciones de cacao, se caracterizó por presentar altos niveles de heterocigosidad dentro de los individuos de un mismo grupo y por mostrar bajos niveles de diferenciación genética entre poblaciones.
AGRADECIMIENTOS
Al Grupo de Investigación en Diversidad Biológica de la Universidad Nacional, Sede Palmira, por su soporte académico, técnico y por la financiación del proyecto. A CORPOICA (C.I Palmira) y FEDECACAO (Granja Tierradura, Miranda), por permitir realizar los muestreos del material vegetal en sus colecciones de germoplasma; y a la Facultad de Ciencias Agrarias de la Universidad del Cauca por la asesoría y apoyo científico.
REFERENCIAS
[1] ORGANIZACIÓN DE LAS NACIONES UNIDAS (ONU). Convenio de Diversidad Biológica. Programa de las Naciones Unidas para el medio ambiente [en linea]. 1992. Programa de las Naciones Unidas para el medio ambiente (PNUMA). Disponible: http://www.cbd.int/doc/legal/cbd-es.pdf. [citado 16 de Febrero de 2014] [ Links ].
[2] LANTERI, S. and BARCACCIA, G. Molecular marker based analysis for crop germoplasm preservation. The role of biotechnology, 2005, p. 55-66. [ Links ]
[3] CUATRECASAS, J. A taxonomic revision of the genus Theobroma. Contributions from the U.S. National Herbarium 35(6), 1964, p. 379-607. [ Links ]
[4] CHEESMAN, E. Notes on the nomenclature, classification and possible relationships of cocoa populations. Journal of Tropical Agriculture, 21, 1944, p. 144–159. [ Links ]
[5] CERVANTES, C., BROWN, J. and SCHNELL, R. Combining ability for disease resistance, yield,and horticultural traits of cacao Theobroma cacao L. clones. Journal of the American Society for Horticultural Science, 131(2), 2006, p. 231-241. [ Links ]
[6] EFOMBAGN, M., NYASSÉ, S., SOUNIGO, O.,KOLESNIKOVA, M. and ESKES, A. Participatory cocoa Theobroma cacao selection in Cameroon:Phytophthora pod rot resistant accessions identified in farmers fields. Crop Protection, 26, 2007,p. 1467-1473. [ Links ]
[7] LANAUD, C., FOUET, O., CLÉMENT, D., BOCCARA, M., RISTERUCCI, A., SURUJDEO, S., LEGAVRE, T. and ARGOUT, X. A meta-QTL analysis of disease resistance traits of Theobroma cacao L. Molecular Breeding, 24, 2009, p. 361-374. [ Links ]
[8] VAZQUEZ, A., MOLINA, F., FARFÁN, J. y SALVADOR,M. Potencial de los marcadores moleculares para el rescate de individuos de Theobroma cacao L., de alta calidad. BioTecnología, 16(1),2012, p. 36–56. [ Links ]
[9] DOYLE, J. and DOYLE, J. Isolation of plant DNA from fresh tissue. Focus, 12, 1990, p. 13–15. [ Links ]
[10] LANAUD, C., RISTERUCCI, A., PIERETTI, I., FALQUE, M., BOUET, A. and LAGODA, P. Isolation and characterization of microsatellites in Theobroma cacao L. Molecular Ecology, 8, 1999, p. 2141-2152. [ Links ]
[11] EXCOFFIER, L., LAVAL, G. and SCHNEIDER, S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis. Evolutionary Bioinformatics [online]. 2005. Disponible: http://www.la-press.com/journal-evolutionarybioinformatics- j17. [citado 6 de Marzo de 2014] [ Links ].
[12] PEAKALL, R. and SMOUSE, P. GenAlEx 6.5: genetic analysis in Excel. Population genetic softwarefor teaching and research-an update. Bioinformatics, 28, 2012, p. 2537-2539. [ Links ]
[13] WRIGHT, S. The genetical structure of populations. Annals of Eugenics, 15, 1951, p. 323-354 [ Links ]
[14] SNEATH, P. and SOKAL, R. Numerical taxonomy. The principles and practice of numerical classification. San Francisco (USA): W.H. Freeman and Co, 1 ed., 1973, 588 p. [ Links ]
[15] NEI, M. Genetic distance between populations. The American Naturalist, 106(949), 1972, p. 283-292. [ Links ]
[16] MILLER, M. Tools for population genetic analyses (TFPGA) 1.3: A Windows program for the analysis of allozyme and molecular population genetic data. Arizona (USA): Northern Arizona University, Department of Biological Sciences, 1997, 30 p. [ Links ]
[17] OSORIO, J. Caracterización molecular del banco de germoplasma de cacao (Theobroma cacao, L) del Instituto Amazónico de Investigaciones Científicas SINCHI mediante marcadores moleculares tipo microsatélites [Tesis Biólogo]. Bogotá (Colombia): Pontificia Universidad Javeriana, Facultad de Ciencias, 2009, p. 12-47. [ Links ]
[18] LOOR, R., RISTERUCCI, A., COURTOIS, B., FOUET, O., JEANNEASU, M., ROSENQUIST, E., AMORES, F., VASCO, A., MEDINA, M. and LANAUD, C. Tracing the native ancestors of the modern Theobroma cacao L. population in Ecuador. Tree Genetics and Genomes, Genomes, 5, 2009,p. 421-433. [ Links ]
[19] CRYER, N., FENN, M., TUMBULL, C. and WILKINSON, M. Allelic size standars and reference genotypes to unify international cocoa Theobroma cacao L microsatellite data. Genetic Resources y Crop Evolution, 53, 2006, p. 1643-1652. [ Links ]
[20] LONDOÑO, J., GIL, D., AGUILAR, S., RIVERA, F. y LÓPEZ, G. Caracterización molecular de clones de Theobroma cacao L., por medio de marcadores moleculares microsatélites. Revista Luna Azul, 32, 2011, p. 52-60. [ Links ]
[21] SCHELTEMA, T. La autoincompatibilidad en los híbridos de cacao del CATIE. San José (Costa Rica): CATIE. 2 -7, Documento de trabajo no 47, 1989, 100 p. [ Links ]
[22] IRISH, B., GOENAGA, R., ZHANG, D., SCHNELL, R., BROWN, S. and MOTAMAYOR, J. Microsatellite Fingerprinting of the USDA-ARS Tropical Agriculture Research Station Cacao Theobroma cacao L. Germplasm Collection. Crop Science, 50, 2010, p. 656-665 [ Links ]
[23] SÁNCHEZ, I., ZÁRATE, L., GALLEGO, G. y TOHME, J. Análisis de la diversidad genética de accesiones de Theobroma cacao L. del banco de conservación a cargo de CORPOICA. Revista CORPOICA – Ciencia y Tecnología Agropecuaria, 8(2), 8(2), 2007, p. 26-31. [ Links ]
[24] SERENO, M., ALBUQUERQUE, P., VENCOVSKY, R. and FIGUEIRA, A. Genetic diversity and natural population structure of cacao Theobroma cacao L., from the Brazilian Amazon evaluated by microsatellite markers. Conservation Genetics, 7, 2006, p. 13–24. [ Links ]
[25] ZHANG, D., BOCCARA, M., MOTILAL, L., BUTLER, D., UMAHARAN, P., MISCHKE, S. and MEINHARDT, L. Microsatellite variation and population structure in the Refractario cacao of Ecuador. Conservation Genetics, 9, 2008, p. 327-337. [ Links ]
[26] RORER, J. Ecuador cacao (part 2). Tropical Agriculture Trinidad, 3, 1926, p. 68-69. [ Links ]
[27] REATEGUI, E., RENNO, J., CARVAJAL, F., CORVERA, R., DEL CASTILLO, D. y GARCÍA C. Evaluación de la variabilidad genética de la castaña Bertholletia excelsa en la región de madre de dios mediante marcadores microsatélites. Folia amazónica, 18(1-2), 2009, p. 41–50. [ Links ]
[28] ZHANG, D., MISCHKE, S., JOHNSON, E., PHILLIPS- MORA, W. y MEINHARDT, L. Molecular characterization of an international cacao collection using microsatellite markers. Tree Genetics & Genomes, 5, 2009, p. 1-10. [ Links ]
[29] ZHANG, D., BOCCARA, M., NOTLLAIL, L., BUTLER, D., UMAHORAN, P., MISHK, S. and LYNDEL, M. Microsatellite variation and population structure in the Refractario Cacao of Ecuador. Conservation Genetics, 9, 2007, p. 327–327. [ Links ]
[30] ROMERO, C., BONILLA, J., SANTOS, E. y PERALTA, E. Identificación varietal de 41 plantas seleccionadas de cacao Theobroma cacao L., provenientes de cuatro cultivares distintos de la región amazónica ecuatoriana mediante el uso de marcadores microsatélites. Revista tecnológica ESPOL, 23(1), 2010, p. 121-128. [ Links ]













