Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Biotecnología en el Sector Agropecuario y Agroindustrial
versão impressa ISSN 1692-3561
Rev.Bio.Agro vol.13 no.2 Popayán jul./dez. 2015
https://doi.org/10.18684/BSAA(13)114-122
DOI: http://dx.doi.org/10.18684/BSAA(13)114-122
OPTIMIZACIÓN DE LA HIDRÓLISIS ENZIMÁTICA DE PROTEÍNAS PRESENTES EN SEMILLAS DE GUANDUL (Cajanus cajan)
OPTIMIZATION OF ENZYMATIC HYDROLYSIS OF PROTEINS PRESENT IN SEEDS OF GUANDUL (Cajanus cajan)
OTIMIZAÇÃO HIDRÓLISE ENZIMÁTICA DE PROTEÍNAS PRESENTES EM SEMENTES DE GUANDU (Cajanus cajan)
EDIER GAVIRIA-ACOSTA1, RICARDO BENÍTEZ-BENÍTEZ2, LUIS LENIS2, JOSÉ LUIS HOYOS-CONCHA3
1 Universidad del Cauca, Facultad de Ciencias Naturales, Exactas y de la Educación, Asubagroin. Químico. Popayán, Colombia.
2 Universidad del Cauca, Facultad de Ciencias Naturales, Departamento de Química, QPN. Profesor Titular. Popayán, Colombia.
3 Universidad del Cauca, Facultad de Ciencias Agrarias. Departamento de Agroindustria. Profesor Titular. Popayán, Colombia.
Correspondencia: egaviria@unicauca.edu.co
Recibido para evaluación: 10 de Septiembre de 2015. Aprobado para publicación: 20 de Octubre de 2015.
RESUMEN
El Guandul es una leguminosa, sus semillas presentan un importante contenido de biomoléculas de interés alimentario con alto potencial agroindustrial, una de estas es la proteína, la cual por medio de procesos de hidrólisis se pueden obtener y desarrollar nuevos productos. En el presente estudio se llevó a cabo la optimización de la hidrólisis enzimática de proteínas presentes en semillas de Guandul (Cajanus cajan). El análisis proximal del Guandul, mostró un importante contenido de proteína, con un porcentaje del 22,6%. El método de superficie de respuesta fue el usado para la optimización del proceso, usando como proteasa el complejo enzimático Neutrasa®. Los valores de las variables optimizadas son; pH: 7,2, temperatura: 53°C, tiempo de 137 minutos y relación de concentración Enzima/Sustrato de 1,5, a estas condiciones se obtiene un grado de hidrólisis del 10% aproximadamente, factores de digestibilidad y propiedades funcionales se deben estudiar con el fin de promover su uso para la alimentación humana y animal.
PALABRAS CLAVE: Enzimas, Hidrolizados, Superficie de respuesta.
ABSTRACT
Guandul (Cajanus cajan) is a legume, whose seeds contain biomolecules with potential applications in (food) industry, one of these is the protein, which by enzymatic hydrolysis may be obtained and develop new products. In this work the proteins' enzymatic hydrolysis was optimized. Guandul seeds contains 22,6% of proteins. The optimization was obtained adapting the response surface method and using the enzymatic complex Neutrasa® as protease. The variable values were the following: pH 7,2, temperature 53°C, time 137 min and enzyme/substrate ratio (1/5). The degree of hydrolysis reached was around 10%. The biomolecules digestibility factors and functional properties should be studied with the aim to spread the use of Guandul seeds in food industry.
KEYWORDS: Enzymes, Hydrolysates, Response surface.
RESUMO
O guandu é uma leguminosa, suas sementes têm um teor significativo de biomoléculas de interesse com alto potencial agro-alimentar, uma destas é a proteína, a qual por hidrólise enzimática pode ser obtida e desenvolver novos produtos. Este estudo foi realizado para otimizar a hidrólise enzimática de proteínas em sementes de ervilha (Cajanus cajan). A análise guandul proximal mostrou um teor de proteína significativa, com uma percentagem de 22,6%. O método de superfície de resposta foi usada para otimizar o processo, utilizando como o complexo enzima protease Neutrasa ®. Os valores das variáveis são otimizados; pH: 7,2, temperatura: 53°C, tempo de 137 minutos, proporção de concentração de enzima / substrato de 1/5, estas condições um grau de hidrólise de cerca de 10%, os factores de digestibilidade e propriedades funcionais deve ser obtido estudo, a fim de promover a sua utilização para consumo humano e animal.
PALAVRAS-CHAVE: Enzimas, Hidrolisados, Superfície de resposta.
INTRODUCCIÓN
El Guandul (Cajanus cajan) se encuentra clasificado en la familia Papilionaceae, género Cajanus, esta especie se caracteriza por la producción de semillas con un alto contenido de carbohidratos y proteína [1,2]. La semilla de Guandul es utilizada para la alimentación humana y animal, la cual se puede consumir fresca o seca, en diferentes presentaciones como guiso, sopas y al vapor [3]. También es utilizada para la fabricación de harinas, lo que lleva a darle diferentes aplicaciones alimenticias [4]. En los últimos años se ha incrementado el cultivo de Guandul en los departamentos del sur occidente colombiano, debido a la gran demanda que presenta la semilla, utilizada en programas de alimentación de campesinos y familias de escasos recursos, siendo el Guandul un alimento altamente nutritivo con un bajo costo de producción [2]. La hidrólisis consiste en el rompimiento de enlaces peptídicos que unen aminoácidos que conforman las proteínas; diferentes métodos se usan para este fin, dentro de los que se encuentran la hidrólisis química e hidrólisis enzimática; la primera usa ácidos y bases fuertes, logrando una mayor disposición de aminoácidos libres. La hidrólisis enzimática es un proceso controlado, bajo factores de pH, temperatura, tiempo y el tipo de enzima usada. Esta tecnología se presenta como una de las alternativas tecnológicas, que contribuyen a la valorización de productos de origen vegetal y animal, por medio de trasformaciones que permiten el cambio de sus propiedades fisicoquímicas y logrando un mayor y mejor uso en la industria alimentaria, cosmética y farmacéutica [5].
Pocos estudios se han realizado sobre el potencial que tiene la proteína presente en esta semilla, y las diferentes características que puede adquirir al ser sometidas a procesos de hidrólisis [6]. Con el fin de buscar una alternativa y generar un proceso que permita dar un valor agregado a las semillas de Guandul, el presente trabajo se enfocó en la optimización de las hidrólisis de proteínas presentes en las semillas, con el fin de generar procesos que potencialicen su uso.
MÉTODO
Materiales y métodos
La semilla de Guandul fue aportada a esta investigación por agricultores del corregimiento La Carbonera, ubicado en la parte sur del Departamento del Cauca, latitud 1.92362, longitud: -77.0501. Como proteasa se empleó Neutrasa® 0.8 L E.C. 3.4.24.28 de Novozymes (A/S Dinamarca), se presenta como una preparación comercial, multienzimática, de grado alimenticio, con una actividad de 0,8 UA/g (UA: Unidades Anson). La enzima es obtenida a partir de Bacillus amyloliquefaciens. Sus condiciones de trabajo están establecidas en los siguientes rangos: temperatura entre 40-60°C, pH entre 6 y 8, y actúa sobre el carbono terminal de fenilalanina, leucina y valina [7, 8]. Un reactor Centricol con capacidad para 20 L, fue usado para las reacciones hidrólisis, la cuantificación y grado hidrólisis se determinó en un espectrofotómetro UV-1800 Shimadzu [9].
Molienda y análisis próximo de la semilla
La semilla de Guandul fue molida mecánicamente, hasta obtener harina de textura fina, la cual se pasó por un tamiz con un número de malla diez (ASTM 11/95, 2,00 mm). El análisis próximo de la semilla de Guandul se llevó a cabo empleando métodos AOAC descritos a continuación.
Humedad. Deshidratación a 100–105°C en estufa a presión constante (600 mmHg-Popayán) hasta peso constante según la norma AOAC 950.43 [10].
Ceniza. Calcinación a 550°C por 4 horas, según AOAC 920.153 [11].
Extracto etéreo. Extracción Soxhlet por 4 horas según AOAC 991.36 [12].
Proteína bruta. Kjeldahl: Digestión ácida y destilación de nitrógeno (N x 6,25), según AOAC 968.06 [13].
Fibra bruta: Método Weende: Digestión ácido-base y calcinación según AOAC 962.09 [14].
Hidrólisis enzimática
Las reacciones de hidrólisis enzimáticas de semillas de Guandul se realizaron en un reactor Centricol con control automático de temperatura y velocidad de agitación. Para ello se pesaron 100 g de muestra, se disolvieron en 1000 mL de agua destilada, las soluciones se homogenizaron con agitación constante a 100 rpm en el reactor; una vez alcanzada la temperatura, se da inicio a la reacción mediante la adición de la proteasa Neutrasa®, la cantidad de enzima está determinada por la relación enzima/sustrato según cada unidad experimental, según el cuadro 2.
Determinación del grado de hidrólisis
El grado de hidrólisis o GH se determinó en cada experimento utilizando el método de ortoparafenilaldehído o método de OPA, el cual consiste en hacer reaccionar los α-aminoacidos de las cadenas peptídicas con el reactivo de ortoparafenilaldehído en presencia de mercaptoetanol y condiciones alcalinas generando derivados o compuestos con un máximo de absorbancia de 340 nm [15,16]. Para determinar la concentración de las muestras se realizó el método de curva de calibración, para ello se prepararon patrones de leucina a diferente concentración, en un rango de concentración entre 6 y 21 ppm, a cada patrón se les adicionó el reactivo de OPA y se llevaron a lectura en un espectrofotómetro UV-1800 Shimadzu, a un longitud de onda de 341 nm, el grado de hidrólisis se calculó mediante la siguiente ecuación 1:
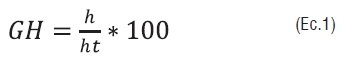
Donde, h: total de mEq leucina en la muestra hidrolizada y ht la cantidad de mEq de leucina en la muestra totalmente hidrolizada [17].
Diseño experimental
Se aplicó un diseño factorial 24, como se muestra a continuación:
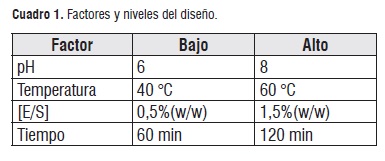
De acuerdo con las condiciones de experimentación y recursos disponibles, además de la prioridad de realizar un proceso de optimización se aplicó un diseño Draper-Lin el cual es un diseño compuesto reducido que consiste en un factorial fraccionado o Plackett-Burman mas unos puntos estrella. A continuación se muestra un diseño Draper-Lin para los 4 factores de trabajo (cuadro 2):
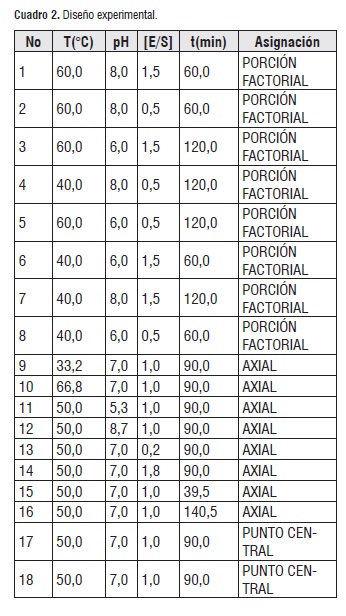
Las primeras 8 corridas abarcan una media fracción de un factorial 24. El segundo conjunto de 8 corridas son los puntos estrella, donde α es la distancia axial como se define para los diseños central compuesto y se agregan dos puntos al centro. El diseño resultante fue capaz de estimar el modelo de Segundo orden completo.
RESULTADOS
Los resultados del análisis próximo muestran que el Guandul cultivado en el Departamento del Cauca, presenta una composición nutricional comparable con otras semillas, la semilla se encuentra compuesta por un importante contenido de carbohidratos y proteína, como se muestra en el cuadro 3, el contenido proteico al ser comparado con otras leguminosas como la arveja, soya y caupí con un porcentaje del 22,6, 29,1 y 26,1 %, respectivamente [18], las ventajas que ofrece la semilla de Guandul sobre las demás, son la poca cantidad de fertilizantes y cuidado que necesita la planta para su desarrollo [19].
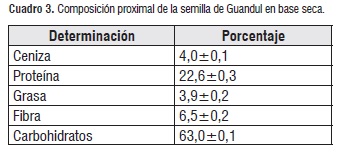
Lo anterior demuestra que las semillas de Guandul contienen un importante valor nutritivo, por lo cual es usado en diferentes partes del mundo para alimentación infantil; por otra parte el contenido de fibra y otros microelementos, hacen que el Guandul no solo contribuya en la nutrición, sino que también ayude en la digestión y metabolismo de los seres vivos.
Al finalizar la reacción se separó el residuo sólido del líquido y se procedió a inactivar la enzima a 90°C en los dos medios. Los residuos líquidos presentaban diferentes tonalidades, variando entre una coloración amarillenta y color crema, esto debido al aumento de solubilidad de las proteínas por efecto de la hidrólisis, y a las diferentes condiciones de hidrólisis en cada reacción. En los residuos líquidos se encuentran los péptidos hidrolizados, además de proteína soluble en esta fase, o que por la acción de hidrólisis llegó a solubilizarse [20]. El grado de hidrólisis en cada experimento se muestra en el cuadro 4:
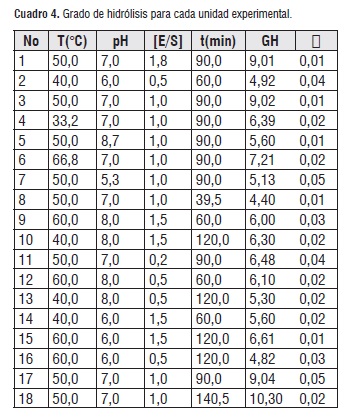
El grado de hidrólisis en todos los experimentos se encuentra en el rango de 4,4-10,3%, donde se puede observar el mayor grado de hidrólisis en experimento número 18, el cual presenta valores medios para el pH, temperatura y relación de concentración enzima /sustrato, y el tiempo más prolongado (140,5 minutos), indicando que el tiempo es uno de los factores más influyentes sobre el grado de hidrólisis, al observar la condiciones del experimento número 8, el cual presenta el menor tiempo, aproximadamente 40 minutos, y se obtiene como resultado el grado de hidrólisis de 4,4%, es el más bajo de todos los experimentos, esta influencia se puede confirmar con el análisis ANOVA a continuación [21, 22].
El análisis del diseño factorial fraccionado Plackett-Burman, el cual representa otra alternativa para fraccionar factoriales completos 2k, donde el número de puntos de diseño no necesariamente es potencia de dos, pero sí múltiplo de cuatro, se realizó con el paquete estadístico Statgraphics® (STSC Inc. Rockville, Md, USA, versión plus 5.1), se utilizó para el análisis de datos usando el método de superficie de respuesta [23], con nivel de significancia de 0,05. Los resultados del Análisis de Varianza (ANOVA) se presentan en el cuadro 5.
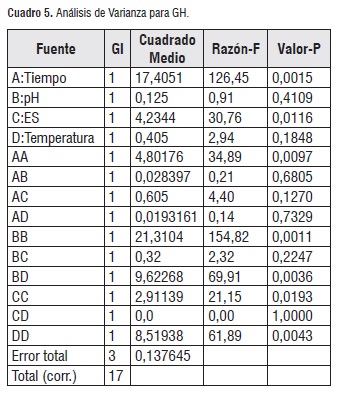
El ANOVA muestra que dos de los factores evaluados presentan diferencia significativa (p<0,05), los cuales corresponden al tiempo y la relación enzima sustrato, siendo el primero el de mayor efecto en el experimento.
La figura 1 muestra el gráfico de Pareto que describe el análisis de varianza y la influencia de los factores y sus relaciones sobre la hidrólisis, el orden de importancia sobre procesos se muestra en orden descendente, se observa una línea vertical, que cruza la gráfica, la ubicación de esta depende del intervalo de confianza del diseño que en este caso es del 95%, aquel factor que sobrepase esta línea afectará de forma significativa el proceso de hidrólisis; en gris se muestran todos los factores que afectan de forma positiva la reacción de hidrólisis y en negro aquellos que influyen de manera negativa nuestra variable de respuesta, en este caso el grado de hidrólisis de proteínas de semillas de Guandul.
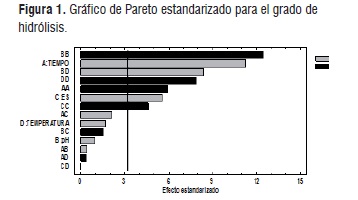
En este sentido se observa que el tiempo es el factor que mayor influencia positiva presenta sobre el proceso de hidrólisis, lo cual se observa en análisis ANOVA; esta influencia se muestra con los resultados de cada corrida experimental así como los valores óptimos descritos en el cuadro 6, a mayor tiempo de reacción presenta un aumento sobre el grado de hidrólisis, lo cual muestra un relación directa de este factor y la variable respuesta.
La relación enzima-sustrato (ES), es el segundo factor con influencia sobre la variable respuesta, esto se atribuye a que una mayor cantidad de enzima puede lograr una mayor y más rápida conversión de sustrato a producto, en este caso de proteína a péptidos o aminoácidos libres, sin embargo se debe tener en cuenta que en procesos de hidrólisis este es uno de los factores a controlar y optimizar, debido a que el uso excesivo de enzima es proporcional al costo del proceso. Por último, el gráfico de Pareto muestra que la temperatura y el pH no influyen de manera significativa sobre el proceso de hidrólisis, debido a que se encuentran en la parte izquierda de la línea vertical, esto se debe a que se utilizó un complejo enzimático que trabaja a un amplio rango de temperatura y pH, posiblemente cambios en estos dos factores no influyeron de manera significativa sobre la actividad proteolítica de la enzima sobre las semillas de guandul [23].
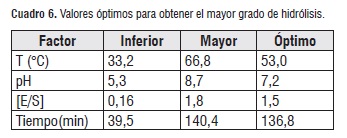
Los valores de los factores óptimos para lograr el mayor grado de hidrólisis se muestran en el cuadro 6, estos se encuentran dentro de los límites previamente estipulados, con esta enzima y este tipo de matriz, a excepción del tiempo de hidrólisis, debido a que este se requiere un tiempo por encima de lo determinado, variable que se amplía gracias a puntos axiales presentes en el diseño, correspondientes en el cuadro 6 a los experimentos 1, 4, 5, 6, 7, 8, 11, 18. El análisis de la figura 2, muestra una idea independiente y cualitativa del efecto de los cuatro factores sobre la respuesta (grado de hidrólisis GH), determinado que a medida que aumenta la temperatura el grado de hidrólisis incrementa su valor, hasta un momento máximo donde encontramos el mayor grado de hidrólisis, posteriormente la línea comienza a descender, esto se debe a que la temperatura influye de gran forma en la actividad enzimática, logrando un incremento de la misma cuando se alcanza la temperatura óptima de la enzima y un descenso cuando la temperatura comienza a desnaturalizarla.
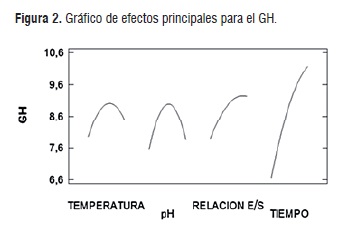
Otro factor que se observa en la gráfica es el pH, el cual tiene un efecto similar al de la temperatura, teniendo un punto máximo donde se logra el mayor grado de hidrólisis, debido a que las enzimas son proteínas y su estructura contiene cargas que afectan su estructura, un cambio en el pH significa un cambio estructural de la proteína, afectado el sitio activo y obviamente la reacción de hidrólisis [24,25].
La relación de concentración de la enzima respecto al sustrato también se optimizó; la gráfica muestra que a medida que se aumenta la cantidad de enzima aumenta el grado de hidrólisis, debido a que una mayor cantidad de enzima logrará romper de forma más rápida y en mayor grado la proteína presente en la semilla de Guandul [26]. Por último, se observa el tiempo, donde se establece la influencia de este parámetro sobre el proceso, su comportamiento describe una línea que incrementa el grado de hidrólisis a media que trascurre el tiempo, además no indica un máximo, por lo que se deduce un comportamiento directo entre el grado de hidrólisis y el tiempo, esta relación se muestra en el cuadro 7 [27].
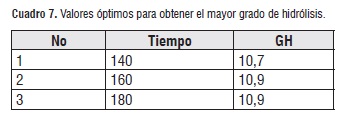
La figura 3 donde se puede observar la superficie de respuesta, expone un incremento del grado de hidrólisis a medida que aumenta el tiempo, llevando de un GH entre el 7% aproximadamente para 60 minutos a 10% cuando se incrementa el tiempo de reacción 120 minutos, el aumento de la relación de concentración enzima/sustrato, aumenta el grado de hidrólisis, sin embargo el incremento de la cantidad de enzima no proporciona un cambio brusco en el grado de hidrólisis.
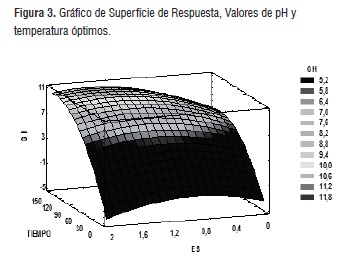
La figura 4 permite observar diferentes contornos, cada uno representa una rango para el grado de hidrólisis, [28], con una clara tendencia a incrementar el valor de la respuesta (GH), esta es una información importante que puede ser usada para establecer los posibles usos de las semillas de gandul, debido a que características y propiedades fisicoquímicas pueden variar, con pequeños cambios en los tamaños y secuencias de las cadenas proteicas [29,30].
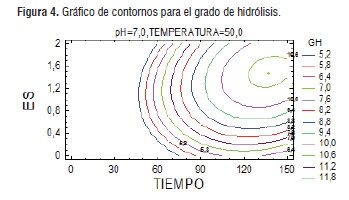
En esta representación se observan líneas circulares o también conocidos contornos, que permiten visualizar diferentes valores de respuesta debido a cambios sobre los factores, al igual que en el gráfico de superficie de respuesta al relacionar la concentración de enzima con el tiempo de reacción, se observa que el contorno para el mayor grado de hidrólisis de proteínas presentes en semillas de Guandul se muestra cuando tenemos el mayor tiempo de reacción y la máxima cantidad de enzima respecto al sustrato, la influencia de estos factores ya fue discutida anteriormente [31,32].
CONCLUSIONES
El análisis proximal de las semillas de Guandul, cultivadas en el Departamento del Cauca mostró un importante contenido en proteína, lo que corrobora el alto valor nutritivo que presenta esta semilla.
El análisis ANOVA mostró que el tiempo y la relación de concentración enzima/sustrato, son los factores que mayor influencia presentan sobre el proceso de hidrólisis, cambios en el pH y la temperatura no mostraron afectar la reacción de hidrólisis posiblemente por la capacidad de la enzima de actuar en un rango amplio para estos dos factores.
Las mejores condiciones para el proceso de hidrólisis de proteínas presentes en semillas de Guandul, se obtuvieron por el método de superficie de respuesta, los valores óptimos encontrados son: pH: 7,2, relación enzima/sustrato: 1,5, temperatura: 53°C y tiempo de 136, 8 min, los cuales fueron evaluados sobre el grado de hidrólisis, obteniendo un GH de 10% aproximadamente, con lo que se pretende generar nuevos procesos que fomente el uso de semillas de Guandul, en diferentes campos.
AGRADECIMIENTOS
A los Grupos de investigación en Química de Productos Naturales (QPN) y Aprovechamiento de Subproductos Agroindustriales (ASUBAGROIND) adscritos a la Universidad del Cauca por todo el apoyo prestado en esta investigación.
REFERENCIAS
[1] GAVIRIA E. Metodología de superficie de respuesta en la optimización de la hidrólisis enzimática de proteínas presentes en semillas de guandul (Cajanus Cajan): propiedades tecnofuncionales del hidrolizado [Tesis de Pregrado]. Popayán (Colombia): Universidad del Cauca, Facultad de Ciencias Naturales Exactas y de la educación, 2013, p 10-20. [ Links ]
[2] RACHAPUDI, V.S. and ATTIPALLI, R. Dynamics of vegetative and reproductive growth patterns in Pigeonpea (Cajanus cajan L.) grown under elevated CO2. Procedia Environmental Sciences, 29, 2015, p. 147–148. [ Links ]
[3] SANTHANAM, S. and EGIGU, M. Field evaluation of a botanical formulation from the milky mangrove Excoecaria agallocha L. against Helicoverpa armígera Hübner. In Abelmoschus esculentus (lady's finger) and Cajanus Cajan (Pigeon pea). Asian Pacific Journal of Tropical Medicine, 7, 2014, p. 171-76. [ Links ]
[4] ZU, Y., LIU, X., FU, Y., WU, N., KONG, Y. and WINK, M. Chemical composition of the SFE-CO2 extracts from Cajanus cajan (L.) Huth and their antimicrobial activity in vitro and in vivo. Phytomedicine, 17, 2010, p. 1095–1101. [ Links ]
[5] PAGAN, J., IBARZ, A., FALGUERA, V. and. BENITEZ, R. Enzymatic hydrolysis kinetics and nitrogen recovery in the protein hydrolysate production from pig bones. Journal of Food Engineering, 119, 2013, p. 55-59. [ Links ]
[6] TORRES, J., RUTHERFURD, S., MUÑOZ, L., MICHAEL-PETERS, M. and MONTOYA, C. The impact of heating and soaking on the in vitro enzymatic hydrolysis of protein varies in different species of tropical legumes. Food Chemistry, 194, 2016, p. 377-82. [ Links ]
[7] NGO, D., RYU, B. and KIM, S. Active peptides from skate (Okamejei kenojei) skin gelatin diminish angiotensin-I converting enzyme activity and intracellular free radical-mediated oxidation. Food Chemistry, 143, 2014, p. 246-55. [ Links ]
[8] NEUTRASA®. Novozymes [en línea]. 2013. Disponible http://www.novozymes.com [citado 15 noviembre 2014] [ Links ].
[9] SARCHAMI, T. and REHMANN, L. Optimizing enzymatic hydrolysis of inulin from Jerusalem artichoke tubers for fermentative butanol production. Biomass and Bioenergy, 69, 2014, p. 175-82. [ Links ]
[10] ASSOCIATION OF OFFICIAL AGRICULTURAL CHEMISTS (AOAC). Official methods of analysis. 950.43: determination of moisture. 19th ed. Gaithersburg (USA): 2012. [ Links ]
[11] ASSOCIATION OF OFFICIAL AGRICULTURAL CHEMISTS (AOAC). Official methods of analysis 1404: mineral analysis by icp-oes. 19th ed. Gaithersburg (USA): 2012. [ Links ]
[12] ASSOCIATION OF OFFICIAL AGRICULTURAL CHEMISTS (AOAC). Official methods of analysis 991.36: fat in feeds. 19th ed. Gaithersburg (USA): 2012. [ Links ]
[13] ASSOCIATION OF OFFICIAL AGRICULTURAL CHEMISTS (AOAC). Official methods of analysis 968.06: determination of the nitrogen content. 19th ed. Gaithersburg (USA): 2012. [ Links ]
[14] ASSOCIATION OF OFFICIAL AGRICULTURAL CHEMISTS (AOAC). Official methods of analysis 962.09.: crude fiber analysis. 19th ed. Gaithersburg (USA): 2012. [ Links ]
[15] SPELLMAN, D., MCEVOY, E., OCUINN, G. and FITZGERALD, R.J. Proteinase and exopeptidase hydrolysis of whey protein: Comparison of the TNBS, OPA and pH stat methods for quantification of degree of hydrolysis. International Dairy Journal, 13, 2003, p. 447–453. [ Links ]
[16] ZACHARIS, C. and TZANAVARAS, P. Liquid chromatography coupled to on-line post column derivatization for the determination of organic compounds: A review on instrumentation and chemistries. Analytica Chimica, 798, 2013, p. 1-24. [ Links ]
[17] SUWAL, S., ROBLET, C., AMIOT, J. and BAZINET, L. Presence of free amino acids in protein hydrolysate during electroseparation of peptides: Impact on system efficiency and membrane physicochemical properties. Separation and Purification Technology, 147, 2015, p. 227-36. [ Links ]
[18] AGUIRRE, P.A. Caracterización nutricional del grano de Caupi Vigna unguiculata L. en ratas [Tesis maestría en Ciencias Agrarias]. Palmira (Colombia): Universidad Nacional de Colombia, escuela de posgrados, 2009, p. 21-54. [ Links ]
[19] DE OLIVEIRA, S.F. and PERRONE, D. Characterization and stability of bioactive compounds from soybean meal. LWT - Food Science and Technology, 63, 2015, p. 992-1000. [ Links ]
[20] NAJAFIAN, L. and BABJI, A. Isolation, purification and identification of three novel antioxidative peptides from patin (Pangasius sutchi) myofibrillar protein hydrolysates. Food Science and Technology, 60, 2015, p. 452-61. [ Links ]
[21] KONG, X., ZHOU, X. and QIAN, H. Enzymatic preparation and functional properties of wheat gluten hydrolysates. Food Chemistry, 101(2), 2007, p. 615-620. [ Links ]
[22] KIM, M., SON, H., KIM, Y., MISAKA, T. and RHYU, M. Umami–bitter interactions: The suppression of bitterness by umami peptides via human bitter taste receptor. Biochemical and Biophysical Research Communications, 456, 2015, p. 586-90. [ Links ]
[23] DAS, B., ROY, A., BHATTACHARJEE, S., CHAKRABORTY, S. and BHATTACHARJEE, C. Lactose hydrolysis by β-galactosidase enzyme: optimization using response surface methodology. Ecotoxicology environment safety, 121, 2015, p. 244-252.
[24] RAVBER, M., KNEZ, Z. and SKERGET, M. Optimization of hydrolysis of rutin in subcritical water using response surface methodology. Journal of Supercritical Fluids, 104, 2015, p. 145-52. [ Links ]
[25] MORR, V., GERMAN, B., KINSELLA, J., REGENSTEIN, J.M., VAN BUREN, J. and KILARA, A. Collaborative study to develop a standardized food protein solubility procedure. Journal of Food Science, 50, 1985, p. 1715–18. [ Links ]
[26] NELSON, D. y COX, M. Lehninger. Principios de Bioquímica. 4 ed. Barcelona (España): Omega, 2005, p.190-230. [ Links ]
[27] BENÍTEZ, R., IBARZ, A. and PAGAN, J. Hidrolizados de Proteína: procesos y aplicaciones. Bioquímica Latinoamericana, 42, 2008, p. 227-36. [ Links ]
[28] NOURI, L., LEGRAND, L., POPINEAU, Y. and BELLEVILLE, P. Enzymatic hydrolysis of wheat proteins Part 2: comparison of performance of batch-stirred and torus reactors. Chemical Engineering Journal, 65, 1997, p. 195-199. [ Links ]
[29] WASSWA, J., TANG, J., GU, X. and YUAN, X. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp (Ctenopharyngodon idella) skin. Food Chemistry, 104, 2007, p. 1698–1704. [ Links ]
[30] PERICIN, D., RADULOVIC, J.L., VASTAG, Z., MADAREV-POPOVIC, S. and TRIVIC, S. Enzymatic hydrolysis of protein isolate from hull-less pumpkin oil cake: Application of response surface methodology. Food Chemistry, 115, 2009, p. 753–757. [ Links ]
[31] MERZA, M., EWERTA, J., BAURA, C., APPELB, D., BLANKB, I., STRESSLERA, T. and FISCHERA, L. Wheat gluten hydrolysis using isolated Flavourzyme peptidases: Product inhibition and determination of synergistic effects using response surface methodology. Journal of Molecular Catalysis B: Enzymatic, in press, 2015. [ Links ]
[32] WANG, L., ZHANG, B., HAN, J., ZHENG, Y., LI, J. and SAHN, A. Optimization of hydrolysis condition of blood meal by Bacillus subtilis with response surface methodology. International Biodeterioration and Biodegradation, 104, 2015, p. 112-117. [ Links ]













