Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.14 no.1 Popayán Jan./June 2016
https://doi.org/10.18684/BSAA(14)19-26
DOI: http://dx.doi.org/10.18684/BSAA(14)19-26
PRODUCCIÓN DE POLIHIDROXIALCANOATOS (PHAs) A PARTIR DE Ralstonia eutropha EN UN MEDIO CON HARINA DE YUCA COMO FUENTE DE CARBONO
PRODUCTION OF POLYHYDROXYALKANOATES (PHAs) FROM Ralstonia eutropha IN A MEDIUM OF CASSAVA FLOUR AS CARBON SOURCE
PRODUÇÃO DE POLIHIDROXIALCANOATOS (PHAS) UTILIZANDO Ralstonia eutropha NUM MEIO COM FARINHA DE MANDIOCA COMO FONTE DE CARBONO
ELIZABETH ROJAS FERNÁNDEZ1 , JOSÉ LUIS HOYOS CONCHA2, SILVIO ANDRÉS MOSQUERA SÁNCHEZ3
1Universidad del Cauca, Facultad de Ciencias Agrarias, Grupo de investigación Aprovechamiento de subproductos y residuos agroindustriales (ASUBAGROIN). Ingeniera agroindustrial. Popayán, Colombia.
2Universidad del Cauca, Facultad de Ciencias Agrarias. Grupo de investigación Aprovechamiento de subproductos y residuos agroindustriales (ASUBAGROIN). Magister en Ingeniería de alimentos, Especialista en Biotecnología, Ingeniero Agroindustrial. Popayán, Colombia.
3Universidad del Cauca, Facultad de Ciencias Agrarias, Grupo de investigación Ciencia y Tecnología de Biomoléculas de Interés Agroindustrial (CYTBIA). Ing. Industrial de Alimentos, M.SC. Ingeniería. Popayán, Colombia.
Correspondencia: jlhoyos@unicauca.edu.co
Recibido para evaluación: 20 de Noviembre de 2015. Aprobado para publicación: 31 de Mayo del 2016.
RESUMEN
Los polihidroxialcanoatos (PHAs) son poliésteres intracelulares sintetizados por diferentes especies bacterianas, las cuales los acumulan como gránulos cuando se encuentran en condiciones limitantes de nutrientes esenciales para su crecimiento como el oxígeno, nitrógeno y carbono, son biodegradables y, dependiendo de su composición química y estructural, pueden ser empleados en aplicaciones semejantes a los polímeros [1]. En la actualidad, este tipo de biopolímeros presentan un mayor costo comparado con los derivados del petróleo, pero el uso de fuentes renovables y el aprovechamiento de subproductos agroindustriales para la generación de nuevos productos es una alternativa ecológica de importancia mundial. En la presente investigación se estudió la producción de polihidroxialcanoatos (PHA) mediante fermentación bacteriana de glucosa, obtenida a partir de harina de yuca HMC1 empleando Ralstonia eutropha en un medio con cinco relaciones carbono/nitrógeno (12:1, 16:1, 20:1, 24:1, 28:1). Se obtuvo como resultado, que la relación carbono/nitrógeno de 20 es la que más favorece la acumulación intracelular de biopolímero, con la cual se alcanza una producción de 0,62 g/L de PHA. El PHA sintetizado se caracterizó por medio de calorimetría diferencial de barrido (DSC), Análisis Termogravimetrico (TGA), Espectroscopía de Infrarrojo con Transformada de Fourier (IR-FT) y Microscopía electrónica de Barrido (SEM), concluyendo que el biopolímero obtenido fue polihidroxibutirato (PHB).
PALABRAS CLAVE:Biopolímero, Fermentación, Carbono, Nitrógeno, Polihidroxibutirato (PHB).
ABSTRACT
The Polyhydroxyalkanoates (PHAs) are intracellular polyesters synthesized by different bacterial species. PHAs are accumulated as granules when bacterias don't find conditions for their growth, like oxygen and essential nutrients (nitrogen, carbon). PHA is biodegradable and depending on its chemical and structural composition can be used in similar applications to polymers [1]. At present this type of biopolymers have a higher cost compared to petroleum, but the use of renewable sources friendly to the environment or the use of agro-products for generating new products is a practice of global importance. The present investigation studied the production of polyhydroxyalkanoates (PHA) by bacterial fermentation of glucose obtained from HMC1 cassava flour using Ralstonia eutropha, using five different ratios carbon/nitrogen (12:1, 16:1, 20:1, 24:1, 28:1). The result showed the carbon/nitrogen ratio of 20 is the most favorable to the intracellular accumulation of biopolymer, with which a production of 0,62 g/L of PHA. The PHA was characterized PHA by differential scanning calorimetry (DSC), thermogravimetric Analysis (TGA), Infrared Spectroscopy with Fourier Transform (FT-IR) and scanning electron microscopy, obteining as conclusión that the polymer synthesized was polyhydroxybutyrate (PHB).
KEY WORDS:Biopolymer, Fermentation, Carbon, Nitron, Polyhydroxybutyrate (PHB).
RESUMO
Os polihidroxialcanoatos (PHAs) são poliésteres intracelulares sintetizados por diferentes espécies bacterianas, as quais acumula-os como grânulos quando encontram-se em condições limitantes de nutrientes essenciais para seu crescimento como o Oxigênio, Nitrogênio e Carbono. São biodegradáveis e dependendo da sua composição química e estrutural podem ser utilizados em aplicações semelhantes aos polímeros [1]. Na atualidade, este tipo de biopolímeros apresentam um maior custo comparado com os derivados do petróleo, mas o uso de fontes amigáveis com o meio ambiente ou o aproveitamento dos subprodutos agroindustriais para a geração de novos produtos é uma prática de importância mundial. Nesta pesquisa estudou-se a produção de polihidroxialcanoatos (PHA) através de fermentação bacteriana de glucose, obtida a partir da farinha de mandioca HMC1 utilizando Ralstonia eutropha num meio com cinco razões carbono/nitrogênio diferentes (12:1, 16:1, 20:1, 24:1, 28:1). Obteve-se que a razão Carbono/Nitrogênio de 20 é a mais favorável na acumulação intracelular de biopolímero, alcançando uma produção de 0,62 g/L de PHA. O PHA sintetizado caracterizou-se através de Calorimetría diferencial de barrido (DSC), Análises Termogravimetrico (TGA), Espectroscopia de Infrarrojo com Transformada de Fourier (IR-FT) e Microscopia electrónica de Barrido (SEM), concluindo assim que o biopolímero obtido foi o polihidroxibutirato (PHB).
PALAVRAS-CHAVE:Biopolímeros, Fermentação, Carbono, Nitrogênio, Polihidroxibutirato (PHB).
INTRODUCCIÓN
Los plásticos derivados del petróleo (sintéticos, no biodegradables), han sido utilizados desde la década de los 40, solo en Estados Unidos en el año 2009 se generaron 31 millones de toneladas entre plásticos, objetos duraderos, como electrodomésticos y objetos no duraderos como platos y tazas [2]. Los polihidroxialcanoatos (PHAs) son biopolímeros sintetizados por numerosas bacterias, son biodegradables y presentan propiedades termoplásticas y altos grados de polimerización, por lo que pueden ser moldeados como los polímeros no biodegradables, sin embargo cabe anotar que la producción de bioplásticos frente a la producción de plásticos derivados del petróleo tiene una gran desventaja con respecto a los costos de producción. Para 2005, producir por fermentación bacteriana un kilogramo de PHA costaba 15 dólares, mientras que; hacer un kilogramo de plástico convencional costaba sólo un dólar [3], es por esta razón que a través de los años se han propuesto diversos tipos de sustrato como una estrategia para reducir los costos de producción. En esta investigación se evaluó harina de yuca como sustrato, debido a que este producto forma parte de una de las cadenas productivas que existen en la región, es una materia prima de bajo costo y posee características composicionales que ofrece al microorganismo la cantidad de energía requerida para sus procesos metabólicos [4].
Entre los plásticos biodegradables más estudiados actualmente son los PHAs, y dentro de los cuales se encuentra el polihidroxibutirato PHB, como el más común. La Ralstonia eutropha es una de las bacterias más utilizadas en la producción de PHA, debido a que es capaz de almacenar hasta un 96% de este material en peso seco; con la ventaja de emplear fuentes de carbono y energía renovables como la fructosa y la glucosa, provenientes de subproductos agroindustriales [1].
La presente investigación tuvo como objetivos la obtención de polihidroxialcanoatos (PHAs) obtenidos a partir de Ralstonia eutropha en un sustrato elaborado con harina de yuca HMC1 y su respectiva caracterización térmica y microscópica.
MÉTODO
Materiales
Harina de Yuca.Se empleó Harina de yuca variedad HCM1, proveniente de la empresa Deriyuca, ubicada en la vereda la Agustina, municipio de Santander de Quilichao, con un tamaño de partícula de 150 µm y una humedad entre 11 y 13%.
Ralstonia eutropha. Cepa bacteriana crioconservada en las instalaciones del Laboratorio de Biotecnología de la Universidad del Cauca.
Métodos
Activación y crioconservación de Ralstonia eutopha. microorganismo acumulador se empleó la bacteria Ralstonia eutropha, la cual se activó en medio Tripticasa Soya (Triptona 17 g/L, Soytona o peptona de soya 3 g/L, Glucosa 2,5 g/L, Cloruro de sodio 5,0 g/L, Fosfato dipotásico de hidrógeno 2,5 g/L), basándose en la metodología descrita por Betancur [1], a condiciones de incubación de 32°C por 48 h. La crioconservación se llevó a cabo en glicerol al 15% para llevarse a temperaturas inferiores a 0°C [5].
Obtención de glucosa a partir de harina de yuca por hidrólisis enzimática. Para la obtención de glucosa a partir de harina de yuca se realizó una hidrólisis enzimática. Las enzimas utilizadas fueron BAN 480L con actividad de alfa – amilasa y DEXTROZIME GA del tipo Glucoamilasa (glucano 1,4 alfa-glucosidasa), con el objetivo de liberar el almidón retenido en la matriz compleja de fibra [6].
Se realizó una mezcla de harina en agua al 20% b.s., el pH de la mezcla fue 5,7 valor óptimo de pH, con adición de cloruro de calcio como cofactor, esta hidrólisis se mantuvo por 90 min a 65°C. Después de inactivar esta primera enzima por efecto de pH, se ajustó nuevamente el pH a 4,3 como condición óptima para la glucoamilasa empleada en la segunda etapa, donde se mantuvo a 62°C con agitación constante durante 18 horas.
El jarabe fue purificado empleando una columna con carbón activado para posteriormente determinar la cantidad de glucosa mediante el método DNS [7].
Fermentación bacteriana con Ralstonia eutropha. La fermentación se llevó a cabo durante 36 horas en un medio mineral mínimo de sales (MSM) [1] a 30°C, agitación de 150 rpm, utilizando como inóculo la bacteria cultivada en el medio enriquecido tripticasa soya (TSB) al 10%, la cual se centrifugó y lavó por duplicado con una solución isotónica al 0,9% durante 30 minutos a 4500 rpm. Como variables de respuesta se emplearon las pruebas de conteo en placa por el método NMP y turbidez para determinar biomasa y análisis mediante la técnica de DNS para consumo de sustrato.
Con el fin de inducir la formación intracelular del biopolímero en la bacteria se estableció una limitación nutricional en el medio, en este caso se limitó la fuente de nitrógeno y se suministró un exceso de fuente de carbono. A partir del balance de electrones y teniendo en cuenta las condiciones estequiométricas para desarrollar el proceso, se determinaron como relaciones a evaluar 12:1, 16:1, 20:1, 24:1, 28:1, usando como fuente de carbono jarabe de glucosa obtenido de la hidrólisis de harina de yuca y como fuente de nitrógeno sulfato de amonio.
Prueba de turbidez.Se realizó un seguimiento por espectofotometría, midiendo la turbidez de cada muestra a 500 nm cada 3 horas, relacionándolo con la densidad poblacional obtenida en la técnica de número más probable.
Técnica de número más probable.Para esta prueba la placa de Petri se dividió en cinco zonas de igual tamaño, en cada zona se sembraron 5 microgotas de 3 µL cada una, de cinco diluciones consecutivas, incubándolas a 30°C por 2 días. La población estimada se determinó con base a la tabla de número más probable para series de diluciones en réplicas de cinco por nivel de dilución [8], aplicando la fórmula correspondiente para calcular densidad poblacional de la muestra.
Determinación de consumo de sustrato mediante DNS.Este protocolo se empleó para determinar la concentración de azúcares reductores, para ello se empleó 1mL de la muestra obtenida de la fermentación a intervalos de 3 horas, llevada a una concentración de 800 ppm, luego se agregó 1 mL del reactivo de DNS y finalmente se agregaron 3 mL de agua destilada, los tubos se agitaron en vortex por 30 seg, se llevaron a ebullición por 5 minutos y se detuvo la reacción en baño de hielo durante 10 minutos, con el fin de realizar la lectura de las muestras en espectrofotómetro SHIMADZU UV-1800 a una longitud de onda de 500nm.
Extracción del biopolímero obtenido.Para la extracción del PHA se centrifugó el medio fermentado a 4500 rpm durante 15 min. La extracción se realizó empleando 5mL de ácido sulfúrico 0,1 M, se llevó a ebullición durante 1h, para nuevamente centrifugar y ajustar el pH a 10 con NaOH a una concentración de 5N [9]. Las muestras se secaron por 10 horas a 30°C [10]. El biopolímero fue decolorado con hipoclorito de sodio al 3%.
Caracterización térmica. Se realizó por Calorimetría de Barrido Diferencial (DSC), para determinar el tipo de polímero, las muestras fueron sometidas a un barrido térmico [11]. Se empleó un equipo de Calorimetría de Barrido Diferencial [TA Instruments, Q20, USA]. Se tomaron 5 mg del material y se depositaron en una cápsula de aluminio, una vez verificada la calidad del sellado en la cápsula, se sometió al ciclo de enfriamiento y calentamiento entre -50°C y 250°C a 20°C/min.
El análisis termogravimétrico (TGA) se llevó a cabo bajo una atmósfera controlada en un equipo TGA TA Instruments, Q50, USA, teniendo en cuenta la norma ASTM E 2402 a una tasa de calentamiento de 20°C/min desde 25 a 400°C.
Caracterización estructural. Para la prueba de Infrarrojo Espectral con Transformada de Fourier (IR-FT), se prepararon pastillas transparentes por medio de prensado, las cuales están compuestas por bromuro de potasio (secado a 100°C) y PHA altamente macerado. La pastilla se colocó en el compartimiento del equipo (Thermo Fisher Scientific, Niccolet 200. USA) y se procedió a hacer un barrido en toda la franja de infrarrojo. Finalmente se obtuvo el espectro para su posterior análisis.
Para la Microscopía electrónica de barrido (SEM) se cortaron y prepararon los pellets activos en una doble capa de bronce y luego se cubrieron con una fina capa de oro (40-50 nm), para observar el corte de la sección transversal de las diferentes superficies. Las muestras se examinaron usando un acelerador de voltaje de 5 kV y se mantuvieron a una humedad relativa constante de 68% y 23°C.
RESULTADOS
Activación de la bacteria
Transcurrido el tiempo de incubación, se evidenció en el medio TSB la formación de colonias de Ralstonia eutropha. El análisis microscópico se determinó por medio de tinción de Gram, donde se identificó la morfología de bacilo Gram negativo, a nivel macroscópico las colonias eran uniformes, de buen tamaño, color beige, bordes redondeados y traslúcidas.
Jarabe de glucosa a partir de la hidrólisis enzimática de harina de yuca
En las diferentes reacciones de hidrólisis enzimática de harina, se observó un cambio de color, de blanco a café claro, a medida que transcurría el tiempo; debido a la generación de dextrosas y algunos carbohidratos producto de la reacción de hidrólisis [6].
El mayor grado de hidrólisis se alcanza en condiciones óptimas de trabajo para las dos enzimas empleadas, durante las cuales la hidrólisis alcanza entre un 10 y 12% de equivalente de dextrosa en primera fase (reacción enzimática con α-amilasa), posteriormente se observa una velocidad de conversión más lenta mostrando estabilidad luego de 16 horas y alcanzando el mayor grado de hidrólisis en la hora 18, con esto se determinó el mejor tiempo de reacción. Por lo tanto los factores más importantes en la obtención de glucosa a partir de harina de yuca por vía enzimática son la concentración de enzima y el tiempo de reacción, la temperatura no influyó de forma directa, debido a que se trabajó en el rango de acción enzimática, alcanzando así un equivalente de dextrosa del 79%.
Fermentación bacteriana y extracción del biopolímero
Los pesos obtenidos en la extracción del biopolímero de cada uno de los tratamientos, se evaluaron mediante un diseño completamente al azar, donde el factor a evaluar fue la relación carbono/nitrógeno. La prueba de promedios de Tukey para los cinco tratamientos, realizada mediante el programa SPSS 20,0. Arrojó tres subconjuntos homogéneos, los cuales presentaron diferencias estadísticamente significativas con un α=0,05, tal como se muestra en el Cuadro 1.
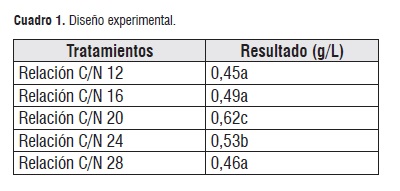
Entre los tratamientos evaluados, la mejor relación de C/N fue 20, con mayor producción de biopolímero de 0,62 g/L, la cual es bastante significativa al ser comparada con la producción reportada por autores de 0,28 g/L de sustrato [12].
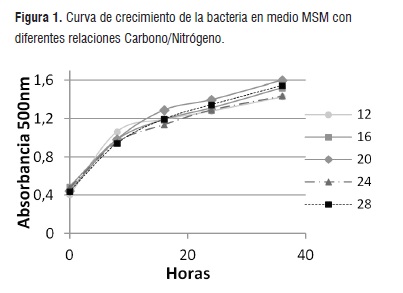
Prueba de turbidez. Durante esta prueba se estableció que durante las primeras 8 horas de fermentación la bacteria se adapta al medio MSM iniciando su fase exponencial y el consumo de sustrato, al tiempo empieza la acumulación del biopolímero (Figura 1) debido a la limitación del nitrógeno y el exceso de glucosa como fuente de carbono presente en el medio.
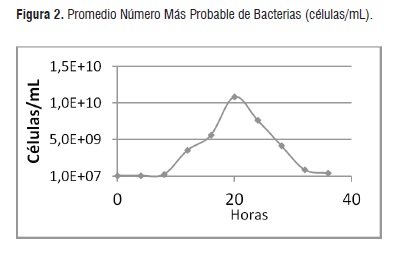
Técnica de número más probable. En las diferentes relaciones C/N, se inició con una concentración celular de 7,67x106 cel/mL, al cabo de las 20 horas cuando se inicia la fase estacionaria el número máximo de células generadas es de 9,00x109 cel/mL luego de este tiempo, la cantidad de células viables se mantuvo y descendió paulatinamente, tal como se observa en la Figura 2.
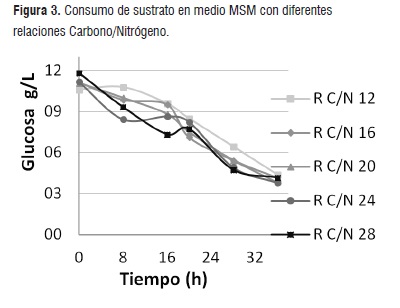
Determinación de consumo de sustrato mediante DNS. Luego de 20 horas de fermentación, la bacteria inicia la fase estacionaria en la cual se dió un equilibrio entre las bacterias generadas y las células no viables, por tal razón las bacterias que permanecen, consumen la fuente de carbono rápidamente con el fin de sobrevivir y generar reservas en su organismo (PHA). Como se evidencia en la Figura 3, a las 36 horas persiste la glucosa en el medio, sin embargo la turbidez muestra que la bacteria lleva 16 horas en fase estacionaria, lo cual indica que si se continúa con el proceso de fermentación es posible que la R. eutropha empiece a utilizar las reservas que tiene en su organismo para sobrevivir, lo cual no es conveniente, ya que las reservas de la bacteria son el material polimérico que se desea obtener.
Caracterización térmica
El polihidroxialcanoato extraído y purificado presenta un color opaco atribuido al tipo de sustrato utilizado en su obtención y al tipo de cristalinidad. El resultado de la calorimetría diferencial de barrido se muestra en la Figura 4. La totalidad de las muestras presentaron una temperatura de transición vítrea alrededor 146°C con lo cual se deduce la presencia de un polímero, al realizar la comparación con lo reportado en la literatura [13]. Se observa que el material obtenido es similar a polihidroxibutirato, uno de los tipos más conocidos de polihidroxialcanoatos.
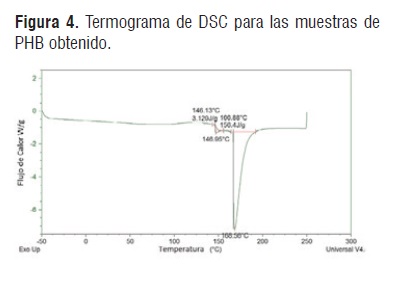
El termograma permitió encontrar la temperatura de fusión del polihidroxibutirato, integrando el área bajo la curva se encontró que la temperatura de fusión del biopolímero fue de 168,58°C, correspondiente a P(3HB), el cual tiene una temperatura de fusión de 170°C, como se observa en la Figura 5, la línea negra representa el DSC para un patrón de PHB. Este resultado se atribuye al tipo de microorganismo empleado.
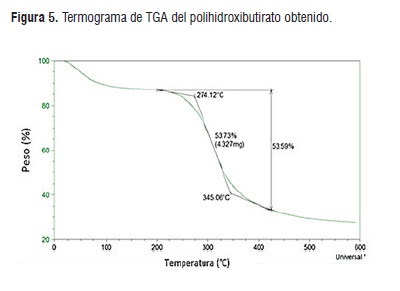
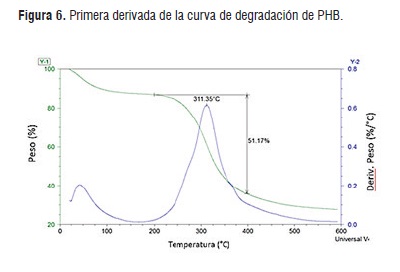
El análisis termogravimétrico o TGA (Figura 6) muestra las temperaturas de descomposición debido a la tensión térmica, el polihidroxibutirato obtenido, arrojó como resultado que el biopolímero presenta una temperatura de descomposición de 274,12°C, con una curva en caída que comienza a 245°C y termina en 410°C, en la curva no se muestra picos u hombros diferentes a lo esperado ni reportado hasta el momento, por lo tanto, se deduce que es inexistente la presencia de impurezas o compuestos ajenos al PHB. La temperatura de descomposición de los PHBs se encuentra a 277°C, temperatura similar con la obtenida experimentalmente, la poca variación que existe se debe al tipo de microorganismo utilizado y a la complejidad del sustrato [14].
Caracterización estructural
En la Figura 7 se presenta el espectro FTIR del PHB, el cual muestra las bandas más importantes para biopolímero a 1726 cm-1, teniendo características similares del estiramiento del enlace C=O en compuestos orgánico (carbonílicos), además se observaron una serie de bandas intensas entre 1000 y 1300 cm-1, producidas por estiramiento del enlace C-O del grupo éster, los cuales conforman los monómeros de ésteres. Asimismo, se presentaron bandas intensas a 1456 cm-1; debida a la deformación asimétrica del enlace CH3, las otras bandas en el rango de 1000 a 1500 cm-1 son ocasionadas por vibraciones o al estiramiento del enlace CH2, se observó además una banda ancha entre 3000 y 3300 cm-1, ocasionada por moléculas de agua [9].
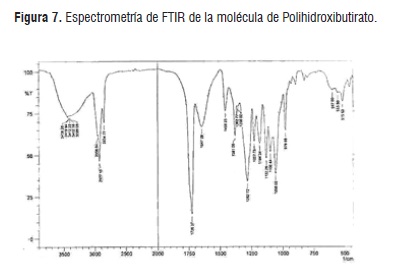
El análisis de las muestras obtenidas por FTIR permitió confirmar el material obtenido es PHB, debido a las coincidencias que se encontraron en las bandas características del biopolímero con los hallazgos de otros investigadores, además, coincidió con el análisis de la caracterización térmica [15, 16].
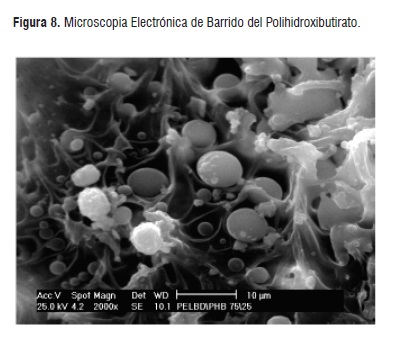
La prueba de Microscopia electrónica de barrido (SEM), permitió determinar, la forma, tamaño y distribución del material lo cual es útil para seguir una cinética de formación, dispersión y compatibilidad de las fases presentes y estudios de degradación del biopolímero. En la Figura 8, se muestra la microfotografía del polihidroxibutirato obtenido por medio de fermentación a partir de hidrolizado de harina de yuca, donde se aprecian los granos de PHB de forma simétrica, con un tamaño aproximado de 1-2µm de longitud, fusionados entre sí formando una matriz polimérica dispersa.
CONCLUSIONES
Mediante el proceso de hidrólisis enzimática, para la obtención de jarabe de glucosa a partir de harina de yuca, se logró obtener un equivalente de dextrosa del 79%, corroborando el alto para el establecimiento y crecimiento de la bacteria en el medio de fermentación.
La producción de PHA utilizando jarabe de glucosa, se dió en mayor proporción al emplear una relación carbono/nitrógeno de 20, con la cual se obtuvieron 0,62 g/L del biopolímero, una cantidad considerable ya que en otras investigaciones se reportan valores de hasta 0,28 g/L.
El polímero sintetizado por R. eutropha, usando como fuente de carbono hidrolizado de harina de yuca es un tipo PHA, el cual fue caracterizado por calorimetría de barrido diferencial y espectroscopía de infrarrojo, con lo que se puede concluir que es del tipo polihidroxibutirato.
AGRADECIMIENTOS
A la Universidad del Cauca y al Departamento Administrativo de Ciencia, Tecnología e Innovación (Colciencias).
REFERENCIAS
[1] BETANCUR, M. y AGUDELO, L.M. Producción de biopolímeros (polihidroxialcanoatos - PHAs) a partir de una cepa comercial empleando sustratos no convencionales [Tesis Maestría en Ingeniería]. Medellín (Colombia): Universidad de Antioquia, Facultad de Ingeniería, 2011, 103 p. [ Links ]
[2] SERRANO, J. Polihidroxialcanoatos (PHAs): Biopolímeros producidos por microorganismos, una solución frente a la contaminación del medio ambiente. Teoría y praxis investigativa, 5(2), 2010, p. 79-84. [ Links ]
[3] MEDINA, R. Plásticos Biodegradables [online]. 2005. Disponible: http://www.cientec.or.cr/ambiente/pdf/plasticos_biodegradables2005-CIENTEC.pdf. [citado 10 de marzo de 2015] [ Links ]
[4] ALARCON, F. y DUFOUR, D. Almidón agrio de yuca en Colombia [online]. 2002. Disponible: http://webapp.ciat.cgiar.org/agroempresas/pdf/almidon_agrio_1.pdf. [Citado Septiembre 10 de 2015] [ Links ].
[5] SIMIONE, F. Cryopreservation manual. New York (USA): Nalge Nunc International Corp., 1998. [ Links ]
[6] BENÍTEZ. R, et al. Hidrolizados de proteína: procesos y aplicaciones. Acta Bioquímica Clínica Latinoamericana, 42(2), 2008, p. 27-36. [ Links ]
[7] MILLER G.L. Use of Dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, 31, 1959, p. 426-428. [ Links ]
[8] S.A. Enumeración bacteriana: El numero mas probable [online]. 2013. Disponible: http://www.uprm.edu/biology/profs/massol/manual/p4-nmpenumeracion.pdf. [citado 20 de enero de 2016] [ Links ]
[9] ABHISHEK, D.T., SURESH, K.S. and RAVI, P.S. Statistical optimization of physical process variables for bio-plastic (PHB) production by Alcaligenes sp. Biomass and bioenergy, 55, 2013, p. 243– 250. [ Links ]
[10] PATNAIK P. Enhancement of PHB biosynthesis by ralstonia eutropha in fed-batch cultures by neural filtering and control. Food and Bioproducts Processing, 84, 2012, p. 150–156. [ Links ]
[11] HÖFER, P., VERMETTE, P. and GROLEAU, D. Production and characterization of polyhydroxy alkanoates by recombinant Methylo bacterium extorquens: Combining desirable thermal properties with functionality. Biochemical Engineering Journal, 54, 2011, p. 26–33. [ Links ]
[12] BARBOSA, M., ESPINOSA, A., MALAGÓN, D. y MORENO, N. Producción de poli-β-hidroxibutirato (PHB) por Ralstonia eutropha ATCC 17697. Universitas scientiarium, Revista de la Facultad de Ciencia Pontificia Universidad Javeriana, 10(1), 2005, p. 45–54.
[13] ERCEG, M., KOVACIC, T. and KLARIC, I. Thermal degradation of poly (3-hydroxybutyrate) plasticized with acetyl tributyl citrate. Polymer degradation and stability, 90(2), 2005, p. 313–318. [ Links ]
[14] MOUSAVIOUN, P., HALLEY, P.J. and DOHERTY, W. Thermophysical properties and rheology of PHB/lignin blends. Industrial crops and products, 50, 2013, p. 270–275. [ Links ]
[15] PANDIAN, R.K., DEEPAK, V., KALISHWARALAL, K., MUNIYANDI, J., RAMESHKUMAR, N. and GURUNATHAN, S. Synthesis of PHB nanoparticles from optimized medium utilizing dairy industrial waste using Brevibacterium casei SRKP2: a green chemistry approach. Colloids and Surfaces Biointerfaces, 74(1), 2009, p. 266–273. [ Links ]
[16] LUO, R., CHEN, J., ZHANG, L. and CHEN, G. Polyhydroxyalkanoate copolyesters produced by Ralstonia eutropha PHB-4 harboring a low-substrate-specificity PHA synthase PhaC2 from Pseudomonas stutzeri 1317. Biochemical Engineering Journal, 32, 2006, p. 218–225. [ Links ]













