Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.14 no.2 Popayán Jul./Dec. 2016
https://doi.org/10.18684/BSAA(14)38-46
DOI: http://dx.doi.org/10.18684/BSAA(14)38-46
ESTANDARIZACIÓN DE UN PROTOCOLO DE DESINFECCIÓN Y ESTABLECIMIENTO DE CULTIVO In vitro DE Aloysia tryphilla
PADRONIZAÇÃO DE PROTOCOLO DE DESINFECÇÃO E ESTABELECIMENTO IN VITRO DE CULTIVO DE Aloysia tryphilla
STANDARIZED DISINFECTION PROTOCOL AND In vitro CULTURE ESTABLISHMENT OF Aloysia tryphilla
JUAN CARLOS BEDOYA-PÉREZ1, CLAUDIA YANETH SÁNCHEZ JARAMILLO2, SANDRA MILENA BERMUDEZ GÓMEZ3,SARA RAMIREZ RESTREPO 4
1Institución Universitaria Colegio Mayor de Antioquia, Facultad de Ciencias de la Salud, Grupo de Investigación en Biociencias (GIB). M. Sc. Biotecnología. Medellín, Colombia.
2Politécnico Colombiano Jaime Isaza Cadavid, Facultad de Ciencias Básicas, Grupo de Investigación en Química Básica y Aplicada a Procesos Bioquímicos, Biotecnológicos y Ambientales (QUIBA). M. Sc. Química. Medellín, Colombia.
3Institución Universitaria Colegio Mayor de Antioquia, Facultad de Ciencias de la Salud, Grupo de Investigación en Biociencias (GIB). Biotecnóloga. Medellín, Colombia
4Institución Universitaria Colegio Mayor de Antioquia, Facultad de Ciencias de la Salud, Grupo de Investigación en Biociencias (GIB). Biotecnóloga. Medellín, Colombia.
Correspondencia: juan.bedoya@colmayor.edu.co
Recibido para evaluación: 24 de Abril de 2015. Aprobado para publicación: 13 de Julio de 2016.
RESUMEN
Las propiedades fitoquímicas del aceite esencial (AE) producido por Aloysia triphylla (LHér.) Britton (Verbenaceae), le han permitido posicionarse en el mercado global de plantas aromáticas y medicinales. Sus altas demandas y bajo rendimiento en el proceso de extracción a partir de hojas secas han conducido a su sobre-explotación. Las técnicas de micro-propagación representan una alternativa para su producción. El objetivo de este trabajo fue la determinación de condiciones necesarias para el establecimiento de cultivos In vitro de esta especie. Los resultados obtenidos indican que el proceso de desinfección de explantes es determinante, y se encontró que la inmersión de hojas en HgCl2 al 0,2% p/v durante cinco (5) minutos permite la obtención de más de un 80% de explantes viables y libres de contaminación. Además, se logró la generación de callos friables usando 4 mg/L de 6-bencil amino purina (BAP) bajo condiciones de oscuridad. Finalmente, se obtuvieron muy buenos resultados (86,3 ± 6,7%) en la producción de plántulas In vitro con 2,0 mg/L de benciladenina (BA). Estos resultados muestran la viabilidad de utilizar las técnicas de cultivo In vitro para la producción de AE a partir de A. triphylla, aunque aún deben ser evaluados los rendimientos del AE en términos de calidad y productividad.
PALABRAS CLAVE:
Aceite esencial, Micropropagación, Planta aromática.
ABSTRACT
Aloysia triphylla (LHér.) Britton (Verbenaceae) produces an essential oil (EO) whose phytochemical properties have enabled it to position itself in aromatic and medicinal plants global market. This EO is currently produced by extraction from dried leaves. However, the yield of this technique is very low to meet the demand, which have led to over-exploitation. As an alternative, micropropagation techniques might become an attractive opportunity. The main aim of this work was to determine the necessary conditions for In vitro cultures establishment of this species. The results indicate that the explants disinfection process is crucial and, in this regard, it was demonstrated that the immersion of leaves in 0,2% w/v HgCl2 solution for five (5) minutes allowed obtaining more than 80% viable and uncontaminated explants. Furthermore, induction of friable calluses formation process was achieved under dark conditions, using 4 mg/L of 6-benzyl-amino-purine (BAP) as a growth regulator. Finally, satisfactory results (86,3 ± 6,7%) were obtained for In vitro plantlets using 2,0 mg/L benzyladenine (BA). The above results show the feasibility of using tissue culture techniques for the production of AE from A. triphylla; however, EO yields are still remaining to be evaluated in terms of quality and productivity.
KEYWORDS:Essential oil, Micropropagation, Aromatic plant.
RESUMO
As propiedades fitoquímicas do óleo essencial (OE) producido por Aloysia triphylla (LHér.) Britton (Verbenaceae) permitiram-lhe posicionar-se no mercado global de plantas aromáticas e medicinais. A maior parte da sua produção é por extração a partir das folhas secas. Os rendimentos obtidos por esta técnica são baixos, o que adicionado a uma demanda elevada, levaram à sua sobre-exploração. As técnicas de micropropagação são uma oportunidade atraente para a sua produção. Neste trabalho foram determinadas condições para o estabelecimento de cultivos in vitro de A. triphylla. Os resultados indicam que o processo de desinfecção de explantes é decisivo. Neste sentido, verificou-sé que a imersão de folhas em HgCl2 0,2% p/v por cinco (5) minutos permite a obtenção de mais de 80% de explantes viáveis e livres de contaminação. A obtenção de calos friáveis foi alcançada em condições de pouca luz e utilizando 4 mg/L de 6-benzil-amino-purina (BAP). Finalmente, bons resultados foram obtidos na obtenção de plântulas (86,3 ± 6,7%) utilizando 2,0 mg/L de benziladenina (BA). Estes resultados mostram a possibilidade de utilizar técnicas de cultivo de tecidos em produção de OE de A. triphylla. No entanto, estudos devem ser realizados para avaliar o rendimento de OE em termos de qualidade e produtividade.
PALAVRAS-CHAVE:Óleo essencial, Micropropagação, Planta aromática.
INTRODUCCIÓN
Durante siglos la medicina tradicional ha utilizado plantas medicinales y aromáticas en la prevención y tratamiento de numerosas enfermedades. La capacidad que tienen estas plantas para producir gran variedad de sustancias con características especiales ha llamado la atención de industrias farmacológicas, cosméticas y alimenticias [1]. Hoy existe alta y creciente demanda de este tipo de metabolitos, creando un negocio multimillonario alrededor de su explotación. Esto, ha creado la necesidad de intensificar el cultivo de plantas medicinales y aromáticas buscando altos índices de producción a bajos costos [2, 3]. Sin embargo, los bajos rendimientos, los altos costos de producción, la baja disponibilidad de material vegetal, entre otros, son factores que limitan la obtención de este tipo de sustancias e incentiva la búsqueda de sustitutos y otras alternativas de producción [4].
Aloysia triphylla (LHér.) Britton, también conocida como Lippia citriodora (Lam) Kunth; Lippia triphylla (L`Hér) Kuntze; Aloysia citriodora L., y popularmente como Cedrón, Lemon verbena o Hierba luisa [5], es una planta aromática perteneciente a la familia de las Verbenáceas que produce un aceite esencial (AE), con fuerte y característico olor a limón, cuyos principales componentes son Geranial, Neral y Limoneno [6]. Por sus características y propiedades, éste ha sido utilizado como estomáquico, digestivo, antiespasmódico, ansiolítico, antioxidante, antidepresivo, expectorante, carminativo, antiestresante, diurético y en tratamientos de hipertensión arterial [7, 8, 9, 10].
En la actualidad, el AE de A. triphylla es obtenido principalmente por extracción mediante arrastre con vapor a partir de hojas de plantas silvestres y cultivadas en campo. La concentración de AE en partes aéreas de la planta, al igual que en la mayoría de plantas aromáticas, oscila entre 0,2 y 1% en peso, de acuerdo a las condiciones medioambientales, estado de desarrollo de la planta, época del año y genotipo utilizado [11, 12, 13]. La demanda creciente e insatisfecha de los metabolitos que son sintetizados por esta planta ha generado su sobreexplotación, y en países como Paraguay, Chile e Italia, ha conducido hacia el establecimiento de grandes cultivos [6].
Debido al escaso o nulo poder germinativo de sus semillas, la multiplicación de A. triphylla es, normalmente de tipo vegetativo, mediante esquejes, acodos o división de pies [14]. Sin embargo, estos procesos son bastante lentos y la obtención de grandes cantidades de hojas para la extracción del AE puede verse muy limitada. En este sentido, toma importancia la búsqueda de alternativas benéficas, confiables y seguras para la propagación de esta planta aromática y la producción de sus metabolitos bajo condiciones controladas [15, 16].
Como primera aproximación al establecimiento de cultivos In vitro de A. triphylla, el objetivo de esta investigación consistió en identificar un protocolo adecuado para la desinfección de explantes de A. triphylla, etapa previa y necesaria para la producción de plántulas e inducción de callogénesis. Los resultados obtenidos servirán como soporte para la posterior evaluación de la producción In vitro de plantas de A. triphylla y la caracterización, composición y calidad de sus AEs respecto al aceite producido por plantas cultivadas en campo.
MÉTODO
Material vegetal y explantes
Las plantas de A. triphylla fueron obtenidas en el vivero Tierra Negra del municipio de la Medellín, Antioquia, Colómbia, y mantenidas bajo condición de invernadero en la Institución Universitaria Colegio Mayor de Antioquia. Inicialmente, se realizó una única aspersión, en suelo y parte foliar de las plantas, con solución acuosa del fungicida sistémico Fosetal 80WP al 0,1% p/v. Durante cada dos días, y por un periodo de 16 días, fueron realizadas aspersiones con una solución de Benomil 50 WP al 2% p/v. Para el establecimiento del cultivo In vitro, se utilizaron como explantes hojas jóvenes, sanas y, sin daño mecánico aparente. Los explantes fueron cortados con materiales previamente autoclavados y transportados al laboratorio en recipientes estériles.
Preparación del medio de cultivo
Se utilizó el Medio Basal MS [17] suplementado con 30g/L de sacarosa y gelificado con 3 g/L de Phytagel. El pH del medio fue ajustado a 5,8 con NaOH 0,1 N y HCl 0,1 N, antes de esterilizar, y autoclavado a 121°C por 15 minutos.
Desinfección del material vegetal
Se evaluaron nueve (9) protocolos de desinfección. Antes de realizar cada protocolo de desinfección, el material vegetal fue prelavado mediante inmersión en una solución 1:200 de detergente aniónico comercial en agua destilada estéril durante un (1) minuto. Posteriormente, se realizaron tres lavados con una solución de ácido ascórbico en agua destilada estéril (0,05 mg/L) para prevenir la oxidación de los explantes.
Protocolo 1. Los explantes se sumergieron en seis (6) soluciones diferentes: 1. NaClO al 1%, un (1) minuto. 2. Etanol al 70%, 30 segundos. 4. Agua destilada estéril con 2 gotas de Tween80, un (1) minuto. 5. Agua destilada estéril con 1 gota de Tween 80, un (1) minuto. 6. Agua destilada estéril con fungicida Benomil 2 g/L y bactericida Gentamicina 2 ppm, un (1) minuto. Luego de cada inmersión, los explantes fueron lavados tres (3) veces con una solución de ácido ascórbico 2 ppm en agua destilada estéril.
Protocolo 2. Propuesto por Marulanda e Isaza (2004) [18], con algunas modificaciones. Los explantes se sumergieron en tres (3) soluciones diferentes: 1. Etanol al 70%, un (1) minuto. 2. NaClO al 1%, 15 minutos. 3. NaClO al 0,5%, 10 minutos. Luego de cada inmersión, los explantes fueron lavados tres (3) veces con agua destilada estéril.
Protocolo 3. Propuesto por El-Hawary y colaboradores (2012) [15]. Los explantes fueron sumergidos en una solución de HgCl2 al 0,2% p/v durante 5 minutos. Posteriormente, los explantes fueron lavados tres (3) veces con agua destilada estéril.
Protocolos 4 al 9. Propuesto por Ramírez y colaboradores (2002) [19], con algunas modificaciones. Los explantes fueron tratados con diferentes concentraciones de NaClO a tiempos de exposición diferente Cuadro 1. Finalmente, los explantes fueron lavados tres (3) veces con agua destilada estéril.
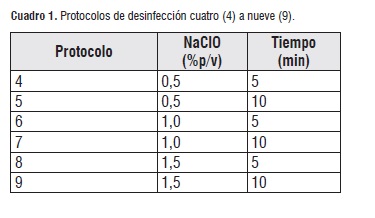 Cuadro 1
Cuadro 1Luego de efectuado el protocolo de desinfección, los explantes fueron sembrados en Medio Basal MS y mantenidos a 25°C bajo condiciones de fotoperiodo (12 horas luz, 12 horas oscuridad) durante 30 días.
Análisis estadístico para el protocolo de desinfección
Los resultados obtenidos fueron analizados mediante análisis de varianza (ANOVA) utilizando el programa Statgraphics Centurión XV.I para un diseño estadístico por bloques aleatorizados. Como variable independiente se definió el protocolo de desinfección (tratamiento) y como variables respuesta se establecieron el número de explantes muertos, viables y contaminados. Cada tratamiento contó con 30 unidades experimentales y con una repetición en el tiempo. La diferencia de medias entre tratamientos fue analizadas mediante la prueba de Tukey con un nivel de significancia del 5% (P<0,05).
Callogénesis
Se utilizaron hojas como explantes. Los dos (2) protocolos de desinfección que mostraron mejores resultados fueron utilizados en esta etapa. La composición del medio de cultivo fue el descrito en la sección 2.2, suplementado con diferentes concentraciones y combinaciones de ácido naftalenacético (ANA) y de 6-bencilaminopurina (BAP) (cuadro 2). Los explantes fueron mantenidos a 25°C y se evaluaron dos (2) condiciones lumínicas. El análisis de los datos se basó en un diseño factorial completamente aleatorizado con 20 réplicas por tratamiento y una repetición en el tiempo.
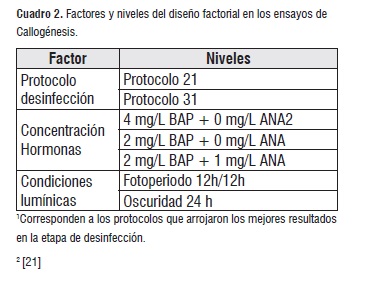 Cuadro 2
Cuadro 2Establecimiento In vitro de plántulas
Se utilizaron como explantes segmentos nodales. Al igual que en el proceso de inducción de callos, se utilizaron dos (2) protocolos de desinfección. Como inductores de crecimiento se evaluaron diferentes concentraciones de benziladenina (BA) (0,0; 1,0; 2,0; 3,0; y 4,0 mg/L) [20, 21]. Los explantes fueron mantenidos a 25°C y condiciones de fotoperiodo 12 h/12 h luz-oscuridad. El análisis de los datos se basó en un diseño factorial completamente aleatorizado con 20 réplicas por tratamiento y una repetición en el tiempo.
RESULTADOS
Protocolo de desinfección
Los mayores porcentajes de contaminación obtenidos (94,4 ± 5,1; 77,8 ± 10,2; 76,7 ± 3,3; 60,0 ± 6,7 y 70,0 ± 6,7) correspondieron a los tratamientos en que se utilizó NaClO como único agente desinfectante (Protocolos 4 a 8, respectivamente) (Fig. 1). En general, al incrementar la concentración de hipoclorito de sodio y el tiempo de exposición, el número de explantes contaminados disminuyó. Sin embargo, esto se tradujo en un incremento del número de explantes muertos. Con el protocolo 9, se logró reducir la contaminación a un nivel aceptable del 26 ± 3,5%. No obstante, la mortalidad causada por este tratamiento (58,9 ± 5,1%) superó en más de dos (2) veces la obtenida en los tratamientos que solo emplearon NaClO como agente desinfectante. Esto puede ser atribuido al elevado grado de oxidación de los explantes generado por la alta concentración de NaClO (1,5%) y el mayor tiempo de exposición del explante (10 min).
Los mejores resultados fueron obtenidos con los protocolos 1, 2 y 3 con porcentajes de contaminación del 21,1 ± 6,9; 14,4 ± 5,1 y 10,0 ± 3,3%, respectivamente. Los resultados obtenidos en los tratamientos 1 y 2 evidencian que la combinación de NaClO y Etanol al 70% presentan una gran alternativa en la desinfección de explantes [24]. No obstante, el alto grado de manipulación de explantes (Protocolo 1) y el alto tiempo de exposición a las soluciones utilizadas (Protocolo 2), favoreció la oxidación incrementando el número de explantes muertos (51,1 ± 8,4 y 33,3 ± 6,7%, respectivamente). Aunque en términos de viabilidad, los resultados obtenidos con los tratamientos 1 y 2 no indicaron diferencia estadística significativa, el alto grado de oxidación de los explantes generado por el tratamiento 1 podría afectar considerablemente la obtención de cultivos In vitro de A. triphylla.
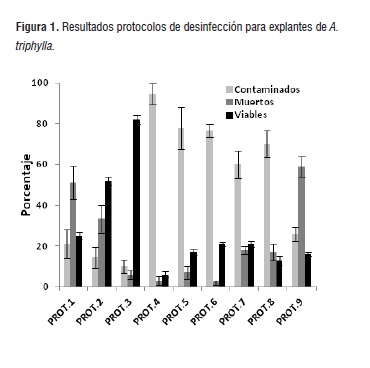 Figura 1
Figura 1El Protocolo 3 mostró los mejores resultados en términos de viabilidad, contaminación y mortalidad. Los resultados obtenidos en esta investigación, muestran niveles de contaminación inferiores (<15%) a los reportados por El-Hawary y colaboradores (2012). Esto indica que la utilización del cloruro de mercurio (HgCl2) como agente desinfectante constituye un método simple, rápido y eficaz para la obtención de explantes viables y libres de contaminación (>80%). Sin embargo, su utilización continúa siendo polémica por su alta toxicidad y elevado nivel de contaminación ambiental.
Callogénesis
Las Figura 2 y 3 muestran los resultados obtenidos para cada uno de los tratamientos utilizados para el establecimiento de callos In vitro. 4 mg/L de BAP favoreció la inducción y desarrollo de células indiferenciadas para la especie A. triphylla. Con esta concentración, el brote de callos se registró en más del 35% (Protocolo 2) y 60% (Protocolo 3) de los explantes utilizados. Sin importar las condiciones de luminosidad que se emplearon en esta investigación, se encontraron diferencias significativas (p&0,05) en el número de callos generados al emplear este tratamiento con respecto a aquellos en los que se utilizó BAP 2 mg/L y la combinación de hormonas BAP 2 mg/L y ANA 1 mg/L.
En general el número de callos obtenidos en cada uno de los tratamientos utilizados fue menor al emplear el protocolo 2 de desinfección. Aunque en este aspecto se obtuvieron diferencias estadísticas significativas respecto a aquellos en los que se utilizó el protocolo 3, cabe anotar que el porcentaje de explantes muertos fue mayor en el primer caso (datos no mostrados). Sin embargo, de acuerdo con los resultados obtenidos, puede afirmarse que la mejor combinación en términos de callogénesis, consistió en emplear el protocolo de desinfección con HgCl2 y una concentración de 4mg/L de BAP. En este caso específico, la inducción de callos es favorecida en un ambiente de oscuridad permanente. Igualmente, al utilizar el protocolo 2 de desinfección, con medio suplementado con 4 mg/L de BAP y bajo condiciones de oscuridad, se observó aparición de callos en un muy alto porcentaje de explantes (60,0 ± 4,5 %).
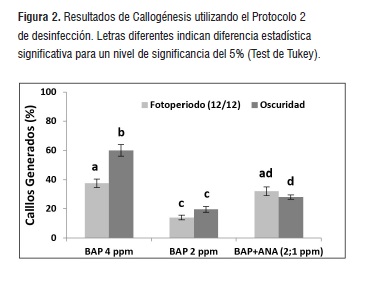 Figura 2
Figura 2
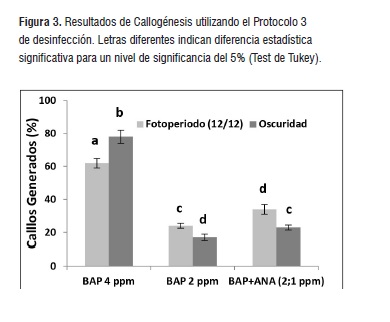 Figura 3
Figura 3Establecimiento del cultivo In vitro de plántulas de A. triphylla
Los datos obtenidos se muestran en la Cuadro 3. En todas las concentraciones de BA evaluadas en esta investigación, incluso en el control (sin BA), se observó formación de brotes y raíces. Con una concentración de 2,0 mg/L de BA, se logró inducir la formación de brotes en un 86,3 ± 6,7% de los explantes, generar un alto número de brotes por explante (7,8±0,8) y una alta longitud de sus raíces (8,3±1,6 cm). Aunque los resultados obtenidos con concentraciones de 2,0 y 3,0 mg/L de BA, no mostraron diferencia estadística significativa, la utilización de una menor cantidad de hormona favorece la economía del proceso de producción de callos.
Si bien, esta investigación representa una fase inicial del establecimiento de cultivos In vitro de A. triphylla, los resultados indican alta probabilidad de éxito en el proceso de micropropagación de esta especie. En general, los porcentajes obtenidos en términos de desinfección, inducción de callogénesis y obtención de plántulas se encuentran por encima del 70%. Un resultado comparable con los niveles obtenidos en investigaciones realizadas con ésta y otras especies aromáticas y medicinales [15, 18, 19, 22, 23, 24, 25, 26, 27].
Sin embargo, aún deben realizarse estudios que permitan determinar la viabilidad técnica y económica de extraer el AE de A. triphylla a partir de cultivos de células indiferenciadas o plántulas cultivadas In vitro. Algunos trabajos publicados indican que es posible, en términos de rendimiento, calidad y actividad, mejorar la efectividad de obtención de AEs utilizando las técnicas de cultivo In vitro [23, 27, 28] e incrementar la velocidad de producción de explantes que han sido establecidos previamente In vitro respecto a aquellos colectados directamente en campo [26]. No obstante, en el caso de organogénesis u obtención de plántulas a partir de células indiferenciadas (callos) existe la posibilidad de variabilidad genética. Esto exige la realización de estudios para determinar la uniformidad en la composición del AE obtenido a través de callos o plantas regeneradas a partir de callos. Es preciso anotar que la composición fitoquímica de un AE determina su efectividad, y ésta es fuertemente dependiente del genotipo utilizado, de las condiciones del cultivo y del método de extracción empleado [23, 29, 30, 31, 32].
CONCLUSIONES
Para la desinfección de explantes, los mejores resultados fueron obtenidos con HgCl2 al 0,2% con menos de un 20% de contaminación. La combinación de etanol e hipoclorito de sodio permitió niveles de contaminación inferiores al 50% mostrándose como una alternativa viable para la especie A. triphylla. Sin embargo, el uso de este protocolo afectó la obtención de callos por ser un procedimiento que exige alta manipulación de los explantes y utilización de sustancias que favorecen su oxidación.
En el proceso de inducción de callogénesis, el tratamiento que generó mejores resultados fue la adición al medio de BAP a una concentración de 4 mg/L. Bajo estas condiciones se lograron obtener callos a partir de más de un 70% de los explantes. Igualmente, la generación de callos a partir de hojas jóvenes de A. triphylla bajo condiciones de oscuridad incrementó en 30% respecto al porcentaje obtenido bajo condiciones de fotoperiodo.
Una concentración de 2,0 mg/L de BA, permitió la generación In vitro de plantas de A. triphylla con formación de brotes en el 86,3 ± 6,7% de los casos con una media de 7,8 ± 0,8 brotes y 5,5 ± 0,6 raíces por explante.
AGRADECIMIENTOS
Universitaria Colegio Mayor de Antioquia y al Politécnico Colombiano Jaime Isaza Cadavid, y al programa Jóvenes Investigadores de Colciencias, Convocatoria Nacional 566-2012 por el apoyo brindado.
REFERENCIAS
[1] OLMEDO, R., ASENSIO, C. and GROSSO, N. Thermal stability and antioxidant activity of essential oils from aromatic plants farmed in Argentina. Industrial Crops and Products, 69, p. 21-28, 2015. [ Links ]
[2] BOULANOUAR, B., ABDELAZIZ, G., AAZZA, S., GAGO, C. and GRAÇA M. Antioxidant activities of eight Algerian plant extracts and two essential oils. Industrial Crops and Products, 46, 2013, p. 85-96. [ Links ]
[3] RETTA, D., DELLACASSA. E., VILLAMIL. J., SUÁREZ. S. and BANDONI. A. Marcela, a promising medicinal and aromatic plant from Latin America: A review. Industrial Crops and Products, 38, 2012, p. 27– 38. [ Links ]
[4] SHANKAR, J. and SANKUNNY, M. A status review on the medicinal properties of essential oils. Industrial Crops and Products, 62, 2014, p. 250-264. [ Links ]
[5] TRONCOSO, N. Los Géneros de Verbenaceae de Sudamérica extratropical (Argentina, Chile, Bolivia, Paraguay, Uruguay y Sur de Brasil). Darwiniana, 18, 1974, p. 295–412. [ Links ]
[6] BENSABAH, F., LAMIRI, A. and NAJA, J. Effect of purified wastewater from the city of Settat (Morocco) on the quality of Lippia citriodora essential oil and infusion. Journal of the Saudi Society of Agricultural Sciences, 14(2), 2015, p. 101-108. [ Links ]
[7] ZEPPENFELD,C., TONI, C., BECKER,° A., DOS SANTOS, D., PARODI, T., HEINZMANN, B., GIL, L., , KOAKOSKI, G., SANTOS DA ROSA, J., LORO, V., ALVES DA CUNHA, M. and BALDISSEROTTO, B. Physiological and biochemical responses of silver catfish, Rhamdia quelen, after transport in water with essential oil of Aloysia triphylla (L'Herit) Britton. Aquaculture, 418–419(1), 2014, p. 101-107. [ Links ]
[8] BLANCO, M., COLAREDA, G., VAN BAREN, C., BANDONI, A., RINGUELET, J. and CONSOLINI, E. Antispasmodic effects and composition of the essential oils from two South American chemotypes of Lippia alba. Journal of Ethnopharmacology, 149(3), 2013, p. 803-809. [ Links ]
[9] CARMONA, F., ANGELUCCI, M., SALES, D., CHIARATTI, T., HONORATO, F., BIANCHI, R. and PEREIRA, A. Lippia alba (Mill.) N. E. Brown hydroethanolic extract of the leaves is effective in the treatment of migraine in women. Phytomedicine, 20 (10), 2013, p. 947-950. [ Links ]
[10] QUIRANTES-PINÉ, R., HERRANZ-LÓPEZ, M., FUNES, L., BORRÁS-LINARES, I., MICOL, V., SEGURA-CARRETERO, A. and FERNÁNDEZ-GUTIÉRREZ, A. Phenylpropanoids and their metabolites are the major compounds responsible for blood-cell protection against oxidative stress after administration of Lippia citriodora in rats. Phytomedicine, 20(12), 2013, p. 112-1118. [ Links ]
[11] FACIO, L., SANGLARD, R., DO VALE, A., SALABERT DE CAMPOS, M., CAMPOS, A., DE OLIVEIRA, M., RABELO, V., GIRARDI, A. and GRAZUL, R. Citral and linalool content has been correlated to DNA content in Lippia alba (Mill.) N.E. Brown (Verbenaceae). Industrial Crops and Products, 59, 2014, p. 14-19. [ Links ]
[12] SORAN, M., STAN, M., NIINEMETS, Ü. and COPOLOVICI, L. Influence of microwave frequency electromagnetic radiation on terpene emission and content in aromatic plants. Journal of Plant Physiology, 171(15), 2014, p. 1436-1443. [ Links ]
[13] ZABKA, M., PAVELA, R. and PROKINOVA, E. Antifungal activity and chemical composition of twenty essential oils against significant indoor and outdoor toxigenic and aeroallergenic fungi. Chemosphere, 112, 2014, p. 443-448. [ Links ]
[14] MUÑOZ, F. Plantas medicinales y aromáticas, estudio, cultivo y procesado. Madrid (España): Mundi-prensa Libros, 2002, 365 p. [ Links ]
[15] EL-HAWARY, S.S., YOUSIF, M.F., ABDEL-MOTAAL, A.A. and ABD-HAMEED, L.M. Bioactivities, phenolic compounds and in-vitro propagation of Lippia citriodora Kunth cultivated in Egypt. BFOPCU, 50(1), 2012, p. 1–6. [ Links ]
[16] GARCÍA-ABARRIO, S., MARTIN, L., BURILLO, J., DELLA PORTA, G. and MAINAR, A. Supercritical fluid extraction of volatile oil from Lippia alba (Mill.) cultivated in Aragón (Spain). Journal of Supercritical Fluids, 94, 2014, p. 206-211. [ Links ]
[17] MURASHIGE, T. and SKOOG, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum, 15(3), 1962, p. 473–497. [ Links ]
[18] MARULANDA, M.L., e ISAZA, L.V. Establecimiento In vitro de heliconias con fines de producción masiva. Scientia Et Technica, 10(26), 2004, p. 193–197. [ Links ]
[19] RAMÍREZ-VILLALOBOS, M., URDANETA, A. y LEÓN DE SIERRALTA, S. Establecimiento In vitro de explantes adultos del guanábano (Annona muricata L.) tratados con hipoclorito de sodio. Revista de La Facultad de Agronomía, 19(1), 2002, p. 48–55. [ Links ]
[20] AHMED, A., GOUTHAMAN, T., RAO, A. and RAO, M. Micropropagation of Phyla nodiflora (L.) Greene: An important medicinal plant. Iranian Journal of Biotechnology, 3, 2005, p. 186-190. [ Links ]
[21] GUPTA, S., KHANUJA, S. and KUMAR, S. In vitro micropropagation of Lippia alba. Current Science, 81(2), 2001, p. 206-209. [ Links ]
[22] GUPTA, S. and SAHU, P. In vitro micro propagation of Withania somnifera (L.) Dunal. Saudi Journal of Biological Science, 2015, p.1-16 [ Links ]
[23] DAKAH, A., ZAID, S., SULEIMAN, M., ABBAS, S. and WINK, M. In vitro propagation of the medicinal plant Ziziphora tenuior L. and evaluation of its antioxidant activity. Saudi Journal of Biological Science, 21(4), 2014, p. 317-323. [ Links ]
[24] FAJINMI, O., AMOO, S., FINNIE, J. and VAN STADEN, J. Optimization of In vitro propagation of Coleonema album, a highly utilized medicinal and ornamental plant. South African Medical Journal, 94, 2014, p. 9-13. [ Links ]
[25] GONÇALVES, S. and ROMANO, A. In vitro culture of lavenders (Lavandula spp.) and the production of secondary metabolites. Biotechnology Advances, 31(2), 2013, p. 166-174. [ Links ]
[26] JULIANI, R., KOROCH, A., ZYGADLO, J. and TRIPPI, V. Evaluation of micropropagation for the introduction into cultivation and conservation of Lippia junelliana, an endemic aromatic plant from Argentina. Industrial Crops and Products, 34(2), 2011, p. 1353-1357. [ Links ]
[27] ZUZARTE, M., DINIS, A., CAVALEIRO, C., SALGUEIRO, L. and CANHOTO, J. Trichomes, essential oils and In vitro propagation of Lavandula pedunculata (Lamiaceae). Industrial Crops and Products, 32(3), 2010, p. 580-587. [ Links ]
[28] SAHOO, S., PARIDA, R., SINGH, S., PADHY, R. and NAYAK,S. Evaluation of yield, quality and antioxidant activity of essential oil of In vitro propagated Kaempferia galanga Linn. JAD, 3(2), 2014, p. 24-130. [ Links ]
[29] RAVINDRA, N. and KULKARNI, R. Essential oil yield and quality in rose-scented geranium: variation among clones and plant parts. Scientia Horticulturae, 2015, 184, p. 31-35. [ Links ]
[30] SAEB, K. and GHOLAMREZAEE, S. Variation of essential oil composition of Melissa officinalis L. leaves during different stages of plant growth. Asian Pacific Journal of Tropical Biomedicine, 2(2), 2012, p. S547-S549. [ Links ]
[31] VERMA, S., PADALIA, R. and CHAUHAN, A. Chemical composition variability of essential oil during ontogenesis of Daucus carota L. subsp. sativus (Hoffm.) Arcang. Industrial Crops and Products, 52, 2014, p. 809-814. [ Links ]
[32] KARIMI, A., HADIAN, J., FARZANEH,M. and KHADIVI-KHUB, A. Phenotypic diversity and volatile composition of Iranian Artemisia dracunculus. Industrial Crops and Products, 65, 2015, p. 315-323.













