Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.15 no.1 Popayán Jan./June 2017
https://doi.org/10.18684/BSAA(15)36-44
DOI: http://dx.doi.org/10.18684/BSAA(15)36-44
ACTIVIDAD LIPOLÍTICA DE MICROORGANISMOS AISLADOS DE AGUAS RESIDUALES CONTAMINADAS CON GRASAS
LIPOLYTIC ACTIVITY OF MICROORGANISMS ISOLATED FROM WASTE WATERS CONTAMINATED WITH FATS
ATIVIDADE LIPOLÍTICA DOS MICRORGANISMOS ISOLADOS DE ÁGUAS RESIDUAIS CONTAMINADO COM GORDURAS
CARMEN JULIA PEDROZA-PADILLA1, MAGALLY ROMERO-TABAREZ2, SERGIO ORDUZ3
1 Universidad Popular del Cesar, Microbiología, Grupo GICBIO. M.Sc. en Ciencias-Biotecnología. Valledupar, Colombia.
2 Universidad Nacional de Colombia Sede Medellín. Facultad de Ciencias, Grupo de Investigación Biología Funcional. Ph.D. en Ciencias Básicas Biomédicas. Medellín, Colombia.
3 Universidad Nacional de Colombia Sede Medellín. Facultad de Ciencias, Grupo SaBio. Ph.D. en Ciencias Naturales. Medellín, Colombia.
Correspondencia: carmenpedroza@unicesar.edu.co
Recibido para evaluación: 28 de Abril de 2016. Aprobado para publicación: 30 de Julio de 2016.
RESUMEN
Las lipasas son uno de los grupos de enzimas con mayor cantidad de aplicaciones industriales y biotecnológicas, en el procesamiento de alimentos lácteos y aceites, detergentes, cosméticos, cuero, productos farmacéuticos, papel, producción de surfactantes, biodiesel y recientemente como una alternativa promisoria para el tratamiento de aguas residuales contaminadas con lípidos. En este estudio se aislaron microorganismos a partir de muestras de aguas residuales con grasas a los que se les determinó la producción de lipasa extracelular utilizando p-nitrofenilpalmitato. De 149 aislados realizados, 37 mostraron actividad lipolítica y la cepa CCEI-1, identificada como Serratia marcescens, tuvo la mayor actividad a pH alcalino y a 30°C. el microorganismo degradó los lípidos y produjo pigmentación en medio de cultivo solido a pH 8,0 y 50°C. Los sobrenadantes de los cultivos de S. marcescens empleados para la determinación de la estabilidad térmica a 50°C, indicaron que la enzima es estable a ésta temperatura y en pH alcalino. La enzima fue purificada parcialmente y sometida a electroforesis (SDS-PAGE) donde se detectaron bandas entre 40 y 116 kDa. Los resultados obtenidos en este estudio indicaron que la cepa de S. marcescens CCEI-1 puede ser posible fuente de lipasas termoestables con futuras aplicaciones industriales y biotecnológicas.
PALABRAS CLAVE: Lipasa, p-NPP, Aguas residuales, Termoestabilidad, Serratia marcescens.
ABSTRACT
Lipases are one of the groups of enzymes with the highest number of industrial and biotechnological applications, processing of dairy foods and oils, detergents, cosmetics, leather, pharmaceuticals, paper, production of surfactants, biodiesel and recently as a promising alternative for the treatment of wastewater contaminated with lipids. In this study, microorganisms were isolated from wastewater samples containing fats and extracellular lipase production was determined using p-nitrophenylpalmitate. From the 149 isolates obtained, 37 showed lipolytic activity and strain CCEI-1, identified as Serratia marcescens, had the highest activity at alkaline pH and at 30°C. Also degraded lipids and produced pigmentation on solid medium at pH 8,0 and 50°C. The culture supernatants of S. marcescens used to determine thermal stability at 50°C indicate that the enzyme is stable at this temperature and at alkaline pH. The enzyme was partially purified and electrophoresed (SDS-PAGE) where bands between 40 and 116 kDa were detected. The results obtained in this study indicate that the strain CCEI-1 of S. marcescens can be a possible source of thermostable lipases with industrial and biotechnological applications.
KEYWORDS: Lipase, p-NPP, Waste Waters, Thermostability, Serratia marcescens.
RESUMO
Foram coletadas amostras de aguas residuais com graxas com a finalidade de realizar o isolamento de microrganismos nativos aos quais determinaram- se e quantificaram-se a produção da enzima extracelular lipase, utilizando um micro-método com p-nitrofenilpalmitato (p-NPP). No total, foram obtidos 149 isolamentos dos quais 37 mostraram atividade lipolítica sendo que o isolamento que apresentou a maior atividade foi selecionado para estudos de determinação das condições ótimas de pH e temperatura para a expressão da lipasa. O isolado CCEI-1, identificado como Serratia marcescens, apresentou a maior atividade a pH alcalino e 30°C, adicionalmente degradou lipídeos e teve produção de pigmentação em meio de cultura sólido a pH 8,0 e 50°C. Os supernadantes dos cultivos de S. marcescens empregados para a determinação da estabilidade térmica a 50°C mostraram resultados que indicam que a enzima é estável nessas condições pH alcalino. A enzima foi purificada parcialmente e sometida a eletroforese em gel SDS-PAGE onde foram detectadas bandas entre 40 y 116 kDa. Os resultados obtidos neste estudo indicam que a cepa S. marcescens CCEI-1 pode ser uma possível fonte de lipases termoestáveis com aplicações industriais e biotecnológicas.
PALAVRAS-CHAVE: Lipase, p-NPP, águas residuais, termoestabilidade, Serratia marcescens.
INTRODUCCIÓN
Las lipasas (triacilglicerolacil hidrolasas, EC. 3.1.1.3), son enzimas con actividad biológica sobre el enlace éster de las moléculas de triacilglicerol presentes en las grasas o en los aceites. Cuando actúan en medio acuoso pueden producir glicerol, ácidos grasos, monoglicéridos y diglicéridos, mientras que en ausencia de agua, la reacción es reversible (esterificación, interesterificación, y transesterificación), generando de ésta manera glicéridos [1,2]. Las reacciones mediadas por estas hidrolasas se dan entre la interface agua y el compuesto lipídico insoluble donde la enzima está disuelta [3,4,5]. Las lipasas son proteínas ubicuas distribuidas ampliamente en la naturaleza, presentes en los animales, en las plantas y en los microorganismos, éstos últimos (bacterias y hongos), generalmente, las secretan al medio extracelular facilitando así, los procesos de extracción y purificación para la industria [3]; además, de ésta ventaja, las enzimas de origen microbiano son preferidas porque actúan en condiciones moderadas, simplicidad en el desarrollo de enzimas recombinantes, mantienen su estabilidad en solventes orgánicos y condiciones extremas de pH y temperatura, tienen alta especificidad y estereoselectividad, no necesitan cofactores, generan baja producción de residuos y altos rendimientos en su recuperación y reutilización, del mismo modo pueden obtenerse en procesos fermentativos cortos por la rápida división celular de los organismos productores y versatilidad del metabolismo microbiano en los medios de cultivo empleados [1,2,3].
La variabilidad, la adaptabilidad y las ventajas en la producción de las lipasas microbianas [1], las ha promovido dentro del grupo de las enzimas más producidas en el mundo con aplicaciones biotecnológicas en el procesamiento de alimentos lácteos y aceites, detergentes, cosméticos, cuero, productos farmacéuticos, papel, producción de surfactantes, biodiesel y recientemente como una alternativa promisoria para el tratamiento de aguas residuales contaminadas con altos contenidos de lípidos [1,3,5,6]. Las aguas con grasas producidas durante los procesos de transformación o refinación de lácteos y aceites tienen baja biodegradabilidad y afectan el medio ambiente, la fauna y flora cuando son vertidas a cuerpos de aguas y suelos sin ningún tratamiento previo; ante esta problemática y en comparación con los procesos químicos convencionales, la prehidrólisis de grasas o aceites por lipasas de origen microbiano podría aumentar la eficiencia, biodegradabilidad o autodepuración de las aguas, favoreciendo así, la asimilación de la carga orgánica por los consorcios microbianos presentes [7].
Sin embargo, aunque el uso de lipasas microbianas purificadas durante el pretratamiento es importante, su aplicación no es económicamente viable con las enzimas comerciales, por lo tanto, se hace necesario el desarrollo de preparaciones económicas a base de extractos crudos con alta actividad lipolítica, a partir de residuos agroindustriales [1,8].
En este estudio se reporta el aislamiento de microorganismos lipolíticos a partir de efluentes industriales contaminados con aceites vegetales, la evaluación de su actividad en condiciones variables de pH, temperatura, e identificación de la cepa con mayor actividad enzimática, Serratia marcescens.
MÉTODO
Aislamiento de microorganismos
Los microorganismos fueron aislados de muestras de sedimentos de aguas residuales con grasas provenientes de una industria productora de aceites vegetales (Barranquilla, Colombia). Para el aislamiento se utilizó el método de siembra por extensión en superficie. Las cepas seleccionadas fueron purificadas por siembra en medio de cultivo solido GEN (glucosa, extracto de levadura, cloruro de sodio, agar) a 30°C por 24 horas en el caso de las bacterias, y los hongos en en el medio de cultivo sólido PDA (papa dextrosa agar, Merck) a 25-30°C por 72 horas. Posteriormente, cada aislamiento fue conservado por triplicado en microtubos con caldo conteniendo glicerol al 40% y almacenados a -20°C. Evaluación de la actividad enzimática en los aislamientos Detección de la actividad lipolítica. Los microorganismos fueron cultivados en 5 mL del medio de cultivo mínimo FAM + aceite de oliva (1% v/v) modificado, (NaNO3 10 mM, KH2PO4 4 mM, Na2HPO4 16 mM, MgSO4.7H2O 0,4mM, CaCl2 60 µM y (NH4)2SO4 9,8 mM) pH 7,0 [9], previamente emulsificado por ultraagitación durante 15 minutos. Los cultivos se incubaron a 30°C por 48 horas a 250 rpm. Luego se tomaron alícuotas de 1 mL y se pasaron por filtros de 0,22 micras para obtener el sobrenadante libre de células en el que se encontraban las enzimas secretadas.
Para la detección hidrolítica de los triacilgliceroles se emplearon dos estrategias, la primera consistió de cajas de Petri con agar FAM + aceite de oliva (1% v/v) suplementado con Rodamina B al 0,001% [10], a las que se les hicieron pozos de 6 mm de diámetro para adicionarles 80 µL del filtrado libre de células. Los cultivos fueron incubados a 30°C por 24-48 horas. Luego fueron sometidas a luz U.V (350 nm) por 15 minutos para detectar la actividad hidrolasa. La segunda estrategia consistió en utilizar agar Tributirina (peptona de carne 2,5 g/L, Bacto peptona 2,5 g/L, extracto de levadura 3,0 g/L, tributirina 10 mL/L y agar 20 g/L) [7], previamente, cada aislamiento se cultivó en 5 mL de caldo Luria Bertani (30°C, 24 horas, 250 rpm) y 80 µL de este cultivo fueron inoculados en pozos realizados al agar tributirina para observar el halo de hidrólisis en la superficie del medio de cultivo. Ensayo con lipasa extracelular. La lipasa extracelular de todos los aislamientos fue cuantificada por un método espectrofotométrico, usando p-nitrofenilpalmitato (p-NPP) (Sigma-Aldrich) como sustrato [11]. En este método se midió la hidrólisis del p-NPP para liberar p-nitrofenol (p-NP). Se disolvieron 30 mg de p-NPP en 10 mL de isopropanol y 90 mL de Tris-HCl 100 mM (pH 8,0) en su orden. De esta mezcla se tomaron 150 µL y la reacción se inició al agregar 100 µL del filtrado libre de células crecidas en el medio de cultivo mínimo FAM + aceite de oliva (1% v/v). Después de 1 hora de incubación a 37°C, se midió la absorbancia a 405 nm en un Microplate Reader Model 680XR (BIO RAD) contra un control que contenía los mismos componentes excepto el filtrado libre de células. Una unidad de actividad enzimática se definió como la cantidad de enzima que libera 1 µmol de p-nitrofenol por minuto bajo las condiciones del ensayo.
El microorganismo que presentó la mayor actividad lipolítica en la evaluación con el método de p-NPP fue seleccionado para la realización de ensayos posteriores que permitieran identificar y caracterizar el microorganismo productor y evaluar parcialmente la lipasa producida por éste.
Efecto del pH en la producción de la enzima. Para la determinación del pH óptimo de crecimiento del microorganismo y para la producción de la enzima, la cepa seleccionada con mayor actividad lipolítica se cultivó en el medio de cultivo mínimo FAM + aceite de oliva (1% v/v) a pHs de 6, 7, 8, 9, y 10, para lo que se emplearon las soluciones buffer Tris HCl 100 mM (pH 6,0 -7,0) y Glicina NaOH 50 mM (pH 8,0 - 10).
Los cultivos microbianos fueron incubados a 30°C por 48 horas a 250 rpm. Los filtrados libres de células se evaluaron con p-NPP, como se describió anteriormente. Cada valor de pH se ensayó por triplicado. Con el control negativo (medio de cultivo sin inóculo) se hizo el mismo procedimiento, así, como también con el control positivo, medio de cultivo con la enzima comercial Lipasa (EC 3.1.13) Tipo VII (Candida rugosa), (Sigma Aldrich).
Efecto de la temperatura en la producción de la enzima.
Para la determinación de la temperatura óptima en la producción de la lipasa, la cepa seleccionada se cultivó en el medio de cultivo mínimo FAM + aceite de oliva (1% v/v) pH 8 y se incubaron a diferentes temperaturas (26, 30, 50, 60, 70 y 80°C) por 48 horas a 250 rpm. Posteriormente, el filtrado libre de células se ensayó con p-NPP. Cada ensayo de temperatura se realizó por triplicado. Los controles fueron sometidos a las mismas condiciones.
Evaluación de la estabilidad térmica y efectos del pH en la lipasa.
Para la evaluación de las propiedades de la enzima, la cepa seleccionada se cultivó en el medio de cultivo mínimo FAM + aceite de oliva (1% v/v) pH 8.0 a 30°C por 48 horas a 250 rpm, luego de obtener el sobrenadante libre de células, éste sirvió como extracto enzimático, se incubó por una hora a diferentes temperaturas (37, 50 y 60°C) a pH de 8,0 y 9,0 antes de iniciar la reacción enzimática al añadir la solución de p-NPP. Cada ensayo se hizo por triplicado con sus respectivos controles.
Caracterización bioquímica y molecular del microorganismo con mayor actividad lipolítica
El microorganismo que mostró la mayor actividad lipolítica fue caracterizado bioquímicamente usando el sistema MicroLogTM Minutes, GN2 MicroplateTM BIOLOG y el programa del sistema de identificación microbiana, MicroLogTM y evaluado en diferentes medios de cultivo microbiológicos.
La amplificación de los genes que codifican para el RNA 16S se realizó por PCR a partir del ADN genómico, extraído a partir de cultivos de 16 horas en caldo Luria Bertani (LB), para la PCR se emplearon iniciadores universales para esta región, Eubac 27F (5´-AGAGTTTGATCCTGGCTCAG-3´) y 1492R (5´-GGTTACATTGTTACGACTT -3´); y un segundo juego de primers, 357F (5´ CTCCTACGGGAGGCAGCAG-3´) y 1100R (GGGTTGCGCTCGTTG). La mezcla de reacción contenía buffer 2,5 µL, MgCl2 2,5 µL, 0,5 µLdNTPs, 1,5 µL DNA polimerasa, 16,5 µL de H2O, 2,5 µL de primers y 1 µL de DNA genómico.
Las condiciones de la PCR fueron un ciclo a 95°C por 2:30 min, 30 ciclos de 95°C por 1 min; 55,8°C por 40 s, 72°C por 1:30 min y un ciclo final a 72°C por 7 min; la reacción se llevó a cabo en un iCyclerThermalcycler, de BIO-RAD.
Los productos de PCR fueron purificados y secuenciados.
Las secuencias del ADNr 16S obtenidas fueron comparadas con las depositadas en la base de datos de GenBank (Nacional Center for Biotechonology Information).
Purificación parcial de la enzima y electroforesis en gel
El microorganismo seleccionado se cultivó en 250 mL del medio de cultivo mínimo FAM + aceite de oliva (1% v/v) a 30°C, por 48 horas a pH 8.0 a 250 rpm. Luego se centrifugó a 8500 rpm por 15 minutos a 4°C y el sobrenadante se hizo pasar a través de un filtro de 0,45 micras. Las proteínas allí presentes, fueron precipitadas con acetona y etanol [12]. Los precipitados se resuspendieron en 25 µL de Tris HCl 100 mM pH 7,0, para ser separados por electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDSPAGE) al 10 y 12% y determinar el peso molecular de las proteínas parcialmente purificadas. Se utilizaron como marcadores una mezcla de estándares de alto peso molecular para electroforesis SDS (Sigma). Los geles fueron teñidos con azul de Coomasie R-250 y nitrato de plata.
RESULTADOS
Aislamiento de los microorganismos y la detección de la actividad lipolítica
A partir de las muestras analizadas se obtuvieron 149 aislados microbianos, de éstos 128 correspondían a bacterias y 21 a hongos. La totalidad de los aislados obtenidos fueron cultivados en el medio de cultivo mínimo FAM + aceite de oliva (1% v/v) suplementado con Rodamina B al 0,001%, (Figura 1A). De los 149 aislados obtenidos, 37 (cerca del 25%) mostraron actividad lipolítica en medio FAM y halo de lipólisis en agar tributirina (Figura 1).
El medio de cultivo mínimo FAM + aceite de oliva (1% v/v) permitió probar la actividad lipolítica sobre el sustrato para las lipasas verdaderas. La fluorescencia alrededor de los pozos positivos evidenció la producción de la lipasa como enzima extracelular, que hidrolizó los enlaces éster carboxil de las moléculas de triacilglicerol aportadas por el aceite, para generar glicerol más ácidos grasos, los cuales se unieron a la Rodamina B y emitieron una señal al excitarse con la luz U.V [3]. La producción de la enzima fue estimulada por la limitación del sustrato (aceite de oliva) como única fuente de carbono [13].
En el agar tributirina se observó el halo de degradación alrededor de los pozos positivos, pero como las lipasas verdaderas catalizan la hidrólisis en las cadenas relativamente largas de acilgliceroles mayores de 10 átomos de carbono y el sustrato aportado por la tributirina consta de menos de 10 átomos de carbono (sustrato para esterasas), no permitió seleccionar los aislamientos con lipasas verdaderas, no obstante estas enzimas son capaces de hidrolizar la tributirina [11,14]. Por lo tanto, su halo de hidrólisis se tomó como una referencia para la observación de la fluorescencia en el medio de cultivo mínimo FAM + aceite de oliva suplementado con Rodamina B, que fue el ensayo determinante.
Ensayo con la lipasa extracelular
La totalidad de los sobrenadantes obtenidos de los medios de cultivos inoculados con los 149 aislados, se evaluaron con p-NPP, un sustrato de 16 átomos de carbono que permitió medir la actividad de la lipasa extracelular presente en el sobrenadante para liberar p-NP, donde el incremento de la coloración amarilla es directamente proporcional a la cantidad de enzima producida por las cepas. De los 149 aislados, 37 mostraron un incremento en la absorbancia a 405 nm. Cinco aislados bacterianos mostraron la mayor absorbancia en las condiciones del ensayo (datos no mostrados), pero de ellos se seleccionó la cepa CCEI-1 para ser identificada y caracterizada por presentar la mayor actividad enzimática. La identificación bioquímica y molecular indicó que se trataba de una cepa de Serratia marcescens.
La conformación estructural del p-NPP con 16 carbonos ha permitido su uso para identificar lipasas verdaderas [11], considerando que las esterasas prefieren las cadenas acilo cortas en los compuestos ésteres de p-NP [15]. La mayor limitación de p-NPP es que las reacciones enzimáticas no pueden realizarse a pH ácidos pero, a pH neutros y alcalinos pueden evaluarse acertadamente con este sustrato [16].
Efecto del pH y la temperatura sobre la producción enzimática
Con el p-NPP como sustrato, la cepa CCEI-1 mostró la mayor capacidad para sintetizar lipasas a un pH de 8,0, aunque, su actividad lipolítica también fue estable en rangos de pH neutros y alcalinos (7 y 9) evidenciados por la hidrólisis enzimática entre el 74 y 81%, respectivamente (Figura 2). Estos resultados coinciden con el comportamiento de una lipasa recombinante de Serratia marcescens expresada en Escherichia coli [17] y de Serratia marcescens ECU1010 [18].
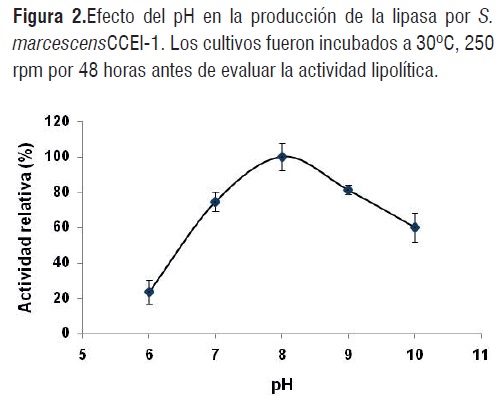 Figura 2
Figura 2La temperatura óptima de crecimiento del microorganismo CCEI-1 para la síntesis de la enzima lipasa y la hidrólisis del aceite de oliva en las condiciones de ensayo fue 30°C. Sin embargo, es importante resaltar que también se dio producción enzimática a 50°C, conservando cerca del 63% de su actividad (Figura 3), mientras que a 60°C la hidrólisis disminuye cerca del 70%. Este comportamiento de la lipasa producida por S. marcescens CCEI-1, coincide con el lugar en el que fue tomada la muestra, dado que los efluentes salen con temperaturas elevadas, entre 50 y 70°C por los procesos requeridos durante la refinación del aceite; permitiendo inferir que el microorganismo produce una enzima termoestable y funcional en pH alcalinos, lo cual podría favorecer futuras aplicaciones biotecnológicas en la fabricación de detergentes o en los procesos de biorremediación de aguas residuales con altos contenidos grasos [4].
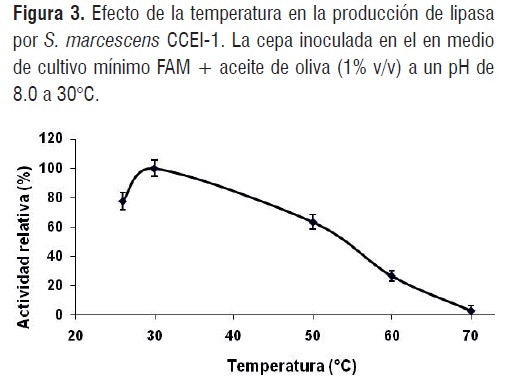 Figura 3
Figura 3Evaluación de la estabilidad térmica y efectos del pH en la lipasa
El extracto enzimático que contiene la lipasa producido por la cepa CCEI-1, presentó estabilidad en un rango de pH entre 8 y 9, alcanzando la mayor actividad enzimática a pH 8,0 y a una temperatura de 37°C, también, se detectó una considerable hidrólisis del sustrato a 50°C donde se mantuvo por una hora el 60 % de su actividad relativa (Figura 4). Existen reportes de la estabilidad térmica en la lipasa extracelular de S. marcescens a 50°C [19], las lipasas mG1 y sG1 de S. marcescens expresadas en la levadura Kluyveromyces lactis mostraron actividades relativas de 60 y 29% respectivamente, a 45°C durante 30 minutos [20], mientras que la lipasa CCEI-1L, del presente estudio, tuvo una mayor actividad relativa considerando la temperatura y tiempo de incubación (50°C por 1 hora).
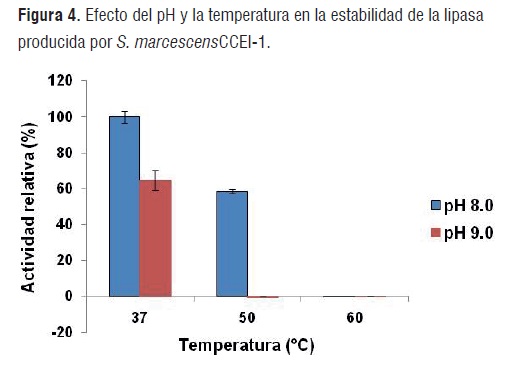 Figura 4
Figura 4La lipasa ECU1010 retuvo el 71% de estabilidad a 50°C durante una hora [18].
En las condiciones de ensayo de esta investigación, no se evaluó la variable temperatura entre 30 y 50°C durante los experimentos con S. marcescens, pero la estabilidad que muestra el extracto enzimático a 37 y 50°C permiten inferir que posiblemente su temperatura óptima de producción enzimática sea superior a 30°C.
La mayor estabilidad de la enzima CCEI-1L a pH de 8,0 a 37 y 50°C concuerdan con las evaluaciones del efecto del pH en la producción de la lipasa por la cepa CCEI-1, donde se observó una mayor actividad de la enzima a un pH de 8,0. Las lipasas mG1 y sG1 alcanzaron su mayor estabilidad en buffers con pH de 7,5 y 7,0 respectivamente, a 25°C durante 10 minutos de incubación [20], mientras que la lipasa CCEI-1L, la obtuvo a 37°C a pH 8,0 durante 1 hora de incubación.
Caracterización bioquímica y molecular del microorganismo con mayor actividad lipolítica
La cepa CCEI-1 mostró ser un bacilo Gram negativo, catalasa positiva, oxidasa negativa, hemolítica, productora de un pigmento rojo (posible prodigiosina), no precipitó los componentes ni fermentó la lactosa cuando creció en agar MacConkey, se caracterizó bioquímicamente frente a 95 sustratos y fue identificada como Serratia marcescens utilizando el sistema de identificación microbiana Biolog (MicroLogTM) con un 99% de probabilidad y un índice de similaridad (SIM) de 0,957.
Los análisis comparativos del fragmento secuenciado de 16S rDNA de 600 pb con las secuencias depositadas en la base de datos del GenBank NCBI mostraron homología con Serratia marcescens con una similaridad del 99%.
Se realizó una extracción parcial y prueba presuntiva del pigmento producido por S. marcescens y resultó positivo para prodigiosina, metabolito secundario de color rojo intenso caracterizado por una estructura común pirrolidipirrolilmetano, producido por varios microorganismos incluyendo especies de los géneros Streptomyces, Pseudomonas y Serratia. Aunque, no se ha definido su papel en la fisiología de la bacteria, se ha reportado su actividad antifúngica, bactericida, antitumoral y antiprotozoaria [21,22].
La cepa CCEI-1 de S. marcescens presentó un óptimo crecimiento con una pigmentación roja en agar BUG suplementado al 5% v/v con sangre (BIOLOG), agar Tributirina, agar Rhodamina B y agar MacConkey (Figura 5), mientras que, en agar GEN, a pesar de tener un crecimiento óptimo, la pigmentación disminuyó por la presencia de la glucosa en el medio de cultivo que inhibió la síntesis de la prodigiosina (Figura 5), posiblemente, debido a una represión catabólica [22,23].
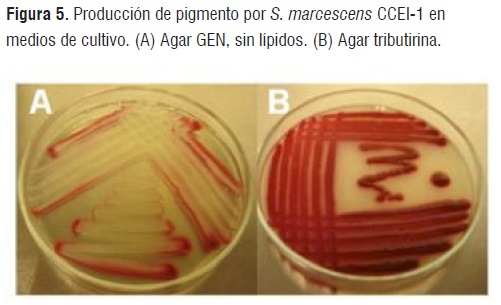 Figura 5
Figura 5En los medios de cultivo con fuentes de lípidos, S. marcescens CCEI-1 presentó un incremento en la pigmentación; por lo tanto, los medios de cultivo con fuentes de grasas podrían ser un sustrato económico para la producción de prodigiosina o de lipasas microbianas para usos biotecnológicos, que podrían reemplazar la glucosa dado que ésta, durante su fermentación disminuye el pH inhibiendo así el crecimiento celular y en consecuencia la síntesis de la prodigiosina [22].
S. marcescens es una bacteria mesófila pero hay reportes que indican que a 37°C disminuye su pigmentación [21]. En este estudio S. Marcescens CCEI-1a un pH de 8.0 tuvo la capacidad de sintetizar lipasas y el pigmento, (aunque con menor intensidad) a 50°C en el medio de cultivo mínimo FAM + aceite de oliva. La pigmentación de la cepa CCEI-1 fue proporcional al tiempo de incubación, dado que la síntesis del pigmento es altamente variable en especies microbianas y depende de las fuentes de carbono, nitrógeno, temperatura, pH, tiempo de incubación, luz, entre otros [21,23].
Purificación parcial de la enzima y electroforesis en gel
El precipitado de proteínas obtenido por medio de solventes orgánicos, se resuspendió en 25 µL de Tris HCl. Los geles para electroforesis con una concentración de poliacrilamida de12% p/v fueron teñidos con nitrato de plata, el cual mostró la presencia de bandas de diferentes pesos moleculares entre 40 y 116 kDa (Figura 6, línea B). La enzima comercial de Candida rugosa (Sigma) fue utilizada como control.
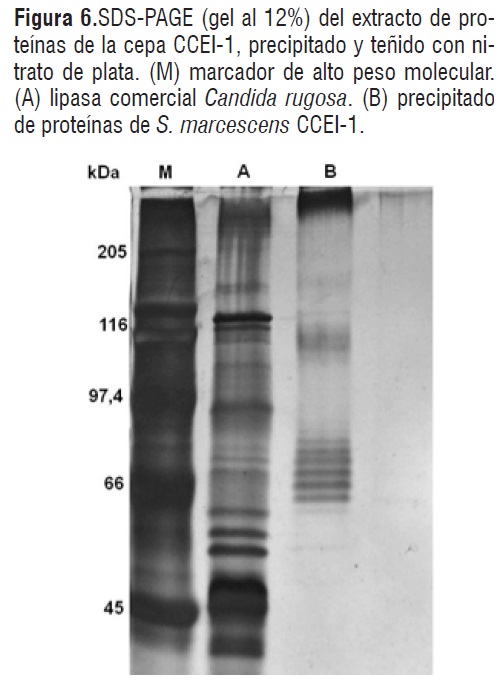 Figura 6
Figura 6Aunque, no se puede definir cuál banda corresponde a la lipasa de S. marcescens, CCEI-1, el empleo de un medio de cultivo con aceite de oliva como única fuente de carbono indica que, una o más bandas pueden corresponder a la enzima de interés. En el precipitado enzimático de S. marcescens CCEI-1 se detectaron varias bandas de posibles proteínas alrededor de los 66 kDa, confirmando la presencia de una lipasa microbiana pues existen varios reportes que indican que esta enzima sintetizada por S. marcescens tiene pesos moleculares en este rango, 66,2 kDa [18,20], 65k Da [17,19] y 52 kDa [17].
CONCLUSIONES
Las aguas residuales con altos contenidos de grasas y aceites, forman ambientes que estimulan el desarrollo de poblaciones microbianas que usan los lípidos presentes en el medio como fuente de carbono y sustrato para su metabolismo, estas condiciones favorecieron el aislamiento de 37 microorganismos productores de lipasas, entre ellos la cepa CCE-1 identificada como S. marcescens, que mostró la mayor actividad enzimática en pH alcalinos y a temperaturas moderadas, la estabilidad de la lipasa bacteriana CCE-1L durante una hora a 50°C, permiten inferir que la enzima y la cepa productora pueden tener posibles aplicaciones biotecnológicas e industriales para usos en biorremediación de aguas contaminadas con grasas o como aditivo para detergentes.
REFERENCIAS
[1] ANOBOM, C.D., PINHEIRO, A., DE-ANDRADE, R. et al. From Structure to Catalysis: Recent Developments in the Biotechnological Applications of Lipases. BioMed Research International, 2014, p. 1-11. [ Links ]
[2] SHARMA, S. and KANWAR, S. Organic Solvent Tolerant Lipases and Applications. The Scientific World Journal, 2014, 2014, p. 1-15. [ Links ]
[3] RABBANI, M., BAGHERINEJAD, M., SADEGHI H., et al. Isolation and characterization of novel thermophilic lipase-secreting bacteria. Brazilian Journal of Microbiology, 44(4), 2013, p.1113-1119. [ Links ]
[4] CHERIF, S., ALOUI, F., CARRIERRE, F., et al. Lipase Pre-Hydrolysis Enhance Anaerobic Biodigestion of Soap Stock from an Oil Refining Industry. Journal of Oleo Science, 63(2), 2014, p. 109-114. [ Links ]
[5] BRABCOVÁ, J., DEMIANOVÁ, Z., VONDRÁEK, J., et al. Highly selective purification of three lipases from Geotrichum candidum 4013 and their characterization and biotechnological applications. Journal of Molecular Catalysis B: Enzymatic, 98, 2013, p. 62-72. [ Links ]
[6] GOPINATH, S., ANBU, P., LAKSHMIPRIYA, T., et al. Strategies to Characterize Fungal Lipases for Applications in Medicine and Dairy Industry. BioMed Research International, 2013, 2013, p. 1-10. [ Links ]
[7] SARANYA, P., SUKANYA, H., PRASAD, B., et al. Lipase production from a novel thermo-tolerant and extreme acidophile Bacillus pumilus using palm oil as the substrate and treatment of palm oil-containing wastewater. Environmental science and pollution research, 21(5), 2014, p. 3907-3919. [ Links ]
[8] FACCHINI, A., VICI, A., PEREIRA, M., et al. Enhanced lipase production of Fusarium verticillioides by using response surface methodology and wastewater pretreatment application. Journal of Biochemical Technology, 6(3), 2015, p. 996-1002. [ Links ]
[9] PALMEROS, B., GUERECA, L., ALAGÓN, A., et al. Biochemical characterization of the lipolytic activity of Pseudomonas aeruginosa IGB 83. Process Biochem, 29(3), 1994, p. 207-212. [ Links ]
[10] KOUKER, G. and JAEGER, K.E. Specific and sensitive plate assay for bacterial lipases.Applied and Environmental Microbiology, 53 (1), 1987, p. 211-213. [ Links ]
[11] LI, M., YANG, L., XU, G., et al. Screening, purification and characterization of a novel cold-active and organic solvent-tolerant lipase from Stenotrophomonas maltophilia CGMCC 4254. Bioresource Technology, 148, 2013, p. 114-120. [ Links ]
[12] HASAN, F., SHAH, A. and HAMEED, A. Purification and characterization of a mesophilic lipase from Bacillus subtilis FH5 stable at high temperature and pH. Acta Biologica Hungarica, 58(1), 2007, p. 115-132. [ Links ]
[13] CERVANTES, E., SALAZAR, L. y DIAZ, P. Lipasas inducidas por hidrocarburos de petróleo. Revista Internacional de Contaminación Ambiental, 29(2), 2013, p. 9-15. [ Links ]
[14] RAO, L., XUE, Y., ZHENG, Y., et al. A Novel Alkaliphilic Bacillus Esterase Belongs to the 13th Bacterial Lipolytic Enzyme Family. PLoS One, 8(4), 2013, e60645. [ Links ]
[15] JIANG, H., ZHANG, S., GAO, H., et al. Characterization of a cold-active esterase from Serratia sp. and improvement of thermostability by directed evolution. BMC Biotechnology, 16(1), 2016, p. 1-11. [ Links ]
[16] GUPTA, R., RATHI, P., GUPTA, N., et al. Lipase Assays for Conventional and Molecular Screening: An Overview. Biotechnology and Applied Biochemistry, 37, 2003, p. 63-71. [ Links ]
[17] MOHAMMADI, M., SEPEHRIZADEH, Z., EBRAHIM. H., et al.Bacterial expression and characterization of an active recombinant lipase A from Serratia marcescens with truncated Cterminal region. Journal of Molecular Catalysis B: Enzymatic, 120, 2015, p. 84-92. [ Links ]
[18] ZHAO, L., XU, J., ZHAO, J., et al. Biochemical properties and potential applications of an organic solvent-tolerant lipase isolated from Serratia marcescens ECU1010. Process Biochemistry, 43(6), 2008, p. 626-633. [ Links ]
[19] SU, E., XU, J. and YOU, P.Functional expression of Serratia marcescens H30 lipase in Escherichia coli for efficient kinetic resolution of racemic alcohols in organic solvents. Journal of Molecular Catalysis B: Enzymatic, 106, 2014, p.11-16. [ Links ]
[20] SIEKSTELE, R., VETEIKYTE, A., TVASKA, B., et al. Yeast Kluyveromyces lactis as host for expression of the bacterial lipase: cloning and adaptation of the new lipase gene from Serratia sp. Journal of Industrial Microbiology and Biotechnology, 42(10), 2015, p.1309-1317. [ Links ]
[21] WANG, S., WANG, C., YEN, Y.,et al. Enhanced production of insecticidal prodigiosin from Serratia marcescens TKU011 in media containing squid pen. Process Biochemistry, 47(11), 2012, p. 1684-1690. [ Links ]
[22] ZANG, C., YEH, C., CHANG, W., et al. Identification and enhanced production of prodigiosin isoform pigment from Serratia marcescens N10612. Journal of the Taiwan Institute of Chemical Engineers, 45(4), 2014, p. 1133-1139. [ Links ]
[23] DARSHAN, N. and MANONMANI, H. Prodigiosin and its potential applications. Journal of Food Science and Technology, 52(9), 2015, p. 5393- 5407. [ Links ]














