Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biotecnología en el Sector Agropecuario y Agroindustrial
Print version ISSN 1692-3561
Rev.Bio.Agro vol.15 no.1 Popayán Jan./June 2017
https://doi.org/10.18684/BSAA(15)56-65
DOI: http://dx.doi.org/10.18684/BSAA(15)56-65
EFECTO ANTIMICROBIANO DEL CLAVO Y LA CANELA SOBRE PATÓGENOS
ANTIMICROBIAL EFFECT OF CLOVES AND CINNAMON ON PATHOGENS
EFEITO ANTIMICROBIANO DE CRAVO E CANELA EM ORGANISMOS PATOGÉNICOS
YENIS IBETH PASTRANA-PUCHE1, ALBA MANUELA DURANGO-VILLADIEGO2, DIOFANOR ACEVEDO-CORREA3.
1 Universidad de Córdoba, Facultad de Ingeniería, Departamento de Ingeniería de Alimentos, Sede de Berástegui. M.S.c en Ciencias Agroalimentarias. Córdoba, Colombia.
2 Universidad de Córdoba, Facultad de Ingeniería, Grupo de Investigacion en Procesos Agroindustriales, Departamento de Ingeniería de Alimentos. PhD en Ciencia y Tecnología de Alimentos. Córdoba, Colombia.
3 Universidad de Cartagena, Facultad de Ingeniería, Grupo de Investigación en Nutrición, Salud y Calidad Alimentaria (NUSCA), Programa de Ingeniería de Alimentos.PhD en Ingeniería de alimentos. Cartagena, Colombia.
Correspondencia: Diofanor3000@gmail.com
Recibido para evaluación: 10 de Septiembre de 2015. Aprobado para publicación: 28 de Marzo de 2016.
RESUMEN
El uso de especias con características antimicrobianas ha tenido gran relevancia en la industria alimenticia. El objetivo del presente trabajo fue estudiar el efecto antimicrobiano del clavo y la canela sobre los patógenos Salmonella spp., Escherichia coli y Staphylococcus aureus utilizando el método de difusión en agar, y diluciones dobles en caldo. Los extractos de canela y clavo estudiados bajo la metodología de difusión en agar, no provocaron ningún efecto antimicrobiano sobre Salmonella spp, mientras que, en sus concentraciones más elevadas (100 y 150 mg/mL), si mostraron un efecto antimicrobiano sobre E. coli y S. aureus, clasificándose como sensibles. En la metodología de diluciones dobles en caldo, se determinó que para el S. aureus ATCC® 29213TM la CMI y la CMB fueron 512 µg/mL y 4096 µg/mL respectivamente y para Escherichia coli O157:H7 la CMI y la CMB fueron 2048 µg/mL y 4096 µg/mL.
PALABRAS CLAVE: Especias, Difusión en agar, Salmonella spp., Escherichia coli, Staphylococcus aureus.
ABSTRACT
The use of spices with antimicrobial properties has been very important in the food industry. The aim of this work was to study the antimicrobial effect of clove and cinnamon on the pathogens Salmonella spp., Escherichia coli and Staphylococcus aureus using the agar diffusion method, and double dilutions in broth. The extracts of cinnamon and clove studied under the agar diffusion method, caused no antimicrobial effect on Salmonella spp, while in its highest concentrations (100 y 150 mg/mL) if they showed an antimicrobial effect on E. coli and S. aureus, classified as sensitive. In the methodology of double dilutions in broth, it was determined that for S. aureus ATCC ® 29213TM the CMI and CMB were 512 µg/mL and 4096 µg/mL respectively and E. coli O157:H7 the CMI and CMB were 2048 µg/mL and 4096 µg/mL.
KEYWORDS: Spices, Agar diffusion, Salmonella spp., Escherichia coli, Staphylococcus aureus.
RESUMO
O uso de especiarias com propriedades antimicrobianas tem tido grande importância na indústria de alimentos. O objetivo deste trabalho foi estudar o efeito antimicrobiano de cravo e canela em patogênico Salmonella spp., Escherichia coli e Staphylococcus aureus, utilizando o método de difusão em ágar, e diluições duplas em caldo. Os extratos de canela e cravo estudadas pelo método de difusão em ágar, não causou nenhum efeito antimicrobiano em Salmonella spp, enquanto em suas concentrações mais elevadas (100 y 150mg/mL) se mostrou um efeito antimicrobiano em E. coli e S. aureus, classificadas como sensíveis. Na metodologia de diluições duplas em caldo, determinou-se que o S. aureus ATCC para o 29213TM CMI e CMB foram 512 µg/ml e 4096 µg/ mL, respectivamente, e Escherichia coli O157: H7, o MIC e CMB foram 2048 µg/ml e 4096 µg/mL.
PALAVRAS-CHAVE: Especiarias, ágar, Salmonella spp., Escherichia coli, Staphylococcus aureus.
INTRODUCCIÓN
Los antimicrobianos son compuestos químicos presentes o añadidos en los alimentos, que retardan el crecimiento microbiano o inactivan a los microorganismos y por lo tanto, detienen el deterioro de la calidad y brindan seguridad al alimento [1]. La acción de los antimicrobianos sobre las células de los microorganismos en la conservación de alimentos está basada en una gran variedad de efectos individuales, dentro de los que se incluyen mecanismos físicos, fisicoquímicos y reacciones bioquímicas de la célula afectada. Algunas veces diversos factores individuales pueden producir un efecto tanto acumulativo como de bloqueo [2]. Ellos actúan sobre los microorganismos inhibiendo la síntesis de la pared, de la membrana celular, de los ácidos nucleídos y la de las proteínas.
Los solutos hidrofílicos de menor tamaño son capaces de pasar la membrana externa a través de los poros proporcionando a las proteínas transmembranales canales hidrófilos, mientras que la membrana externa sirve como barrera de penetración hacia macromoléculas y compuestos hidrófobos, y es por esta razón que las bacterias Gram-negativas son relativamente resistentes a los antibióticos y a las drogas tóxicas hidrófobas [3, 4, 5]. De igual forma, el uso de antimicrobianos como conservantes también, ha sido de gran importancia, al permitir alargar la vida de los productos de anaquel, evitando la colonización por microorganismos alterantes.
Un amplio rango de sistemas antimicrobianos naturales ha sido desarrollado a partir de microorganismos, plantas y animales, muchos de ellos ya se han empleado para la conservación de alimentos y otros están siendo investigados para ser usados en estos [6].
El uso de diversos ingredientes con características antimicrobianas como la sal, el azúcar, el vinagre y las especias han tenido gran relevancia en la industria alimenticia [7]. Unas de estas sustancias con esas características son los aceites esenciales (AE) y sus componentes cuyas propiedades antibacterianas están evidentemente relacionadas con su carácter lipofílico, lo que lleva a la acumulación en las membranas y posteriormente, a eventos asociados, como el agotamiento de la energía. Presentan un efecto antibacteriano contra las bacterias Gram-negativas, dado que ellas poseen una membrana externa rica en lipopolisacáridos que le proporciona una superficie hidrofílica [8, 9, 10, 11]. Las especias como la canela y el clavo han sido utilizadas en los alimentos no solo por su sabor, sino también, como medicamentos y conservantes [1]. Las especias también estimulan el apetito mediante el aumento de la salivación, y preservan los alimentos por sus propiedades antimicrobianas y antioxidantes.
En el mundo, diferentes países, utilizan más o menos 400 especias, principalmente, para mejorar el sabor y la palatabilidad de los alimentos, esto se demostró en un estudio de Billing y Sherman [12] los cuales evaluaron el uso de 43 especias en 4.578 recetas a base de carne procedentes de 36 países y el por qué las personas las utilizan y llegaron a la conclusión de que en los países de clima caliente, la proporción de recetas con especias, el número de estas utilizadas en cada receta, el número total de ellas, y el uso de la mayoría fueron superiores que en los países de clima frío. En donde, en países con clima caliente, se utilizaron más el ajo, la cebolla, la pimienta, la canela, el comino que en los de clima frío. Por otra parte, las comidas con sabores picantes y con fuerte adición de especias tienen mayor poder antimicrobiano sobre los microorganismos patógenos. Estos mismos autores compararon las pro iedades antimicrobianas, de 30 especias y resumieron el espectro antibacteriano de cada especia y observaron que el 80% de ellas inhibieron el crecimiento de más del 50% de las bacterias del estudio, de hecho los clavos y la canela, inhibieron entre el 75 y el 100% de las cepas bacterianas utilizadas.
El objetivo del presente trabajo fue estudiar el efecto antimicrobiano del clavo y la canela sobre los patógenos Salmonella spp., E. coli y Staphylococcus aureus, utilizando el método de difusión en agar, y diluciones dobles en caldo.
MÉTODO
Materias primas
Las astillas de canela y paquetes de clavo se compraron en Mercado Central de Cereté, Córdoba. Se mezclaron seis gramos de cada especia en un frasco tapa rosca y se les adicionó 200 mL de etanol al 70% v/v [13]. Se forró el recipiente con papel aluminio para evitar la degradación de los posibles compuestos fotosensibles presentes en la matriz alimentaria. Se dejó actuar el solvente a 45°C por dos días, luego se filtró la solución para la separación de las fases, la líquida fue rotaevaporada a una temperatura que no sobrepasó a la de ebullición del disolvente. El extracto obtenido fue transferido a viales forrados con papel aluminio y almacenados a 4°C hasta llevar a cabo los análisis de actividad antimicrobiana.
Actividad antimicrobiana
Para la determinación del efecto antimicrobiano se utilizaron dos metodologías, la propuesta por [14, 15] de difusión en agar y la propuesta por CLSI (antes NCCLS) en la que se determinó la Concentración Mínima Inhibitoria (CMI), Concentración Mínima Bactericida (CMB) y la curva de letalidad.
Difusión en Agar. De los cultivos de las cepas de estudio: Staphylococcus aureus, Escherichia coli y Salmonella spp, con un tiempo de incubación de 18 a 24, se hizo el inóculo con una concentración de 0,5 patrón de McFarland suspendidas en solución salina del medio de cultivo. Previamente, se tomaron discos estériles sumergidos en 20 µL del extracto de clavo y canela diluido en 25% v/v de dimetilsulfoxido (DMSO) en concentraciones de 150, 100, 50 y 25 µg/mL, los cuales se dejaron secar por 12 horas. Los discos impregnados se colocaron en la superficie del medio y el compuesto se dejó difundir, se incubó a 37°C durante 24 horas. Se utilizó ampicilina 10 µg/mL como control positivo y negativo la oxacillin 5 µg/mL. Se ejecutaron los ensayos en dos fechas con tres repeticiones cada uno. En esta fase se aplicó un análisis descriptivo obteniéndose la media y la desviación estándar. La actividad antibacteriana se evaluó midiendo el diámetro de la zona de inhibición formado alrededor de los discos.
CMI, CMB y Curva de letalidad. Se determinó la CMI, CMB y la curva de letalidad frente a los microrganismos Staphylococcus aureus ATCC® 29213TM y Escherichia coli O157:H7. Para la CMI se partió de una solución madre y stock de 8.500 µg/mL (originada del extracto puro rotoevaporado) y 5.120 µg/mL respectivamente, y a partir de ellas se hicieron diluciones dobles en Caldo Muller Hinton (CMH) con diferentes concentraciones del extracto de clavo y canela (cuadro 1). En el tubo 1 se tiene un volumen final de 250 µL y se adicionaron 2,5 µL del microrganismo respectivo a cada tubo. Las cepas fueron suspendidas en CMH a partir de un cultivo de 18-24 horas, a una concentración de 0,5 de patrón McFarland. Finalmente, los cultivos se incubaron a 37°C por 24 horas en una incubadora con shaker a 250 rpm. A partir del resultado de la CMI, se realizó la CMB repitiendo el procedimiento de CMI sin proceder a la incubación, e inoculando cada uno de los cultivos, en cajas con agar nutritivo por estrías 5 µL, se incubaron a 37 °C durante 24 horas.
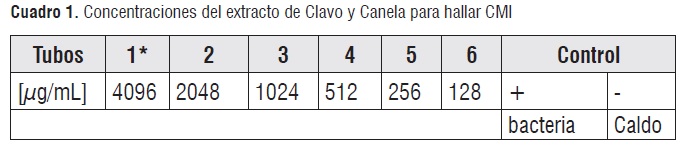 Cuadro 1
Cuadro 1 La CMB se definió como la concentración más baja del extracto que no permitió el crecimiento bacteriano en el agar nutritivo. Con respecto a la curva de letalidad se prepararon soluciones del extracto con la concentración que arrojó la CMI, la mitad y cuatro veces esta (cuadro 2). Se inoculó en cajas con agar nutritivo por estrías 10 µL a partir de los cultivos bacterianos a las 0, 2, 4, 8, y 24 horas, incubándose a 37°C durante 24 horas.
RESULTADOS
En la actualidad, se conoce sólo de manera parcial, la composición química de las sustancias antimicrobianas de las especias; sin embargo, los componentes más comunes son los taninos, aldehídos y ácidos orgánicos, presentes también, en el clavo y la canela. Se ha descubierto que las sustancias antimicrobianas de la mayoría de las especias son los propios aceites esenciales (AE), mezclas de diferentes productos volátiles, entre los que se incluyen alcoholes, cetonas-éteres fenólicos, fenoles, ácidos y sus esteres [16]. Para la obtención del extracto, se utilizó tanto, etanol al 70 % v/v y no etanol puro, con base en estudios, que han observado que los extractos obtenidos con etanol/ agua presentan mayor eficiencia de extracción que los correspondientes al agua o al etanol independientemente; debido a que el etanol y el agua tienen diferente polaridad y al mezclarse, se incrementa la capacidad de extracción, ya que se extraen los compuestos fenólicos afines al agua y los compuestos fenólicos afines al etanol [13].
Este efecto también fue observado por Hauser et al., [17] que realizaron extracciones de las hojas y del fruto de la murta, encontrando que una mezcla de 50 %v/v etanol/agua resultó más eficiente en la extracción de polifenoles que con los solventes puros (agua y etanol).
También Agafonova et al. [18], investigaron con hojas de Limoniastrum monopetalum y observaron que se incrementaba el poder de extracción de los compuestos fenólicos, cuando se adicionaba un 20% v/v de agua a otros solventes como el metanol, acetona o etanol.
Difusión en agar. En el cuadro 3 se puede observar los resultados en mm producidos por las zonas de inhibición para cada microorganismo frente a los extractos. Esta medición relaciona la sensibilidad del microorganismo al extracto, según el diámetro del halo, así; los microorganismos se clasifican en: no sensibles (d< 8 mm), sensibles (9 mm<d<14 mm), muy sensibles (14 mm<d<19 mm) y extremadamente sensibles (d>20 mm) [19, 20]. Se puede observar que E. coli en el día 1 y S. aureus en el día 1 y 2, presentaron una sensibilidad de 9 mm (restando 6 mm del disco) clasificándose como sensibles. Esta medición relaciona la sensibilidad del microorganismo al extracto, según el diámetro del halo, así; los microorganismos se clasifican en: no sensibles (d< 8 mm), sensibles (9 mm < d < 14 mm), muy sensibles (14 mm < d< 19 mm) y extremadamente sensibles (d > 20 mm) [21] En el caso, de la Salmonella spp se observa que para ninguna de las concentraciones estudiadas se obtuvo un efecto antimicrobiano, resultados similares obtuvieron [22, 23] quienes trabajaron con extractos acuosos de clavo y canela sin obtener ningún grado de inhibición considerable.
Estos últimos encontraron que los componentes activos de los extractos de clavo y canela son similares entre sí, haciendo suponer que su acción antibacteriana también lo es.
Sin embargo, frente a E. coli y S. aureus, se observa el efecto antimicrobiano con la mayor concentración de 150 mg/mL, esto es posible por la presencia de alcaloides, oxhidrilos fenólicos, y el eugenol presente en el clavo, datos reportados por Khan et al., [24], en cambio, en la canela el efecto antimicrobiano lo proporciona el aldehído cinámico [25].
En cuanto a S. aureus los resultados de este estudio concuerdan, con lo reportado por Garcia-Caramillo et al., [23] quienes demostraron que el extracto de clavo y canela, presenta un efecto antibacteriano principalmente contra S. aureus. Lo anterior, se debe a que el aceite esencial de la canela contiene una alta concentración de trans-cinamaldehído, que es el componente en mayor proporción, también presenta linalol, eugenol y otros compuestos fenólicos. Otros estudios, han identificado al trans-cinamaldehído como el mayor componente antibacterial del aceite esencial de esta especia. El cinamaldehído actúa inhibiendo las amilasas y proteasas provocando el deterioro de la pared y un alto grado de lisis celular [26].
En el caso de las bacterias Gram negativas sensibles, así, como de las Gram positivas, los aceites esenciales se introducen a través de los lípidos de la membrana celular, alterando su estructura y haciéndolas más permeables. Como consecuencia tiene lugar una fuga de iones y de otros contenidos celulares, de forma más o menos intensa, que puede llevar a la muerte celular [26].
Goñi et al., citado por [27] estudiaron la actividad antimicrobiana por contacto directo y en la fase de vapor del clavo y la canela , observaron halos de inhibición de 18 y 20 mm por contacto directo para E. coli y S. aureus respectivamente, en nuestro caso, los resultados dieron por debajo de las citadas. Estudios hechos por Smith-Palmer et al., [28] con los aceites esenciales de 21 plantas entre las que figuran el clavo y la canela de forma independiente, mostraron halos de inhibición de 14 mm para E. coli y S. aureus, siendo estos resultados más cercanos a los arrojados en este experimento.
Hernández et al., [29] afirman que en los diversos resultados obtenidos en los estudios que aplican el método de difusión en agar se tienen que tener en cuenta factores tales como; diámetro del disco, cantidad del aceite esencial adicionado, cantidad específica de microrganismos y la fase de crecimiento en que este se encuentre; pues cualquier cambio o descuido en estos factores originará variabilidad en los resultados y diferencias significativas con lo reportado en la literatura.
CMI, CMB y Curva de Letalidad de los microrganismos frente al extracto de Clavo y Canela. Esta metodología fue dirigida inicialmente a la determinación de la actividad de los antibióticos pero ha sido modificado para determinar la actividad de los AE; adaptándose para determinar la actividad antimicrobiana de los AE y los extractos de plantas [30, 31]. La CMI se define como la menor concentración del extracto que produce el 90% de reducción en el crecimiento de las colonias.
La CMB se define como la mínima concentración del extracto que produce al menos un 99,9% de reducción en el crecimiento de las colonias [20].
La evaluación de la técnica de microdilución en tubo arrojó una CMI de 512 µg/mL para el Staphyloccoccus aureus ATCC® 29213TM en la concentración de 512 µg/mL. Moleyar y Narasimhm Citado por Seow et al., [32] estudiaron el efecto inhibitorio de la mezcla del cinamaldehido y el eugenol, componentes fenólicos principales del clavo y la canela, observaron inhibición del S. aureus entre 250 y 500 µg/ mL, y cuando se evaluaron individualmente, en esas mismas concentraciones no observaron la misma inhibición del crecimiento. Lu et al., [33], confirmaron que el aceite de canela es un agente antibacteriano fuerte. Por otro lado [27] mostraron valores de CMI en fase de vapor de la mezcla de clavo y canela de 54 µg/mL, valor mucho más bajo que el reportado por este estudio.
El mecanismo de acción de los AE contra bacterias Gram positivas, se basa en que los componentes del aceite destruyen la pared celular y la membrana citoplasmática, lo que resulta en el derrame del citoplasma y su coagulación, además, de inhibir la síntesis de ADN, ARN y proteínas [33].
Los resultados de la curva de letalidad se observan en la figura 1; en 256 µg/mL no se da ninguna inhibición, lo que si se da en 512 µg/mL y la eliminación del crecimiento se observa en 2048 µg/mL a las 24 horas. Estos resultados contrastan con las pruebas hechas para CMB del S. aureus que mostro el punto de corte en 4096 µg/mL; explicándose quizás por una serie de factores que influyen en la estimación de la actividad antimicrobiana de los AE, entre los que se encuentran la temperatura, el pH, el potencial óxido-reducción y la actividad de agua, según Hernández et al., [31]; el método utilizado, tipo y volumen del medio, concentración y edad del in&oacte;culo, el tipo de cepa del microorganismo en estudio, la temperatura, el tiempo, la atmósfera de incubación y el solvente o agente dispersante.
Para la Escherichia coli O157:H7, la CMI arrojo un resultado de 2048 µg/mL, siendo la menor concentración del extracto que produjo el 90% de reducción en el crecimiento. Goñi et al., [29] reportaron valores de CMI para esta bacteria de 90 µg/mL en la mezcla en fase de vapor; y para los extractos independientes de clavo y canela de 27 y 18 µg/mL respectivamente, mostrando un resultado sinérgico, o sea, la actividad conjunta es mayor que las suma de las actividades de los dos antimicrobianos por separado. Esta afirmación es opuesta a la de Lu et al., [33], quienes reportan resultados antagónicos; es decir, en el caso, de E. Coli, la actividad conjunta de los extractos es menor que las suma de la actividad de los dos antimicrobianos por separado e indiferentes. Estos resultados tan diversos están explicados, además, de los factores comentados por [29], por las diferencias en la estructura de la canela o el clavo utilizado; pues según Delgado [34], la época y el lugar de recolección, la parte de la planta utilizada y la etapa en la que se encuentre la planta, determinarán la concentración de los componentes mayoritarios en la especia; generalmente los aceites esenciales de plantas que fueron cosechadas durante o inmediatamente después de la floración poseen mayor actividad antimicrobiana. Otro factor importante es el sitio de producción de los compuestos, en algunos casos pueden sintetizarse en toda la planta; en otras especies puede haber producción selectiva de metabolitos en cada órgano de la planta, como ocurre con la canela (Cinnamomum zeylanicum Blume), que en la corteza del tallo produce altas concentraciones de aldehído cinámico, en las hojas predomina el eugenol y en la corteza de la raíz el camfor
Algunas investigaciones de actividad antimicrobiana de aceites AE de clavo y canela combinados [20, 27, 35], se realizaron para evaluar el crecimiento de bacterias Gram-negativas: Escherichia coli, Yersinia enterocolitica, Pseudomona aeruginosa y Salmonella choleraesuis y cuatro bacterias Gram positivas Staphylococcus aureus, Listeria monocytogenes, Bacillus cereus y Enterococcus faecalis. Se determinó que ejercen efecto antagónico sobre el crecimiento de E. coli y sinérgico en la inhibición de L. monocytogenes, B. cereus y Y. enterocolitica.
El eugenol, componente mayoritario del aceite de clavo de olor, y el cinamaldehido, componente de la canela, actúan inhibiendo la producción de enzimas extracelulares, tales como amilasas y proteasas, lo que provoca el deterioro de la pared y un alto grado de lisis celular. La adición de los AE presenta una buena respuesta a la inhibición al crecimiento de E. coli, es así como, los derivados fenólicos tales como carvacrol y eugenol provenientes del clavo de olor y el tomillo, causan la desintegración de la membrana en la E. coli y S. typhimurium [33].
Con respecto a la curva de letalidad de la Escherichia coli O157:H7 que se observa en la figura 2; se evidencia que en la concentración 1024 y 2048 µg/ mL, no hubo inhibición del crecimiento, mientras que en la concentración 8194 µg/mL se dio una constante inhibición desde el tiempo 0 hasta la finalización del experimento a las 24 horas. La CMB del microrganismo se dio en la concentración de 4096 µg/mL, es decir, a esta es la más baja concentración del extracto de clavo y canela necesario para eliminar el 99% del inóculo inicial después de la incubación por 24 horas bajo condiciones estandarizadas. Esto puede explicarse por la alta concentración de la misma y por la elevada viscosidad pues como se observa en la Figura 2, esta solución se preparó a partir del extracto madre, con un muy bajo porcentaje del diluyente CMH, por lo que es una suspensión altamente lipídica, que impide el normal desarrollo del microrganismo.
En los alimentos se ha demostrado que se necesitan más cantidades de AE que la que se ha necesitado en experimentos previos in vitro, lo cual se explica por factores intrínsecos del propio alimento (grasa, proteína, agua, antioxidantes, conservantes, pH, sal y otros aditivos) y por factores extrínsecos, como la temperatura, pH, tipo de envasado y características del microorganismo. La matriz física de los alimentos también puede limitar la actividad antibacteriana de los AE. La extrapolación de los resultados de las pruebas in vitro a los alimentos es por lo tanto, difícil y siempre es más alto en los alimentos [36].
CONCLUSIONES
Los extractos de canela y clavo estudiados bajo la metodología de difusión en agar, no provocaron ningún efecto antimicrobiano sobre Salmonella spp, mientras que, en sus concentraciones más elevadas (100 y 150 mg/mL), si mostraron un efecto antimicrobiano sobre E. coli y S. aureus, clasificándose como sensibles. En la metodología de diluciones dobles en caldo, se determinó que para el Staphylococcus aureus ATCC® 29213TM la CMI y la CMB fueron 512 µg/mL y 4096 µg/mL respectivamente y para Escherichia coli O157:H7 la CMI y la CMB fueron 2048 µg/mL y 4096 µg/mL.
REFERENCIAS
[1] MOMPIÉ, A., PASCUAL, Y.M., , CUNHA, L., DE LA PAZ-LORENTE, C. y AGUILAR, F. Evaluación de la actividad antimicrobiana de extractos de hojas y semillas de Morinda citrifolia L. (noni). Revista Cubana de Plantas Medicinales, 19(4), 2015, p. 1-8. [ Links ]
[2] FRANK, F., XU, Y. and XIA, W. Protective effects of garlic (Allium sativum) and ginger (Zingiber officinale) on physicochemical and microbial attributes of liquid smoked silver carp (Hypophthalmichthys molitrix) wrapped in aluminium foil during chilled storage. African Journal of Food Science, 8(1), 2014, p. 1-8. [ Links ]
[3] HERAS, I., ALVIS, A. y ARRAZOLA, G. Optimización del Proceso de Extracción de Antocianinas y Evaluación de la Capacidad Antioxidante de Berenjena (Solana melonera L.). Información Tecnológica, 24 (5), 2013, p.93-102. [ Links ]
[4] ROSÁRIO-MARTINS, M., ARANTES, S., CANDEIAS, F., TINOCO, M.T. and CRUZ-MORAIS, J. Antioxidant, antimicrobial and toxicological properties of Schinus molle L. essential oils. Journal of ethnopharmacology, 151(1), 2014, p. 485- 492. [ Links ]
[5] FADLI, M., CHEVALIER, J., HASSANI, L. and MEZRIOUI, N. Natural extracts stimulate membrane- associated mechanisms of resistance in Gram-negative bacteria. Letters in applied microbiology, 58(5), 2014, p. 472-477. [ Links ]
[6] AKTHAR, M., DEGAGA, B. and AZAM, T. Antimicrobial activity of essential oils extracted from medicinal plants against the pathogenic microorganisms: a review. Issues in Biological Sciences and Pharmaceutical Research, 2(1), 2014, p. 1-7. [ Links ]
[7] ADEYINKA, A. and RICHARD, F. Application of phytochemical extracts and essential oils in food products: A review. International Journal of Biotechnology and Food Science, 3(3), 2015, p. 31- 35. [ Links ]
[8] GRANADOS, C., YANEZ, X. y ACEVEDO, D. Evaluación de la Actividad Antioxidante del Aceite Esencial Foliar de Myrcianthes leucoxyla de Norte de Santander (Colombia). Información Tecnológica, 25(3), 2014, p. 11-16. [ Links ]
[9] ZAPATA, K., CORTES, F.B. y ROJANO, B.A. Polifenoles y Actividad Antioxidante del Fruto de Guayaba Agria (Psidiumaraca). Información Tecnológica, 24(5), 2013, p.103-112. [ Links ]
[10] ACEVEDO, D., NAVARRO, M. y MONROY, L. Composición química del aceite esencial de hojas de Orégano (Origanum vulgare). Información Tecnológica, 24(4), 2013a, p. 43-48. [ Links ]
[11] ACEVEDO, D., NAVARRO, M. y MONRROY, L. Composición química del aceite esencial de las hojas de toronjil (Melissa officinalis L.). Información Tecnológica, 24(4), 2013b, p. 49-54. [ Links ]
[12] PINKAS, J.M. and KELLER, S. Spices In The Microbiological Safety of Low Water Activity Foods and Spices. New York (USA): Springer, 2014, p. 99-114. [ Links ]
[13] ARAUJO, P. Capacidad antimicrobiana y antioxidante de extractos de orégano obtenidos mediante fluidos supercríticos [Tesis de Maestría en Gestión y Seguridad Alimentaria]. Valencia (España): Universidad Politécnica de Valencia, 2011, 20 p. [ Links ]
[14] MATOS-CHAMORRO, R., QUISPE-CONDORI, S., QUITO-VIDAL, M.R., and BELTRAN-CÁRDENAS, S.K. Evaluación de la Capacidad Antimicrobiana del Aceite Esencial de Orégano (Origanum vulgare) Microencapsuladas en Β-ciclodextrina Aplicados en Cultivos Microbianos. Revista de Investigación en Ciencia y Tecnología de Alimentos, 1(1), 2015, p. 18-24. [ Links ]
[15] GUTIERREZ-LARRAINZAR, M., RUA, J., CARO, I., DE CASTRO, C., DE ARRIAGA, D., GARCÍAARMESTO, M. and DEL VALLE, P. Evaluation of antimicrobial activities of natural phenolic compounds against foodborne pathogene and spoilage bacteria. Food Control, 26(2), 2012, p. 555- 563. [ Links ]
[16] ORTEGA-RAMIREZ, L.A., RODRIGUEZ-GARCIA, I., LEYVA, J.M., CRUZ-VALENZUELA, M.R., SILVA- ESPINOZA, B., GONZALEZ-AGUILAR, G.A., SIDDIQUI, M. and AYALA-ZAVALA, J. Potential of medicinal plants as antimicrobial and antioxidant agents in food industry: a hypothesis. Journal of food science, 79(2), 2014, p. R129-R137. [ Links ]
[17] HAUSER, C., PEÑALOZA, A., RODRÍGUEZ, F., GUARDA, A. and GALOTTO, M. Promising antimicrobial and antioxidant extracts of Murta leaves (Ugni molinae Turcz): Shelf-life extension and food safety. Food Packaging and Shelf Life, 1(1), 2014, p. 77-85. [ Links ]
[18] AGAFONOVA, A., ALEKSANDROV, A., ALTINOK, O., AMBROSIO, M., ANOKHINA, A., AOKI, S., ARIGA, A., ARIGA, T., AUTIERO, D., BADERTSCHER A., BAGULYA, A., BENDHABI, A., BERTOLIN, A., BESNIER, M., BICK, D., BOYARKIN, V., BOZZA, C., BRUGIÈRE, T., BRUGNERA, R., BRUNET, F., BRUNETTI, G., BUONTEMPO, S., CAZES, A., CHAUSSARD, L., CHERNYAVSKY, M., CHIARELLA, V., CHON-SEN, N., CHUKANOV, A., CIESIELSKI, R., DAL CORSO, F., D'AMBROSIO, N., DECLAIS, Y., DEL AMO, P., DE LELLIS, G., DE SERIO, M., DI CAPUA, DI CRESCENZO, A. and DI FERDINANDO, A. Observation of a first candidate event in the OPERA experiment in the CNGS beam. Physics Letters B, 691(3), 2010, p.138- 145. [ Links ]
[19] GÁLVEZ, A., LÓPEZ, R.L., PULIDO, R.P. and BURGOS, M. Natural Antimicrobials for Food Biopreservation. In: Food Biopreservation. New York (USA): Springer, 2014, p. 3-14. [ Links ]
[20] BURT, R., VOLTARELLI, J., COURI, C., STRACIERI, A., OLIVEIRA, M., MORAES, D. y PIERONI, F. Autólogo no mieloablativo de células madre hematopoyéticas en el diagnóstico reciente de diabetes mellitus tipo 1. Jama, 297(14), 2007, p. 1568-1576. [ Links ]
[21] PASTRANA, Y.I. Evaluación de sustancias antimicrobianas naturales en la conservación de bebidas autóctonas del Departamento de Córdoba [Tesis maestría Ciencias Agroalimentarias]. Montería (Córdoba): Facultad de Ingeniería, 87 p. [ Links ]
[22] HERNÁNDEZ-OCHOA, L., AGUIRRE-PRIETO, Y.B., NEVÁREZ-MOORILLÓN, G.V., GUTIERREZ- MENDEZ, N. and SALAS-MUÑOZ, E. Use of essential oils and extracts from spices in meat protection. Journal of food science and technology, 51(5), 2014, p. 957-963. [ Links ]
[23] GARCÍA-CARAMILLO, E., QUEZADA, J., MORENO, G., SÁNCHEZ, G., MORENO-MARTÍNEZ, E. y PÉREZ, M. Actividad antifúngica de aceites esenciales de canela y orégano y su efecto sobre la producción de aflatoxinas en nuez pecanera. Revista Mexicana de fitopatología, 24(1), 2006, p. 8-12. [ Links ]
[24] BOULAABA, M., SNOUSSI, M., SAADA, M., MKADMINI, K., SMAOUI, A., ABDELLY, C. and KSOURI, R. Antimicrobial activities and phytochemical analysis of Tamarix gallica extracts. Industrial Crops and Products, 76(1), 2015, p. 1114-1122. [ Links ]
[25] FERRIÑO, E., PEDROZA, G., SANDOVAL, N., MARTÍNEZ, E., MENDOZA, L. y BALDERAS, I. Ensayo Químico Dirigido y Estudio del Efecto Antimicrobiano in vitro de Algunos Condimentos Empleados en la Cocina Mexicana. Revista Salud Pública y Nutrición, 10, 2010, p. 23-25. [ Links ]
[26] ROMERO, J.A., SOGBE, E. y DÍAZ, C. Estudio serológico e histopatológico de la infección por Toxoplasma gondii en Cerdos del estado Aragua-Venezuela. Revista de la Facultad de Ciencias Veterinarias, 48(2), 2011, p.85-95. [ Links ]
[27] SADO-KAMDEM, S., BELLETTI, N., TCHOUMBOUGNANG, F., ESSIA-NGANG, J.J., MONTANARI, C., TABANELLI, G., LANCIOTTI, R. and GARDINI, F. Effect of mild heat treatments on the antimicrobial activity of essential oils of Curcuma longa, Xylopia aethiopica, Zanthoxylum xanthoxyloides and Zanthoxylum leprieurii against Salmonella enteritidis. Journal of Essential Oil Research, 27(1), 2015, p. 52-60. [ Links ]
[28] SMITH-PALMER, A., STEWART, J. and FYFE, L. Antimicrobial properties of plant essential oils and essences against five important food-borne pathogens. Letters in applied microbiology, 26(2), 1998, p. 118-122. [ Links ]
[29] HERNÁNDEZ, J., CUBILLOS-HINOJOSA, J. y MILIAN, P.E. Aislamiento de cepas de Rhizobium spp., asociados a dos leguminosas forrajeras en el Centro Biotecnológico del Caribe. Revista Colombiana de Microbiología tropical, 2(2), 2012, p. 51-62. [ Links ]
[30] CLINICAL AND LABORATORY STANDARDS INSTITUTE (CLSI). Performance standards for antimicrobial susceptibility testing: 23rd informational supplement (M100-S23). Wayne (USA): 2013. [ Links ]
[31] JASPERS, S., AERTS, M., VERBEKE, G. and BELOEIL, P.A. A new semi-parametric mixture model for interval censored data, with applications in the field of antimicrobial resistance. Computational Statistics and Data Analysis, 71(1), 2014, p. 30-42. [ Links ]
[32] SEOW, Y.X., YEO, C.R., CHUNG, H. L. and YUK, H. Plant essential oils as active antimicrobial agents. Critical reviews in food science and nutrition, 54(5), 2014, p. 625-644. [ Links ]
[33] RINCÓN-MEJÍA, C., CASTAÑO-OSORIO, J. y RÍOS-VÁZQUEZ, E. Actividad biológica de los aceites esenciales de Acmella ciliata (Kunth) Cass. Revista Cubana de Plantas Medicinales, 17(2), 2012, p. 160-171. [ Links ]
[34] DELGADO, R. Empleo de la melaza de caña de azúcar como aditivo de galletas dulces. Ciencia y Tecnología de Alimentos, 20(2), 2010, p. 1-7. [ Links ]
[35] BINDUHEVA, U. and NEGI, P. Efficacy of cinnamon oil to prolong the shelf-life of pasteurised, acidified, and ambient stored papaya pulp. Acta Alimentaria, 43(3), 2014, p. 378-386. [ Links ]
[36] BURT, S. Essential oils: their antibacterial properties and potential applications in foods: a review. International Journal of Food Microbiology, 94(3), 2004, p. 223-253. [ Links ]














